高炉炼铁为什么出铁口在出渣口下面拜托了各位 谢谢
 放与不放2022-10-04 11:39:541条回答
放与不放2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 ID不好申请啊 共回答了14个问题
ID不好申请啊 共回答了14个问题 |采纳率71.4%- 因为炉渣的主要成分是CaSiO3,其密度小于铁水的密度,总是浮在铁水的上方.所以出铁口低于炉渣出口
- 1年前
相关推荐
- 高炉炼铁过程中发生的主要反应为:[1/3]Fe2O3(s)+CO(g)⇌[2/3]Fe(s)+CO2(g).已知该反应在
高炉炼铁过程中发生的主要反应为:[1/3]Fe2O3(s)+CO(g)⇌[2/3]Fe(s)+CO2(g).已知该反应在不同温度下的平衡常数如下:
请回答下列问题:温度/℃ 1000 1150 1300 平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K=c(CO2) c(CO) ,△H______0(填“>”、“<”或“=”).c(CO2) c(CO)
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0mol,反应经过l0min后达到平衡.求该时间范围内反应的平均反应速率υ(CO2)=______CO的平衡转化率=______
(3)欲提高(2)中CO的平衡转化率,可采取的措施是______.
A.减少Fe的量B.增加Fe2O3的量C.移出部分CO2
D.提高反应温度E.减小容器的容积F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是______.A B C D n(Fe2O3) 0.350 0.027 0.080 0.080 n(CO) 0.010 0.010 0.010 0.050 n(Fe) 0.100 0.064 0.080 0.080 n(CO2) 0.035 0.088 0.040 0.050  hitrinity1年前1
hitrinity1年前1 -
 利爪德鲁伊 共回答了22个问题
利爪德鲁伊 共回答了22个问题 |采纳率90.9%解题思路:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意固体、纯液体的浓度为常数,不需要写固体、纯液体;
由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应;
(2)令平衡时CO的物质的量变化为nmol,利用三段式表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,进而计算CO的浓度变化量,利用v=[△c/△t]计算v(CO),再利用转化率定义计算CO的转化率;
(3)提高CO的平衡转化率,应使平衡向正反应移动,但不能增大CO的用量,结合选项根据平衡移动原理分析.
(4)化学计量数都是1,利用物质的量代替浓度计算各状态的浓度商Qc,与平衡常数比较,据此判断.(1)反应[1/3]Fe2O3(s)+CO(g)⇌[2/3]Fe(s)+CO2(g)的平衡常数k=
c(CO2)
c(CO),
由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0,
故答案为:
c(CO2)
c(CO);<;
(2)令平衡时CO的物质的量变化为nmol,则:
[1/3]Fe2O3(s)+CO(g)⇌[2/3]Fe(s)+CO2(g)
开始(mol):1 0
变化(mol):n n
平衡(mol):1-n n
所以[n/1−n]=4,解得n=0.8,
所以n(CO)=
0.8mol
10L
10min=0.008 mol•L-1•min-1,
CO的平衡转化率为[0.8mol/1mol]×100%=80%,
故答案为:0.008 mol•L-1•min-1;80%;
(3)A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故C正确;
D.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故D错误;
E.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故E错误;
F.加入合适的催化剂,平衡不移动,故F错误;
故选C;
(4)A、浓度商Qc=[0.035mol/0.01mol]=3.5,等于平衡常数,故处于平衡状态,故A符合;
B、浓度商Qc=[0.88mol/0.01mol]=8.8,大于平衡常数3.5,故反应向逆反应进行,故B不符合;
C、浓度商Qc=[0.04mol/0.01mol]=4,大于平衡常数3.5,故反应向逆反应进行,故C不符合;
D、浓度商Qc=[0.05mol/0.05mol]=1,小于平衡常数3.5,故反应向正反应进行,故D不符合;
故选A.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算、化学反应速率计算、平衡常数等,难度中等,注意掌握化学平衡常数的应用:1、用来判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、用来计算物质的转化率.1年前查看全部
- 某钢铁厂用高炉炼铁的主要原料是赤铁矿石、焦炭、空气等,主要反应过程y图:
某钢铁厂用高炉炼铁的主要原料是赤铁矿石、焦炭、空气等,主要反应过程y图:

(b)在图方框中填出有关反应生成物的化学式:______、______.
(2)写出反应的化学方程式
①3+O2
3O2高温 .3+O2;
3O2高温 .
②3O2+3
23O高温 .3O2+3;
23O高温 .
③Fe2O3+33O
2Fe+33O2高温 .Fe2O3+33O.
2Fe+33O2高温 . yanchenll1年前1
yanchenll1年前1 -
 Im Tony 共回答了13个问题
Im Tony 共回答了13个问题 |采纳率61.5%解题思路:(1)根据焦炭在高温条件下能和氧气反应生成二氧化碳,二氧化碳在高温条件下能和焦炭反应生成一氧化碳分析;
(2)根据焦炭在高温条件下能和氧气反应生成二氧化碳,二氧化碳在高温条件下能和焦炭反应生成一氧化碳;氧化铁在高温条件下能够一氧化碳反应生成铁和二氧化碳.焦炭在高温条件下能和氧气反应生成它氧化碳,它氧化碳在高温条件下能和焦炭反应生成一氧化碳;氧化铁在高温条件下能够一氧化碳反应生成铁和它氧化碳,故答案:(1)CO八;CO(八)①C+O八
高温
.
CO八;②CO八+C
高温
.
八CO;Fe八O3+3CO
高温
.
八Fe+3CO八 .点评:
本题考点: 铁的冶炼;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查化学式、化学方程式的书写方面的知识,书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
- 高炉炼铁的反应原理化学方程式(氧化物是氧化铁)
 太平妹妹1年前2
太平妹妹1年前2 -
 xjl3508 共回答了15个问题
xjl3508 共回答了15个问题 |采纳率100%Fe2O3 +3CO = 2Fe +3CO21年前查看全部
- 工业高炉炼铁用的原料有什么
 eee43231年前1
eee43231年前1 -
 夏日雪影 共回答了13个问题
夏日雪影 共回答了13个问题 |采纳率92.3%主要由铁矿石、燃料(焦炭)和熔剂(石灰石)三部分组成. 通常,冶炼1吨生铁需要1.5-2.0吨铁矿石,0.4-0.6吨焦炭,0.2-0.4吨熔剂1年前查看全部
- 高炉炼铁时,当发现炼铁炉口排出的尾气中CO的含量过高,为提高反应中CO的利用率,采取下列哪个措施一定是徒劳的( )
高炉炼铁时,当发现炼铁炉口排出的尾气中CO的含量过高,为提高反应中CO的利用率,采取下列哪个措施一定是徒劳的( )
A.提高炉温
B.增高炉的高度
C.加大原料铁矿石的投放量
D.增加气体压强 天空很蓝啊1年前1
天空很蓝啊1年前1 -
 水心水泪 共回答了15个问题
水心水泪 共回答了15个问题 |采纳率93.3%解题思路:高炉炼铁过程中发生的主要反应为Fe2O3(s)+3CO(g)⇌2Fe(s)+2CO2(g),该反应为可逆反应,正反应是体积减小的吸热反应,结合外界条件对平衡移动的影响分析.A.正反应为吸热反应,提高炉温,平衡向正反应方向移动,CO的利用率增大,故A不选;
B.增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故B选;
C.铁矿石是固,增大铁矿石的投放量,不能影响平衡移动,CO的利用率不变,故C选;
D.增大气体的压强,平衡向正反应方向移动,CO的利用率增大,故D不选;
故选BC.点评:
本题考点: 化学平衡的调控作用.
考点点评: 本题以工业炼铁为载体,考查化学平衡的影响因素,比较基础,注意掌握外界条件对化学平衡的影响.1年前查看全部
- (2012•雅安)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如图所示.
(2012•雅安)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如图所示.

(1)A处发生反应的化学方程式是Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 .
(2)B中发生反应的化学方程式是______.
C处点燃酒精灯的目的是______.
(3)实验结束后,小李看到红色固体全部变黑了,认为产物就是单质铁,但小王提出了质疑:还有可能生成其它物质.为了进一步验证其固体成分,小王查到下列资料:
①铁的氧化物有氧化铁、氧化亚铁、四氧化三铁(该化合物中铁有+2、+3两种化合价),其中氧化铁为红棕色,其余都为黑色;并且只有四氧化三铁能被磁铁吸引.
②铁的氧化物(四氧化三铁除外)都能与酸发生反应而溶解.
根据上述信息,小王又设计了两个实验.
【实验1】
将黑色固体研磨后,取少量加入足量______溶液中,观察到有气泡出现,溶液未变黄色,据此得出的结论是______.
【实验2】
再用磁铁吸引余下黑色固体,实验后即可对黑色固体成分进行判断______. pjy010962311年前1
pjy010962311年前1 -
 leng110 共回答了20个问题
leng110 共回答了20个问题 |采纳率85%解题思路:根据一氧化碳还原氧化铁得到铁和二氧化碳的原理,产生的二氧化碳使澄清石灰水变浑浊,过程中可能一氧化碳过多,必须对尾气进行处理.(1)A处氧化铁还原为铁,发生反应的化学方程式是Fe2O3+3CO
高温
.
2Fe+3CO2
故答案为:Fe2O3+3CO
高温
.
2Fe+3CO2
(2)B为试管,所盛石灰水与二氧化碳反应生成碳酸钙沉淀,C处酒精灯点燃着燃烧未反应的一氧化碳,防止剩余的CO扩散到空气中,污染空气
答案为:Ca(OH)2+CO2=CaCO3↓+H2O;燃烧未反应的一氧化碳,防止剩余的CO扩散到空气中,污染空气
【实验1】
将黑色固体研磨后,取少量加入稀盐酸溶液中,观察到有气泡出现,说明有金属铁生成,溶液未变黄色,说明黑色固体中无氧化铁据此得出的结论是 一定有单质铁,一定没有氧化铁;
故答案为:稀盐酸、一定有单质铁,一定没有氧化铁;
【实验2】
用磁铁吸引余下黑色固体(这个剩下不是说第一步的反应后的剩下,而是第一取走后剩下的,干脆理解为与第一步无关也可以),如果黑色固体被磁铁全部吸引,说明只有单质铁;如果被部分吸引,说明黑色固体为Fe和FeO.
故答案为:如果黑色固体被磁铁全部吸引,说明只有单质铁;如果被部分吸引,说明黑色固体为Fe和FeO(本题猜测的四氧化三铁理论上行不通,因为和还原性物质反应要失氧的,而四氧化三铁应该是得氧的产物,所以不会生成)点评:
本题考点: 一氧化碳还原氧化铁;实验探究物质的组成成分以及含量;书写化学方程式、文字表达式、电离方程式.
考点点评: 通过回答本题知道了炼铁的反应原理,鉴别生成物的方法和尾气处理方法.1年前查看全部
- 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H>0
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)⇌Fe(s)+CO2(g)△H>0
其平衡常数可表示为K=c(CO2)/c(CO),已知1 100℃时K=0.263,且化学平衡常数只与温度有关,不随浓度和压强的变化而变化.
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值______,平衡常数K值______(均填“增大”、“减小”或“不变”).
(2)1 100℃时测得高炉中c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,在这种情况下,该反应是否处于化学平衡状态______(填“是”或“否”).此时,化学反应速率是v正______v逆(填“大于”、“小于”或“等于”),其原因是因难度商Qc=
=[0.025mol/L/0.1mol/L]=0.25<K=0.263,温度不变,K值不变,为增大c(CO2) c(CO)
比值,v(正)大于v(逆)c(CO2) c(CO) 因难度商Qc=.
=[0.025mol/L/0.1mol/L]=0.25<K=0.263,温度不变,K值不变,为增大c(CO2) c(CO)
比值,v(正)大于v(逆)c(CO2) c(CO)
(3)试通过计算当20L的高炉中,通入10molCO和矿石在1 100℃时达平衡时,CO的转化率? wpdi1231年前1
wpdi1231年前1 -
 sb360 共回答了11个问题
sb360 共回答了11个问题 |采纳率90.9%解题思路:(1)升高温度平衡向吸热方向移动,根据平衡移动的方向判断高炉内CO2和CO的体积比值变化以及平衡常数K值;
(2)反应是吸热反应,计算浓度商,与平衡常数比较,可判断反应是否达到平衡状态并判断反应进行的方向;
(3)设出反应的一氧化碳的物质的量x,然后根据1100℃的平衡常数计算出反应的一氧化碳的物质的量,再计算出转化率.解(1)化学反应是吸热反应,温度升高,化学平衡正向进行,化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值增大;依据化学平衡常数概念和计算式判断平衡常数增大,
故答案为:增大;增大;
(2)1100℃时测得高炉中c(CO2)=0.025mol•L-1,c(CO)=0.1mol•L-1,在这种情况下,难度商Qc=
c(CO2)
c(CO)=[0.025mol/L/0.1mol/L]=0.25<K=0.263,所以此时反应未达到化学平衡,反应正向进行,正反应速率大于逆反应速率;
故答案为:否;大于;因难度商Qc=
c(CO2)
c(CO)=[0.025mol/L/0.1mol/L]=0.25<K=0.263,温度不变,K值不变,为增大
c(CO2)
c(CO)比值,v(正)大于v(逆);
(3)设一氧化碳反应的物质的量为x,
根据反应方程式 FeO(s)+CO(g)⇌Fe(s)+CO2(g)
反应前 10mol 0
反应中 xmol xmol
达到平衡时浓度 ( 10-x )mol xmol
根据平衡常数列式可得:
x
20
10−x
20=0.263,解得x=2.08mol,
一氧化碳的转化率为:[2.08mol/10mol]×100%=20.8%,
答:一氧化碳的转化率为20.8%.点评:
本题考点: 化学平衡常数的含义;化学平衡建立的过程;化学平衡状态的判断.
考点点评: 本题考查了化学平衡常数的计算判断,关键理解平衡常数是随温度变化,平衡常数的计算应用,浓度商和平衡常数比较判断反应是否平衡,反应进行的方向,题目难度中等.1年前查看全部
- (2014•江西模拟)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
(2014•江西模拟)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)△H=a kJ•mol-1.
(1)已知①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.则a=______.
(2)冶炼铁反应的平衡常数表达式K=c3(CO2) c3(CO) ,温度升高后,K值______(填“增大”、“不变”或“减小”).c3(CO2) c3(CO)
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为______.Fe2O3 CO Fe CO2 甲/mol 1.0 1.0 1.0 1.0 乙/mol 1.0 2.0 1.0 1.0
②下列说法正确的是______(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
(4)工业上利用CO与 H2的混合气体在催化剂作用下合成甲醇,甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用如图装置模拟上述过程:
①写出阳极电极反应式______;
②写出除去甲醇的离子方程式______.
(5)某工业废液中含有Ba2+、Sr2+,为了回收Sr2+.现向该废液中加入适量SO42-并调节该溶液的PH至8-10,充分反应后过滤.若滤液中Ba2+ 浓度为1×10-5mol•L-1,依表数据推算出滤液中Sr2+物质的量浓度不大于______mol•L-1.SrSO4 BaSO4 Sr(OH)2 KSP 3.3×10-7 1.1×10-10 3.2×10-4  我本川狂人1年前1
我本川狂人1年前1 -
 唯一的骄傲 共回答了15个问题
唯一的骄傲 共回答了15个问题 |采纳率93.3%解题思路:(1)依据盖斯定律和热化学方程式计算得到;
(2)平衡常数结合化学方程式书写,用生成物平衡浓度的幂次方乘积除以反应物平衡浓度的幂次方乘积,依据计算得到a的值分析反应能量变化,结合化学平衡移动原理判断平衡常数岁温度变化;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,依据平衡三段式列式计算结合转化率概念计算得到;
②Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)△H=-28.5kJmol-1
a.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态;
b.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率.
c.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率;
d.依据平衡三段式计算平衡物质的量;计算甲、乙容器中,CO的平衡浓度之比;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-═Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平写出:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+;
(5)根据BaSO4的Ksp求出溶液中硫酸根的浓度,再根据SrSO4的Ksp求出Sr2+物质的量浓度;(1)①Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1;
②C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1.
依据盖斯定律计算①-②×3得到:Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1.
则a=-28.5kJ•mol-1;
故答案为:-28.5kJ•mol-1 ;
(2)Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)△H=-28.5kJmol-1,平衡常数K=
c3(CO2)
c3(CO);反应是放热反应,升温平衡逆向进行,平衡常数减小;
故答案为:
c3(CO2)
c3(CO);减小;
(3)①在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=
c3(CO2)
c3(CO)=
(1+x)3
(1−x)3=64,计算得到x=0.6
转化率=60%,
故答案为:60%;
②Fe2O3(s)+3CO(g)⇌2Fe(s)+3CO2(g)△H=-28.5kJmol-1
A.反应前后气体质量变化,体积不变,若容器内气体密度恒定时,标志反应达到平衡状态,故A正确;
B.固体量增加不影响化学平衡,增加Fe2O3不能提高CO的转化率,故B错误;
C.乙容器中一氧化碳增加,相当于增大压强,反应前后体积不变,甲容器中CO的平衡转化率等于乙的转化率,故C错误;
D.甲容器中平衡一氧化碳物质的量为0.4mol;乙容器中结合平衡常数计算得到消耗一氧化碳为1.4mol,平衡物质的量为0.6mol,甲和乙容器中CO的平衡浓度之比为0.4:0.6=2:3;故D正确;
故答案为:AD;
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-═Co3+,
故答案为:Co2+-e-═Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+,
故答案为:6Co3++CH3OH+H2O═CO2↑+6Co2++6H+;
(5)滤液中Ba2+浓度为1×10-5mol•L-1,则c(SO42-)=
Ksp(BaSO4)
c(Ba2+)=
1.1×10−10
1×10−5=1.1×10-5mol/L;
所以滤液中Sr2+物质的量浓度为c(Sr2+)=
Ksp(SrSO4)
c(SO42−)=
3.3×10−7
1.1×10−5=0.03mol/L,当Sr2+物质的量浓度大于0.03mol/L是会析出SrSO4沉淀,所以滤点评:
本题考点: 化学平衡常数的含义;用盖斯定律进行有关反应热的计算;化学平衡的计算;难溶电解质的溶解平衡及沉淀转化的本质;电解原理.
考点点评: 本题考查了化学平衡的分析应用,化学反应速率、平衡常数计算应用、原电池原理、电解原理的电极反应书写方法、沉淀溶解平衡和溶度积常数的计算应用分析,题目难度中等.1年前查看全部
- 请问一个题:自然界中没有单质铁,高炉炼铁是用焦炭与氧化铁反应得到铁.写出该化学反应的化学方程式.
 xudukeren1年前5
xudukeren1年前5 -
 pandating 共回答了18个问题
pandating 共回答了18个问题 |采纳率88.9%C + O2 = CO2(点燃),CO2 + C = 2CO(加热),Fe2O3 + 3CO = 2Fe + 3CO2(高温)
或者简化为2Fe2O3 + 3C = 4Fe + 3CO2(高温)1年前查看全部
- 高炉炼铁用赤铁矿做原料,若要炼出1120吨含铁95%的生铁,需要含氧化铁80%的赤铁矿多少吨?
 fanzilin1年前4
fanzilin1年前4 -
 phoenixelva 共回答了15个问题
phoenixelva 共回答了15个问题 |采纳率86.7%设需要含氧化铁80%的赤铁矿的质量为X
3CO+ Fe2O3= 高温= 2Fe + 3CO2
160 112
X*80% 1120*95%
160:112=X*80% :1120*95%
解得:X=1900t
答:需要含氧化铁80%的赤铁矿1900吨1年前查看全部
- 我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。高炉内可能发生如下反应:
C(s)+O 2 (g)=CO 2 (g) △H1=-393.5 kJ/mol ①
C(s)+CO 2 (g)=2CO(g) △H2=+172.5 kJ/mol ②
4CO(g)+Fe 3 O 4 (s)=4CO 2 (g)+3Fe(s) △H3=-13.7 kJ/mol ③
请回答下列问题:
(1)反应3Fe(s)+2O 2 (g)=Fe 3 O 4 (s)的△H=_____________。
(2)800℃时,C(s)+CO 2 (g) 2CO(g)的平衡常数K=1.64,测得高炉内c(CO)= 0. 20 mol/L、c(CO 2 )=
2CO(g)的平衡常数K=1.64,测得高炉内c(CO)= 0. 20 mol/L、c(CO 2 )=
0.05mol/L,此时反应向____(填“正”或“逆”)方向进行。
(3)某种矿石中铁元素以氧化物Fe m O n 形式存在(矿石中杂质不与酸反应),现进行如下实验:将少量铁矿石样品粉碎,称取25.0 g样品于烧杯中,加入稀H 2 SO 4 充分溶解,并不断加热、搅拌,滤去不溶物。向所得滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得剩余固体36 g。剩下滤液用浓度为2
mol/L的酸性KMnO 4 滴定,至终点时消耗KMnO 4 溶液体积25.0 mL。提示:2Fe 3+ +Cu=2Fe 2+ +Cu 2+
8H + +MnO 4 - +5Fe 2+ =Mn 2+ +5Fe 3+ +4H 2 O
①计算该铁矿石中铁元素的质量分数。
②计算氧化物Fe m O n 的化学式(m、n为正整数)(请写出计算过程)。 xuww1151年前1
xuww1151年前1 -
 amandaqq 共回答了20个问题
amandaqq 共回答了20个问题 |采纳率95%(1) -1118. 3 kJ/mol
(3)①解:n(Fe)=5n(KMnO 4 )=50.025L×2mol/L=0. 25mol
m(Fe)=0.25mol×56g/mol=14g
ω(Fe)=14g/25g×100%=56%
②反应的铜的物质的量n(Cu)=(10g-3.6g)/64g/mol=0.1mol
由方程式得:n(Fe 3+ )=0.2 mol、n(Fe 2+ )=0.05 mol
该氧化物的化学式可表示为:Fe 5 O 7 或FeO·Fe 2 O 31年前查看全部
- 高炉炼铁过程中发生的主要反应为1/3Fe 2 O 3 (s) + CO(g) 2/3Fe(s) + CO 2 (g) 已
高炉炼铁过程中发生的主要反应为1/3Fe 2 O 3 (s) + CO(g)  2/3Fe(s) + CO 2 (g)
2/3Fe(s) + CO 2 (g) 
已知该反应在不同温度下的平衡常数如上表:请回答下列问题
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe 2 O 3 、CO、CO 2 各1.0 mol,反应经过l0min后达到平衡。求该时间范围内反应的平均反应速率υ(CO 2 )=________,CO的平衡转化率为________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe 2 O 3 的量
C.移出部分CO 2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂 玛瑙皇后1年前1
玛瑙皇后1年前1 -
 文文信心 共回答了20个问题
文文信心 共回答了20个问题 |采纳率85%(1)K=c(CO 2 )/c(CO);<
(2)0.006mol·L -1 ·min -1 ;60%
(3)C1年前查看全部
- 如图所示是高炉炼铁时高炉内的化学变化过程:认真阅读有关信息,回答下列问题: (1)高炉炼铁的主要原料是 ________
如图所示是高炉炼铁时高炉内的化学变化过程:认真阅读有关信息,回答下列问题: 
(1)高炉炼铁的主要原料是 _________ ;
(2)将铁从铁矿石中还原出来的物质是(填化学式) _________ ;
(3)取少量高炉中炼出的生铁放入烧杯中,加入足量稀盐酸,可观察到的现象是 _________ ,当反应停止后,还可观察到烧杯底部有黑色不溶物,该物质是(填化学式) _________ ,请设计一个简单实验证明你的判断,简要写出主要操作和现象 _________ . 吕二口1年前1
吕二口1年前1 -
 搜索小狐 共回答了17个问题
搜索小狐 共回答了17个问题 |采纳率100%(1)铁矿石、焦炭、石灰石.
(2)CO.
(3)有气泡产生,溶液逐渐变为浅绿色;C;将黑色固体放在坩埚内加热至其燃烧,并在火焰上方罩一个杯壁沾有澄清石灰水的烧杯,杯壁出现白色斑点.1年前查看全部
- 高炉炼铁的生铁出口为什么比炉灰的出口低
 黑色收藏老广东1年前1
黑色收藏老广东1年前1 -
 A20011006 共回答了17个问题
A20011006 共回答了17个问题 |采纳率94.1%铁水的比重大,炉渣(不是炉灰)漂浮在铁水的上面,所以铁口比渣口低!1年前查看全部
- 高炉炼铁:不同高炉的风速如何选择?
 杯酒一梦1年前1
杯酒一梦1年前1 -
 jiangyangmmmm 共回答了13个问题
jiangyangmmmm 共回答了13个问题 |采纳率76.9%你问地应该是高炉风口前的鼓风动能的选择问题,这是一门综合冶炼学科,在实际操作中需要根据高炉设备,外部原燃料条件,高炉风口个数,风口间距,炉缸直径、高炉喷吹量、富氧量、风压、炉顶压力等各个指标来综合考虑的问题,不是简单几句话能说清楚的,也没有一个冶炼工程师敢坐在远处对你进行远程指导的,这是一门学科,需要根据各种内外部条件的变化去不断的探究和摸索的.1年前查看全部
- 图甲是一氧化碳与氧化铁反应装置的示意图,图乙是高炉炼铁示意图.请回答下列问题.
图甲是一氧化碳与氧化铁反应装置的示意图,图乙是高炉炼铁示意图.请回答下列问题.

(1)写出甲图硬质玻璃管内反应的化学方程式是3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 .
(2)甲图中尾气处理的目的是______.
(3)乙图中高炉炼铁时焦炭的作用是①______;②______.
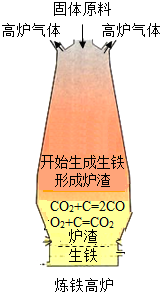
(4)为什么乙图中生铁出口低于炉渣出口?______.
(5)请写出一种证明产物中含铁粉的方法:______. cdzzf1年前1
cdzzf1年前1 -
 佳佳的土土 共回答了24个问题
佳佳的土土 共回答了24个问题 |采纳率87.5%解题思路:(1)根据玻璃管内盛放的氧化铁与通入的气体一氧化碳反应原理书写方程式;
(2)一氧化碳有毒,是污染空气的三种有害气体之一,不能直接排放;
(3)焦炭为单质碳,可在氧气中燃烧生成二氧化碳,同时放出大量的热;在高温条件下与二氧化碳可反应生成一氧化碳;
(4)被还原出来的铁在高温条件下熔化成液态铁,铁的密度大于炉渣.
(5)考虑铁与稀酸(如稀盐酸、稀硫酸)反应进行回答.(1)玻璃管内的氧化铁在高温条件下与一氧化碳反应生成铁和二氧化碳,其化学方程式是为:3CO+Fe2O3 高温 . 2Fe+3CO2;(2)一氧化碳是有毒气体,尾气中的一氧化碳需要进行处理以防止直接排放污染空气...
点评:
本题考点: 一氧化碳还原氧化铁;书写化学方程式、文字表达式、电离方程式.
考点点评: 掌握炼铁的反应原理,一氧化碳的性质,高炉炼铁中焦炭作为燃料和还原剂,是主要能源等知识才能正确解答.1年前查看全部
- (2013•湛江二模)高炉炼铁是冶炼铁的主要方法.
(2013•湛江二模)高炉炼铁是冶炼铁的主要方法.
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体______(填化学式),会污染空气.100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少.高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿)Fe3O4+4CO
3Fe+4CO2高温 .Fe3O4+4CO.
3Fe+4CO2高温 .
(2)已知:①4Fe(s)+3O2=2Fe2O3(s)△H1
②4Fe3O4(s)+O2(g)=6Fe2O3(s)△H2
③3Fe(s)+2O2(g)=Fe3O4(s)△H3
则△H2=______(用含上述△H的代数式表示).
(3)高铁酸钠(Na2FeO4)是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用______ (填H2SO4、HNO3、KOH、NaOH、Na2SO4)溶液,原因是______,阳极反应式为______.
(4)某温度下,HX的电离平衡常数K为1×10-5.计算该温度下0.100mol/L的HX溶液的H+浓度.(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程.) ygtqxx1年前1
ygtqxx1年前1 -
 恭禧发财 共回答了17个问题
恭禧发财 共回答了17个问题 |采纳率94.1%解题思路:(1)炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有有毒气体CO;据炼铁原理,用一氧化碳还原铁矿石生成铁和二氧化碳;
(2)根据盖斯定律来分析;
(3)根据是否引入杂质来分析;根据阳极失去电子被氧化;
(4)先根据三段法求出各物质的平衡浓度,然后根据HX的电离常数K(HX)=
计算H+浓度.C(H+)C(X−) C(HX) (1)炼铁和炼钢生产中,CO是主要的还原剂,故尾气均含有有毒气体CO;高炉炼铁主要反应原理是用一氧化碳还原铁矿石生成铁和二氧化碳,化学方程式为:Fe3O4+4CO
高温
.
3Fe+4CO2,
故答案为:CO;Fe3O4+4CO
高温
.
3Fe+4CO2;
(2)已知:①4Fe(s)+3O2=2Fe2O3(s)△H1
③3Fe(s)+2O2(g)=Fe3O4(s)△H3
①×3-③×4,得:4Fe3O4(s)+O2(g)=6Fe2O3(s)△H2=3△H1-4△H3;
故答案为:3△H1-4△H3;
(3)据因Na2SO4中含有硫酸根离子,H2SO4、HNO3中含有硫酸根、硝酸根离子,KOH中含有钾离子,通过反应得不到纯净的高铁酸钠,选用NaOH,当OH-放电完毕之后,溶液中就溶液中就没有其他杂质了,阳极反应式为Fe-6e-+8OH-=FeO42-+4H2O,
故答案为:NaOH;其他溶液会引入杂质;Fe-6e-+8OH-=FeO42-+4H2O;
(4)HX⇌X-+H+
初始浓度/mol•L-1 0.10000
变化浓度/mol•L-1 a a a
平衡浓度/mol•L-1 0.100 a a
K=c(H+)c(X-)c(HX)=a×a0.100=1×10-5
∴a≈1×10-3
答:该温度下0.100mol/L的HX溶液的H+浓度为1×10-3mol•L-1.点评:
本题考点: 高炉炼铁;用盖斯定律进行有关反应热的计算;电解原理.
考点点评: 本题主要考查了工业炼铁、盖斯定律、电解原理、化学平衡计算,难度不大,掌握原理即可解答.1年前查看全部
- 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)⇌Fe(s)+CO 2 (g)△H>0其平衡常数可表达为: K
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)⇌Fe(s)+CO 2 (g)△H>0其平衡常数可表达为: K=
,已知1100℃时,K=0.263.c(C O 2 ) c(CO)
(1)当温度升高,化学平衡移动后达到新的平衡,高炉内CO 2 和CO体积比值______,平衡常数K值______(选“增大”、“减小”或“不变”).
(2)1100℃时测得高炉中,c(CO 2 )=0.025mol/L,c(CO)=0.1mol/L,在这种情况下,该反应是否处于化学平衡状态______(选“是”或“否”).
(3)若加入催化剂,平衡时气体混合物的总物质的量______(选“增大”、“减小”或“不变”). 71001761年前1
71001761年前1 -
 小强的兄弟 共回答了16个问题
小强的兄弟 共回答了16个问题 |采纳率100%(1)反应吸热,升高温度平衡向正反应方向移动,则高炉内CO 2 和CO体积比值增大,平衡常数K值增大,故答案为:增大;增大;
(2)(CO 2 )=0.025mol/L,c(CO)=0.1mol/L,Q=
0.025
0.1 =0.25<0.263,该反应不处于化学平衡状态,故答案为:否;
(3)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:不变;
不变;1年前查看全部
- 高炉炼铁中发生b基本反应之一如下:F人人(s)+C人(g)⇌F人(s)+C人f(g)△H>多;其平衡常数可表示为K=c(
高炉炼铁中发生b基本反应之一如下:F人人(s)+C人(g)⇌F人(s)+C人f(g)△H>多;其平衡常数可表示为K=c(C人f)/c(C人),已知1 1多多℃时K=多.fc3,且化学平衡常数只与温度有关,不随浓度和压强b变化而变化.
(1)温度升高,化学平衡移动后达到新b平衡,高炉内C人f和C人b体积比值______,平衡常数K值______(均填“增大”、“减小”或“不变”).
(f)1 1多多℃时测r高炉中c(C人f)=多.多f5m人l•L-1,c(C人)=多.1m人l•L-1,在这种情况下,该反应是否处于化学平衡状态______(填“是”或“否”).此时,化学反应速率是c正______c逆(填“大于”、“小于”或“等于”),其原因是在这种情况下,浓度商Qc=
=[多.f5m人l/L/多.1m人l/L]=多.f5<K,所以此时反应未达到化学平衡,反应正向进行,正反应速率大于逆反应速率c(C人f) c(C人) 在这种情况下,浓度商Qc=.
=[多.f5m人l/L/多.1m人l/L]=多.f5<K,所以此时反应未达到化学平衡,反应正向进行,正反应速率大于逆反应速率c(C人f) c(C人)
(3)在一个容积为5多多mLb密闭容器中,充入5m人l Hf和fm人l C人.在一定温度和一定压强下,发生如下反应:fHf(g)+C人(g)⇌CH3人H(g),经过5mcn后达到平衡状态.若此时测rCH3人H蒸气b浓度为fm人l•L-1,求:
①达平衡时C人b转化率.
②该温度下bK. headchef1年前1
headchef1年前1 -
 果冻猫咪 共回答了26个问题
果冻猫咪 共回答了26个问题 |采纳率92.3%解题思路:(1)反应吸热,升高温度平衡向正反应方向移动;化学平衡移动后达到新的平衡,高炉内CO2和CO的体积比值增大,平衡常数增大;
(2)反应是吸热反应,计算浓度商,与平衡常数比较,可判断反应是否达到平衡状态并判断反应进行的方向;
(3)依据化学平衡三段式列式计算,经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为2mol/L.物质的量为0.5L×2mol/L=1mol;
2H2(g)+CO(g)⇌CH3OH(g)
起始量(mol) 5 2 0
变化量(mol) 21 1
平衡量(mol) 3 1 1
据此计算反应速率V=[△c/△t],转化率=[消耗量/起始量]×100%,平衡常数概念是生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积.(d)化学反应是吸热反应,温度升高,化学平衡正向进行,化学平衡移动后达到新9平衡,高炉内COv和CO9体积比值增大,化学平衡常数增大,
故答案为:增大;增大;
(v)dd00℃时测得高炉中c(COv)=0.0v5mol•L-d,c(CO)=0.dmol•L-d,在这种情况下,浓度商Qc=
c(COv)
c(CO)=[0.v5mol/L/0.dmol/L]=0.v5<6,所以此时反应达到化学平衡,反应正向进行,正反应速率大于逆反应速率;
故答案为:否;大于,在这种情况下,浓度商Qc=
c(COv)
c(CO)=[0.v5mol/L/0.dmol/L]=0.v5<6,所以此时反应达到化学平衡,反应正向进行,正反应速率大于逆反应速率;
(b)经过5mi五后达到平衡状态.若此时测得ChbOh蒸气9浓度为vmol/L.物质9量为0.5L×vmol/L=dmol;
vhv(g)+CO(g)⇌ChbOh(g)
起始量(mol) 5 v 0
变化量(mol) vd d
平衡量(mol) b d d
①hv9浓度变化表示9该反应9速率=
vmol
0.5L
5mi五=0.七mol/(L•mi五),答:以hv9浓度变化表示9该反应9速率为0.七mol/(L•mi五);
②反应9平衡常数6=
dmol
0.5L
(
bmol
0.5L)v×
dmol
0.5L=0.0v七(L/mol)v,该反应9平衡常数为0.0v七(L/mol)v;
答:平衡常数为0.0v七(L/mol)v.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了化学平衡常数的计算判断,关键理解平衡常数是随温度变化,平衡常数的计算应用,浓度商和平衡常数比较判断反应是否平衡,反应进行的方向,题目难度中等.1年前查看全部
- 高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g) Fe(s)+CO 2 (g)ΔH>0,已知1 373 K时K=
高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g)
 Fe(s)+CO 2 (g)ΔH>0,已知1 373 K时K=0.263。
Fe(s)+CO 2 (g)ΔH>0,已知1 373 K时K=0.263。
(1)该反应的平衡常数表达式为 。
(2)温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减小”或“不变”)。
(3)1 373 K时测得高炉中c(CO 2 )="0.025" mol/L,c(CO)="0.1" mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。 asdeol1年前1
asdeol1年前1 -
 zhzhzh0905 共回答了24个问题
zhzhzh0905 共回答了24个问题 |采纳率79.2%1年前查看全部
- 高炉炼铁中 一氧化碳是怎么制得的?
高炉炼铁中 一氧化碳是怎么制得的?
是通过氧气与碳的反应?那么碳酸钙是做什么用的?
还是直接加热碳酸钙分解得到的二氧化碳? 超级牛Bvv男1年前1
超级牛Bvv男1年前1 -
 阿森000 共回答了26个问题
阿森000 共回答了26个问题 |采纳率84.6%高炉炼铁中 一氧化碳是这样得到的
C+O2=CO2,C+CO2=2CO
碳酸钙是用来除去矿石中的脉石(主要成分SiO2)
CaCO3=高温=CaO+CO2,CaO+SiO2=CaSiO3 (炉渣)1年前查看全部
- 高炉炼铁时加入石灰石的目的是什么?
 chenchunyun1年前2
chenchunyun1年前2 -
 Daria12 共回答了17个问题
Daria12 共回答了17个问题 |采纳率82.4%造渣,就是和铁矿石里的二氧化硅形成硅酸钙炉渣.1年前查看全部
- “高炉炼铁”包含一个反应:Fe 2 O 3 +3CO 高温 2Fe+3CO 2 ,该反应中的氧化剂是( ) A.CO
“高炉炼铁”包含一个反应:Fe 2 O 3 +3CO
2Fe+3CO 2 ,该反应中的氧化剂是( )高温 A.CO 2 B.CO C.Fe D.Fe 2 O 3  baiehui1年前1
baiehui1年前1 -
 mengha 共回答了21个问题
mengha 共回答了21个问题 |采纳率95.2%由反应式可知,氧化铁在反应中失去了氧,发生了还原反应,是氧化剂,一氧化碳在反应中得到氧是还原剂.
故选D1年前查看全部
- 还原剂还原金属氧化物1 氢气还原氧化物 2 木炭还原氧化物 3 木炭还原氧化铜 4 一氧化碳还原氧化铜 5 高炉炼铁的反
还原剂还原金属氧化物
1 氢气还原氧化物 2 木炭还原氧化物 3 木炭还原氧化铜 4 一氧化碳还原氧化铜 5 高炉炼铁的反应原理 yukitoseki1年前1
yukitoseki1年前1 -
 矿泉水好喝 共回答了22个问题
矿泉水好喝 共回答了22个问题 |采纳率90.9%H2+CuO=高温==H2O+CU C+2CaO==高温==CO2↑+2Ca C+2CuO==高温==CO2↑+2Cu CO+CuO==高温==Cu+CO2↑ 5、2C+O2(不足)==点燃==2CO 3CO+Fe2O3==高温==3CO2+2Fe1年前查看全部
- 高炉炼铁Fe2O3+3CO=2Fe+3CO,下列说法正确的是
高炉炼铁Fe2O3+3CO=2Fe+3CO,下列说法正确的是
A.反应中Fe2O3被氧化
B.反应中碳元素的化合价有+2价变为+4价
C.反应中铁元素的化合价有有+2价变为0价
D.该反应属于复分解反应
要答案,要分析 581512531年前2
581512531年前2 -
 外面下着鱼 共回答了19个问题
外面下着鱼 共回答了19个问题 |采纳率94.7%B
A 被还原
C 由+3 价到0
D 氧化还原反应1年前查看全部
- 高炉炼铁是冶炼铁的主要方法。(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体
高炉炼铁是冶炼铁的主要方法。
(1)从炼铁高炉口排出的尾气中含有一定量的有毒气体 (填化学式),会污染空气。100多年前,人们曾耗巨资改建高炉,结果尾气中的该物质含量并未减少。高炉炼铁的主要反应方程式为(设铁矿石用磁铁矿) 。
(2)已知:①4Fe(s) + 3O 2 =2Fe 2 O 3 (s) ΔH 1
②4Fe 3 O 4 (s)+O 2 (g)=6Fe 2 O 3 (s)ΔH 2
③3Fe(s)+2O 2 (g)=Fe 3 O 4 (s) ΔH 3
则ΔH 2 = (用含上述ΔH的代数式表示)。
(3)高铁酸钠(Na 2 FeO 4 )是铁的一种重要化合物,可用电解法制备,阳极材料为铁,其电解质溶液应选用_______ (填H 2 SO 4 、HNO 3 、KOH、NaOH、Na 2 SO 4 )溶液,原因是_____________,阳极反应式为_________________。
(4)某温度下,HX的电离平衡常数K为1×10 -5 。计算该温度下0.100mol/L的HX溶液的 H + 浓度。(平衡时HX的浓度以0.100mol/L计,水的电离忽略不计,写出计算过程。) 西山蝴蝶1年前1
西山蝴蝶1年前1 -
 haoyueer 共回答了25个问题
haoyueer 共回答了25个问题 |采纳率88%(16分)
(1)CO(2分) Fe 3 O 4 (s)+4CO(g) 3Fe(s)+4CO 2 (g) (写等号扣1分,不标状态不扣分)(2分)
3Fe(s)+4CO 2 (g) (写等号扣1分,不标状态不扣分)(2分)
(2)3ΔH 1 -4ΔH 3 (2分)
(3)NaOH(2分) 酸性条件会反应,KOH会引进K元素杂质(合理也给分)(2分)
Fe-6e - + 8OH - = FeO 4 2 - + 4H 2 O (2分)
(4) HX X - + H +
X - + H +
初始浓度/ mol·L -1 : 0.100 0 0
变化浓度/ mol·L -1 : a a a
平衡浓度/ mol·L -1 : 0.100 a a (1分)
K= =
= =1×10 - 5 ∴a≈1×10 - 3 (1+1+1分)
=1×10 - 5 ∴a≈1×10 - 3 (1+1+1分)
(K的表达式正确得1分,算式正确得1分,计算结果正确得1分)。
<>1年前查看全部
- 高炉炼铁的残渣的成分是什么?
 wbpcc1年前4
wbpcc1年前4 -
 霄靇 共回答了21个问题
霄靇 共回答了21个问题 |采纳率100%主要成分有Sio2、Al2O3、CaO、MgO,
这些都是高熔点物质,在高炉条件难反应.1年前查看全部
- 高炉炼铁 算料公式求高炉炼铁算料公式
 SuddenStrike1年前2
SuddenStrike1年前2 -
 diver_jing 共回答了21个问题
diver_jing 共回答了21个问题 |采纳率90.5%高炉炼铁算料公式:
矿石质量*(1-损耗率)= 生铁质量
例如,100t的矿石,炼铁时损耗率为20%,则得到的生铁质量 = 1000*(1-20%) = 80t
这只是理论的公式,实际上比这复杂得多.1年前查看全部
- 某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示,请回答下列问题。 (1)A处通入气体的化学式为_____
某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示,请回答下列问题。 
(1)A处通入气体的化学式为___________,仪器C的名称是___________,C中盛有的试剂是___________;
(2)B处发生反应的化学方程式是____________;该套装置的不足之处是____________,
(3)向20g赤铁矿粉通入足量气体,充分反应后,获得11. 2g铁,则赤铁矿石中三氧化二铁的质量分数为_______________。 柔dd乱1年前1
柔dd乱1年前1 -
 小鸟在唱歌 共回答了15个问题
小鸟在唱歌 共回答了15个问题 |采纳率100%1年前查看全部
- 初三化学实验题 求解某化学小组的同学学习高炉炼铁的原理之后,做了相关探究实验.在硬质玻璃管内放入一定量的Fe2O3样品,
初三化学实验题 求解
某化学小组的同学学习高炉炼铁的原理之后,做了相关探究实验.
在硬质玻璃管内放入一定量的Fe2O3样品,高温加热后,直至观察到红色粉末全部变成黑色粉末.
探究课题:黑色粉末的成分.
查询资料:①铁粉和氧化亚铁粉末均为黑色.②CO与Fe2O3可能发生的化学反应方程式为Fe2O3+3CO=高温=2Fe+3CO2;Fe2O3+CO=高温=2FeO+CO2;FeO+CO=高温=Fe+CO2
他们从玻璃管中取出反应后的固体粉末,加入适量稀盐酸,震荡后,溶液呈黄色,原因是__________________________.能说明溶液变黄的化学方程式_____________________.
 为你而安静1年前1
为你而安静1年前1 -
 llyinng123 共回答了16个问题
llyinng123 共回答了16个问题 |采纳率93.8%原因是__没有冷却就停止加热,至生成的铁又被氧化__.能说明溶液变黄的化学方程式__Fe2O3+6HCl==2FeCl3+3H2O___.1年前查看全部
- 某钢厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分是Fe2O3)、空气等,主要反应过程如下所示:
某钢厂高炉炼铁的主要原料是焦炭、赤铁矿(主要成分是Fe2O3)、空气等,主要反应过程如下所示:

(1)请在上面方括号中写出反应后生成物的化学式.
(2)写出②、③两步反应的化学方程式.
②CO2+C
2CO高温 .CO2+C,③
2CO高温 .Fe2O3+3CO
2Fe+3CO2高温 .Fe2O3+3CO.
2Fe+3CO2高温 . xiwenq1年前1
xiwenq1年前1 -
 算盘珠儿 共回答了23个问题
算盘珠儿 共回答了23个问题 |采纳率95.7%解题思路:(1)根据工业炼铁的流程分析即可;
(2)根据焦炭与二氧化碳的反应原理及工业炼铁的原理分析即可;
其中赤铁矿的主要成分是三氧化二铁.(1)炼铁过程中焦炭先与过量高温空气反应生成二氧化碳,二氧化碳再与过量焦炭反应生成一氧化碳,
故选A、CO2B、CO;
(2)②、③两步反应的化学方程式分别为:CO2+C
高温
.
2CO、Fe2O3+3CO
高温
.
2Fe+3CO2
故选CO2+C
高温
.
2CO、Fe2O3+3CO
高温
.
2Fe+3CO2点评:
本题考点: 铁的冶炼;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 因为炼铁过程中需要高温,所以要使焦炭先与过量空气反应生成二氧化碳而不是直接生成所需要的还原剂一氧化碳.1年前查看全部
- I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) ΔH
(1)已知:①Fe2O3(s)+ 3C(石墨)=2Fe(s)+3CO(g) ΔH1
②C(石墨)+CO2(g)=2CO(g) ΔH2
则ΔH= (用含ΔH1、ΔH2代数式表示)
(2)高炉炼铁反应的平衡常数表达式K= .
Fe2O3 CO Fe CO2
甲/mol 1.0 1.0 1.0 1.0
乙/mol 1.0 1.5 1.0 1.0
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按右表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为 . 花ee1年前1
花ee1年前1 -
 星光雨1 共回答了19个问题
星光雨1 共回答了19个问题 |采纳率94.7%1.答案是 h1-3倍的h2
2.co2浓度的3次 除以 co的浓度的3次
3.答案是0.6 就是百分之60 而且这个答案是和容器的体积是没关系的1年前查看全部
- 高炉炼铁时焦炭的作用写出两点
 益母草11年前2
益母草11年前2 -
 热血少年 共回答了18个问题
热血少年 共回答了18个问题 |采纳率100%1.焦炭本身有还原性,可还原铁矿石
2.与氧气不完全反应制成一氧化碳(还原剂)还原铁矿石1年前查看全部
- 高炉炼铁中焦炭的作用
 docxushu1年前1
docxushu1年前1 -
 李小猫ss 共回答了21个问题
李小猫ss 共回答了21个问题 |采纳率90.5%焦炭不完全燃烧生成一氧化碳,再还原氧化铁1年前查看全部
- 高炉炼铁的原理是什么
 森sen森1年前3
森sen森1年前3 -
 ssr328 共回答了22个问题
ssr328 共回答了22个问题 |采纳率95.5%炼铁过程实质上是将铁从其自然形态——矿石等含铁化合物中还原出来的过程. 炼铁方法主要有高炉法、直接还原法、熔融还原法等,其原理是矿石在特定的气氛中(还原物质CO、H2、C;适宜温度等)通过物化反应获取还原后的生铁.生铁除了少部分用于铸造外,绝大部分是作为炼钢原料. 高炉炼铁是现代炼铁的主要方法,钢铁生产中的重要环节.这种方法是由古代竖炉炼铁发展、改进而成的.尽管世界各国研究发展了很多新的炼铁法,但由于高炉炼铁技术经济指标良好,工艺简单,生产量大,劳动生产率高,能耗低,这种方法生产的铁仍占世界铁总产量的95%以上.高炉生产时从炉顶装入铁矿石、焦炭、造渣用熔剂(石灰石),从位于炉子下部沿炉周的风口吹入经预热的空气.在高温下焦炭(有的高炉也喷吹煤粉、重油、天然气等辅助燃料)中的碳同鼓入空气中的氧燃烧生成的一氧化碳和氢气,在炉内上升过程中除去铁矿石中的氧,从而还原得到铁.炼出的铁水从铁口放出.铁矿石中不还原的杂质和石灰石等熔剂结合生成炉渣,从渣口排出.产生的煤气从炉顶导出,经除尘后,作为热风炉、加热炉、焦炉、锅炉等的燃料.1年前查看全部
- 高炉炼铁过程中发生的主要反应为 1 3 Fe 2 O 3 (s)+CO(g)= 2 3 Fe(s)+CO 2 (g)已知
高炉炼铁过程中发生的主要反应为
Fe 2 O 3 (s)+CO(g)=1 3
Fe(s)+CO 2 (g)已知该反应在不同温度下的平衡常数如下:2 3
请回答下列问题:温度/℃ 1000 1150 1300 平衡常数 4.0 3.7 3.5
(1)该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe 2 O 3 、CO、CO 2 各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(C0 2 )= 、CO的平衡转化率= :
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量B.增加Fe 2 0 3 的量C.移出部分C0 2
D.提高反应温度E.减小容器的容积F.加入合适的催化剂. helenejenkin1年前1
helenejenkin1年前1 -
 HELLOBEST 共回答了11个问题
HELLOBEST 共回答了11个问题 |采纳率90.9%/1年前查看全部
- 高炉炼铁反应中加石灰石的目的是什么
 无业游民03281年前1
无业游民03281年前1 -
 秋之雅 共回答了15个问题
秋之雅 共回答了15个问题 |采纳率80%石灰石的主要作用是将矿石中的二氧化硅转变为炉渣1年前查看全部
- 高炉炼铁中,风口前焦炭循环区的物理结构如何?
 bshrk1年前1
bshrk1年前1 -
 贺ii 共回答了19个问题
贺ii 共回答了19个问题 |采纳率100%结构疏松,也就是疏松层,随鼓风做激烈回旋运动,一般情况下风口上是看不到的;鼓风动能较低或炉缸工作不好能看到.1年前查看全部
- 工业制造硫酸、合成氨、高炉炼铁、海水提镁的化学方程式
 蓝天空wxx1年前1
蓝天空wxx1年前1 -
 无心无知 共回答了19个问题
无心无知 共回答了19个问题 |采纳率84.2%制硫酸:
2SO2+O2==2SO3 (可逆反应,条件:高温高压、催化剂)
SO3+H2O==H2SO4(实际操作时用98%的浓硫酸吸收SO3 )
合成氨:
N2+3H2==2NH3(可逆反应,条件:高温高压、催化剂)
高炉炼铁:(原料是焦炭和铁矿石)
C+O2==CO2 (条件:高温或点燃)
CO2+C==2CO (条件:高温)
3CO+Fe2O3==2Fe+3CO2(CO是主要的还原剂,条件:高温)
海水提镁:
MgSO4+2NaOH==Na2SO4+Mg(OH)2(富集,也有MgCl2反应)
Mg(OH)2==MgO+H2O(条件:加热)
2MgO==2Mg+O2(条件:电解)(也可以将MgO与HCl反应制成更纯净的MgCl2再电解)1年前查看全部
- 高炉炼铁的原理 化学方程式C+O2=CO2的条件到低是高温还是点燃啊 哥哥姐姐帮帮俺吧
 孤单如影随形1年前3
孤单如影随形1年前3 -
 无休止 共回答了19个问题
无休止 共回答了19个问题 |采纳率84.2%点燃1年前查看全部
- 高炉炼铁反应中 不是fe3o4还原成fe2o3 在由fe2o3还原成feo 又变成fe么
 天慕雪蕊1年前3
天慕雪蕊1年前3 -
 讨厌空调 共回答了12个问题
讨厌空调 共回答了12个问题 |采纳率91.7%不是的,都是铁的氧化物还原成铁1年前查看全部
- 高炉炼铁为什么生铁出口低于煤渣出口
 ten33071年前1
ten33071年前1 -
 lq2008ql 共回答了22个问题
lq2008ql 共回答了22个问题 |采纳率95.5%渣的密度低 浮在铁水上面 其实铁口渣口性质都一样的 都是从炉子里排出东西 只是因为两个口的位置不同 打开后先排出的东西也不同 所以分为铁口和渣口 随着矿石入炉品位的提高渣量的减少 现代高炉已经很少再设置专门的渣口 就设个铁口 铁口打开后出铁 出到一定程度就有渣和铁水一起出来了1年前查看全部
- I.高炉炼铁的主要反应为Fe 2 O 3 +3CO2Fe+3CO 2 。
I.高炉炼铁的主要反应为Fe 2 O 3 +3CO2Fe+3CO 2 。
已知该反应的 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe 2 O 3 、CO、CO 2 各1.OmoI,反应经10 min后达到平衡。
H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe 2 O 3 、CO、CO 2 各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO 2 )=_________mol/L min
min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
E.使用合适的催化剂 F.减少容器的容积A.减少Fe的量 B.增加Fe 2 O 3 的量 C.升高反应温度 D.移出部分CO 2
Ⅱ.已知化学反应①:Fe(s)+CO 2 (g) FeO(s)+CO(g),其平衡常数为K 1 ;化学反应②:Fe(s)+H 2 O(g)
FeO(s)+CO(g),其平衡常数为K 1 ;化学反应②:Fe(s)+H 2 O(g) FeO(s)+H 2 (g),其平衡常数K 2 .在温度973K和1173K情况下,K 1 、K 2 的值分别如下:
FeO(s)+H 2 (g),其平衡常数K 2 .在温度973K和1173K情况下,K 1 、K 2 的值分别如下:温度 K 1 K 2 973K 1.47 2.38 1173K 2.15 1.67
(4)通过表格中的数值可以推断:反应①的△H_ O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K 3 =____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K 3 =__________。据此关系式和上表数据,也能推断出反应③的△H_ _0(填“>”“<”)。 sweetdays1年前1
sweetdays1年前1 -
 心之蚀 共回答了19个问题
心之蚀 共回答了19个问题 |采纳率94.7%(14分)
(1)0.006(2分)
(2)60%(2分)
(3)D(2分)
(4)>(2分)
(5) (2分)
(2分)
(6)K 3 =K 1 /K 2 (2分) >(2分)
I.⑴在1000℃时,该反应的平衡常数K=64,在10L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe 2 O 3 (s)+3CO(g) 2Fe(s)+3CO 2 (g)
2Fe(s)+3CO 2 (g)
起始量(mol) 1 1 1 1
变化量(mol) x x
平衡量(mol) 1-x 1+x
K=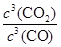 =
= =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
v(CO 2 )= =0.006mol/L
=0.006mol/L min
min
故答案为:⑴0.006mol/L min⑵60%;
min⑵60%;
⑶A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe 2 O 3 的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故C错误;
D.移出部分CO 2 ,平衡向正反应移动,CO的平衡转化率增大,故D正确;
E.加入合适的催化剂,平衡不移动,故E错误;
F.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故F错误;
故选D;
⑷由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,△H >0
故答案为:>;
⑸依据反应CO 2 (g)+H 2 (g) CO(g)+H 2 O(g),根据平衡常数的概念,该反应的平衡常数K 3 的数学表达式:K=
CO(g)+H 2 O(g),根据平衡常数的概念,该反应的平衡常数K 3 的数学表达式:K=
,故答案为:
(6)已知:①Fe(s)+CO 2 (g) FeO(s)+CO(g);
FeO(s)+CO(g);
②Fe(s)+H 2 O(g) FeO(s)+H 2 (g);
FeO(s)+H 2 (g);
利用盖斯定律将①-②可得:③H 2 (g1年前查看全部
- 高炉炼铁的主要反应是:Fe 2 O 3 +3CO 2Fe +3CO 2 。下列说法正确的是( ) A.CO 2 的电子
高炉炼铁的主要反应是:Fe 2 O 3 +3CO
 2Fe +3CO 2 。下列说法正确的是()
2Fe +3CO 2 。下列说法正确的是()A.CO 2 的电子式为 
B.Fe 2 O 3 分别与浓硝酸和稀硝酸反应,二者产物不同 C.在高炉炼铁过程中,若增加炼铁高炉的高度能提高CO的转化率 D.在高炉炼铁过程中,将铁矿石粉碎后投入高炉可以提高该反应的化学反应速率  爱上水妖的牧神1年前1
爱上水妖的牧神1年前1 -
 zhuozhuoh3 共回答了15个问题
zhuozhuoh3 共回答了15个问题 |采纳率93.3%1年前查看全部
- 下列说法正确的是( )A.工业上炼铁是用电炉B.工业炼铁的原料主要是:生铁、焦炭、石灰石C.高炉炼铁时,加入石灰石的目
下列说法正确的是( )
A.工业上炼铁是用电炉
B.工业炼铁的原料主要是:生铁、焦炭、石灰石
C.高炉炼铁时,加入石灰石的目的是把矿石中的二氧化硅转变成炉渣去掉
D.高炉炼出的铁是纯铁 杨衡1年前1
杨衡1年前1 -
 lukicat 共回答了15个问题
lukicat 共回答了15个问题 |采纳率86.7%解题思路:A.根据工业炼铁的设备来分析;B.根据炼铁的原料来分析;C.根据炼铁过程中加入石灰石的作用来分析;D.根据高炉炼铁的产物来分析.A.工业炼铁用高炉,故错误;
B.工业炼铁的原料主要是铁矿石、焦炭、石灰石,故错误;
C.高炉炼铁时,加入石灰石的作用是把矿石中的二氧化硅转化为炉渣除去,故正确;
D.高炉炼出的铁中含有杂质,属于生铁,故错误.
故选C.点评:
本题考点: 铁的冶炼.
考点点评: 本题考查了高炉炼铁的知识,题目比较简单,要掌握高炉炼铁的原理、设备及原料.1年前查看全部
- 化学一个题(2012•雅安)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如图所示. (
化学一个题(2012•雅安)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如图所示. (
(2012•雅安)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如图所示.
(1)A处发生反应的化学方程式是
Fe2O3+3CO 高温 .2Fe+3CO2
.
(2)B中发生反应的化学方程式是
Ca(OH)2+CO2=CaCO3↓+H2O
C处点燃酒精灯的目的是
燃烧未反应的一氧化碳,防止剩余的CO扩散到空气中,污染空气
.
(3)实验结束后,小李看到红色固体全部变黑了,认为产物就是单质铁,但小王提出了质疑:还有可能生成其它物质.为了进一步验证其固体成分,小王查到下列资料:
①铁的氧化物有氧化铁、氧化亚铁、四氧化三铁(该化合物中铁有+2、+3两种化合价),其中氧化铁为红棕色,其余都为黑色;并且只有四氧化三铁能被磁铁吸引.
②铁的氧化物(四氧化三铁除外)都能与酸发生反应而溶解.
根据上述信息,小王又设计了两个实验.
【实验1】
将黑色固体研磨后,取少量加入足量
稀盐酸
溶液中,观察到有气泡出现,溶液未变黄色,据此得出的结论是
一定有单质铁,一定没有氧化铁
.
【实验2】
再用磁铁吸引余下黑色固体,实验后即可对黑色固体成分进行判断
如果黑色固体被磁铁全部吸引,说明只有单质铁;如果被部分吸引,说明黑色固体为Fe和FeO
.
.请大神帮忙分析下第三问... angsigh1年前1
angsigh1年前1 -
 猪婆君 共回答了17个问题
猪婆君 共回答了17个问题 |采纳率76.5%我不知道你的第三问是什么,我简单分析一下吧.
实验一:有气泡产生,那么只有单质铁与酸发生置换反应生成氢气,由于四氧化三铁不能溶解于酸,那么溶液中为变黄说明没有三价铁,也就是说不存在氧化铁.氧化亚铁是无色的,所以无法判断是否有氧化亚铁.四氧化三铁通过是否有为溶解无判断.
实验二:进一步验证氧化亚铁.首先吸铁石是可以吸引铁和四氧化三铁的,如果全部吸引,那么就是没有氧化亚铁.如果是部分吸引,则就存在氧化亚铁.1年前查看全部
- 高炉炼铁一小时10吨需多大容量的炉
 手机让你哭1年前1
手机让你哭1年前1 -
 TatenceLi 共回答了26个问题
TatenceLi 共回答了26个问题 |采纳率80.8%80-100m3够了1年前查看全部
- (本题共12分)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示。
(本题共12分)某实验小组模拟高炉炼铁的化学反应原理进行实验,其装置如下图所示。

(1)A处发生反应的化学方程式是 。
(2)B中发生反应的化学方程式是_____________________。
C处点燃酒精灯的目的是_______________________。
(3)实验结束后,小李看到红色固体全部变黑了,认为产物就是单质铁,但小王提出了质疑:还有可能生成其它物质。为了进一步验证其固体成分,小王查到下列资料:
铁的氧化物有氧化铁、氧化亚铁、四氧化三铁(该化合物中铁有+2、+3两种化合价),其中氧化铁为红棕色,其余都为黑色;并且只有四氧化三铁能被磁铁吸引。②铁的氧化物都能与酸发生反应而溶解。
根据上述信息,小王又设计了两个实验。
①将黑色固体研磨后,取少量加入_______溶液中,观察到有气泡出现,溶液未变黄色,据此得出的结论是______________________________。
2再用磁铁吸引余下黑色固体,实验后即可对黑色固体成分进行判断_______________________________________________________________。 zjm102501年前1
zjm102501年前1 -
 小易拉罐 共回答了24个问题
小易拉罐 共回答了24个问题 |采纳率91.7%(1)3CO+Fe 2 O 3 2Fe + 3CO 2 (2分)
2Fe + 3CO 2 (2分)
(2)CO 2 +Ca(OH) 2 = CaCO 3 ↓ + H 2 O(2分);防止CO污染环境(1分)
(3)①稀硫酸(或稀盐酸)(1分);有单质铁(1分),无Fe 3 O 4 (1分)
2如果黑色固体被磁铁全部吸引(1分),说明只有单质铁(1分),如果被部分吸引(1分),说明黑色固体为Fe和Fe 3 O 4 (1分)。
(1)A处发生的化学反应为CO还原Fe 2 O 3 ,其化学方程式为3CO+Fe 2 O 3 2Fe + 3CO 2 ;
2Fe + 3CO 2 ;
(2)A处产生的CO 2 气体进入装置B中,可以使澄清石灰水变沉淀,其化学方程式为CO 2 +Ca(OH) 2 = CaCO 3 ↓ + H 2 O,CO 2 气体中会混有少量的CO气体,由于CO有毒又可以燃烧,故C处点燃酒精灯的目的是防止CO污染环境;
(3)①金属铁与酸反应会生成氢气产生气泡,故加入的溶液应为酸性溶液——稀硫酸(或稀盐酸);溶液未变黄色,说明该溶液不含有Fe 3+ ,故黑色固体不含有四氧化三铁,只含有铁单质;
2若用磁铁吸引余下黑色固体,如果黑色固体被磁铁全部吸引,说明只有单质铁,如果被部分吸引,说明黑色固体为Fe和Fe 3 O 4 。1年前查看全部
- 某地根据当地资源特点将石灰石开采、加工和高炉炼铁建在一起形成联产.
某地根据当地资源特点将石灰石开采、加工和高炉炼铁建在一起形成联产.
(1)炼铁的原料有铁矿石、焦炭、石灰石和空气.焦炭的主要作用有两点:其一是生成还原剂CO,其二是______.
(2)炼铁过程中,固体原料从炉顶往下加,而热空气却是从炉底通入.这样做的优点是______.
(3)高炉炼铁排放的废气中含有大量的高温一氧化碳,可作为能源用来煅烧石灰石.请写出煅烧石灰石的化学方程式:CaCO3
CaO+CO2↑高温 .CaCO3.
CaO+CO2↑高温 .
(4)此联产方式的主要优点是:______ (答出一点即可). 苏雨20061年前1
苏雨20061年前1 -
 魔枫狂灵 共回答了21个问题
魔枫狂灵 共回答了21个问题 |采纳率81%解题思路:(1)根据高炉炼铁的原料及各原料的作用分析即可;
(2)根据高炉炼铁时原料的加入方法分析;
(3)根据煅烧石灰石的原理分析即可;
(4)综合考虑炼铁和煅烧石灰石的原理.(1)炼铁时要用到焦炭,它有两个作用.炼铁时需要高温,焦炭与氧气反应生成二氧化碳,同时放出大量热,可供给炼铁使用;炼铁时还需一氧化碳作还原剂,二氧化碳与过量焦炭反应可以生成一氧化碳;
(2)高炉炼铁时原料的加入方法是:铁矿、焦炭、石灰石从炉顶投入,而高温的空气从炉底通入,这样原料和空气可以充分接触;
(3)高温煅烧石灰石生成氧化钙和二氧化碳;
(4)煅烧石灰石需要高温,而高炉废气中含有大量高温的一氧化碳,所以可以用一氧化碳带出来的热能供给煅烧石灰石所需要的能量.
故答案为:(1)燃烧放热,维持炉温;
(2)使反应物充分接触;
(3)CaCO3
高温
.
CaO+CO2↑;
(4)降低成本(或变废为宝、减少环境污染、节约能源、合理利用资源等,其他合理答案均可).点评:
本题考点: 铁的冶炼;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题是对炼铁知识的考查,解决的关键是知道炼铁的原理、原料及过程,属基础性知识考查题.1年前查看全部
大家在问
- 1相遇时间=路程和(差)?/速度和(差)?
- 2写出格言的引申含义一分耕耘,一分收获.春华秋实.种瓜得瓜,种豆得豆.一年之计在于春.
- 31:One day two fathers and two sons went hunting.They killed
- 4含有分别以Z Y L开头的单词组成的唯美英文句子.
- 5Fe3+ I- H+ Cl- 能 共存吗 为什么
- 6a+b的绝对值再加a-b的平方等于0求2A+3B等于多少
- 7物体的体积跟浸入水中排开的体积浸入之后是相等吗?我是指一样物体,无论浸在什么液体,排开的液体相等吗?
- 8演讲2200多字十个自然段的演讲稿怎么背才能记牢啊?
- 9小甘的练习册很好吗我们这里的很多人都选择的是小甘英语,所以我想知道它到底实不实用
- 10介绍自己的英语小短文结尾怎么写
- 11在大雨中洗个澡时官兵们最痛快的是改变词序改变下面的句子不改变句子的意思
- 121..已知常数a,b和正变量x,y满足a+b=10,a\x+b\y=1,x+y的最小值为18,求a,b的值.
- 13设y=e^x是微分方程xy'+p(x)y=x的一个解,求此微分方程满足条件y(ln2)=0的特解
- 14在矩形ABCD中,AB=3,AD=4,将一个足够大的直角三角板ROQ的直角顶点O放在对角线AC上(除A、C两点外),将三
- 15(2014•余姚市模拟)某程序图如图所示,该程序运行后输出的结果是( )



