将31克的氯酸钾和二氧化锰的混合物进行加热,反应完全后,得到21.4克固体.求剩余固体中含什么物质,各多少克.
 ztenj2022-10-04 11:39:541条回答
ztenj2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 一觉到kk 共回答了21个问题
一觉到kk 共回答了21个问题 |采纳率76.2%- 反应失去31-21.4=9.6g的O2,根据方程式计算可得,那剩余固体只能是15.9g的KCl、1g的KClO3和5.5g的MnO2了
- 1年前
相关推荐
- 在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会______(填“加快”或“减慢”
在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会______(填“加快”或“减慢”或“不变”),产生的氧气的质量会______(填“增加”或“减少”或“不变”),高锰酸钾在反应中______催化剂(填“是”或“不是”).氯酸钾受热制氧气的化学方程式为:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△  橙小丸91年前1
橙小丸91年前1 -
 shengchiyou 共回答了16个问题
shengchiyou 共回答了16个问题 |采纳率93.8%解题思路:根据高锰酸钾分解的产物(锰酸钾、二氧化锰和氧气)、催化剂的定义进行分析解答本题.高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,高锰酸钾分解生成的二氧化锰能对氯酸钾的分解起到催化作用,故在氯酸钾受热制氧气的实验中,若没有催化剂二氧化锰,则加入少量的高锰酸钾后,反应的速度会加快;由于高锰酸钾分解生成氧气,故产生的氧气的质量会增加;高锰酸钾在反应中不是催化剂,作催化剂的是高锰酸钾分解生成的二氧化锰.氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
故答案为:加快;增加;不是;2KClO3
MnO2
.
△2KCl+3O2↑.点评:
本题考点: 实验室制取氧气的反应原理;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,掌握实验室制取氧气的原理原理、催化剂的概念等并能灵活运用是正确解答本题的关键.1年前查看全部
- 某同学取0.5g的二氧化锰和一定量的氯酸钾混合加热制取氧气.加热一段时间,冷却后称得剩余固体质量为15.4g
某同学取0.5g的二氧化锰和一定量的氯酸钾混合加热制取氧气.加热一段时间,冷却后称得剩余固体质量为15.4g
试问:生成______克氧气,剩余固体中一定存在的物质是_________.参加反应的氯酸钾的质量是多少? ys8301年前2
ys8301年前2 -
 呵呵天亮了 共回答了11个问题
呵呵天亮了 共回答了11个问题 |采纳率100%加热一段时间,不一定完全反应,缺数据,无法计算
如果完全反应,剩余固体中氯化钾的质量为:15.4g-0.5g=14.9g
2KClO3=MnO2=2KCl+3O2
245 149 96
x 14.9g y
245/x=149/14.9g=96/y
x=24.5g y=9.6g
生成_9.6_克氧气,剩余固体中一定存在的物质是_氯化钾14.9g,二氧化锰0.5g__.参加反应的氯酸钾的质量是 24.5g1年前查看全部
- 在实验室中可用如图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
在实验室中可用如图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
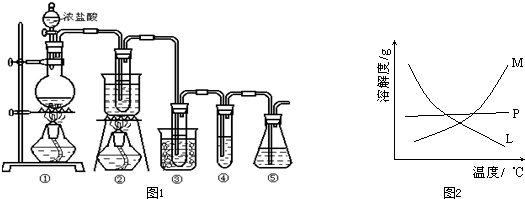
图1中:①为氯气发生装置;②的试管里盛有15mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置.
请填写下列空白:
(1)制取氯气时,在烧瓶里加人一定量的二氧化锰,通过______(填写仪器名称)向烧瓶中加人适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有______(填写下列编号字母)的净化装置.
A.碱石灰B.饱和食盐水C.浓硫酸D.饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是______.反应完毕经冷却后,②的试管中有大量晶体析出.图2中符合该晶体溶解度曲线的是______(填写编号字母);从②的试管中分离出该晶体的方法是
______(填写实验操作名称).
(3)本实验中制取次氯酸钠的离子方程式是:______.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化:紫色→______→______→黄绿色. 七朵半rr1年前1
七朵半rr1年前1 -
 flying_78 共回答了18个问题
flying_78 共回答了18个问题 |采纳率88.9%解题思路:(1)实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,可用饱和食盐水除去氯气中的氯化氢气体;
(2)在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,溶质的溶解度随温度的降低而降低;
(3)氯气在常温下与NaOH反应生成次氯酸钠和氯化钠;
(4)氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色.( l )实验室制备氯气用浓盐酸和二氧化锰在加热条件反应,所用反应仪器为分液漏斗和圆底烧瓶,通过分液漏斗向烧瓶中加人适量的浓盐酸;用饱和食盐水除去氯气中的氯化氢气体,故在①与②之间安装盛有饱和食盐水的洗气瓶,
故答案为:分液漏斗;B;
( 2 )根据题中信息可知,在加热条件下,氯气与浓KOH溶液反应生成氯酸钾,在常温以下,氯气与稀NaOH溶液反应生成次氯酸钠,二者反应的浓度和温度都不相同,反应完毕经冷却后,②的试管中有大量晶体析出,说明溶质的溶解度随温度的降低而降低,只有M符合,不溶性固体与液体的分离常采用过滤的方法,
故答案为:碱溶液(或反应物)的浓度不同,反应温度不同; M;过滤;
( 3 )氯气在常温下与NaOH反应生成次氯酸钠和氯化钠,二者在水中溶解且电离,反应的离子方程式为Cl2+2OH-═ClO-+Cl-+H2O,
故答案为:Cl2+2OH-=ClO-+Cl-+H2O;
( 4 )氯气与水反应生成盐酸和次氯酸,反应生成的H+使石蕊变成红色,次氯酸具有强氧化性,将石蕊氧化为无色物质,所以反应现象为先变红,后褪色,反应后如继续通入氯气,氯气微溶于水,则为氯气的溶液,溶液呈黄绿色,
故答案为:红色;无色.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氯气的制备、性质、实验方案的设计、评价,该类试题综合性强,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,注意该类试题常以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确及灵活运用知识解决实际问题的能力,该题难度中等.1年前查看全部
- 用氯酸钾制取氧气、 将收满氧气的集气瓶正放在实验桌面上的原因是什么?
用氯酸钾制取氧气、 将收满氧气的集气瓶正放在实验桌面上的原因是什么?
甲烷的化学是是什么?
生石灰遇水变熟石灰的化学方程式是什么、 Litaolang1年前2
Litaolang1年前2 -
 苗蛊的老大 共回答了14个问题
苗蛊的老大 共回答了14个问题 |采纳率78.6%因为氧气的密度比空气大.或者说氧气的分子质量(32)比空气平均相对分子质量(29)大
CH4
CaO+H2O=Ca(OH)21年前查看全部
- 如何测知一定量的氯酸钾和二氧化锰的混合物反应后生成的氧气的量_______ 原理:________操作方法:______
如何测知一定量的氯酸钾和二氧化锰的混合物反应后生成的氧气的量_______ 原理:________操作方法:_______
我觉得因为在化学反应前后,反应物和生成物的总质量不变,那么生成氧气的质量是不是等于反应物二氧化锰和氯酸钾的混合物的质量呢?
望能尽快得到答复哦!好的一定立即采纳! aa都怕偶1年前1
aa都怕偶1年前1 -
 第三极刘诚 共回答了13个问题
第三极刘诚 共回答了13个问题 |采纳率92.3%氯酸钾和二氧化锰在加热条件下生成氯化钾和氧气.而二氧化锰在其中的作用只是起到催化剂的作用,加快反映的速率,可有可无.
测定氧气的量可用排水集气法,将一个量筒放入装有水的水槽中,灌满水,瓶口向下浸没于水中,将有氧气生成的导管通入瓶口内,当气体不在生成时,用玻璃盖盖住瓶口拿出水面,量出瓶中水的体积V1,用量筒总体积V-V1=氧气体积1年前查看全部
- (2008•松北区一模)实验室有下列仪器和氯酸钾、二氧化锰、稀硫酸、大理石、15%的过氧化氯溶液五种药品及蒸馏水、木块、
(2008•松北区一模)实验室有下列仪器和氯酸钾、二氧化锰、稀硫酸、大理石、15%的过氧化氯溶液五种药品及蒸馏水、木块、火柴等实验用品.
请回答下列问题:
(1)利用上述仪器和药品.可以制取的气体是______,用化学方程式表示制取该气体的化学反应原理2H2O2
2H2O+O2↑MnO2 .2H2O2制取该气体所选择的仪器是(填仪器序号)______,请画出制取该气体的装置图:
2H2O+O2↑MnO2 .
(2)在实验中,若用注射器代替长颈漏斗.其优点是______,换药品后,上述装置还可以制取的气体是______. 雪儿不回家1年前1
雪儿不回家1年前1 -
 zzos 共回答了21个问题
zzos 共回答了21个问题 |采纳率90.5%解题思路:(1)利用上述仪器和药品.可以制取的气体是氧气,如果制氧气只能是用双氧水制氧气,用氯酸钾制氧气需要铁架台,所给仪器中没有,制二氧化碳需用稀盐酸,所以只能制氧气;
(2)若用注射器代替长颈漏斗,可以控制反应的进行,如果换药品后还可以制取二氧化碳.(1)氯酸钾制氧气需要用到铁架台,而所给仪器中没有,制二氧化碳需要用到大理石和稀盐酸,所给药品中也没有,只能是用双氧水制氧气,先检查装置的气密性,再向锥形瓶中加入二氧化锰,从长颈漏斗口加入双氧水,待气泡连续均匀冒出再用向上排空气法收集.所以用到的仪器有:③④⑤⑥⑩.
(2)用注射器,可以控制反应速度,也可以控制反应的发生和停止,节约了药品.
故答案为(1)氧气,2H2O2
MnO2
.
2H2O+O2↑,③④⑤⑥⑩ ;
;
(2)控制反应速度,也可以控制反应的发生和停止,节约了药品;二氧化碳点评:
本题考点: 实验室制取气体的思路;制取气体的反应原理的探究;化学实验方案设计与评价;仪器的装配或连接;书写化学方程式、文字表达式、电离方程式.
考点点评: 利用所给的仪器和药品来制取气体时,首先考虑制取某种气体用到什么药品,所给药品中是否有,如果有了再考虑用到什么仪器,所给的仪器中是否都有,按照这样的思路考虑.1年前查看全部
- 氯酸钾和二氧化锰混合制氧使用排水法收集的氧气中混有空气的原因是什么
 polaris_yang1年前1
polaris_yang1年前1 -
 kk做手术 共回答了15个问题
kk做手术 共回答了15个问题 |采纳率86.7%原因可能有2个
1是等气泡一冒出立刻开始收集,原试管内留有的空气进入
2是通过氯酸钾和二氧化锰混合制氧可以有两个化学式
(1)2KClO3===(MnO2加热)===2KCl+3O2上箭头
(2)2KClO3+2MnO2===加热===2KMnO4+Cl2上箭头+O2上箭头
还可以有氯气生成
有什么不明白可以继续问,随时在线等.1年前查看全部
- (2013•黄浦区一模)实验室对氯酸钾和二氧化锰混合制取氧气后的剩余固体进行了如下实验
(2013•黄浦区一模)实验室对氯酸钾和二氧化锰混合制取氧气后的剩余固体进行了如下实验
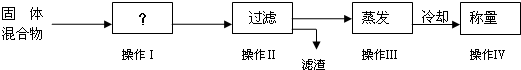
①写出操作Ⅰ的名称______;
②操作Ⅳ称量所得的固体为1.49g(不计每步操作损耗),请问该实验中氯酸钾和二氧化锰混合加热,产生了多少molO2?(根据化学方程式列式计算) lzhf19861年前1
lzhf19861年前1 -
 烧香的猪 共回答了19个问题
烧香的猪 共回答了19个问题 |采纳率84.2%解题思路:要将二氧化锰从混合物中分离出来,首先将固体溶解再进行过滤;根据操作过程可知:操作Ⅳ所得固体为氯化钾,根据氯化钾的质量并结合方程式可减少出生成氧气的物质的量.(1)要将二氧化锰从混合物中分离出来,首先将固体溶解再进行过滤;
故答案为:溶解;
(2)氯化钾的物质的量为:[1.49g/74.5g/mol]=0.02mol
设生成O2x mol.
2KClO3
MnO2
.
△3O2↑+2KCl
32
x0.02mol
[3/x]=[2/0.02mol]
x=0.03mol
答:生成O20.03mol.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 本题考查了学生获取信息,及利用方程式规范答题的能力,要细心分析,仔细解答.1年前查看全部
- 取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后停止加热冷却称得大试管中剩余固体的质...
取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后停止加热冷却称得大试管中剩余固体的质...
取氯酸钾与二氧化锰的混合物30g放在大试管中加热,过一段时间后停止加热冷却称得大试管中剩余固体的质量为25.5g 然后继续加热,至不再有气体放出为止第二次收集氧气为4.8g1共收集到氧气多少克2第一次加热后,有多少克氯酸钾分解了3第一次加热后剩余的25.2g固体中含有那些物质各多少克 baobaomimi1年前2
baobaomimi1年前2 -
 haike200 共回答了23个问题
haike200 共回答了23个问题 |采纳率78.3%1、根据质量守恒定律第一次收集到氧气质量=30g-25.5g=4.5g
一共收集到氧气的质量=4.8g+4.5g=9.3g
2、设第一次加热分解的氯酸钾质量为X,生成氯化钾的质量为Y
2KClO3 = MnO2 △=2KCl + 3O2 ↑
245 149 96
X Y 4.5g
X=11.5g
Y=7g
3、设第二次分解氯酸钾的质量为Z
2KClO3 = MnO2 △=2KCl + 3O2 ↑
245 96
Z 4.8g
Z=12.25g
二氧化锰的质量=25.5g-12.25g-7g=6.25g
第一次加热后剩余的25.2g固体中含有氯酸钾、氯化钾、二氧化锰,
质量分别是:12.25g、7g、6.25g
希望我回答能对你的学习有帮助!1年前查看全部
- 某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下:
某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用.实验步骤如下: 
①称量ag胆矾固体放入烧杯中,加水制成溶液,向其中滴加氢氧化钠溶液至溶解完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热至溶液中的沉淀全部变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为bg;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如图所示.请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是(填写序号)______.
(2)由胆矾制备氧化铜的产率(实验产量与理论产量的百分比)为______×100%.
(3)为保证Cu 2+ 沉淀完全,步骤①中溶液的pH应大于10,简述pH试纸测定溶液pH的操作:______.
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①~④后还应该进行的实验操作是(按实验先后顺序填写字母序号)______.
a、过滤b、烘干c、溶解d、洗涤e、称量
(5)但有的同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用.你认为还应该进行的另一个实验是______. 2006andy1年前1
2006andy1年前1 -
 fhb0991 共回答了14个问题
fhb0991 共回答了14个问题 |采纳率100%(1)胆矾固体放入烧杯中,加水制成溶液时需要用玻璃棒搅拌,加速胆矾固体溶解速度;在蒸发时用玻璃棒搅拌,是为了防止局部温度过高使液滴飞溅;过滤时用到玻璃棒的作用是引流;氧化铜固体和一定质量的氯酸钾固体,混合均匀也需要玻璃棒的搅拌,所以选择①②③④;
(2)ag胆矾中含铜元素质量为ag×
64
250 =
64
250 a ,设能制得氧化铜的质量为X由X×
64
80 ×100% ═
64
250 a 解得X=
8
25 a 所以由胆矾制备氧化铜的产率:
bg
8
25 a ×100%=
25b
8a ;
(3)pH试纸的用法:用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读出数值即可;
(4)由于需要证明反应前后氧化铜的质量不变,反应后先将氧化铜从混合物中分离出来:加水溶解,进行过滤,得到的氧化铜上有氯化钾溶液,进行洗涤干燥,再进行称量即可;
(5)通过对比实验才能说明氧化铜的确加快了氯酸钾的反应速度,另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢,现象很明显.
故答案为:(1)①②③④;(2)25b/8a;(3)用干燥的玻璃棒蘸取少量溶液滴在pH试纸上,将呈现的颜色和标准比色卡对比,读数;(4)cadbe;(5)另取相同质量的氯酸钾固体,不加氧化铜直接加热,对比放出氧气的速率快慢.1年前查看全部
- (2009•天河区一模)现有 ①四氧化三铁,②甲烷,③铜粉,④氯酸钾,⑤氧气,⑥水,⑦
(2009•天河区一模)现有①四氧化三铁,②甲烷,③铜粉,④氯酸钾,⑤氧气,⑥水,⑦乙醇,⑧碳酸钠等物质,
(1)属于有机化合物的是(填编号,下同) ______;
(2)属于单质的是 ______;
(3)属于氧化物的是 ______;属于盐的是 ______. 狐媚天香1年前1
狐媚天香1年前1 -
 木而风 共回答了17个问题
木而风 共回答了17个问题 |采纳率100%解题思路:利用纯净物、有机物及化合物的分类可以解决此题,有机物是含碳的化合物;单质是含一种元素的纯净物;氧化物是由两种元素组成,其中一种是氧元素;盐是电离时生成金属离子与酸根离子的化合物.(1)有机物是含碳的化合物,故答案为:②⑦
(2)单质是纯净物,只含一种元素.故答案为:③⑤
(3)氧化物是含氧元素的化合物,且只有两种元素;盐是电离时生成金属离子与酸根离子的化合物.
故答案为:①⑥;④⑧点评:
本题考点: 有机物与无机物的区别;物质的简单分类;单质和化合物的判别;常见的氧化物、酸、碱和盐的判别.
考点点评: 此题是对物质分类知识的考查,通过对有机物、单质、氧化物、盐的选择,加深了对物质分类知识的理解.1年前查看全部
- 用排水法收集3瓶每瓶250ml的氧气,需称取的氯酸钾质量为2.74g 氧气密度1.43g每l 这句话咋不对了
 夏季未了1年前2
夏季未了1年前2 -
 shawthesky1 共回答了11个问题
shawthesky1 共回答了11个问题 |采纳率100%氧气的质量为:1.43g/L*(250ml*3)/1000ml/L=1.07g
2KClO3----->3O2
123.5*2 96
X 1.07
X=2.74g
理论上是正确的
但实际需要排掉反应容器中的空气,所以要大于2.74g1年前查看全部
- 把氯酸钾和二氧化锰混合物25克放在试管里加热,直到氯酸钾全部完全冷却后称得剩余固体物质的质量为15.4g.
把氯酸钾和二氧化锰混合物25克放在试管里加热,直到氯酸钾全部完全冷却后称得剩余固体物质的质量为15.4g.
1.反应后制得氧气多少克?
2.原混合物中氯酸钾有多少克?
3.原混合物中二氧化锰有多少克? 光头chen1年前2
光头chen1年前2 -
 xiaoye5577 共回答了15个问题
xiaoye5577 共回答了15个问题 |采纳率86.7%1,由于MnO2是催化剂所以不参加反应,KClO3在MnO2得催化下加热生成KCl与O2,所以氧气为9.6g.2,因为2KClO3=加热=2KCl+3O2所以M(KClO3)=225*9.6/96=24.5g.3.M(MnO2)=25-24.5=0.5.1年前查看全部
- 氯酸钠氯酸钾和碘化钾反应为何要在硫酸介质中进行
 forgive_hate1年前1
forgive_hate1年前1 -
 glay820530 共回答了21个问题
glay820530 共回答了21个问题 |采纳率85.7%硫元素S是媒介元素,氯酸钠氯酸钾和碘化钾需要媒介元素支持反应1年前查看全部
- 现有①铁 ②氧化镁 ③氧气 ④氯酸钾 ⑤四氧化三铁 ⑥石灰水 ⑦水 ⑧洁净的空气等八种物质,其中属于混合物的是(以下均填
现有①铁 ②氧化镁 ③氧气 ④氯酸钾 ⑤四氧化三铁 ⑥石灰水 ⑦水 ⑧洁净的空气等八种物质,其中属于混合物的是(以下均填序号)______,属于化合物的是______,属于单质的______,属于氧化物的是______.
 chris66181年前6
chris66181年前6 -
 小妖精楠楠 共回答了22个问题
小妖精楠楠 共回答了22个问题 |采纳率86.4%解题思路:由一种物质组成的物质属于纯净物,由两种或两种以上物质组成的物质属于混合物.由一种元素组成的纯净物属于单质,由不同元素组成的纯净物属于化合物.由两种元素组成,一种元素是氧元素的化合物属于氧化物.①铁由一种物质组成,属于纯净物,由铁元素一种元素组成,属于单质;②氧化镁由氧化镁一种物质组成,属于纯净物,由镁和氧两种元素组成,属于化合物,还属于氧化物;③氧气由氧分子一种分子构成,属于纯净物,由氧元素一种元素组成,属于单质;④氯酸钾由一种物质组成,属于纯净物,由钾、氯、氧三种元素组成,属于化合物;⑤四氧化三铁由一种物质组成,属于纯净物,由铁和氧两种元素组成,既属于化合物,又属于氧化物;⑥石灰水中含有氢氧化钙和水两种物质,属于混合物; ⑦水由水分子一种分子构成,属于纯净物,由氢和氧两种元素组成,既属于化合物,又属于氧化物;⑧洁净的空气中含有氮气、氧气、二氧化碳等物质,属于混合物.
故答案为:⑥⑧;②④⑤⑦;①③;②⑤⑦.点评:
本题考点: 纯净物和混合物的判别;从组成上识别氧化物;单质和化合物的判别.
考点点评: 纯净物与混合物的区别:是否由一种物质组成,单质和化合物的区别是:是否由同种元素组成,氧化物是由两种元素组成、一种是氧元素.1年前查看全部
- 实验室常采用加热氯酸钾和二氧化锰的混合物制取氧气,怎样证明氧气是由氯酸钾而不是由二氧化锰分解生成的?
 风声雨起1年前5
风声雨起1年前5 -
 z38293 共回答了22个问题
z38293 共回答了22个问题 |采纳率86.4%在实验前称量二氧化锰的质量,实验之后把剩余固体放进足量水里,过滤,然后烘干,称量,后来的质量=原来二氧化锰的质量,就可以说明氧气不是二氧化锰分解产生的1年前查看全部
- 氯酸钾制取氧气的化学方程式是什么?
 lingru1年前4
lingru1年前4 -
 jianren88 共回答了18个问题
jianren88 共回答了18个问题 |采纳率77.8%2KClO3==(条件:加热)2KCl+3O21年前查看全部
- 氯酸钾在二氧化锰的催化下能分解为氯化钾和氧气,现有氯酸钾m克和n克二氧化锰的混合物,完全反应可得到w克固体,则生成的氧气
氯酸钾在二氧化锰的催化下能分解为氯化钾和氧气,现有氯酸钾m克和n克二氧化锰的混合物,完全反应可得到w克固体,则生成的氧气的克数为( )
A.m+n
B.m+n-w
C.m+n+w
D.m-w 平平淡淡的1年前1
平平淡淡的1年前1 -
 chenhuishiling 共回答了18个问题
chenhuishiling 共回答了18个问题 |采纳率83.3%解题思路:固体质量减少是因为产生了氧气这种气态物质,它会逸出体系,使得固体质量减少,所以生成氧气的质量就是固体减少的质量,可以据此结合二氧化锰的作用即催化剂的概念来解答该题.参加反应的氯酸钾的质量等于反应后生成的氯化钾和氧气的质量和,由于氧气逸散到空气中,所以反应后减少的质量就是生成的氧气的质量;二氧化锰在反应中充当了催化剂,其质量在反应前后不发生改变,所以剩余固体的质量为wg中包含着二氧化锰,故在计算质量的减少量时,必须加上二氧化锰的质量,所以生成氧气的质量为:(m+n-w)g,分析所给选项可以知道选项B是正确的.
故选:B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题考查质量守恒定律的内容以及应用,很具有新颖性,同时也考查了学生的分析和应变能力.1年前查看全部
- 某兴趣小组取氯酸钾和二氧化锰的混合物共26.5g进行加热,产生的气体质量随时间的关系如表所示:
某兴趣小组取氯酸钾和二氧化锰的混合物共26.5g进行加热,产生的气体质量随时间的关系如表所示:
加热时间 一分钟 三分钟 五分钟 七分钟 九分钟
产生的气体量 26.5g 23.8g 18.2g 16.9g 16.9g
试求:(1)由此可知,该小组共制得气体的量为-------- (2)求原混合物中氯酸钾的质量 (3)反应后混合物中二氧化锰的质量分数 tangtangjian1年前1
tangtangjian1年前1 -
 zwjoebear 共回答了20个问题
zwjoebear 共回答了20个问题 |采纳率85%小组共制得气体的量为:26.5-16.9=9.6g
2KClO3===MnO2====2KCl + 3O2
245 96
X=24.5 9.6g
原混合物中氯酸钾的质量:24.5g
反应后混合物中二氧化锰的质量:26.5-24.5=2g
质量分数:2/16.9=11.8%1年前查看全部
- 将ag的氯酸钾和bg的二氧化锰混合加热一会后得到cg残余物生成氧气多少g
 补_丁1年前1
补_丁1年前1 -
 hbycsmile 共回答了19个问题
hbycsmile 共回答了19个问题 |采纳率94.7%2KCLO3+MNO2=2KCL+3O2+MNO2
氧气的质量=ag+bg-cg1年前查看全部
- 现有氯酸钾和二氧化锰的混合物30g,加热完全反应后,冷却称量剩余物体的质量为20.4g
现有氯酸钾和二氧化锰的混合物30g,加热完全反应后,冷却称量剩余物体的质量为20.4g
求:剩余固体中二氧化锰的质量. 风霜渐起1年前2
风霜渐起1年前2 -
 忘记等于想起 共回答了18个问题
忘记等于想起 共回答了18个问题 |采纳率94.4%设混合物中的质量为x克,MnO2是催化剂,质量不变.反应前KClO3的质量为30-x克,反应后KCl的质量为20.4-x克.
2KClO3 = 2KCl + 3O2 (g)
2*122.5 2*74.5
30 - x 20.4 -x
245 :149 = (30 - x) :(20.4 - x)
x = 5.51年前查看全部
- 认为高锰酸钾不是氯酸钾分解的催化剂的理由是?
 清瘦的浮云1年前3
清瘦的浮云1年前3 -
 郁金飘香 共回答了20个问题
郁金飘香 共回答了20个问题 |采纳率90%在化学反应前后的KMno4的化学性质和质量都发生改变,而催化剂不变1年前查看全部
- 将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g.求:(1)生成氧气多少克?
将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g.求:(1)生成氧气多少克?
为什么我怎么算氧气的质量都不等于9.6 g 会游泳的树袋熊1年前3
会游泳的树袋熊1年前3 -
 小呓 共回答了16个问题
小呓 共回答了16个问题 |采纳率100%残渣中二氧化锰0.5g,氯化钾14.9g,正好是0.2mol,生成0.3mol氧气,正好是9.6g.1年前查看全部
- 按下列要求正确书写化学方程式:(1)实验室用氯酸钾和二氧化锰共热制取氧气:2KClO3MnO2.△2KCl+3O2↑2K
按下列要求正确书写化学方程式:
(1)实验室用氯酸钾和二氧化锰共热制取氧气:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3
2KCl+3O2↑MnO2 .△
(2)用熟石灰处理工厂排放出的废水中硫酸______
(3)用主要成分是Al(OH)3的药物来治疗胃酸过多______
(4)赤铁矿冶炼成铁的反应原理3CO+Fe2O3
2Fe+3CO2高温 .3CO+Fe2O3.
2Fe+3CO2高温 . sim959551年前1
sim959551年前1 -
 Iampigpig 共回答了24个问题
Iampigpig 共回答了24个问题 |采纳率91.7%解题思路:氯酸钾在二氧化锰的催化作用下,受热分解生成氯化钾和氧气;
稀硫酸和氢氧化钙反应生成硫酸钙和水;
氢氧化铝和稀盐酸反应生成氯化铝和水;
高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳.(1)氯酸钾在二氧化锰的催化作用下受热分解的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑;
(2)稀硫酸和氢氧化钙反应的化学方程式为:H2SO4+Ca(OH)2=CaSO4+2H2O;
(3)稀盐酸和氢氧化铝反应的化学方程式为:3HCl+Al(OH)3=AlCl3+3H2O;
(4)高温条件下,氧化铁和一氧化碳反应的化学方程式为:3CO+Fe2O3
高温
.
2Fe+3CO2.
故填:2KClO3
MnO2
.
△2KCl+3O2↑;H2SO4+Ca(OH)2=CaSO4+2H2O;3HCl+Al(OH)3=AlCl3+3H2O;3CO+Fe2O3
高温
.
2Fe+3CO2.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.1年前查看全部
- 根据所学知识回答下列问题:(1)实验室用B装置制取氧气的化学方程式为______;(2)实验室用氯酸钾制取氧气,可选用的
根据所学知识回答下列问题:
(1)实验室用B装置制取氧气的化学方程式为______;
(2)实验室用氯酸钾制取氧气,可选用的发生装置是______(填字母);
(3)实验室用C装置收集氧气时验满的方法是______.
 dukeking121年前1
dukeking121年前1 -
 他说下辈子 共回答了25个问题
他说下辈子 共回答了25个问题 |采纳率84%(1)装置B是固液常温型装置,可用双氧水溶液制取氧气,化学方程式为2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑.
(2)实验室用氯酸钾制取氧气,需要加热,所以用A作为发生装置.
(3)验满的方法是:将带火星的木条放在集气瓶口,若木条复燃,证明氧气收集满.
故答案为:(1)2H 2 O 2
Mn O 2
.
2H 2 O+O 2 ↑.
(2)A.
(3)将带火星的木条放在集气瓶口,若木条复燃,证明氧气收集满.1年前查看全部
- 19.向试管中加入a克高锰酸钾,加热后试管中剩余固体b克,再往试管中加c克氯酸钾,继续加热后,试管中剩余
19.向试管中加入a克高锰酸钾,加热后试管中剩余固体b克,再往试管中加c克氯酸钾,继续加热后,试管中剩余
固体d克,则生成氧气的质量为( )
19.答案:B 点拨:根据质量守恒定律,在化学反应后的:第一次生成的氧气的质量为(a-b)克;第二次氯酸钾全部反应后生成的氧气质量为c-d,两次生成氧气的质量为a-b+c-d 所以选B.
加入的物质的总质量=a+c
最后剩余的固体质量=d g
所以生成氧气的质量即是固体减小的质量,为a+c-d g 哪个答案才是对的?
我练习册上的答案是a+c-d g 真情告白52591年前4
真情告白52591年前4 -
 SDFGBAER 共回答了18个问题
SDFGBAER 共回答了18个问题 |采纳率94.4%第二个答案是对的.
因为在第一个答案中说【第二次氯酸钾全部反应后生成的氧气质量为c-d】,c是氯酸钾的质量,而d是ag高锰酸钾和cg氯酸钾加热分解后固体的总质量.所以c和d不属于一个范畴,不能乱减.另外c也有可能小于d,生成氧气的质量肯定不可能是负值,所以这种方法一定是错的.1年前查看全部
- 以下几种物质,请按要求用序号填空:①自来水②干冰③氖气④氯酸钾⑤水银等、其中属于混合物的是______;属于单质的是__
以下几种物质,请按要求用序号填空:①自来水②干冰③氖气④氯酸钾⑤水银等、其中属于混合物的是______;属于单质的是______;属于化合物的是______;常温下,属于气态单质的是______;属于氧化物的是______.
 纨绔谈歌1年前1
纨绔谈歌1年前1 -
 齐齐yy1 共回答了13个问题
齐齐yy1 共回答了13个问题 |采纳率92.3%解题思路:物质分为混合物和纯净物,混合物是由两种或两种以上的物质组成,自来水属于混合物;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质,氖气、水银属于单质;由两种或两种以上的元素组成的纯净物叫化合物,干冰、氯酸钾属于化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,干冰是二氧化碳的固体,属于氧化物.常温下,属于气态单质的是氖气.混合物是由两种或两种以上的物质组成,自来水属于混合物;纯净物是由一种物质组成.纯净物又分为单质和化合物.由同种元素组成的纯净物叫单质,氖气、水银属于单质;由两种或两种以上的元素组成的纯净物叫化合物,干冰、氯酸钾属于化合物.氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素,干冰是二氧化碳的固体,属于氧化物.常温下,属于气态单质的是氖气.故答案为:①;③⑤;②④;③;②;
点评:
本题考点: 纯净物和混合物的判别;单质和化合物的判别.
考点点评: 本考点考查了物质的分类,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用.本考点的基础性比较强,主要出现在选择题和填空题中.1年前查看全部
- 关于质量守恒定律的一道习题a克氯酸钾和b克二氧化锰的混合物,加热一会儿后,冷却,称得残余物质质量为c克,则生成氧气___
关于质量守恒定律的一道习题
a克氯酸钾和b克二氧化锰的混合物,加热一会儿后,冷却,称得残余物质质量为c克,则生成氧气_____克. yueminzhou1年前5
yueminzhou1年前5 -
 mousehj 共回答了27个问题
mousehj 共回答了27个问题 |采纳率96.3%a+b-c1年前查看全部
- 分别写出下列反应的化学方程式:(1)加热氯酸钾与二氧化锰制取氧气:2KClO3MnO2.△2KCl+3O2↑2KClO3
分别写出下列反应的化学方程式:
(1)加热氯酸钾与二氧化锰制取氧气:2KClO3
2KCl+3O2↑MnO2 .△ 2KClO3.
2KCl+3O2↑MnO2 .△
(2)电解水:2H2O
2H2↑+O2↑通电 .2H2O.
2H2↑+O2↑通电 .
(3)铁在氧气中燃烧:3Fe+2O2
Fe3O4点燃 .3Fe+2O2.
Fe3O4点燃 .
(4)二氧化碳通入澄清石灰水变浑浊:______
(5)红磷在氧气中燃烧:4P+5O2
2P2O5点燃 .4P+5O2;属于______反应.
2P2O5点燃 .
(6)3g H2在充足氧气中燃烧可以产生水的质量是______g.写出解题过程.
(7)16g甲在氧气中完全燃烧生成44CO2 和 36gH2O,求甲的化学式______. qianliang_g1年前1
qianliang_g1年前1 -
 嘎12 共回答了16个问题
嘎12 共回答了16个问题 |采纳率93.8%解题思路:首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写即可.(1)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为:2KClO3
MnO2
.
△2KCl+3O2↑.
(2)水通电分解生成氢气和氧气,反应的化学方程式为:2H2O
通电
.
2H2↑+O2↑.
(3)铁在氧气中燃烧生成四氧化三铁,反应的化学方程式为:3Fe+2O2
点燃
.
Fe3O4.
(4)石灰水中的溶质是氢氧化钙,能与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(5)生成五氧化二磷,反应的化学方程式为:4P+5O2
点燃
.
2P2O5,该反应符合“多变一”的特征,属于化合反应.
(6)设生成水的质量为x,
2H2+O2
点燃
.
2H2O
436
3g x
[4/36=
3g
x] x=27g.
(7)甲在氧气中充分燃烧生成二氧化碳和水,说明该物质中一定含有碳元素和氢元素,且反应前后碳元素和氢元素的质量不变,
则二氧化碳中碳元素质量为:44g×[12/44]=12g,水中氢元素质量为:36g×[1×2/18]=4g,碳和氢元素的质量和为:12g+4g=16g,故该物质不含有氧元素;
设其化学式为CxHy,则该分子中碳原子和氢原子的个数比为[12g/12]:[4g/1]=1:4,其化学式为CH4.
故答案为:(1)2KClO3
MnO2
.
△2KCl+3O2↑;
(2)2H2O
通电
.
2H2↑+O2↑;
(3)3Fe+2O2
点燃
.
Fe3O4;
(4)CO2+Ca(OH)2═CaCO3↓+H;
(5)4P+5O2
点燃点评:
本题考点: 书写化学方程式、文字表达式、电离方程式;质量守恒定律及其应用;根据化学反应方程式的计算.
考点点评: 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.1年前查看全部
- (2006•菏泽)某课外活动小组用氯酸钾和二氧化锰的混合物制取干燥、较纯净的氧气.实验步骤如下:
 (2006•菏泽)某课外活动小组用氯酸钾和二氧化锰的混合物制取干燥、较纯净的氧气.实验步骤如下:
(2006•菏泽)某课外活动小组用氯酸钾和二氧化锰的混合物制取干燥、较纯净的氧气.实验步骤如下:
①检查装置的气密性,气密性良好;
②先在试管中放入MnO2,再放入略多于计算量的KClO3;
③连接好实验装置;
④加热;
⑤收集气体;
⑥适当的时间后,停止加热,拆卸装置.
回答下列问题:
(1)装置A中的试剂______.
(2)方框B中最好选用下列装置中的______(填字母序号).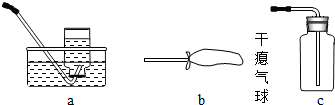
(3)实验中观察到何种现象时开始收集气体______.
(4)实验结束后,该同学发现收集到的气体比预计的少许多,百思不得其解.你认为可能的原因是______.
(5)欲从反应的残渣中回收二氧化锰(难溶于水),其操作步骤是:溶解、______、烘干. 小小香草1年前1
小小香草1年前1 -
 qulinshan 共回答了17个问题
qulinshan 共回答了17个问题 |采纳率88.2%解题思路:(1)依据图示及其作用,辨识常用药品,正确写出药品名称;
(2)根据实验要求,选择合适的实验装置;
(3)根据氧气的性质收集氧气时,掌握开始收集气体应注意的问题;
(4)在实验出现误差或失误时,会分析解决问题,找出原因.
(5)学会固体混合物的分离方法及操作步骤.(1)依据图示及其作用装置A中的试剂可用浓硫酸;因浓硫酸具吸水性,可做氧气的干燥剂.故答案为:浓硫酸
(2)根据实验要求分析方框B中最好选用的装置:a 装置是用排水法收集,得不到干燥的氧气.b装置可以收集到纯净而干燥的氧气,且能够观察收集气体的量;c 装置收集氧气时,无法排除集气瓶内空气.故答案为:b
(3)根据氧气不易溶于浓硫酸的性质收集氧气时,开始有气泡冒出因混有空气不纯,不要立即收集.看到有气泡从A中均匀冒出才能收集.故答案为:看到有气泡从A中均匀冒出
(4)实验结束后,该同学发现收集到的气体比预计的少许多,出现这样的现象可能是:装置A漏气、气球漏气、药品量少等.故答案为:装置A漏气(或气球漏气)等
(5)从反应的残渣中回收难溶于水的二氧化锰时,残渣中的氯化钾(或存在没反应完的氯酸钾)能溶于水,故其操作步骤为:溶解、过滤、烘干.故答案为:过滤
故答案为:
(1)浓硫酸
(2)b
(3)看到有气泡从A中均匀冒出
(4)装置A漏气(或气球漏气)
(5)过滤点评:
本题考点: 制取氧气的操作步骤和注意点;混合物的分离方法;过滤的原理、方法及其应用;氧气的制取装置;氧气的收集方法.
考点点评: 掌握常用气体的干燥剂、制取氧气的装置与收集方法及注意事项,学会固体混合物的分离方法及操作步骤1年前查看全部
- T——T将27.6克氯酸钾(KClO3)与2克二氧化锰(MnO2)加热制取一定量的氧气后,使反应停止,测得剩余固体中含二
T——T
将27.6克氯酸钾(KClO3)与2克二氧化锰(MnO2)加热制取一定量的氧气后,使反应停止,测得剩余固体中含二氧化锰的质量分数为10%.计算:
(可能用到的相对原子质量:O—16;Cl—35.5;Mn—55;K—39)
⑶反应停止时剩余固体的质量.⑷制得氧气的质量.
⑸有多少克氯酸钾没有分解.
具体的写明过程. 68809511年前1
68809511年前1 -
 weixi5924 共回答了17个问题
weixi5924 共回答了17个问题 |采纳率100%反应停止时剩余固体的质量:2g/10%=20g
制得氧气的质量:27.6g+2g-20g=9.6g
设分解的氯酸钾质量为x
2KClO3=2KCl+3O2
245 96
X 9.6g
列比例式
x=24.5g
没有分解的 氯酸钾的质量为27.6g-24.5g=3.1g1年前查看全部
- 实验室用氯酸钾制取氧气时,如果没有二氧化锰,也可以在氯酸钾中加入少量高锰酸钾,产生氧气的速度也会加快.用符号表达式表示其
实验室用氯酸钾制取氧气时,如果没有二氧化锰,也可以在氯酸钾中加入少量高锰酸钾,产生氧气的速度也会加快.用符号表达式表示其原因:
1.
2. foxren1年前4
foxren1年前4 -
 omarsharif 共回答了11个问题
omarsharif 共回答了11个问题 |采纳率90.9%1、2KMnO4=K2MnO4+MnO2+O2↑
2、2KClO3=2KCl+3O2(MnO2催化剂)1年前查看全部
- 氯酸钾能否代替过氧化氢制取氧气?主要理由是什么?
 bbswang1年前2
bbswang1年前2 -
 忘了忘了你 共回答了15个问题
忘了忘了你 共回答了15个问题 |采纳率86.7%不能
理由:过氧化氢制氧用的是固液反应不加热装置,前者要用固固反应加热装置才能制氧1年前查看全部
- 将氯酸钾. 二氧化锰. 高锰酸钾的混合物装入试管并充分加热,反应完成后试管中残渣中物质有 [
将氯酸钾. 二氧化锰. 高锰酸钾的混合物装入试管并充分加热,反应完成后试管中残渣中物质有 [ ]A.1种
B.2种
C.3种
D.4种 族长001年前1
族长001年前1 -
 daisuki_why 共回答了20个问题
daisuki_why 共回答了20个问题 |采纳率95%C1年前查看全部
- 、从实验室用氯酸钾于二氧化锰制取氧气后的残渣中(假定反应充分)回收氯化钾和二氧化锰.
 zjx21cn1年前4
zjx21cn1年前4 -
 小鱼蛮儿 共回答了16个问题
小鱼蛮儿 共回答了16个问题 |采纳率93.8%加水后,用过滤纸过滤氯化钾和二氧化锰,把过滤纸上的水分蒸发掉,就可以得到干燥的氯化钾和二氧化锰.1年前查看全部
- 用氯酸钾制取氧气,当看到_____向倒立在水槽中的集气瓶_____时,说明集气瓶充满氧气.这种收集气体的方法叫____法
用氯酸钾制取氧气,当看到_____向倒立在水槽中的集气瓶_____时,说明集气瓶充满氧气.这种收集气体的方法叫____法.其条件是这种气体必须_____.
点燃氢气前,必须_____.
某同学把一只点燃的蜡烛伸进盛有氧气的集气瓶里,燃烧停止后,冷却,可观察到瓶壁上_____,由此说明蜡烛中一定含有_____元素.
还有一题.
用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收满,这是利用了氧气的___、_____性质. 御风荷1年前1
御风荷1年前1 -
 bagizo 共回答了16个问题
bagizo 共回答了16个问题 |采纳率100%用氯酸钾制取氧气,当看到__大气泡___向倒立在水槽中的集气瓶_冒出____时,说明集气瓶充满氧气.这种收集气体的方法叫___排水_法.其条件是这种气体必须___不溶于水的__.
点燃氢气前,必须____验纯_.
某同学把一只点燃的蜡烛伸进盛有氧气的集气瓶里,燃烧停止后,冷却,可观察到瓶壁上__有水珠生成___,由此说明蜡烛中一定含有___H__元素.
用向上排空气法收集氧气,并用带火星的木条放在集气瓶口检验氧气是否收满,这是利用了氧气的__密度比空气大_、__有助燃性___性质.
我补充了1年前查看全部
- 3.讲氯酸钾和二氧化锰的混合物14.5g,加热使之充分反应到不再产生气体为止,冷却后称得剩余的质量为9.7g,问:(1)
3.讲氯酸钾和二氧化锰的混合物14.5g,加热使之充分反应到不再产生气体为止,冷却后称得剩余的质量为9.7g,问:(1)产生氧气的质量 (2)剩余固体是什么物质?各为多少克?还有一题 4.用含有一定杂质的高锰酸钾样品8.78g,加热使之完全反应(杂质不参加反应)制得0.56L的氧气(标准状态下氧气的密度为1.429g/L)计算:(1)该样品中高锰酸钾的质量是多少?纯度为多少?(2)反应后试管中什么固体物质?各为多少克?
 我意乱天下11年前1
我意乱天下11年前1 -
 lnyyllj 共回答了20个问题
lnyyllj 共回答了20个问题 |采纳率85%1.设氧气为X ,2KCLO3=2KCL+3O2 245 149 96 X 14.5-9.7 X=4.8*149/96=7.45 9.7-7.45=2.25 剩余固体为二氧化锰和氯化钾的混合物 其中二氧化锰2.25克 氯化钾7.45克.2.其化学反应方程式为 2KMnO4(加热)=K2MnO4+MnO2+O2↑ 316 197 87 32 X Y Z 0.8 据题得,氧气的质量为0.56L×1.429g/L≈0.8克 将其代入方程式,设KMnO4的质量为X克,反应后的K2MnO4为Y克,MnO2为W克.解得X=7.9 Y=4.925 W=2.175 所以高锰酸钾样品的纯度为7.9克/8.78克≈90﹪ 反应后试管中剩余的物质为锰酸钾和二氧化锰,重量分别是4.925克和2.175克.希望我的回答能够帮到你哦.1年前查看全部
- 碳酸氢铵 氯酸钾 亚硫酸钠 亚硝酸钠.
 simon_yxd1年前1
simon_yxd1年前1 -
 tiemin001 共回答了10个问题
tiemin001 共回答了10个问题 |采纳率90%NH4HCO3
KClO3
Na2SO3
NaNO21年前查看全部
- 硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
硫酸 盐酸 硝酸 氯酸钾 高锰酸钾 锰酸钾 氯化钠 食盐 氯化钾
氯化钙 氯化镁 氯化锌 氯化铝 氯化银 氯化铁 氯化亚铁 氯化铜 氯化亚铜 氯化钡 sp_zy1年前3
sp_zy1年前3 -
 江薇cc 共回答了16个问题
江薇cc 共回答了16个问题 |采纳率87.5%H2SO4
HCl
HNO3
KClO3
KMnO4
K2MnO4
KMnO3
NaCl
NaCl
KCl
CaCl2
MgCl2
ZnCl2
AlCl3
AgCl
FeCl3
FeCl2
CuCl2
CuCl
BaCl2
Cu(OH)2CO31年前查看全部
- 写出“氯酸钾”的化学式0 - 离问题结束还有 14 天 23 小时还有一道题目 氯气(Cl2)和氧气一样,都是性质非常活
写出“氯酸钾”的化学式
0 - 离问题结束还有 14 天 23 小时
还有一道题目
氯气(Cl2)和氧气一样,都是性质非常活泼的非金属单质.在一定条件下,甲烷和充足的氯气反应,推测其产物是( )
A.CCl4和HCl
B.CCl4和H2
C.CH2Cl2
D.C和HCl 黄色青年1年前2
黄色青年1年前2 -
 星语星梦 共回答了17个问题
星语星梦 共回答了17个问题 |采纳率94.1%氯酸钾
中文名称:氯酸钾
分子式:KClO3
A.CCl4和HCl
我刚好学了``1年前查看全部
- 加热氯酸钾制取氧气安全吗?
 魔力BEIBEI1年前3
魔力BEIBEI1年前3 -
 shiyang211 共回答了17个问题
shiyang211 共回答了17个问题 |采纳率82.4%安全是肯定安全啦,不然实验室还敢用吗?
缺点是:要加热、加催化剂等,步骤太多太复杂,生成的氧气是热的,冷却后气压减小,可能会使空气进入,从而影响精确的实验计算!1年前查看全部
- 氯酸钾的化学式怎么写?还有一道判断题,望赐教.
氯酸钾的化学式怎么写?还有一道判断题,望赐教.
碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物.如果对的话,可后半句,SO2算不算是个反例啊? hlg82882561年前4
hlg82882561年前4 -
 花火0098 共回答了12个问题
花火0098 共回答了12个问题 |采纳率83.3%KClO3
碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物.
是对的
后半句,不一定的意思就是酸性氧化物有非金属氧化物,也有金属氧化物,SO2是非金属氧化物,而且是酸性氧化物,没有什么问题
这句话的原因是比如说Mn2O7是金属氧化物,酸性氧化物1年前查看全部
- 2.某兴趣小组用氯酸钾和二氧化锰的化合物加热制取氧气,试管中固体的质量随时间变化的数据见下表.制取结束后,将剩余固体用适
2.某兴趣小组用氯酸钾和二氧化锰的化合物加热制取氧气,试管中固体的质量随时间变化的数据见下表.制取结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g.

(1)共制得氧气 g.
(2)计算生成氯化钾的质量. 在镜中飞翔1年前1
在镜中飞翔1年前1 -
 晓曦cc 共回答了13个问题
晓曦cc 共回答了13个问题 |采纳率100%1) 28.0-18.4=9.6g
2KClO3 = 2KCl + 3O2
149 96
x 9.6
x=14.9g1年前查看全部
- 将21.8g氯酸钾和二氧化锰的混合物,装入大试管加热到不再有气体产生.剩余固体质量为12.2g.
将21.8g氯酸钾和二氧化锰的混合物,装入大试管加热到不再有气体产生.剩余固体质量为12.2g.
1.生成氧气多少克?2.氯化钾多少克?3.二氧化锰多少克? rieu1年前3
rieu1年前3 -
 hhb127 共回答了18个问题
hhb127 共回答了18个问题 |采纳率88.9%根据题意可知生成氧气的质量为:21.8g-12.2g=9.6g
设生成氯化钾质量为x
2KClO3==MnO2==2KCl+3O2↑
149 96
x 9.6g
149/x=96/9.6g
x=14.9g
说明你的数据有问题,因为生成氯化钾的质量比反应后混合物的总质量都多,1年前查看全部
- 氯酸钾和二氧化锰制氧气的化学方程式能改写成离子方程式吗
 睡mm101年前1
睡mm101年前1 -
 allenwhm 共回答了16个问题
allenwhm 共回答了16个问题 |采纳率81.3%不能.
因为离子方程式是需要离子参与的化学反应才能改写.氯酸钾加热生成氧气的化学反应过程中没有离子参与,故而不能写离子方程式.1年前查看全部
- 在30℃时,把氯酸钾不饱和溶液等分成两份,恒温蒸发,一份蒸发去10克水析出晶体0.5克,另一份蒸发去20克水
在30℃时,把氯酸钾不饱和溶液等分成两份,恒温蒸发,一份蒸发去10克水析出晶体0.5克,另一份蒸发去20克水
析出晶体1.5克,则30℃时氯酸钾的溶解度是? henryxiang19801年前1
henryxiang19801年前1 -
 llhecf 共回答了17个问题
llhecf 共回答了17个问题 |采纳率94.1%蒸发10克水后溶液析出固体,说明蒸发10克水,溶液已经饱和
这样饱和溶液再蒸发10克水析出1.5-0.5=1克固体.(相当与原溶液直接蒸发20克水)
说明10克水溶解1克氯酸钾达到饱和
1/10=10/100 氯酸钾溶解度为10克/100克水1年前查看全部
- 122.5克氯酸钾在40克二氧化锰作摧化剂的条件下完全分解后,剩余产物中有二氧化锰多少克,有氯化钾多少克?
 yao妹儿1年前3
yao妹儿1年前3 -
 冰河雪莲 共回答了11个问题
冰河雪莲 共回答了11个问题 |采纳率100%1楼的说的对二氧化锰作为催化剂不会消耗,故反应前的质量==反应后的质量
即M二氧化锰==40g
2KClO3==2KCl+3O2↑(设有X克的氯化钾生成)
245 149
122.5 X
X===74.5克1年前查看全部
- 下列反映的生成物都是单质的是1.分解过氧化氢2.电解水3.硫在氧气中燃烧4.加热分解氯酸钾2.下列说法正确的是1.反应物
下列反映的生成物都是单质的是
1.分解过氧化氢
2.电解水
3.硫在氧气中燃烧
4.加热分解氯酸钾
2.下列说法正确的是
1.反应物都是化合物
2.反映属于分解反应
3.生成物可能是氧化物
4.反应前后分子种类不变
3.蒸馏水不宜养鱼,是因为蒸馏水中几乎不含
1.水分子
2.氧元素
3.氧分子
4.氧原子 erwear1年前2
erwear1年前2 -
 阳光不锈623 共回答了20个问题
阳光不锈623 共回答了20个问题 |采纳率85%下列反应的生成物都是单质的是:( )
A.电解水 B.分解过氧化氢
C.加热高锰酸钾 D.硫在氧气中燃烧
A
2.某两种物质在一定条件下发生化学反应的微观示意如图(其中●和○分别代表两种不同的原子)
●●+○○ ○○→○●○ ○●○
对上述反应,下列说法正确的是
A.反应物都是化合物 B.反应属于分解反应 C.生成物可能是氧化物 D.反应前后分子种类不变
C
蒸馏水不宜用来养鱼,其主要原因是因为蒸馏水中几乎不含什么?
A氧元素 B氧分子 C氧原子 D氧离子
B氧分子1年前查看全部
- .二氧化锰的作用.在用氯酸钾制氧气和用浓盐酸制氯气时都要用到二氧化锰.二氧化锰的作用是否相同?分别起什么作用?
 伊卜拉欣a1年前4
伊卜拉欣a1年前4 -
 johnsonfly 共回答了18个问题
johnsonfly 共回答了18个问题 |采纳率88.9%不一样
用氯酸钾制氧气时,MnO2作为催化剂,不参与反应.起催化作用.
制氯气时,MnO2作为反应物,是氧化剂.氧化Cl-变成Cl2.起氧化作用.1年前查看全部
大家在问
- 1求英语大神、The club is pleased to present the TV version of The C
- 2英语翻译Soldiers only used several days to recover the important
- 3某物沿一条直线运动,若前一半位移的平均速度为v1,后一半位移的平均速度为v2,全程的平均速度又是多少?
- 4简单平面图形几何中心怎么求?几何中心的概念是什么?比如三角形几何中心是三条中线交点
- 5汽车上坡时为什么要换低挡?练习答案说是P=FV,P一定,V减小,F就争大,所以能上坡,可是谁说P一定了?
- 6形容大雾的词语多点,还有薄雾
- 7y=x的2/3次方的图象应该怎么画
- 8一个小游戏 就是从水、火一直到微生物到人类的
- 9已知A关于P(0,3)的对称点为B,B关于点Q(1,5/2)的对称点为C,点C关于点B(2,9/2)的对称点A,求A坐标
- 10用 起初 .到后来 .造句用 起初 .到后来 .造句快
- 11在线求指导:根据句意和首字母填入
- 12观察下列算式:1*5+4=3平方,2*6+4=4的平方,3*7+4=5的平方,4*8+4=6的平方,请你观察规律之后用你
- 13如何分析“谦虚使人进步”中“谦虚”的词性
- 14This reality could be observed by the visit to com-panies co
- 15What is not all important.happy is the most important
