30ml 1.0mol/l L NaCl溶液和40ml 0.5mol/L CaCl2 溶液混合后,混合液中Cl-浓度为.
 55wenjie2022-10-04 11:39:541条回答
55wenjie2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 s3iu 共回答了18个问题
s3iu 共回答了18个问题 |采纳率83.3%- Cl的摩尔数:[ 1.0mol/l L*30ml+0.5mol/L*2*40ml ]/1000=0.07mol
Cl的摩尔浓度为(0.07mol / 70mL)*1000=1.0 mol/L - 1年前
相关推荐
- 配制250ml1.0mol/l的硫酸溶液,需12.5mol/l的硫酸溶液的体积是多少?若与足量的锌粒发生反应,在标准状况
 guan_10191年前1
guan_10191年前1 -
 mmbbmmgg 共回答了18个问题
mmbbmmgg 共回答了18个问题 |采纳率100%①思路:物质的量不变,由C1V1=C2V2,代入得V2=20ml ②:Zn+H2SO4=ZnSO4+H2↑,根据 ①得出H2SO4 物质的量n(H2SO4 )=C1V1=0.25mol,在代入化学方程式得出氢气物质的量n(H2)=0.25mol,所以氢气的体积为V=0.25×22.4=5.6L1年前查看全部
- 硫酸体积计算例:欲配制1.0mol/L的硫酸溶液0.50L,需取用密度为1.84g/cm,98%的浓硫酸多少ml?由硫酸
硫酸体积计算
例:欲配制1.0mol/L的硫酸溶液0.50L,需取用密度为1.84g/cm,98%的浓硫酸多少ml?
由硫酸的物质的量不变得出
1.0*0.50=m/M=ρ*V/M*98%
0.5M=ρ*V*98%
V=27.17ml
我想不明白为什么要乘以98%我查过密度为1.84g/cm的硫酸,它的质量分数就是98%了,即1.84g/cm的硫酸=98%的硫酸,那么两者相乘还有什么意义? 我爱王璐1年前1
我爱王璐1年前1 -
 bnu1980 共回答了10个问题
bnu1980 共回答了10个问题 |采纳率90%m是浓硫酸的质量 M是纯硫酸的相对分子质量 用浓硫酸的质量承以质量分数可以得到vml内纯硫酸的质量 也就是m 就得到了vml硫酸物质的量 所以应该和密度体积V乘在一块 而不是和相对分子质量M1年前查看全部
- 向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应PCl5(g)⇌PCl3(g)+C
向2.0L恒容密闭容器中充人1.0mol PCl5,在温度为T时发生如下反应PCl5(g)⇌PCl3(g)+Cl2(g)△H=124kJ•mol-1.反应过程中测定的部分数据见下表:
回答下列问题:时间t/s 0 50 150 250 350 n(PCL3)/mol 0 0.16 0.19 0.2 0.2
(1)反应在前50s的平均速率v(PCl5)=______.
(2)温度为T时,该反应的化学平衡常数=______.
(3)要提高上述反应的转化率,可采取的措施有______.
(4)在温度为T时,若起始时向容器中充入0.5mol PCl5和a mol Cl2平衡时PCl5的转化率仍为20%,则a=______.
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),该反应的化学方程式是______.若将0.01mol PCl5投入lL热水中,再逐滴加入AgN03溶液,先产生的沉淀是______[已知Ksp(Ag3P04)=1.4×10-16,Ksp(AgCl)=1.8×10-10].
(6)一定条件下,白磷溶于硝酸溶液产生一种氮氧化合物气体,该气体与白磷的物质的量之比为20:3,反应的化学方程式为______. IreneEcho1年前1
IreneEcho1年前1 -
 望999 共回答了14个问题
望999 共回答了14个问题 |采纳率100%解题思路:(1)根据反应速率的表达式计算出反应在前50s的平均速率v(PCl5);
(2)根据表中数据判断达到平衡状态的时间,然后根据平衡状态下各组分的浓度及平衡常数表达式计算出温度为T时,该反应的化学平衡常数;
(3)要提高上述反应的转化率,必须使平衡向着正向移动,根据影响化学平衡的影响进行判断;
(4)温度不变,平衡常数不变,根据该温度下的平衡常数及题中数据列式计算出a值;
(5)根据五氯化磷完全水解,生成磷酸(H3PO4)写出反应的化学方程式;先计算出饱和磷酸银、氯化银沉淀需要银离子的浓度,需要银离子浓度越小,说明越难溶,加入银离子时优先生成沉淀;
(6)白磷分子为P4,该气体与白磷的物质的量之比为20:3,设物质的量分别为20mol、3mol,白磷倍氧化成磷酸,3mol白磷化合价升高:5×4×3mol=60mol,20mol该氮氧化物化合价降低了60mol,生成1mol氮氧化物转移了:[60mol/20mol]mol=3mol电子,所以该氮氧化物为NO,据此写出反应的化学方程式.(1)反应在前50s中生成了0.16molPCl3,根据反应PCl5(g)⇌PCl3(g)+Cl2(g)可知,消耗的PCl5的物质的量为0.16mol,所以反应在前50s的平均速率v(PCl5)=
0.16mol
2.0L
50s=0.0016mol•L-1•s-1,
故答案为:0.0016mol•L-1•s-1;
(2)由表中数据可知,反应在250s、350s时三氯化磷的物质的量相等,说明250s时达到了平衡状态,则:
PCl5(g)⇌PCl3(g)+Cl2(g)
反应前(mol) 1.0 0 0
变化(mol) 0.2 0.2 0.2
平衡时(mol) 0.8 0.20.2
平衡时各组分的浓度为:c(PCl5)=[0.8mol/2.0L]=0.4mol/L,c(PCl3)=c(Cl2)=[0.2mol/2.0L]=0.1mol/L,
该温度下该反应的平衡常数为:K=
c(PCl3)•c(Cl2)
c(PCl5)=[0.1×0.1/0.4]=0.025,
故答案为:0.025;
(3)根据反应PCl5(g)⇌PCl3(g)+Cl2(g)△H=124kJ•mol-1可知,增大反应物转化率,需要使平衡向着正向移动,可以升高温度、减小压强、移走氯气、三氯化磷等,平衡都会向着正向移动,
故答案为:升高温度(或降低压强或移走PCl3、Cl2等合理答案);
(4)由于温度相同,所以平衡常数K=0.025,
利用三段式可得:PCl5(g)⇌PCl3(g)+Cl2(g)
反应前(mol) 0.5 0a
变化(mol)0.1 0.10.1
平衡时(mol) 0.4 0.1a+0.1
平衡时各组分浓度为:c(PCl5)=0.2mol/L,c(PCl3)=0.05mol/L,c(Cl2)=[a+0.1/2]mol/L,
则:K=0.025=
a+0.1
2×0.05
0.2,解得a=0.1,
故答案为:0.1;
(5)在热水中,五氯化磷完全水解,生成磷酸(H3PO4),则该反应的化学方程式为:PCl5+4H2O=H3PO4+5HCl;
设饱和磷化银溶液中银离子浓度为x,则:Ksp(Ag3P04)=x3×([x/3])=1.4×10-16,x=
44.2×10−16
=
44.2
×10−4;设饱和氯化银溶液中银离子浓度为y,则y2=Ksp(AgCl)=1.8×10-10,y=
1.8×10−10=点评:
本题考点: 反应速率的定量表示方法;化学平衡常数的含义;化学平衡的影响因素.
考点点评: 本题考查了化学反应速率的计算、化学平衡常数的计算、化学平衡的影响因素,题目难度中等,注意掌握化学反应速率的表达式及计算方法,明确化学平衡常数的概念及计算方法.1年前查看全部
- 某待测浓度naoh溶液25ml,加入20ml 1.0mol每升的硫酸溶液后呈酸性,再加入1.0mol每升koh溶液1.5
某待测浓度naoh溶液25ml,加入20ml 1.0mol每升的硫酸溶液后呈酸性,再加入1.0mol每升koh溶液1.5ml达...
某待测浓度naoh溶液25ml,加入20ml 1.0mol每升的硫酸溶液后呈酸性,再加入1.0mol每升koh溶液1.5ml达到中和.计算naoh溶液物质的量浓度? 不要说难过1年前1
不要说难过1年前1 -
 西门飘呀飘 共回答了14个问题
西门飘呀飘 共回答了14个问题 |采纳率92.9%NaOH和KOH的浓度和:H2SO4=1:2
n(NaOH)=0.02*1*2-0.015*1=0.0385mol
c(NaOH)=n(NaOH)/v=0.0385/25=1.54mol/L1年前查看全部
- 大一无机化学:在1L的1.0mol/lHAC和1.0mol/l NAOH混合溶液中,向其加入0.01L浓度时0.5mol
大一无机化学:在1L的1.0mol/lHAC和1.0mol/l NAOH混合溶液中,向其加入0.01L浓度时0.5mol/l的NAOH,求ph
 安旎宝贝1年前1
安旎宝贝1年前1 -
 330620148 共回答了24个问题
330620148 共回答了24个问题 |采纳率87.5%在1L的1.0mol/lHAC和1.0mol/l NAOH混合溶液中,
说明刚好生成醋酸钠
向其加入0.01L浓度时0.5mol/l的NAOH,此时醋酸钠不水解
[OH-]= 0.01L*0.5mol/L /(1+0.01)L=0.005mol/L
[H+]=2*10^-12 pH=-lg2*10^-12=11.7
------------
在1L的1.0mol/lHAC和1.0mol/l NAOH混合溶液中,此处题意不明确,上面我当总体积为1L
如果是1L的1.0mol/lHAC和(1L)1.0mol/l NAOH混合溶液中,那么总体积是2L
[OH-]= 0.01L*0.5mol/L /(2+0.01)L=0.0025mol/L
[H+]=4*10^-12 pH=-lg4*10^-12=11.41年前查看全部
- 将足量的锌粒放入100mL 1.0mol/L的盐酸中,充分反应,计算 1.参加反应的锌粒的质量 2
将足量的锌粒放入100mL 1.0mol/L的盐酸中,充分反应,计算 1.参加反应的锌粒的质量 2
将足量的锌粒放入100mL 1.0mol/L的盐酸中,充分反应,计算
1.参加反应的锌粒的质量
2.生成H2的体积(标准状况下)
我急用, aizaisheshou1年前0
aizaisheshou1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 化学计算题(这类题怎么做)把一定量的碳酸钠,碳酸氢钠和硫酸钠的混合物溶解在200mL,1.0mol/L盐酸中,完全反应后
化学计算题(这类题怎么做)
把一定量的碳酸钠,碳酸氢钠和硫酸钠的混合物溶解在200mL,1.0mol/L盐酸中,完全反应后,生成0.09mol干燥的二氧化碳(标况).然后加入400mL0.1mol/L氢氧化钡溶液,使硫酸钡沉淀完全,再加40mL1.0mol/L盐酸恰好把溶液中过量的碱完全中和.最后把沉淀分离出来,测得干燥的硫酸钡的质量为1.48g.求这三种化合物的质量分数. 清朗一笑1年前1
清朗一笑1年前1 -
 sdplayer 共回答了16个问题
sdplayer 共回答了16个问题 |采纳率81.3%首先判断加入的碳酸钠,碳酸氢钠和硫酸钠,只有碳酸钠,碳酸氢钠才和盐酸反应,硫酸钠不与盐酸反应.所以可以直接由沉淀的质量计算出硫酸钠的质量和用去的氢氧化钡物质的量.
Ba(OH)2+Na2SO4==NaOH+BaSO4↓
1 142 233
n1 m1 1.48g m1=0.902g,n1=0.006352mol
而共加入Ba(OH)2的物质的量为400mL×0.1mol/L=0.04mol,再加入盐酸中和掉的为40mL×1.0mol/L/2=0.02mol,说明最初加入氢氧化钡溶液时,溶液中盐酸有过量,过量了2×(0.04mol-0.02mol-0.006352mol)=0.0273mol,而最初的盐酸溶液中,共有盐酸200mL×1.0mol/L=0.2mol,说明与碳酸钠和碳酸氢钠反应消耗了0.2mol-0.0273mol=0.1727mol.
设碳酸钠质量为m2,碳酸氢钠质量为m3,则:
Na2CO3+2HCl==2NaCl+CO2↑+H2O
106 2 1
m2
NaHCO3+HCl==NaCl+CO2↑+H2O
84 1 1
m3
m2/53+m3/84=0.1727 m2/106+m3/84=0.09
则解得m2=8.7662g,m3=0.6132g.
则混合物的总质量=m1+m2+m3=0.902g+8.7662g+0.6132g=10.2814g,则w(Na2SO4)=0.902g/10.2814g=8.77%,w(Na2CO3)=8.7662g/10.2814g=85.26%,w(NaHCO3)=0.6132g/10.2814g=5.96%1年前查看全部
- 用1L的1.0mol.L-1NaOH溶液吸收0.8molCO2,所得溶液中的Na2CO3和NaHCO3的浓度之比约是多少
 悬崖边唱歌1年前1
悬崖边唱歌1年前1 -
 cqd2001 共回答了16个问题
cqd2001 共回答了16个问题 |采纳率87.5%0.5mol的CO2就可以把1mol的NaOH全部变为0.5mol的Na2CO3
剩下0.3mol的CO2又可以参与和Na2CO3的反应,消耗0.3mol的Na2CO3生成0.6mol的NaHCO3
所以最后还有0.2mol的Na2CO3和0.6mol的NaHCO3
体积相等,于是浓度之比为1:31年前查看全部
- 某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450mL.提供的试剂是:NaOH固体、98
某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450mL.提供的试剂是:NaOH固体、98%的浓硫酸(密度为1.84g/cm3)和蒸馏水.
(1)配制两种溶液时都需要的玻璃仪器是______.
(2)应用托盘天平称量NaOH______g,应用量筒量取浓硫酸______mL.
(3)浓硫酸溶于水的正确操作方法是______.
(4)在配制上述溶液实验中,下列操作引起结果偏低的有______.
A.该学生在量取浓硫酸时,俯视刻度线
B.胶头滴管加水定容时俯视刻度
C.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
D.在烧杯中溶解搅拌时,溅出少量溶液
E.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
F.将量筒洗涤2~3次,并全部转移至容量瓶中
G.容量瓶中原来存有少量蒸馏水. 甜甜的唇1年前1
甜甜的唇1年前1 -
 宁菜臣 共回答了15个问题
宁菜臣 共回答了15个问题 |采纳率80%解题思路:(1)根据配制NaOH溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来分析需要的仪器,配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶来分析需要的仪器;
(2)根据n=cV和m=nM来计算;先计算出浓硫酸的物质的量浓度为c=[1000ρω/M],然后根据溶液稀释定律C浓V浓=C稀V稀来计算;
(3)根据浓硫酸密度大、溶于水放热的特点来分析;
(4)根据c=并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,故1.0mol/L的NaOH溶液和稀H2SO4各450mL均应用500ml容量瓶.
配制NaOH溶液的步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,用到的仪器是:托盘天平、烧杯、玻璃棒、500ml容量瓶、胶头滴管;
配制稀H2SO4的步骤是计算、量取、稀释、洗涤、定容、摇匀、装瓶,用到的仪器是:量筒、烧杯、玻璃棒、500ml容量瓶、胶头滴管.
故配制两种溶液时都需要的玻璃仪器是:烧杯、玻璃棒、500ml容量瓶和胶头滴管,
故答案为:烧杯、玻璃棒、500ml容量瓶和胶头滴管;
(2)根据n=cV可知NaOH的物质的量n=1.0mol/L×0.5L=0.5mol,质量m=nM=0.5mol×40g/mol=20.0g;
98%的浓H2SO4(密度为1.84g/cm3)的物质的量浓度C=[1000ρω/M]=[1000×1.84g/ml×98%/98g/mol]=18.4mol/L,设需要的浓硫酸的体积为Vml,根据溶液稀释定律C浓V浓=C稀V稀可知:1.0mol/L×500mL=18.4mol/L×Vml,解得:V=27.2ml,
故答案为:20.0;27.2;
(3)由于浓硫酸密度大、溶于水放热,故稀释浓硫酸的方法:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌,
故答案为:将浓硫酸沿烧杯内壁注入水中,边倒边用玻璃棒搅拌;
(4)A、量取浓硫酸时,俯视刻度线,会导致所量取的浓硫酸的体积偏小,故所配稀硫酸的浓度偏低,故A选;
B.胶头滴管加水定容时俯视刻度,则溶液体积偏小,浓度偏高,故B不选;
C.溶解H2SO4操作时没有冷却至室温就移液并定容,会导致溶液体积偏小,所配溶液浓度偏高,故C不选;
D.在烧杯中溶解搅拌时,溅出少量溶液会导致溶质的损失,则所配溶液的浓度偏低,故D选;
E.没有用蒸馏水洗烧杯2-3次,会导致溶质的损失,则所配溶液的浓度偏低,故E选;
F.量筒不能洗涤,若将量筒洗涤2-3次,并全部转移至容量瓶中,会导致浓硫酸取多了,则所配溶液的浓度偏高,故F不选;
G.若容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响,故G不选;
故选ADE.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.1年前查看全部
- 将25gCuSO4·5H2O溶于100ml蒸馏水中配置100ml 1.0mol.L-1的CuSo4溶液.
将25gCuSO4·5H2O溶于100ml蒸馏水中配置100ml 1.0mol.L-1的CuSo4溶液.
为什么. 6001072171年前2
6001072171年前2 -
 xx_雄鹰 共回答了20个问题
xx_雄鹰 共回答了20个问题 |采纳率95%因为CuSO4·5H2O含有五分子的结晶水,而题目要求为配置1.0mol.L-1的CuSo4溶液.溶质为CuSo4,而非CuSO4·5H2O,对于此类问题,日后你要仔细审题.1年前查看全部
- 欲配置250mlPH为5.00的缓冲溶液,问在125ml1.0mol/LNaAc溶液中应加多少6.0mol/LHAc
 我爱zzzz1年前2
我爱zzzz1年前2 -
 moukai345 共回答了9个问题
moukai345 共回答了9个问题 |采纳率77.8%pH=pKa+lg(c盐/c酸),pKa是4.74,盐的浓度是0.5mol/L,因为最后要稀释到250mL,代到公式里就可以算出酸配好时的浓度,再乘以0.25L算出物质的量,最后除以6mol/L就可以算它的体积来了,因为手上没工具不好计算请按步骤算就行了,有计算器的话很容易的,实在不行我明天还可以再补充完整.1年前查看全部
- 在密闭容器中,对于反应2SO2(g)+O2(g)⇌2SO3(g),SO2和O2起始时分别为2.0mol和1.0mol;达
在密闭容器中,对于反应2SO2(g)+O2(g)⇌2SO3(g),SO2和O2起始时分别为2.0mol和1.0mol;达平衡时,SO2的转化率为80%.若从SO3开始进行反应,在相同的温度下,欲使平衡时各成分的百分含量与前者相同,则起起始时SO3的物质的量及其转化率为( )
A. 1.0 mol和 10%
B. 2.0 mol和 80%
C. 2.0 mol和 40%
D. 2.0 mol和 20% seseaa1年前1
seseaa1年前1 -
 老黑失陷 共回答了19个问题
老黑失陷 共回答了19个问题 |采纳率94.7%解题思路:在相同的温度下,使平衡时各成分的百分含量相同,说明两平衡是等效平衡,按化学计量转化到一边,对应成分的物质的量相同,据此计算从SO3开始进行反应,达相同的平衡状态,需要SO3的物质的量;
根据从SO2和O2起始达平衡时,SO2的转化率为80%SO2,据此计算平衡时n(SO3),从SO3开始进行反应,达相同的平衡状态,SO3的物质的量相同,SO3的起始物质的量减去平衡时物质的量为转化的SO3的物质的量,据此计算转化率.在相同的温度下,使平衡时各成分的百分含量相同,说明两平衡是等效平衡,按化学计量转化到一边,对应成分的物质的量相同,根据方程式2SO2(g)+O2(g)⇌2SO3(g)可知,2.0molSO2和1.0molO2完全转化,可得n(SO3)=n(SO2)=2.0mol,故从SO3开始进行反应,达相同的平衡状态,需要SO3的物质的量为2.0mol;
从SO2和O2起始达平衡时,SO2的转化率为80%SO2,转化的n(SO2)=2.0mol×80%=1.6mol,由硫元素守恒可知据平衡时n(SO3)=n(SO2)=1.6mol,所以从SO3开始进行反应,达相同的平衡状态,SO3的物质的量相同为1.6mol,转化的SO3的物质的量为2.0mol-1.6mol=0.4mol,SO3转化率为[0.4mol/2.0mol]×100%=20%.
故选D.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡计算、等效平衡等,难度中等,清楚等效平衡规律是解题的关键.1年前查看全部
- 已知某KOH样品中含水7.62%,含K2CO3 2.23%,含KOH90%.现将1g样品加入46.00毫升1.0mol/
已知某KOH样品中含水7.62%,含K2CO3 2.23%,含KOH90%.现将1g样品加入46.00毫升1.0mol/L的盐酸中,过量的
酸用1.07mol/l的KOH中和,蒸发溶液,蒸发到无水时,可得的固体的质量是多少?(过程详细易懂) sun_is_shining1年前2
sun_is_shining1年前2 -
 流浪的娃 共回答了23个问题
流浪的娃 共回答了23个问题 |采纳率91.3%经过两步反应后,最后的溶液的溶质为KCl(设生成X摩尔).根据氯元素守衡得:
HCl-------Cl-------KCl
1-------------------1
0.046*1------------X
X=0.046mol.
质量为:0.046*74.5=3.427克
注意"过量的酸用1.070mol/L KOH溶液中和"应该为完全中和.不然就没有答案.1年前查看全部
- 某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450mL.提供的试剂是:NaOH固体、98
某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450mL.提供的试剂是:NaOH固体、98%的浓硫酸(密度为1.84g/cm3)和蒸馏水.
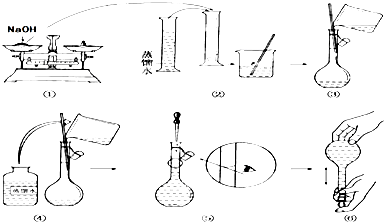
(1)请你观察图示判断其中不正确的操作有______(填序号).
(2)应用托盘天平称量NaOH______g,应用量筒量取浓硫酸______mL.
(3)浓硫酸溶于水的正确操作方法是______.
(4)在配制上述溶液实验中,下列操作引起结果偏低的有______.
A.该学生在量取浓硫酸时,俯视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度. 慕童1年前1
慕童1年前1 -
 6873610 共回答了18个问题
6873610 共回答了18个问题 |采纳率88.9%解题思路:(1)依据腐蚀性物质的称量、量筒的正确使用方法、定容时正确读数方法判断;(2)依据m=CVM计算需要氢氧化钠的质量;依据C=1000ρωM计算98%的浓硫酸(密度为1.84g/cm3)的物质的量浓度,然后依据稀释前后溶液中所含溶质的物质的量不变计算需要浓硫酸的体积;(3)依据浓硫酸稀释的正确操作方法解答;(4)根据c=nV并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.(1)①氢氧化钠为腐蚀品,应放在小烧杯中称量;②量筒量取液体后不需要洗涤,如果洗涤量取的液体的体积偏大;⑤定容读数时,眼睛应平视刻度线;
故答案为:①②⑤;
(2)欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450mL,需选择500ml容量瓶,
需要氢氧化钠的质量m=1.0mol/L×0.5L×40g/mol=20.0g;
98%的浓硫酸(密度为1.84g/cm3)的物质的量浓度C=[1000×1.84g/ml×98%/98g/mol]=18.4mol/L,依据稀释前后溶液中所含溶质的物质的量,设需要浓硫酸的体积为V,则V×18.4mol/L=500mL×1.0mol/L,解得V=27.2mL;
故答案为:20.0;27.2;
(3)浓硫酸密度大于水,稀释时放出大量的热,稀释浓硫酸的正确操作方法为:先在烧杯中倒入适量水,然后将浓硫酸沿烧杯内壁慢慢倒入,并用玻璃棒搅拌;
故答案为:先在烧杯中倒入适量水,然后将浓硫酸沿烧杯内壁慢慢倒入,并用玻璃棒搅拌;
(4)A.该学生在量取浓硫酸时,俯视刻度线,导致量取的浓硫酸体积偏小,溶质的物质的量偏小,溶液的浓度偏低,故A选;
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作,冷却后溶液的体积偏小,溶液的浓度偏高,故B不选;
C.在烧杯中溶解搅拌时,溅出少量溶液,导致溶质的物质的量偏小,溶液的浓度偏低,故C选;
D.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中,导致溶质的物质的量偏小,溶液的浓度偏低,故D选;
E.将量筒洗涤2~3次,并全部转移至容量瓶中,量取的浓硫酸体积偏大,溶质的物质的量偏大,溶液的浓度偏搞,故E不选;
F.容量瓶中原来存有少量蒸馏水,对溶质的物质的量和溶液的体积都不会产生影响,溶液浓度不变,故F不选;
G.胶头滴管加水定容时俯视刻度,导致溶液体积偏小,溶液的浓度偏高,故G不选;
故选ACD.点评:
本题考点: 配制一定物质的量浓度的溶液.
考点点评: 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,题目难度不大,熟悉配置原理是解题关键,注意浓硫酸稀释的正确操作.1年前查看全部
- 高中化学题,在6,8之前解答①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下
高中化学题,在6,8之前解答
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
 earlygirl1年前1
earlygirl1年前1 -
 weiwei_453 共回答了14个问题
weiwei_453 共回答了14个问题 |采纳率85.7%你想害死人呀?原题:
以CH4、O2为原料可设计成燃料电池:设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:---------
答案:C(K+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+)...1年前查看全部
- 物质量的浓度的应用题将50ml某氢氧化钠溶液和100ml 1.0mol/L的硫酸溶液混合,充分作用后,溶液恰好呈中性,求
物质量的浓度的应用题
将50ml某氢氧化钠溶液和100ml 1.0mol/L的硫酸溶液混合,充分作用后,溶液恰好呈中性,求氢氧化钠溶液物质的量的浓度 和尚风流1年前2
和尚风流1年前2 -
 镀铜龟 共回答了21个问题
镀铜龟 共回答了21个问题 |采纳率85.7%p(0.1*1*2)/0.05=4
硫酸中H+的浓度=氢氧化钠中OH-的浓度(Ph=7)1年前查看全部
- 往1.00ml1.0molZnCl2溶液中加入NaOH固体至ph=6,需NaOH的物质的量
 叫板拍一砖1年前2
叫板拍一砖1年前2 -
 musickiller 共回答了17个问题
musickiller 共回答了17个问题 |采纳率82.4%ZnCl2+H2O=Zn(OH)2+2HCl
1.0mol/LZnCl2溶液,[H+]=2mol/L
NaOH的物质的量 (2-10^-6)/1000=0.002-10^-9 mol1年前查看全部
- 配置100ml 1.0mol每升的NA2CO3溶液
配置100ml 1.0mol每升的NA2CO3溶液
A选项中:称取10.6g无水碳酸钠,加入100ml蒸馏水,搅拌,
为什么A选项是错的? 燕南菲菲1年前1
燕南菲菲1年前1 -
 胖乎乎的猫 共回答了18个问题
胖乎乎的猫 共回答了18个问题 |采纳率94.4%溶液的配置流程不对
先加适量水
溶解后转入容量瓶中,再洗烧杯和玻璃棒
之后再加水至刻度线1年前查看全部
- 欲配制 1L PH=5.00,HAc浓度为0.2mol.L 的缓冲溶液,问需要1.0mol.L的HAc和NaAc溶液各多
欲配制 1L PH=5.00,HAc浓度为0.2mol.L 的缓冲溶液,问需要1.0mol.L的HAc和NaAc溶液各多少毫升.
 孤苦飘零1年前1
孤苦飘零1年前1 -
 欧紫珊 共回答了15个问题
欧紫珊 共回答了15个问题 |采纳率93.3%PH为5,由醋酸解离出来的氢离子浓度为10^-5mol/l,即有10^-5mol醋酸电离,那么醋酸总加入量为:电离部分+未电离部分=(10^-5+0.2)mol,醋酸加入体积为200.05ml;
醋酸-醋酸钠缓冲溶液配制
公式的推导
醋酸电离:HAC=H+AC
Ka=[H][AC]/[HAC]
[H]=Ka[HAC]/[AC]
HAC的pKa=4.75
代入得[AC]/[HAC]=Ka/[H]=10^(-4.75)/10^(-5)=10^(0.25)=1.78
所以醋酸钠和醋酸的物质的量之比为1.78即可
醋酸钠体积为1.78[HAC]=1.78*200.05ml=356.089ml1年前查看全部
- (2009•沈阳三模)2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:P
(2009•沈阳三模)2.0mol PCl3和1.0mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3+Cl2⇌PCl5.达平衡时,PCl5为0.40mol,如果此时移走1.0mol PCl3和0.50mol Cl2,在相同温度下再达平衡时PCl5的物质的量是( )
A.0.40mol
B.0.20mol
C.小于0.20mol
D.大于0.20mol,小于0.40mol sqm_黑马1年前1
sqm_黑马1年前1 -
 intodust 共回答了20个问题
intodust 共回答了20个问题 |采纳率85%解题思路:达平衡后移走1.0mol PC13和0.50mol C12,重新到达的平衡,可以等效为开始加入1.0mol PC13和0.50mol C12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故平衡时PC15的物质的量小于原平衡的[1/2]倍.达平衡后移走1.0mol PC13和0.50mol C12,重新到达的平衡,可以等效为开始加入1.0mol PC13和0.50mol C12到达的平衡,与原平衡相比压强减小,平衡向逆反应移动,反应物的转化率减小,故达新平衡时PC15的物质的量小于原平衡的[1/2]倍,即达平衡时PC15的物质的量小于0.4mol×[1/2]=0.2mol,
故选C.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 考查化学平衡的有关减小,化学平衡的建立等,难度中等,关键是设计等效平衡建立的途径.1年前查看全部
- 把2.0mol/LCuSO 4 溶液和1.0mol/LH 2 SO 4 溶液等体积混合(假设混合后溶液的体积等于两溶液的
把2.0mol/LCuSO 4 溶液和1.0mol/LH 2 SO 4 溶液等体积混合(假设混合后溶液的体积等于两溶液的体积之和).
(1)溶液中H + 的物质的量浓度为______,SO 4 2- 的物质的量浓度为______.
(2)向混合溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余.此时,溶液中的Fe 2+ 物质的量浓度为______. 打破历史的龌撮1年前1
打破历史的龌撮1年前1 -
 priest789 共回答了16个问题
priest789 共回答了16个问题 |采纳率93.8%(1)把2.0mol•L -1 CuSO 4 和1.0mol•L -1 H 2 SO 4 溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO 4 )=
1
2 ×1.0mol/L=1.0mol/L,c(H 2 SO 4 )=
1
2 ×1.0mol/L=0.5mol/L,
混合后溶液中c(H + )=2c(H 2 SO 4 )=2×0.5mol/L=1mol/L,溶液中硫酸根来源于硫酸铜与硫酸电离,故c(SO 4 2- )=c(CuSO 4 )+c(H 2 SO 4 )=1mol/L+0.5mol/L=1.5mol/L,
故答案为:1mol/L;1.5mol/L;
(2)向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO 4 ,故c(Fe 2+ )=c(SO 4 2- )=1.5mol/L,
故答案为:1.5mol/L.1年前查看全部
- 一道化学计算题 不会了如何用98%的浓硫酸(密度为1.84g/ml)配制1.0mol/L 的硫酸溶液500毫升?计算题
一道化学计算题 不会了
如何用98%的浓硫酸(密度为1.84g/ml)配制1.0mol/L 的硫酸溶液500毫升?
计算题 谢谢各位 星月如水1年前2
星月如水1年前2 -
 ZTWING 共回答了19个问题
ZTWING 共回答了19个问题 |采纳率89.5%设所需要98%的浓硫酸体积为V L,则根据物质的量守恒得
(1.84*V*1000*98%)/98=1.0*0.5
计算出V即可1年前查看全部
- 在一体积为10l的容器中,某一气体反应物的物质的量为1.0mol,经过2s后,它的物质的量变成了
在一体积为10l的容器中,某一气体反应物的物质的量为1.0mol,经过2s后,它的物质的量变成了
.2mol;在这2s内它的平均反应速率为?
 rebeccaying21年前1
rebeccaying21年前1 -
 要做穷光蛋 共回答了10个问题
要做穷光蛋 共回答了10个问题 |采纳率80%物质量改变量为2mol-1mol=1mol
体积如果没变10升
浓度该变量1mol/10L
单位时间浓度该变量 1mol/10L / 2s =0.05 就是平均速度1年前查看全部
- T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)⇌Cl2(g)+
T K时,向2.0L恒容密闭容器中充入1.0mol COCl2,反应COCl2(g)⇌Cl2(g)+CO(g),经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )t/s 0 2 4 6 8 n(Cl2)/mol 0 0.16 0.19 0.20 0.20
A.反应在前2 s的平均速率v(CO)=0.080 mol•L-1•s-1
B.保持其他条件不变,升高温度,平衡时c(Cl2)=0.11 mol•L-1,则反应的△H<0
C.T K时起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,反应达到平衡前v正>v逆
D.T K时起始向容器中充入1.0 mol Cl2和0.9 mol CO,达到平衡时,Cl2的转化率小于80% gdyangjs1年前1
gdyangjs1年前1 -
 yzxhblr 共回答了20个问题
yzxhblr 共回答了20个问题 |采纳率95%解题思路:A.根据v(Cl2)=[△c/△t]结合反应速率之比等于化学计量数之比计算v(CO).
B.平衡时c(Cl2)=[0.20mol/2.0L]=0.10mol/L,升高温度,平衡时c(Cl2)=0.11 mol•L-1,说明平衡向正反应方向移动;
C.根据平衡时氯气的物质的量计算各物质的平衡浓度,可计算该温度下的平衡常数,以此判断反应进行的方向;
D.从等效平衡的角度分析.A.反应在前2 s的平均速率v(Cl2)=[△c/△t]=
0.16mol
2.0L
2s=0.04mol•L-1•s-1,则反应在前2 s的平均速率v(CO)=v(Cl2)=0.04mol•L-1•s-1,故A错误;
B.平衡时c(Cl2)=[0.20mol/2.0L]=0.10mol/L,升高温度,平衡时c(Cl2)=0.11 mol•L-1,说明平衡向正反应方向移动,则正反应应为吸热反应,△H>0,故B错误;
C.COCl2(g)⇌Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
该温度下k=[0.1×0.1/0.4]=0.025,
若起始向容器中充入0.9 mol COCl2、0.10 mol Cl2和0.10 mol CO,此时Qc=[0.1×0.1/0.9]<0.025,
则反应应向正反应方向移动,反应达到平衡前v正>v逆,故C正确;
D.T K时起始向容器中充入1.0molCl2和1.0molCO,应等效于向2.0L恒容密闭容器中充入1.0mol COCl2,达到平衡时Cl2的转化率等于80%,如加入1.0 mol Cl2和0.9 mol CO,相当于在原来的基础上减小0.1molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率小于80%,故D正确.
故选CD.点评:
本题考点: 化学平衡的计算.
考点点评: 本题综合考查化学平衡的计算以及等效平衡问题,题目难度较大,注意把握平衡常数的意义及应用.1年前查看全部
- 使一定量的H2在Cl2中充分燃烧,将反应后的气体缓缓通入100ml 1.0mol/L的NaOH溶液中.
使一定量的H2在Cl2中充分燃烧,将反应后的气体缓缓通入100ml 1.0mol/L的NaOH溶液中.
什么离子的物质的量先增大后减小 送423支野百合1年前1
送423支野百合1年前1 -
 红酒丽人 共回答了30个问题
红酒丽人 共回答了30个问题 |采纳率93.3%H+
HCl没有完全反应完时,H+在增加,后来中和完,浓度减小.1年前查看全部
- 配置100ml 1.0mol每升的NA2CO3溶液 为什么A选项中 :称取10.6g无水碳酸钠放入100ml容量瓶中加水
配置100ml 1.0mol每升的NA2CO3溶液 为什么A选项中 :称取10.6g无水碳酸钠放入100ml容量瓶中加水溶解 定容
我觉得10.6g 即1mol碳酸钠 加入100ml的容量瓶意思就是说 溶质和溶剂的总体积是100ml那么 c=0.1mol/0.1L=1mol/L 没错呀 为什么答案说是错的? 吃一钱长一智1年前1
吃一钱长一智1年前1 -
 梅川磊酷 共回答了25个问题
梅川磊酷 共回答了25个问题 |采纳率88%称取10.6g的固体时会吸收空气中的水有误差1年前查看全部
- 浓硝酸还是稀硝酸?Cu与2L 1.0mol/l的硝酸反映,若溶液中硝酸根物质的量浓度下降了0.2mol/l.求溶液中氢离
浓硝酸还是稀硝酸?
Cu与2L 1.0mol/l的硝酸反映,若溶液中硝酸根物质的量浓度下降了0.2mol/l.求溶液中氢离子浓度下降了多少?
这个题是把硝酸当成稀的还是浓的来算呀?
另外溶液的浓稀怎么判断,若是硫酸呢 hyrenjian1年前3
hyrenjian1年前3 -
 Cinderella┊ 共回答了19个问题
Cinderella┊ 共回答了19个问题 |采纳率89.5%我告诉你个解题密码,你看他的密度1.0mol/l,小的很,不用算,就知道是稀硝酸.1年前查看全部
- 1.0mol/L的KNO3溶液:Na+,Fe2+,Cl-,SO42-
1.0mol/L的KNO3溶液:Na+,Fe2+,Cl-,SO42-
答案显示不能共存 是不是因为Fe2+会水解生成H+ 然后氧化还原反应
那也就是说 只要体系中有Fe2+ NO3- 就可以发生氧化还原反应了?好奇怪啊. 雪色纱衣1年前1
雪色纱衣1年前1 -
 7x9f 共回答了16个问题
7x9f 共回答了16个问题 |采纳率87.5%反应不共存,共存不反应.
不会吧?这个是可以大量共存的啊.
1.0mol/L的KNO3溶液:H+,Fe2+,Cl-,SO42-
这个才不共存,因为H+和NO3-离子形成硝酸有强氧化性,会把Fe2+氧化成3+1年前查看全部
- 常温下,1.0mol每L的醋酸溶液中,水的离子积是不是1x10的负14次方?
常温下,1.0mol每L的醋酸溶液中,水的离子积是不是1x10的负14次方?
如上..带说明 长河夕照1年前1
长河夕照1年前1 -
 crystal_orchid 共回答了20个问题
crystal_orchid 共回答了20个问题 |采纳率100%是的.
Kw值跟温度有关,在25℃,Kw=[H+ ][OH-]=1×10-7×1×10-7=1×10-14.
在常温下,[H +]和[OH-]的乘积都等于1×10-14.不管是在算或是碱性溶液中.它只随温度变化1年前查看全部
- 化学配位平衡的计算将c(AgNO3)=0.20mol/L的硝酸银溶液20ml与(1) c(NH3)=1.0mol/L的氨
化学配位平衡的计算
将c(AgNO3)=0.20mol/L的硝酸银溶液20ml与
(1) c(NH3)=1.0mol/L的氨水20ml混合;
(2) c(KCN)=1.0mol/L的氰化钾水溶液20ml混合.
求混合液中的c(Ag+).
要求具体的步骤和原因. 独角妖精阿咿拉1年前2
独角妖精阿咿拉1年前2 -
 czy2000 共回答了15个问题
czy2000 共回答了15个问题 |采纳率86.7%1、AgNO3+NH3.H2O=AgOH↓+NH4NO3
2、AgNO3+KCN=AgCN↓+KNO3
两个方程式都有沉淀,要计算的就是AgNO3过量还是不足的问题.
因为量都是20ml,可以都看成1L,方便计算
你确定后面的是1mol每升?0.2mol的AG+将完全被1mol的OH-或者CN-中和的
因为离子比例是1:1,那么AG都将完成沉淀下来,所以不含有银离子了.1年前查看全部
- 5.2-化学9/选用一种试剂即能把浓度均为1.0mol/L 的Na2SO3、Na2SO4、BaCl2、Na2CO3、Na
5.2-化学9/选用一种试剂即能把浓度均为1.0mol/L 的Na2SO3、Na2SO4、BaCl2、Na2CO3、Na2S五种溶液区别开来,这种试剂为()?
(A)CaCl2溶液
(B)AgNO3溶液
(C)稀H2SO4
(D)NaOH溶液
我不知如何下手去做.请具体分析每个选项~
请写出详细过程及思路. 依赖哦1年前1
依赖哦1年前1 -
 tttnets 共回答了21个问题
tttnets 共回答了21个问题 |采纳率95.2%稀H2SO4 + Na2SO3 有SO2生成,刺激性气体
+Na2SO4 没有反应
+BaCl2 BaSO4 白色沉淀
+Na2CO3 有CO2生成,无味的气体
+Na2S 有H2S,臭鸡蛋味的气体
我的意见,逐一检验
比如A中,Na2SO3、Na2SO4 现象一样,都是微溶的
B Na2SO3、Na2SO4、BaCl2、Na2CO3、Na2S,都是白色沉淀
D Na2SO3、Na2SO4、BaCl2、Na2CO3、Na2S 都没有现象1年前查看全部
- 将0.2mol/L硫酸铜溶液和1.0mol/L硫酸溶液等体积混合,计算:混合液中硫酸铜和硫酸
将0.2mol/L硫酸铜溶液和1.0mol/L硫酸溶液等体积混合,计算:混合液中硫酸铜和硫酸
将0.2mol/L硫酸铜溶液和1.0mol/L硫酸溶液等体积混合,计算:混合液中硫酸铜和硫酸的物质的量浓度为多少 yxh8011年前1
yxh8011年前1 -
 康乐人家 共回答了17个问题
康乐人家 共回答了17个问题 |采纳率100%都为原来的二分之一1年前查看全部
- (2012•江苏)温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)=PCl3
(2012•江苏)温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)=PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )t/s 0 50 150 250 350 n(PCl3)/mol 0 0.16 0.19 0.20 0.20
A.反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 mol PCl3 和2.0 mol Cl2,达到平衡时,PCl3 的转化率小于80% 秋风赋1年前1
秋风赋1年前1 -
 算yy天 共回答了23个问题
算yy天 共回答了23个问题 |采纳率91.3%解题思路:A、由表中数据可知50s内,△n(PCl3)=0.16mol,根据v=
计算v(PCl3);△n V △t
B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.22mol,根据平衡时n(PCl3),判断平衡移动方向,升高温度平衡向吸热反应方向移动;
C、先求平衡常数K,再求浓度商(Qc),K>Qc,说明平衡向正反应方向移动,K<Qc,说明平衡向逆反应方向移动,K=Qc,说明平衡不移动,据此判断平衡移动;
D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,据此判断.A、由表中数据可知50s内,△n(PCl3)=0.16mol,v(PCl3)=
0.16mol
2L
50s=0.0016mol/(L•s),故A错误;
B、由表中数据可知,平衡时n(PCl3)=0.2mol,保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol/L,则n′(PCl3)=0.11 mol/L×2L=0.22mol,说明升高温度平衡正向移动,正反应为吸热反应,即△H>O,故B错误;
C、对于可逆反应:PCl5(g)⇌PCl3(g)+Cl2(g),
开始(mol/L):0.5 0 0
变化(mol/L):0.1 0.1 0.1
平衡(mol/L):0.4 0.1 0.1
所以平衡常数k=[0.1×0.1/0.4]=0.025.
起始时向容器中充入1.0 mol PCl5、0.20 molPCl3和0.20 molCl2,起始时PCl5的浓度为0.5mol/L、PCl3的浓度为0.1mol/L、Cl2的浓度为0.1mol/L,浓度商Qc=[0.1×0.1/0.5]=0.02,K>Qc,说明平衡向正反应方向移动,反应达平衡前v(正)>v(逆),故C正确;
D、等效为起始加入2.0molPCl5,与原平衡相比,压强增大,平衡向逆反应方向移动,平衡时的PCl5转化率较原平衡低,故平衡时PCl3的物质的量小于0.4mol,即相同温度下,起始时向容器中充入2.0 mol PCl3和2.0 mol Cl2,达到平衡时,PCl3的物质的量小于0.4mol,参加反应的PCl3的物质的量大于1.6mol,故达到平衡时,PCl3的转化率高于[1.6mol/2mol]=80%,故D错误.
故选C.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查反应速率、平衡常数计算、平衡移动、等效平衡等,难度中等,注意D中使用等效平衡思想分析,使问题简单化,也可以根据平衡常数计算,但比较麻烦.1年前查看全部
- 有氧化镁氧化铝混合物完全溶于200mL盐酸,而后逐滴加入1.0mol/L的NaOH溶液.溶液中生成沉淀的物质的量随加入的
有氧化镁氧化铝混合物完全溶于200mL盐酸,而后逐滴加入1.0mol/L的NaOH溶液.溶液中生成沉淀的物质的量随加入的NaOH的溶液体积的变化,如图所示:反应开始是在NaOH体积为20ml时开始,V为520时达到最大值,V为620时停止反应.(1)所用hcl物质的量浓度(2)求氧化镁氧化铝的物质的量之比.

 littleghost1年前1
littleghost1年前1 -
 窝不林清 共回答了20个问题
窝不林清 共回答了20个问题 |采纳率85%(1)沉淀量最大时所用OH-的物质的量与100mL强酸中H+的物质的量相等,n(OH-)=1.0mol·L-1×0.52L=0.52mol,故n(H+)也为0.52mol,盐酸的浓度为2.6mol·L-1
(2)根据Al(OH)3+OH-=AlO2-+2H2O
该反应用去的n(NaOH)=1.0mol·L-1×(0.62-0.52)L=0.10mol
故Al(OH)3为0.10mol,而Al2O3为0.050mol
根据Al3++3OH-=Al(OH)3生成Al(OH)3用去0.30mol NaOH.而生成氢氧化镁也用去0.20mol NaOH,氢氧化镁为0.10mol,氧化镁、氧化铝物质的量比为2:11年前查看全部
- 2012 江苏 高考 ③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 混合物Y
2012 江苏 高考
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图8 所示(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同).在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是 (填化学式).

答案为在NaOH溶液中产生氢气的主要物质是铝.怎么氢化镁不是啊?图中产生氢气也多啊 happy250go1年前1
happy250go1年前1 -
 yuh0p 共回答了12个问题
yuh0p 共回答了12个问题 |采纳率83.3%图中是反应后残留固体物质的X-射线衍射谱图,也就是在图中氢化镁剩得比较多,而生成的含镁化合物在图中未看到,生成的含铝化合物比较多,所以答案是Al.1年前查看全部
- 将17.92L标准状况下的二氧化碳气体通入1L1.0mol*L-1氢氧化钠溶液中,充分反应后,所得溶液中的CO2-3和H
将17.92L标准状况下的二氧化碳气体通入1L1.0mol*L-1氢氧化钠溶液中,充分反应后,所得溶液中的CO2-3和HCO-3的物质的量之比约是
A1:3 B1:2 C2:3 D3:2 runner81091年前4
runner81091年前4 -
 A-shin_kk 共回答了17个问题
A-shin_kk 共回答了17个问题 |采纳率88.2%选A
设1L1.0mol*L-1氢氧化钠转化为碳酸钠需要CO2的物质的量为X、生成碳酸钠的物质的量为Y
标准状况下17.92L的二氧化碳的物质的量n=17.92L/22.4L/mol=0.8mol
2NaOH + CO2 = Na2CO3 + H2O
2 1 2
1L*1.0mol/L X Y
X=0.5mol
Y=1mol/L
剩余CO2的物质的量=0.8mol-0.5mol=0.3mol
剩余CO2能与Z摩尔的碳酸钠反应,生成碳酸氢钠的物质的量为W
CO2 + Na2CO3 + H2O=2NaHCO3
1 1 2
0.3mol Z W
Z=0.3mol
W=0.6mol
剩余碳酸钠的物质的量=0.5mol-0.3mol=0.2mol
所得溶液中的CO2-3和HCO-3的物质的量之比0.2mol:0.6mol=1:31年前查看全部
- 在200ml1.0mol*LNaHCO3溶液中加入一定量的常见纯净物X 恰好使其转化为只含Na2CO3
在200ml1.0mol*LNaHCO3溶液中加入一定量的常见纯净物X 恰好使其转化为只含Na2CO3
某小苏打溶液中含16.8gNaHCO3,加入一定量的单质或化合物X,恰好使溶液中溶质只有Na2CO3,请你填写出X的化学式和质量.
编号 1 2 3 4
X的化学式NaOH Na
加入X的量 6.2
2中发生反应的化学方程式
反应后溶液中Na+物质的量均为 mol
在1-4中所得碳酸钠溶液中溶质的质量分数最小的是 最大的是 西风醉1年前1
西风醉1年前1 -
 87724413 共回答了22个问题
87724413 共回答了22个问题 |采纳率86.4%答案:
编号 1 2 3 4
X的化学式 NaOH Na2O Na Na2O2
加入X的量(g) 8 6.2 4.6 7.8
2中发生反应的化学方程式为:
Na2O+H2O=2NaOH
NaHCO3+NaOH=Na2CO3+H2O
反应后溶液中Na+物质的量均为 0.4 mol
在1-4中所得碳酸钠溶液中溶质的质量分数最小的是1(加入NaOH )
最大的是3(加入Na)
分析:
16.8gNaHCO3的物质的量为n=16.8g/84g/mol=0.2mol
NaHCO3+NaOH=Na2CO3+H2O
1 1
0.2mol X
X=0.2mol
n(Na+)=n(Na2CO3)=2*0.2mol=0.4mol
1、NaHCO3+NaOH=Na2CO3+H2O
84 40
16.8g 8g
溶液质量增加8克
2、Na2O+H2O=2NaOH
62 80
6.2g 8g
溶液质量增加6.2克
3、2Na+2H2O=2NaOH+H2↑
46 80 2
4.6g 8g 0.2g
4.6g-0.2g=4.4g
溶液质量增加4.4克
4、2Na2O2+2H2O=4NaOH+O2↑
156 160 32
7.8g 8g 1.6g
7.8g-1.6g=6.2g
溶液质量增加6.2克
四种溶液中所得的溶质的质量相等,而1中所得溶液增加质量最多,因此溶质的质量分数最小,
3所得溶液增加质量最小,因此溶质的质量分数最大.1年前查看全部
- 相同条件下,1.0mol/L的氨水与10.0mol/L的氨水的密度大?为什么?
 jeffye1年前1
jeffye1年前1 -
 kkdown 共回答了14个问题
kkdown 共回答了14个问题 |采纳率78.6%因为氨水越浓密度越小.其原因可能是MH3与水的结合比水-水之间的结合要疏松.
普通液态水中间实际上广泛的氢键,而NH3形成氢键的能力要比H2O弱很多.1年前查看全部
- 1.0mol/l盐酸配制成0.1mol/l的怎么配
1.0mol/l盐酸配制成0.1mol/l的怎么配
250ml的瓶,举例说明,是取25ml再稀释吗?
 yhyxwx1年前1
yhyxwx1年前1 -
 鹭岛听涛 共回答了14个问题
鹭岛听涛 共回答了14个问题 |采纳率92.9%用稀释公式M1V1=M2V2
1.0mol/L*X=0.1mol/L*250ml
X=25ml
就是用25ml 1.0mol/L的HCL加水到250ml1年前查看全部
- 1.0mol/l的氨水与0.6mol/l的盐酸等体积混合,求混合液的PH值
 天_流浪狗_涯1年前1
天_流浪狗_涯1年前1 -
 秀气囡囡1983 共回答了21个问题
秀气囡囡1983 共回答了21个问题 |采纳率81%设 1.0mol/l的氨水与0.6mol/l的盐酸体积均为1L
则反应生成氯化铵0.6mol,剩余0.4mol的氨
因为电离或水解程度很小
C(NH4+)=0.3mol/L
C(NH3)=0.2mol/L
代入Kb=[NH4+][OH-]/[NH3]=1.8*10-5
C(OH-)=1.2*10-5 mol/L
C(H+)=Kw/C(OH-)=8.33*10-10
pH=9.081年前查看全部
- 怎样配置100ML1.0mol/L硫酸溶液
怎样配置100ML1.0mol/L硫酸溶液
题目尚未说明使用的硫酸溶液浓度 桔子昏了1年前3
桔子昏了1年前3 -
 13bk 共回答了12个问题
13bk 共回答了12个问题 |采纳率91.7%题目说的不是很清楚,给你的原料是什么?98%的浓硫酸?还是标定好浓度的硫酸溶液?
配置药品基本步骤如下:
1.计算需要溶质的量.
2.称取或移取需要的溶质
3.选用合适的容量瓶(本题为100mL)
4.将称取或移取的溶质溶解在有少量水的烧杯中(小于需配溶液体积).
5.搅拌使溶质充分溶解,用玻璃棒导流,倒入容量瓶中.
6.将烧杯润洗3-4次,将润洗的水到入容量瓶中.
7.向容量瓶中加水,当液位要到刻度线的时候改用滴管滴加至刻度线.
8.盖上瓶盖,摇匀即可.1年前查看全部
- 在一定温度下,反应Y2 (g) +X2 (g) 2XY (g) 的平衡常数为4.若将1.0mol的XY(g)通入体积为1
在一定温度下,反应Y2 (g) +X2 (g) 2XY (g) 的平衡常数为4.若将1.0mol的XY(g)通入体积为1.0L的密闭容器中
发生反应:2XY (g) Y2 (g) +X2 (g),在该温度下XY (g)的最大分解率为( )
A.10% B.15% C.25% D.50% salangane1年前1
salangane1年前1 -
 结冰的泡泡 共回答了24个问题
结冰的泡泡 共回答了24个问题 |采纳率83.3%选D因为是可逆反应,且一定温度,所以要求的反应中K=0.25,三行式你会列吧,开根号后,转化率是0.5,既为最大分解率1年前查看全部
- 在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:
CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.
试回答下列问题:
(1)平衡时CO的转化率为______,该反应的化学平衡常数为______.
(2)如果继续向该平衡体系中通入1.0mol的H2O(g),相同条件下反应达到新的平衡状态,则CO的转化率将______(填“增大”、“减小”、“不变”),预计CO的转化率为______.
(3)427℃时该反应的平衡常数为9.4,请结合(1)中的计算结果判断该反应的△H______0(填“>”、“=”、“<”). 5490liu1年前1
5490liu1年前1 -
 lwt35 共回答了15个问题
lwt35 共回答了15个问题 |采纳率93.3%解题思路:令容器体积为1L,根据反应的方程式H2O (g)+CO (g)⇌H2(g)+CO2 (g),分别计算起始、转化以及平衡时的浓度,首先可计算出800℃时该反应的平衡常数、转化率等,根据温度变化时平衡常数的变化可判断反应热.①令容器体积为1L,
H2O (g)+CO (g)⇌H2(g)+CO2 (g)
起始:1 1 0 0
变化:0.5 0.5 0.5 0.5
平衡:0.5 0.5 0.5 0.5
则800℃时该反应的平衡常数k=1.
平衡时CO的转化率为[0.5/1×100%=50%,
故答案为:50%;1;
②如果继续向该平衡体系中通入1.0mol的H2O(g),设从起始到平衡CO的浓度变化为xmol•L -1,
H2O (g)+CO(g)⇌H2(g)+CO2 (g)
起始:2 1 0 0
变化:x x x x
平衡:(2-x) (1-x) xx
k=
x2
(2−x)(1−x)]=1,解得x=[2/3],CO转化率为
2
3
1×100%=66.7%,转化率增大,
故答案为:增大;66.7%;
③427℃时该反应的平衡常数为9.4,若保持其他条件不变,将温度从800℃降到427℃,平衡常数增加意味着反应正向移动,说明正反应放热,则该反应的△H<0,
故答案为:<.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,综合考查学生对化学平衡的理解以及计算能力,题目难度中等,本题注意根据物质的量浓度的变化利用三段式法解答.1年前查看全部
- 配制500ml 1.0mol/L,密度是1.16g/cm3的稀硫酸,需要质量分数为98%,密度为1.84g/cm3的浓硫
配制500ml 1.0mol/L,密度是1.16g/cm3的稀硫酸,需要质量分数为98%,密度为1.84g/cm3的浓硫酸多少毫升?需要加水多少毫升?
 散步的灿1年前1
散步的灿1年前1 -
 我爱成熟 共回答了15个问题
我爱成熟 共回答了15个问题 |采纳率100%解题思路:根据c=[1000ρω/M]计算浓硫酸物质的量浓度,再根据稀释定律计算需要浓硫酸的体积,根据m=ρV计算浓硫酸、稀硫酸的质量,进而计算加入水的质量,再根据V=[m/ρ]计算水的体积.质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度为[1000×1.84×98%/98]mol/L=18.4mol/L,配制500mL 1.0mol/L的稀硫酸需要浓硫酸体积为[500mL×1mol/L/18.4mol/L]=27.2mL,
浓硫酸的质量为[500mL×1mol/L/18.4mol/L]×1.84g/mL=500g,稀硫酸的质量为500mL×1.16g/mL=580g,故加入水的质量为580g-500g=80g,故加入水的体积为[80g/1g/mL]=80mL,
答:需要浓硫酸27.2毫升,需要加水80毫升.点评:
本题考点: 物质的量浓度的相关计算.
考点点评: 本题考查溶液浓度有关计算,难度不大,注意理解掌握物质的量浓度与质量分数之间的关系.1年前查看全部
- 求离子方程式:有氧化镁,氧化铝的混合物完全溶于200ml盐酸,而后逐滴加入1.0mol/L的NaOH溶液.
求离子方程式:有氧化镁,氧化铝的混合物完全溶于200ml盐酸,而后逐滴加入1.0mol/L的NaOH溶液.
溶液中生成沉淀的物质的量随加入的NaOH的溶液体积的变化,如图所示

最初加入的20mL NaOH溶液发生的离子方程式是 firstbabay1年前1
firstbabay1年前1 -
 李大伦 共回答了20个问题
李大伦 共回答了20个问题 |采纳率90%AL2O3+2OH-=2ALO2-+H2O1年前查看全部
- Ag2s+H2=2Ag+H2S在740K时的K=0.36.若在该温度下,在密闭容器中将1.0molAg2S还原为银,试计
Ag2s+H2=2Ag+H2S在740K时的K=0.36.若在该温度下,在密闭容器中将1.0molAg2S还原为银,试计算最少需用...
Ag2s+H2=2Ag+H2S在740K时的K=0.36.若在该温度下,在密闭容器中将1.0molAg2S还原为银,试计算最少需用的物质的量 不太想说1年前4
不太想说1年前4 -
 小布点xiaobudian 共回答了18个问题
小布点xiaobudian 共回答了18个问题 |采纳率100%平衡:n(H2)=0.5/0.36=1.4mol
需要消耗n(H2)=1.9mol1年前查看全部
- 实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
实验室需要配制1.0mol/L硫酸溶液500mL,根据溶液配制情况回答下列问题:
(1)实验中除了烧杯、量筒、玻璃棒外还需要的其它仪器有:______.
(2)根据计算得知,所需质量分数为98%、密度为1.84g/cm 3 的浓硫酸体积为______mL.(计算结果保留一位小数)
(3)配制一定物质的量浓度溶液的实验中,如果出现以下操作:
A.量取浓硫酸的量筒内有少量水;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中;
C.住容量瓶转移时,有少量液体溅出
D.将量筒洗涤后洗涤液一并转入容量瓶
E.定容时仰视刻度线
F.容量瓶未干燥即用来配制溶液
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线.
对配制的溶液物质的量浓度可能造成偏大的有______(填写字母);无影响有______. 超越是一种美1年前1
超越是一种美1年前1 -
 陌上优花 共回答了16个问题
陌上优花 共回答了16个问题 |采纳率93.8%(1)配制500ml1.0mol/L稀硫酸,操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.
所以需要的仪器为:烧杯、筒量、玻璃棒、500mL容量瓶、胶头滴管.
所以还需要的仪器是:500mL容量瓶、胶头滴管,故答案为:500mL容量瓶、胶头滴管;
(2)质量分数为98%、密度为1.84g/cm 3 的浓硫酸的物质的量浓度为
1000×1.84×98%
98 mol/L=18.4mol/L,根据稀释定律,稀释前后溶质的物质的量不变,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=500mL×1.0mol/L,解得:x≈27.2,故答案为:27.2;
(3)A.量取浓硫酸的量筒内有少量水,量取浓硫酸的体积偏小,所配溶液浓度偏小;
B.浓硫酸在烧杯中溶解后,未经冷却就立即转移到容量瓶中进行定容,溶液冷却后导致所配溶液的体积偏小,溶液浓度偏大;
C.住容量瓶转移时,有少量液体溅出,移入容量瓶内的硫酸减少,所配溶液浓度偏小;
D.量筒为流量式仪器,将量筒洗涤后洗涤液一并转入容量瓶,移入容量瓶内硫酸增大,所配溶液浓度偏大;
E.定容时仰视刻度线,导致所配溶液的体积偏大,溶液浓度偏小;
F.溶液配制需加水定容,容量瓶未干燥即用来配制溶液,对所配溶液浓度无影响;
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,少量溶液残留在瓶塞与瓶口之间,再加水至刻度线,所配溶液的体积偏大,溶液浓度偏小.
对配制的溶液物质的量浓度可能造成偏大的有BD;无影响有F.
故答案为:BD;F.1年前查看全部
- 将200ml0.5mol/l的naoh溶液和200ml1.0mol/l的naoh溶液混合,求所得溶液nacl的物质的量浓
将200ml0.5mol/l的naoh溶液和200ml1.0mol/l的naoh溶液混合,求所得溶液nacl的物质的量浓度是多少?
 sqzjojo1年前1
sqzjojo1年前1 -
 zhong8882006 共回答了25个问题
zhong8882006 共回答了25个问题 |采纳率84%两者会合无论如何也不可能得到食盐溶液,可能是把NaOH误写为NaCl.如果是,那么
不同浓度的氢氧化钠溶液混合,得到的溶液的体积会略小于,两者的体积之和,如果忽略体积的变化.混合后溶液的物质的量浓度是(0.5+1.0)/2=0.75mol/L.1年前查看全部
- 在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)
在密闭容器中,将1.0mol CO与1.0mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),一段时间后该反应达到平衡,测得CO的物质的量为0.5mol.则下列说法正确的是( )
A. 800℃下,该反应的化学平衡常数为0.25
B. 427℃时该反应的平衡常数为9.4,则该反应的△H<0
C. 同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),则平衡时CO转化率为66.7%
D. 同温下,若继续向该平衡体系中通入1.0 mol的CO(g),则平衡时CO物质的量分数为33.3% public_88991年前1
public_88991年前1 -
 wangljy 共回答了12个问题
wangljy 共回答了12个问题 |采纳率91.7%解题思路:A、根据CO的物质的量,利用三段式计算平衡时各组分的物质的量,由于反应前后气体的体积不变,各物质的系数为1,故可以用物质的量代替浓度代入平衡常数表达式计算;
B、结合A中的平衡常数,判断降低温度平衡的移动方向,据此判断反应热效应;
C、同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),等效为开始加入1.0mol CO与2.0mol H2O,令平衡时参加反应的CO的物质的量为amol,利用三段式表示出平衡时各组分的物质的量,代入平衡常数列方程计算a的值,再根据转化率定义计算;
D、同温下,若继续向该平衡体系中通入1.0 mol的CO(g),等效为开始加入2.0mol CO与1.0mol H2O,令平衡时参加反应的CO的物质的量为bmol,利用三段式表示出平衡时各组分的物质的量,代入平衡常数列方程计算b的值,再根据转化率定义计算.A、平衡时CO的物质的量为0.5mol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):1 1 0 0
变化(mol):0.5 0.5 0.5 0.5
平衡(mol):0.5 0.5 0.5 0.5
故该温度下平衡常数k=[0.5×0.5/0.5×0.5]=1,故A错误;
B、427℃时该反应的平衡常数为9.4,大于800℃时的平衡常数1,故降低温度平衡向正反应进行,该反应正反应是放热反应,即△H<0,故B正确;
C、同温下,若继续向该平衡体系中通入1.0 mol的H2O(g),等效为开始加入1.0mol CO与2.0mol H2O,令平衡时参加反应的CO的物质的量为amol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):12 0 0
变化(mol):a a a a
平衡(mol):1-a2-a aa
所以[a×a
(1−a)×(2−a)=1,解得a=
2/3],故CO的转化率为
2
3mol
1mol×100%=66.7%,故C正确;
D、同温下,若继续向该平衡体系中通入1.0 mol的CO(g),等效为开始加入2.0mol CO与1.0mol H2O,令平衡时参加反应的CO的物质的量为bmol,则:
CO(g)+H2O(g)⇌CO2(g)+H2(g)
开始(mol):21 0 0
变化(mol):b b b b
平衡(mol):2-b1-bbb
所以[b×b
(2−b)×(1−b)=1,解得b=
2/3],故CO的转化率为
2
3mol
1mol×100%=66.7%,故D错误;
故选BC.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡常数的有关计算,难度中等,注意化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率.1年前查看全部
大家在问
- 1使用奥氏粘度计时注入粘度计中的标准液体和待测液体的体积为什么必须相同
- 2草原上有一个等边三角形的建筑物,边长是3米,一只羊被栓在建筑物的一个角上,已知绳子长度为4米,这只羊能吃到草的总面积是多
- 3lim的2x^2-3x+5除3x^2+2x+4,计算极限
- 4制作蘑菇浸制标本的数学问题制作蘑菇浸制标本,主要步骤是:1、制保存液,每100毫升酒精含量占10分之7的液体加入6毫升福
- 5求:英语作文120字要求:假设你是李华,你的美国朋友David写信询问你高中毕业后是打算出国留学还是留在国内读大学.请根
- 6从孔子对水的评述,你能悟到什么?
- 7“孙悟空大闹天宫”出自《西游记》,请你用概括的语言,再写其中一个与孙悟空有关的故事
- 8有一种铁的氧化物样品,用5mol/L的盐酸50mL恰好完全溶解
- 9400平方的面积需要多少块80*80(厘米)的瓷砖?
- 10陋室铭中苔痕上阶绿的绿,草色入帘青中的绿,我们老师讲的是形容词作动词,翻译为映上绿色
- 11《十万个为什么》读后感20篇
- 12关于声和电磁波的说法正确的是( )
- 134.2×10的5次方 4.20×10的5次方 3.69万 3.70亿 都精确到什么位?
- 14已知∠ABC=∠DAE=90°,AD+BC=CE,E为AB的中点,求证:∠DEC=90°
- 15推荐一本能拔高的教辅书,英语的,
