对角线规则的适用范围?RT..对于过渡元素与长周期元素能用吗?
 oo里的小白杨2022-10-04 11:39:541条回答
oo里的小白杨2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 laiqin1019 共回答了23个问题
laiqin1019 共回答了23个问题 |采纳率95.7%- Li与Mg,Be与Al,B与Si这三对元素在周期表中处于对角线位置:
Li Be B C
Na Mg Al Si
相应的两元素及其化合物的性质有许多相似之处.这种相似性称为对角线规则.
锂与镁的相似性:
★ 锂和镁在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物.
★ 锂、镁都能与氮气直接化合而生成氮化物.
★ 锂、镁与水反应均较缓慢.
★ 锂、镁的氢氧化物都是中强碱,溶解度都不大,在加热时分解为Li2O和MgO.
★ 锂、镁的氟化物、碳酸盐、磷酸盐均难溶于水.
★ 锂、镁的碳酸盐在加热时均能分解为相应的氧化物和二氧化碳.
★ 锂、镁的氯化物均能溶于有机溶剂中,表现出共价特性.
铍与铝的相似性
·★铍、铝都是两性金属,既能溶于酸,也能溶于强碱.
·★铍和铝都能被冷的浓硝酸钝化.
·★铍和铝的氧化物均是熔点高、硬度大的物质.
★·铍和铝的氢氧化物Be(OH)2、Al(OH)3都是两性氢氧化物,而且都难溶于水.
★铍和铝的氟化物都能与碱金属的氟化物形成配合物,如Na2,Na3[AlF6].它们的氯化物、溴化物、碘化物都易溶于水,氯化物都是共价型化合物,易升华,易聚合,易溶于有机溶剂.
对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律,对此可以用离子极化的观点加以粗略地说明.同一周期最外层电子构型相同的金属离子,从左至右随离子电荷数的增加而引起极化作用的增强.同一族电荷数相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱.因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷数和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质有许多相似之处.由此反映出物质的性质与结构的内在联系. - 1年前
相关推荐
- (2007•南京二模)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”
 (2007•南京二模)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”.则下列叙述不正确的是( )
(2007•南京二模)元素周期表中,某些主族元素与右下方的主族元素(如图)的性质具有相似性,这种规律被称为“对角线规则”.则下列叙述不正确的是( )
A.Li在N2中燃烧生成Li3N
B.Li在空气中燃烧生成Li2O2
C.Be(OH)2既能溶于强酸又能溶于强碱溶液
D.硼酸钠溶液显碱性 pcdigital1年前1
pcdigital1年前1 -
 bingge198601 共回答了22个问题
bingge198601 共回答了22个问题 |采纳率95.5%解题思路:根据对角线规则知,Li元素和Mg元素性质相似,Be和Al元素的性质相似,根据Mg元素及其化合物的性质判断Li元素及其化合物的性质,根据Al元素及其化合物的性质判断Be元素及其化合物的性质.A.镁和氮气反应生成氮化镁,根据对角线规则知,Li和氮气反应生成Li3N,故A正确;
B.镁在空气中燃烧是氧化镁,根据对角线规则知,锂在空气中燃烧生成氧化锂,故B错误;
C.氢氧化铝能溶于强酸和强碱,根据对角线规则知,氢氧化铍能溶于强酸和强碱,故C正确;
D.硅酸钠溶液显碱性,根据对角线规则知,硼酸钠显碱性,故D正确;
故选:B.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查了物质的性质,明确对角线规则的含义是解本题关键,根据对角线规则来分析解答即可,难度不大.1年前查看全部
- 元素周期表中有三组元素:Li与Mg、Be(铍)与Al、B与Si的单质及其化合物很多理化性质相似,称为“对角线规则”.由此
元素周期表中有三组元素:Li与Mg、Be(铍)与Al、B与Si的单质及其化合物很多理化性质相似,称为“对角线规则”.由此判断下列说法不正确的是( )
A.Li2CO3受热分解生成Li2O和CO2
B.Be、BeO和Be(OH)2既能与NaOH(aq)反应又能HCl(aq)反应
C.单质硼的熔沸点高、硬度大,属于原子晶体
D.Li、Be和B三种单质及其化合物化学性质都相似 zsbetty1年前1
zsbetty1年前1 -
 hwdragon 共回答了19个问题
hwdragon 共回答了19个问题 |采纳率100%解题思路:根据对角线规则知,对角线上单质及其化合物性质具有相似性,根据Mg、Al、Si元素及其化合物性质确定Li、Be、B元素及其化合物性质.A.碳酸镁受热不易分解,根据对角线规则知,碳酸锂受热不易分解,故A错误;B.Al、氧化铝及氢氧化铝都能溶于强酸和强碱,根据对角线规则知,Be、BeO和Be(OH)2既能与NaOH(aq)反应又能HCl(aq)反应,故B正确;C....
点评:
本题考点: 元素周期表的结构及其应用;元素周期律和元素周期表的综合应用.
考点点评: 本题考查了对角线规则,明确对角线规则含义是解本题关键,再结合已知物质的性质采用知识迁移的方法分析解答,题目难度不大.1年前查看全部
- 下列说法中错误的是( ) A.根据对角线规则,铍和铝的性质具有相似性 B.
下列说法中错误的是()
A.根据对角线规则,铍和铝的性质具有相似性 B.在H 3 O + 、NH 4 + 和[Cu(NH 3 ) 4 ] 2+ 中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.P 4 和CH 4 都是正四面体分子且键角都为109 o 28ˊ  hxz3951年前1
hxz3951年前1 -
 boing787 共回答了15个问题
boing787 共回答了15个问题 |采纳率86.7%D
1年前查看全部
- 下列说法中错误的是( )A.53129I与53127I互为同位素B.根据对角线规则,铍和铝的性质具有相似性C.元素电负
下列说法中错误的是( )
A.53129I与53127I互为同位素
B.根据对角线规则,铍和铝的性质具有相似性
C.元素电负性越大的原子,吸引电子的能力越强
D.1个原子轨道里最多只能容纳2个电子,且自旋方向相同 飘零的鱼1年前1
飘零的鱼1年前1 -
 wanganjiang 共回答了22个问题
wanganjiang 共回答了22个问题 |采纳率86.4%解题思路:A.具有相同质子数不同中子数的原子,互称同位素;
B.周期表中某一元素的性质,和它左上或右下方的另一元素性质的相似性,称为对角线规则;
C.元素的电负性是元素的原子在化合物中吸引电子能力的标度.元素电负性数值越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性数值越小,相应原子在化合物中吸引电子的能力越弱(稀有气体原子除外);
D.泡利原理:1个原子轨道里最多只能容纳2个电子,且自旋方向相反.A.两原子质子数都是53,中子数不同分别是76和74,故A正确;B.铍和铝在周期表中位置,铍左上或铝右下方,符合对角线规则,故B正确;C.元素的电负性是元素的原子在化合物中吸引电子能力的标度.元素电负性数值越大...
点评:
本题考点: 同位素及其应用;元素周期表的结构及其应用;元素周期律的作用;原子核外电子排布.
考点点评: 本题考查了同位素、元素电负性的概念以及周期表中对角线规则,电子排布规律,题目比较简单,注意概念的记忆和理解.1年前查看全部
- 氢氧化锂和氢氧化镁的相似性目前一轮复习中,在讲碱金属的时候老师提了一句Li和Mg的对角线规则,麻烦给详解一下(百度百科就
氢氧化锂和氢氧化镁的相似性
目前一轮复习中,在讲碱金属的时候老师提了一句Li和Mg的对角线规则,麻烦给详解一下(百度百科就不用了)谢谢 szqsong1年前1
szqsong1年前1 -
 metresunny 共回答了15个问题
metresunny 共回答了15个问题 |采纳率93.3%二者处于对角线的位置,所以两种离子的半径差异不大,所以形成的晶体晶胞结构相似,形成的分子键长键能等都比较相似,这是二者性质相近的原因.氢氧化锂和氢氧化镁都是中强碱且二者在水溶液中的溶解度都不高,这就是体现1年前查看全部
- 下列说法中错误的是( ) A.根据对角线规则,铍和铝的性质具有相似性 B.在H 3 O + 、NH 4 +
下列说法中错误的是( ) A.根据对角线规则,铍和铝的性质具有相似性 B.在H 3 O + 、NH 4 + 和[Cu(NH 3 ) 4 ] 2+ 中都存在配位键 C.元素电负性越大的原子,吸引电子的能力越强 D.P 4 和CH 4 都是正四面体分子且键角都为109°28′  lulu04061年前1
lulu04061年前1 -
 浅紫茉莉 共回答了20个问题
浅紫茉莉 共回答了20个问题 |采纳率95%A、根据周期律对角线规则,金属Be与铝单质及其化合物的性质相似,故A正确;
B、NH 4 + 和[Cu(NH 3 ) 4 ] 2+ 、H 3 O + 中都存在配位键,故B正确;
C、元素电负性越大的原子,得电子能力越强,故C正确;
D、CH 4 是正四面体分子,键角都为109°28′,P 4 是正四面体分子,键角为60°,故D错误.
故选D.1年前查看全部
- 下列说法中错误的是( )A.根据对角线规则,铍和铝的性质具有相似性B.冰的密度比液态水的密度小与氢键有关C.升高温度能
下列说法中错误的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.冰的密度比液态水的密度小与氢键有关
C.升高温度能加快化学反应的速率,是因为活化分子百分数均增加
D.P4和CH4都是正四面体分子且键角都为109°28ˊ yuhao1981251年前1
yuhao1981251年前1 -
 hou_na1314 共回答了20个问题
hou_na1314 共回答了20个问题 |采纳率95%解题思路:A、铍和铝处于对角线上,所以铍和铝的性质具有相似性;
B、水变成冰体积变大,是因为液态水中水分子之间存在着较强的氢键作用力.它比分子间的作用力(范得瓦耳斯力)大得多.当水处于液态时,在氢键力的作用下,水分子靠近,在宏观上就表现为体积小.而变为固体时,水变为晶体,分子排列有了规律,分子间距离增大且被固定在一个位置上,氢键的作用力削弱,宏观的表现为体积变大;
C、温度升高,活化分子的百分数增加;
D、CH4是正四面体分子且键角都为109°28ˊ,P4是正四面体分子且键角都为60°.A、铍和铝处于对角线上,根据对角线规则,所以铍和铝的性质具有相似性,故A错误;
B、水变成冰体积变大,是因为液态水中水分子之间存在着较强的氢键作用力.它比分子间的作用力(范得瓦耳斯力)大得多.当水处于液态时,在氢键力的作用下,水分子靠近,在宏观上就表现为体积小.而变为固体时,水变为晶体,分子排列有了规律,分子间距离增大且被固定在一个位置上,氢键的作用力削弱,宏观的表现为体积变大,所以氢键的存在使冰的密度比液态水的密度小,故B正确;
C、温度升高,活化分子的百分数增加,故C正确;
D、CH4是正四面体分子且键角都为109°28ˊ,P4是正四面体分子且键角都为60°,故D错误;
故选D.点评:
本题考点: 元素周期表的结构及其应用;判断简单分子或离子的构型;含有氢键的物质.
考点点评: 本题是综合考查题,涉及对角线规则、氢键、活化分子的百分数和分子的空间结构,比较容易.1年前查看全部
- 下列说法中错误的是( )A. 根据对角线规则,铍和铝的性质具有相似性B. 在H3O+、NH4+ 和[Cu(N
下列说法中错误的是( )
A. 根据对角线规则,铍和铝的性质具有相似性
B. 在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键
C. 元素电负性越大的原子,吸引电子的能力越强
D. P4和CH4都是正四面体分子且键角都为109°28′ 金星vince1年前1
金星vince1年前1 -
 xxx19860923 共回答了12个问题
xxx19860923 共回答了12个问题 |采纳率91.7%解题思路:A、对角线规则:处于对角线位置的元素性质具有相似性;
B、配位键是成键原子一方提供电子对,一方提供空轨道的化学键;
C、根据元素电负性的含义来回答;
D、正四面体分子且键角都为109°28′.A、根据周期律对角线规则,金属Be与铝单质及其化合物的性质相似,故A正确;
B、NH4+ 和[Cu(NH3)4]2+、H3O+中都存在配位键,故B正确;
C、元素电负性越大的原子,得电子能力越强,故C正确;
D、CH4是正四面体分子,键角都为109°28′,P4是正四面体分子,键角为60°,故D错误.
故选D.点评:
本题考点: 元素周期律的作用;元素电离能、电负性的含义及应用;配合物的成键情况.
考点点评: 本题考查学生有关电负性的作用、配位键的概念以及元素周期律的作用等方面的知识,属于综合知识的考查,难度不大.1年前查看全部
- 在元素周期表中,什么是对角线规则?
 沙子虫1年前2
沙子虫1年前2 -
 四时万物 共回答了18个问题
四时万物 共回答了18个问题 |采纳率88.9%元素周期表中处于对角线位置的金属在性质上有很多共同之处,如Be和Al等,被称为对角线规则.1年前查看全部
- 下列说法中错误的是 [ ] A.根据对角线规则,铍和铝的性质具有相似性
下列说法中错误的是 [ ]A.根据对角线规则,铍和铝的性质具有相似性
B.在H 3 O + 、NH 4 + 和[Cu(NH 3 ) 4 ] 2+ 中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P 4 和CH 4 都是正四面体分子且键角都为109°28ˊ bmcc_co1年前1
bmcc_co1年前1 -
 事事村 共回答了18个问题
事事村 共回答了18个问题 |采纳率88.9%D1年前查看全部
- 4阶行列式的计算看到一道例题,用展开式方法算就是图中结果,为什么我用对角线规则算完结果是1+aˆ4,为什么·结
4阶行列式的计算
看到一道例题,用展开式方法算就是图中结果,为什么我用对角线规则算完结果是1+aˆ4,为什么·结果不同?
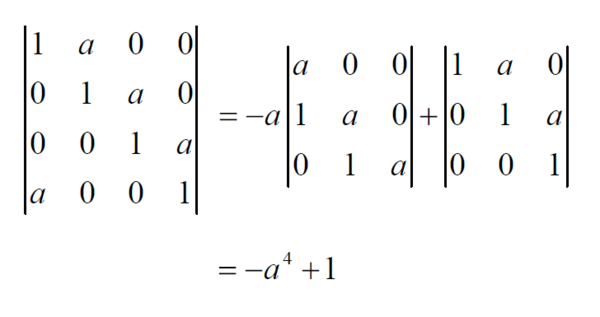
 BINYANG1年前1
BINYANG1年前1 -
 接龙362 共回答了23个问题
接龙362 共回答了23个问题 |采纳率100%你对角线法则错了,4次的不能完全按照3次的方法求解,而是寻找其逆序数,a^4列下标为2341,其逆序数为3,故前面符号应该为负.1年前查看全部
- 什么是化学中的对角线规则?尽快回答我,本人不胜感激,感激涕零!请告知具体相似理由,及完整的定义内容!
 北极胖狐狸1年前1
北极胖狐狸1年前1 -
 archilangelo2 共回答了24个问题
archilangelo2 共回答了24个问题 |采纳率79.2%周期表中某一元素的性质,和它左上或右下方的另一元素性质的相似性,称为对角线规则.譬如处于第二周期的锂与第三周期的镁相似、铍—铝相似和硼—硅相似.这种对角相似仅限于此三对元素之间.为什么会产生这种现象呢?先来分析一下硼与硅的相似.
硼位于第Ⅲ主族,它的原子半径显然要比铝要小,非金属性比铝强,而硅位于第Ⅳ主族,它的原子半径亦比铝要小,非金属性比铝强.硼、硅在形成化合物时其离子极化力相接近的缘故,致使硼—硅相似.事实证明硼与硅从单质到化合物性质相似.1年前查看全部
- 化学周期表里的对角线规则是什么
 扭扭的妞妞1年前1
扭扭的妞妞1年前1 -
 ricky555 共回答了20个问题
ricky555 共回答了20个问题 |采纳率85%周期表中某一元素的性质,和它左上或右下方的另一元素性质的相似性,称为对角线规则.譬如处于第二周期的锂与第三周期的镁相似、铍—铝相似和硼—硅相似.这种对角相似仅限于此三对元素之间.为什么会产生这种现象呢?先来分析一下硼与硅的相似.
硼位于第Ⅲ主族,它的原子半径显然要比铝要小,非金属性比铝强,而硅位于第Ⅳ主族,它的原子半径亦比铝要小,非金属性比铝强.硼、硅在形成化合物时其离子极化力相接近的缘故,致使硼—硅相似.事实证明硼与硅从单质到化合物性质相似.
参考资料:www.blog.edu.cn1年前查看全部
- 根据周期律对角线规则,金属Be与Al单质及化合物的性质相似,试回答下列问题:
根据周期律对角线规则,金属Be与Al单质及化合物的性质相似,试回答下列问题:
(1)写出Be与NaOH溶液反应的化学方程式(生成Na2BeO2)
(2)Be(OH)2与Mg(OH)2可用试剂_______鉴别,其离子方程式为:___________ snoopy0011年前1
snoopy0011年前1 -
 hwstarsz 共回答了21个问题
hwstarsz 共回答了21个问题 |采纳率76.2%Be+2NaOH+=Na2BeO2+H2↑
用NaOH鉴别 Be+2OH- = BeO2^2- + H2↑
Mg(OH)2不溶1年前查看全部
- 根据周期表对角线规则,回答下列问题:
根据周期表对角线规则,回答下列问题:
1.写出氢氧化钡分别与盐酸和氢氧化钠溶液反应的化学方程式.
2.氯化钡溶液和氯化镁溶液可用什么加以鉴别?现象是? hwj_681年前3
hwj_681年前3 -
 1024520 共回答了24个问题
1024520 共回答了24个问题 |采纳率95.8%确定是Ba(OH)2氢氧化钡?不是Be(OH)2氢氧化铍?
1、氢氧化铍Be(OH)2性质类似于氢氧化铝Al(OH)3
Be(OH)2 + 2 HCl = BeCl2 + 2 H2O
Be(OH)2 + 2 NaOH = Na2BeO2 + 2 H2O
2、BeCl2溶液和MgCl2溶液.
鉴别:加入NaOH溶液,产生白色沉淀并且一直不溶解的是MgCl2.
产生白色沉淀,NaOH过量后又溶解的是BeCl21年前查看全部
- 怎样用电负性解释对角线规则?
 fatimalc1年前3
fatimalc1年前3 -
 垂莲子 共回答了19个问题
垂莲子 共回答了19个问题 |采纳率94.7%对角线规则其实不是什么规则,是大家总结出来的一个经验罢了
而且只适用于第二第三周期的几个有限的元素之间,如:Li与Mg,Be与Al,B与Si这三对元素
这几个元素为什么会这样,一般用离子极化的观点加以说明:同一周期最外层电子构型相同的金属离子,从左至右随离子电荷数的增加而引起极化作用的增强.同一族电荷数相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱.因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷数和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质有许多相似之处.
如果你非用电负性来解释,可以这样认为,有对角线规则的元素电负性相近
比如:锂的电负性是1,镁是1.3;铍和铝的电负性几乎一样,一个是1.57,一个是1.61,硼的电负性是2.04,硅是1.91年前查看全部
- 元素周期表第2,3族的元素具有对角线规则是什么意思?说清楚点
 scnksunny1年前2
scnksunny1年前2 -
 受伤的丁丁虫 共回答了32个问题
受伤的丁丁虫 共回答了32个问题 |采纳率93.8%就是讲Li与Mg,Be与Al,B与Si这三对元素的相似性,不指其他元素.相似性指的是金属性和非金属性,并且对角线规则不是官方定律、定则,而是通用说法、习惯说法.资料参见:http://baike.baidu.com/view/968396.htm1年前查看全部
大家在问
- 1我若不爱你,又怎会允许你践踏我的自尊心?帮翻译成英文,谢谢
- 2已知双曲线C的方程为x^2/a^2-y^2/b^2=1的离心率为根号3,右准线方程为x=根号3/3,设直线l是圆O:x^
- 3一道初一的数学题(代数式)杭州跨海大桥打下的一根用特殊材料制成的桩管(圆环柱)长73米,质量为P吨.它的外半径为R米,用
- 4一艘轮船在水中航行,已知水流速度是8千米/时,此船在静水中的速度是40千米/时,A、B两地之间相距150千米,则在A、B
- 5跪求两篇英语日记,可以不写内容,直接告诉我具体事件就行了,明天就要交了,速度啊
- 6作文 我是一() 可填动物.植物.自然景观 如:我是一只小鸟.我是一个树.我是一阵风
- 7判断题:一个比的前项和后项同时缩小2倍,比值也缩小2倍.( ) 甲数是乙数的4分之5,则甲
- 8小车在高速公路上被大车超了,会被吸向大车还是被吹出?
- 9英语翻译我想预约一下你的时间
- 10在《邓稼先》一课中,在写邓稼先之前,为什么先概述我国近一百多年来的历史???
- 11某车间计划30天完成1200个零件.实际前8天就加工了40%,照这样计算,完成任务要多少天?
- 12“班风”中的“风”字指的是()意思."风景"中的“风”指的是()意思.
- 13"Good-bye,Mr.Chen.I'm pleased __________."
- 14我最感激的一个人作文100字
- 15选择恰当的角度赏析下面的句子:小姑娘挺直了身子,翘起了头,就像她是位真正的公主那样,挺身翘首。
