25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,
 寻找星星10192022-10-04 11:39:542条回答
寻找星星10192022-10-04 11:39:542条回答25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466g 沉淀.滤液跟2.00mol/L氢氧化钠溶液反应,共用去10.00mL碱液时恰好中和.下列说法中正确的是x05 ( )
A.原混合液中c(SO)=0.20mol/L
B.原混合液中c(NO)=0.90mol/L
C.原混合液中pH=0
D.原混合液中由水电离出的c(H+)=0.10mol/L

已提交,审核后显示!提交回复
共2条回复
 wckfg 共回答了19个问题
wckfg 共回答了19个问题 |采纳率89.5%- 由题意:滤液跟2.00mol/L氢氧化钠溶液反应,共用去10.00mL碱液时恰好中和,设20.00mL硫酸和硝酸的混合溶液中氢离子浓度为x.
故2.00mol/L*10.00mL=x*20.00mL
X=1.00mol/L
原混合液中pH=0 - 1年前
 kugolove 共回答了12个问题
kugolove 共回答了12个问题 |采纳率- 由0.466g沉淀(硫酸钡0.002mol)可知,原混合液中硫酸浓度为0.002mol/0.02L=0.1mol/L;由“滤液跟2.00mol/L氢氧化钠溶液反应,共用去10.00mL碱液时恰好中和”知,硝酸浓度为1.00mol/L;酸性或碱性条件下水的电离都是受抑制的,所以由水电离出的氢离子浓度比10的-7次方还要低。原溶液中氢离子浓度为1.2mol/L,根据公式计算pH近似为0...
- 1年前
相关推荐
- 甲、乙、丙、丁四位同学各取了0.1mol•L-1的一元酸(他们所取的酸可能是不同的)20.00mL,分别向其中滴加0.1
甲、乙、丙、丁四位同学各取了0.1mol•L-1的一元酸(他们所取的酸可能是不同的)20.00mL,分别向其中滴加0.1mol•L-1的一元碱(他们所用的碱也可能是不同的),在滴加过程中不断测定混合液的pH,下表是测得的部分数据.
请回答下列问题:测定溶液的pH 加入碱溶液的体积/mL 甲 乙 丙 丁 19.98 4.3 7.7 4.3 20.00 7.0 7.0 8.7 5.3 20.02 9.7 10.0
(1)向酸溶液中滴加碱溶液时,盛装碱溶液所用的仪器是______.
(2)滴定操作图示正确的是______(填编号).
(3)四位同学所选用的酸溶液pH最大的是______(在甲、乙、丙、丁中选填).
(4)请计算甲同学在滴入19.98mL碱溶液时,溶液的pH约为______(保留一位小数,可用对数形式表示).
(5)若以上酸碱用于中和滴定,试给出选用指示剂的建议(填在表格中)甲 丙 建议选用的指示剂
______
______ H79351年前1
H79351年前1 -
 askdufgkesgt 共回答了18个问题
askdufgkesgt 共回答了18个问题 |采纳率94.4%解题思路:(1)滴定时,碱溶液存放在碱式滴定管中;
(2)碱式滴定管放液体的方法:用食指和中指紧压橡皮管中的玻璃球,使液体流下;
(3)根据酸碱恰好反应只生成盐和水,根据盐溶液的酸碱性确定酸、碱的强弱和对应酸的强弱;
(4)在滴入19.98mL碱溶液时,酸过量,过量的酸为0.1mol•L-1×2×10-5L,计算过量的c(H+),进而根据pH=-lgc(H+)计算溶液的pH.
(5)根据酸碱恰好反应只生成盐和水,根据盐溶液的酸碱性结合指示剂的变色范围确定.(1)滴定时,向酸溶液中滴加碱溶液时,盛装碱溶液所用的仪器为碱式滴定管;
故答案为:碱式滴定管;
(2)碱溶液存放在碱式滴定管中,而A、C是酸式滴定管,碱式滴定管操作为:用食指和中指紧压橡皮管中的玻璃球,使液体流下;
故选:B;
(3)当加入20.00mL碱溶液时生成盐和水,甲、乙、丙、丁中只有丙溶液呈碱性,说明为强碱弱酸盐,所以所选用的酸溶液pH最大的是丙;
故答案为:丙;
(4)在滴入19.98mL碱溶液时,酸过量,过量的酸为0.1mol•L-1×2×10-5L,过量的c(H+)=
0.1mol•L−1×2×10−5L
0.04L=5×10-5mol•L-1,pH=-lgc(H+)=5-lg5=4.3;
故答案为:4.3;
(5)甲滴定后溶液呈中性,应选择酸性或碱性变色范围的指示剂,如甲基橙或酚酞;丙滴定后溶液呈碱性,应选择碱性变色范围的指示剂,如酚酞;
故答案为:甲基橙或酚酞;酚酞.点评:
本题考点: 中和滴定.
考点点评: 本题主要考查酸碱中和滴定仪器的使用、盐类的水解、混合后溶液PH的计算以及指示剂的选择,题目难度不大,注意把握盐类的水解的运用.1年前查看全部
- (2014•湛江模拟)常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000m
 (2014•湛江模拟)常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
(2014•湛江模拟)常温下,用0.1000mol/L HCl溶液滴定20.00mL 0.1000mol/L NH3•H2O溶液,滴定曲线如图.下列说法正确的是( )
A.①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+)
B.②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+)
C.③溶液:c(OH-)>c(H+)
D.滴定过程中可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) hanxiaofei1年前1
hanxiaofei1年前1 -
 绝对之偶然 共回答了14个问题
绝对之偶然 共回答了14个问题 |采纳率71.4%解题思路:A、由图象可知,点①反应后溶质为NH4C1与NH3•H2O,二者物质的量之比为1:1,溶液pH>7,说明NH3•H2O电离程度大于NH4C1的水解程度,故c(NH4+)>c (C1-)>c(OH-)>c(H+);
B、由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),由图象可知②处pH=7,即c(H+)=c(OH-),故c(NH4+)=c(C1-)>c(OH-)=c(H+);
C、由图象可知,点③体积相同,则恰好完全反应生成NH4C1,利用盐的水解来分析溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-);
D、当NH3•H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3•H2O浓度远大于NH4C1浓度,可能出现c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+).A、在①处,反应后溶质为NH4C1与NH3•H2O,二者物质的量之比为1:1,溶液呈碱性,NH3•H2O电离程度大于NH4+的水解程度,则溶液中离子浓度大小关系为:c(NH4+)>c (C1-)>c(OH-)>c(H+),故A错误;
B、②点pH=7,则c(H+)=c(OH-),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),所以溶液中离子浓度关系为:c(NH4+)=c(C1-)>c(OH-)=c(H+),故B正确;
C、在③处氨水和HCl溶液体积相同,浓度又相等,则二者恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,溶液中离子浓度为:c(C1-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、当NH3•H2O物质的量较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3•H2O浓度远大于NH4C1浓度,则溶液中可能满足:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选BD.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了盐类的水解原理、酸碱混合后溶液离子浓度的大小比较,题目难度中等,注意掌握酸碱混合后溶液酸碱性的判断,能够利用电荷守恒、质子恒等、物料守恒等比较溶液中离子浓度大小关系.1年前查看全部
- 0.1000mol/lNaOH标准溶液滴定20.00ml,0.1000mol/l苯甲酸,计算中和至99%,100%,10
0.1000mol/lNaOH标准溶液滴定20.00ml,0.1000mol/l苯甲酸,计算中和至99%,100%,100.1%各点的PH值
 你见1年前1
你见1年前1 -
 东北响马 共回答了18个问题
东北响马 共回答了18个问题 |采纳率88.9%答 苯甲酸 pKa = 4.21 苯甲酸钠 Kb = 10^-9.7
【1】计算中和至99%的PH值,pH = 4.21+ 3 =7.21
【2】100%的PH值;,产物为0.05mol/L 苯甲酸钠:
H = 14.- POH = 14 - 0.5P(10^9.79x10^1.3) = 14 - 5.55 = 8.45
【3】100.1%的PH值 PH = 14-4.30 = 9.701年前查看全部
- 常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L
常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L HCl溶液和20.00mL 0.1000mol/L CH3COOH溶液,得到2条滴定曲线,如图所示:
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=______ mL;
(3)c(Na+)=c(CH3COO-)的点是______
(4)E点对应离子浓度由大到小的顺序为______.
(5)该温度下CH3COOH的电离常数为1 107−104 (列式代入数据计算)1 107−104
(6)当NaOH溶液滴定CH3COOH溶液过程中,NaOH溶液消耗了10.00mL时,则此时混合液中c(CH3COOH)______ c(CH3COO-) (“>”或“<”或“=”).
(7)t℃时,浓度均为0.0035mol/L的CH3COONa和NaOH的混合液pH=11,则溶液中c(H+)+c(CH3COO-)+2c(CH3COOH)=______(t℃时,Kw=4×10-14 mol2/L2) LoveSterCC1年前1
LoveSterCC1年前1 -
 nmfdai 共回答了16个问题
nmfdai 共回答了16个问题 |采纳率93.8%解题思路:(1)如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸溶液的初始pH确定盐酸滴定曲线;
(2)根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
(3)溶液中c(Na+)=c(CH3COO-),则该溶液中氢离子浓度等于氢氧根离子浓度,溶液呈中性;
(4)根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成盐,醋酸钠为强碱弱酸盐,其溶液呈碱性,再结合电荷守恒判断离子浓度;
(5)电离平衡常数只与温度有关,与溶液的浓度无关,根据Ka=
计算;C(H+).C(CH3COO−) C(CH3COOH)
(6)当滴加10mL NaOH溶液时,溶质为醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解;
(7)根据电荷守恒可知,[Na+]-[CH3COO-]=[OH-]-[H+],结合溶液中浓度均为0.0035mol/L的CH3COONa和NaOH进行解答;(1)如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,故答案为:图1; (2)滴定20.00mL 0.1000mol/L HCl溶液,NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱...
点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合时溶液定性判断及有关pH的简单计算,题目难度中等,注意掌握根据电荷守恒、物料守恒比较溶液中离子浓度定性关系的方法.注意过程的分析.1年前查看全部
- (2013•朝阳区一模)室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL
 (2013•朝阳区一模)室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定
(2013•朝阳区一模)室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定
曲线如图所示.下列说法正确的是( )
A.Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B.V(NaOH)=10.00 mL 时
>1c(CH3COO) c(CH3COOH)
C.pH=7时,两种酸所用NaOH溶液的体积相等
D.V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) 灵魂涂鸦1年前1
灵魂涂鸦1年前1 -
 wong198168 共回答了10个问题
wong198168 共回答了10个问题 |采纳率90%解题思路:A.根据盐酸和醋酸在滴定开始时的pH来判断;
B.醋酸电离大于醋酸根的水解程度;
C.醋酸钠水解呈碱性;
D.V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠.A.滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图Ⅱ,滴定醋酸的曲线是图Ⅰ,故A错误;
B.加入10ml氢氧化钠时,溶液中恰好为同浓度的醋酸和醋酸钠,醋酸电离大于醋酸根的水解程度,故
c(CH3COO)
c(CH3COOH)>1,故B正确;
C.醋酸钠水解呈碱性,氯化钠不水解,pH=7时,醋酸所用NaOH溶液的体积小,故C错误;
D.V(NaOH)=20.00 mL 时,二者反应生成氯化钠和醋酸钠,醋酸根发生水解,浓度小于氯离子,故D错误.
故选B.点评:
本题考点: 中和滴定.
考点点评: 本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用醋酸电离大于醋酸根的水解程度做题.1年前查看全部
- (2012•奉贤区一模)室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水
 (2012•奉贤区一模)室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
(2012•奉贤区一模)室温下,将1.000mol•L-1盐酸滴入20.00mL 1.000mol•L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.a、b之间可能出现:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
C.c点:c(Cl-)═c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 joycewuxiaofei1年前1
joycewuxiaofei1年前1 -
 jiajia2mingming 共回答了14个问题
jiajia2mingming 共回答了14个问题 |采纳率92.9%解题思路:A、氨水中的氢离子是水电离的,根据氨水中氢离子浓度大小进行判断;
B、当加入盐酸溶液体积很少时,则会出现c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+);
C、c点溶液的pH=7,为中性溶液,则c(H+)=c(OH-),根据电荷守恒进行判断;
D、d点盐酸与氨水的中和反应结束,导致温度不再升高.A、a点为氨水溶液,氨水中的氢离子为水电离的,由于a点溶液的pH<14,则溶液中氢离子浓度大于1.0×10-14mol•L-1,即:水电离出的c(H+)>1.0×10-14mol•L-1,故A错误;
B、当加入的盐酸体积较少时,消耗的一水合氨较少,则溶液中会出现离子浓度关系:c(NH3•H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故B正确;
C、c点pH=7,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Cl-)=c(NH4+),故C正确;
D、d点时盐酸和氨水恰好完全反应,放热最多,再加盐酸温度降低只能是加入盐酸的温度低于溶液温度,这才是温度下降的原因,故D错误;
故选BC.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查水溶液中的电离平衡以及酸碱中和滴定,题目难度中等,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒判断溶液中离子浓度大小.1年前查看全部
- (2011•淄博二模)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
(2011•淄博二模)(1)向20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,请回答相关问题:
①当加入10.00mL盐酸时,溶液中各种离子浓度之间的大小关系为(请在括号中填入离子符号):c(______)>c(______)>c(______)>c(______)
②当盐酸与氨水等物质的量反应时,溶液的pH______7(填“>”或“<”或“=”,下同)
③当溶液pH=7时,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3•H2O)______n(HCl),溶液中c(NH4+)______c(Cl-).
(2)已知某弱酸的酸式酸根离子HB-既能发生电离,又能发生水解,请通过实验确定HB-离子是电离程度大还是水解程度大?请简述实验过程和结论.____________. 水上汗颜1年前1
水上汗颜1年前1 -
 zhch2505 共回答了20个问题
zhch2505 共回答了20个问题 |采纳率85%解题思路:(1)①判断反应后,溶液中的溶质,再根据电离与盐类水解解答;
②盐酸与氨水恰好反应,为氯化铵溶液,利用盐类水解规律判断溶液酸碱性;
③利用电荷守恒判断出c(NH4+) 与c(Cl-)大小关系,再根据溶液中存在平衡 NH4++H2O⇌NH3•H2O判断;
(2)对于弱酸的酸式酸根离子,若电离程度大于水解程度,溶液呈酸性;若电离程度小于水解程度,则溶液呈碱性,若电离程度等于水解程度,溶液呈中性,据此解答.(1)①当加入10.00mL盐酸后,溶液为等物质的量浓度的氨水与氯化铵的混合液,氨水电离使呈碱性,氯化铵水解使溶液呈酸性,等物质的量浓度,电离程度大于水解程度,溶液呈碱性,即:c(OH-)>c(H+);
根据电荷守恒有:c(NH4+)+c(H+)=c(Cl-)+c(OH-),溶液呈碱性,所以,c(NH4+)>c(Cl-);
水解程度微弱,溶液中c(Cl-)远远大于c(OH-),
故溶液中各种离子浓度之间的大小关系为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
故答案为:NH4+;Cl-;OH-;H+
②盐酸与氨水恰好反应,为氯化铵溶液,氯化铵是强酸弱碱盐,故溶液呈酸性,即PH<7
故答案为:<
③根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于溶液pH=7,即c(OH-)=c(H+),所以c(NH4+)>c(Cl-),溶液中存在平衡 NH4++H2O⇌NH3•H2O,根据物料守恒有,反应所消耗的物质(包括还在溶液中存留的物质)之间的关系为:n(NH3•H2O)>n(HCl).
故答案为:>;=
(2)用pH试纸测NaHB溶液的pH值,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.
故答案为:用pH试纸测NaHB溶液的pH,若pH>7,说明HB-水解程度大于其电离程度;若pH=7,说明其水解程度等于其电离程度;如果pH<7,则说明其水解程度小于其电离程度.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;离子浓度大小的比较.
考点点评: 离子浓度大小比较的等式关系,主要根据“三大守恒”,即电荷守恒、物料守恒和质子守恒.1年前查看全部
- (2014•郑州一模)25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.100
 (2014•郑州一模)25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
(2014•郑州一模)25℃时,用浓度为0.1000mol•L-1的NaOH溶液分别滴定20.00mL浓度均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是( )
A.相同浓度时,三种酸的酸性强弱顺序是:HX>HY>HZ
B.根据滴定曲线,可得Ka(HX)=10-3mol•L-1
C.滴定HY,V(NaOH)=20mL时,c(Na+)=c(Y-)>c(OH-)=c(H+)
D.滴定HZ,V(NaOH)=10mL时,c(Z-)>c(H+)>c(Na+)>c(OH-) xingshiluo1年前1
xingshiluo1年前1 -
 fu米兰 共回答了13个问题
fu米兰 共回答了13个问题 |采纳率92.3%解题思路:A、根据图象分析,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1;
B、根据氢氧化钠滴到10mL时,c(HX)≈c(X-),Ka(HX)≈c(H+);
C、HY为弱电解质,V(NaOH)=20mL时,HY与氢氧化钠恰好完全反应生成NaY,Y-水解溶液显示碱性;
D、滴定HZ,V(NaOH)=10mL时,HZ为强电解质,HZ有一半参与反应,溶液中氢离子来自HY和水电离的两部分,所以c(H+)>c(Na+).A、氢氧化钠体积为0时,0.1000mol•L-1的三种酸HX、HY、HZ的pH分别为4、3、1,故酸性大小为HX<HY<HZ,故A错误;
B、当NaOH溶液滴到10mL时,溶液中c(HX)≈c(X-),即Ka(HX)≈c(H+)=10-pH,由于pH>4,则Ka(HX)<10-4,故B错误;
C、V(NaOH)=20mL时,HY与氢氧化钠恰好完全反应生成NaY,HY为弱电解质,Y-水解溶液显示碱性,c(OH-)>c(H+),故C错误;
D、V(NaOH)=10mL时,HZ有一半与氢氧化钠反应,且HZ为强电解质,溶液中氢离子浓度大于钠离子浓度,浓度关系为:c(Z-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合时的定性判断及有关pH的计算,题目难度中等,根据图象数据判断电解质强弱是解题关键,注意掌握根据溶液pH判断电解质强弱的方法.1年前查看全部
- (2014•海南)室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00mL 0.100mol•L
 (2014•海南)室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
(2014•海南)室温下,用0.100mol•L-1 NaOH溶液分别滴定20.00mL 0.100mol•L-1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-)
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) buick气1年前1
buick气1年前1 -
 槐谷听风 共回答了30个问题
槐谷听风 共回答了30个问题 |采纳率86.7%解题思路:A.醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸;
B.pH=7时,溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则醋酸的体积稍微大于NaOH;
C.V(NaOH)=20.00mL时,两种溶液中的溶质分别是醋酸钠和NaCl,醋酸根离子水解、氯离子不水解;
D.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,再结合电荷守恒判断.A.醋酸是弱电解质,HCl是强电解质,相同浓度的醋酸和HCl溶液,醋酸的pH>盐酸,所以I是滴定醋酸的曲线,故A错误;
B.pH=7时,溶液呈中性,醋酸钠溶液呈碱性,要使溶液呈中性,则醋酸的体积稍微大于NaOH,所以滴定醋酸消耗的V(NaOH)小于20mL,故B正确;
C.V(NaOH)=20.00mL时,两种溶液中的溶质分别是醋酸钠和NaCl,醋酸根离子水解、氯离子不水解,所以c(Cl-)>c(CH3COO-),故C错误;
D.V(NaOH)=10.00mL时,醋酸溶液中的溶质为等物质的量浓度的CH3COOH、CH3COONa,醋酸电离程度大于醋酸根离子水解程度,溶液呈酸性,则c(H+)>c(OH-),再结合电荷守恒得c(Na+)<c(CH3COO-),故D错误;
故选B.点评:
本题考点: 真题集萃;酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合溶液定性判断,涉及弱电解质的电离、盐类水解、酸碱中和反应等知识点,根据弱电解质的电离特点、溶液酸碱性及盐类水解等知识点来分析解答,题目难度不大.1年前查看全部
- 用0.2000mol/L的NaOH标准溶液滴定20.00mL某未知浓度的盐酸(指示剂为酚酞).两次滴定结果如下:
用0.2000mol/L的NaOH标准溶液滴定20.00mL某未知浓度的盐酸(指示剂为酚酞).两次滴定结果如下:
(1)根据以上数据计算盐酸的物质的量浓度为______mol/L.NaOH溶液起始读数 NaOH溶液终点读数 盐酸体积 第一次 0.10mL 18.60mL 20.00mL 第二次 0.40mL 19.00mL 20.00mL
(2)若0.2000mol/L的NaOH标准溶液由于露置空气变质,则测出的盐酸浓度(填“偏高”、“偏低”、“不受影响”)______.
(3)若有下列滴定操作,会导致测出的盐酸浓度偏低的是(填编号)______.
A.碱式滴定管用蒸馏水洗后,未用NaOH标准碱液润洗
B.滴定前碱式滴定管尖端有气泡,滴定后气泡消失
C.从滴定管读数时,滴定前仰视,滴定后俯视
D.待测液中指示剂酚酞(有机弱酸)加得太多. 丫头的命1年前1
丫头的命1年前1 -
 chengjingjing_26 共回答了24个问题
chengjingjing_26 共回答了24个问题 |采纳率87.5%解题思路:(1)先求出两组平均消耗V(NaOH),接着根据c(待测)=
来分析来计算;V(标准)×c(标准) V(待测)
(2)根据c(待测)=
来分析不当操作对V(标准)的影响,以此判断;V(标准)×c(标准) V(待测)
(3)根据c(待测)=
来分析不当操作对V(标准)的影响,以此判断.V(标准)×c(标准) V(待测) (1)两次滴定消耗的体积为:18.50mL,18.60mL,平均消耗V(NaOH)=18.55mL,c(待测)=
V(标准)×c(标准)
V(待测)=[0.2000mol/L×18.55mL/20.00mL]=0.1855mol/L,
故答案为:0.1855;
(2)NaOH标准溶液由于露置空气变质,变成碳酸钠,以酚酞为指示剂,碳酸钠与盐酸反应生成碳酸氢钠,所以若0.2000mol/L的NaOH标准溶液由于露置空气变质,则消耗的V(标准)偏高,根据c(待测)=
V(标准)×c(标准)
V(待测)来分析,可知测出的盐酸浓度偏高;
故答案为:偏高;
(3)A.碱式滴定管用蒸馏水洗后,未用NaOH标准碱液润洗,标准液被稀释,造成V(标准)偏大,根据c(待测)=
V(标准)×c(标准)
V(待测),可知c(待测)偏大,故A错误;
B.滴定前碱式滴定管尖端有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=
V(标准)×c(标准)
V(待测),可知c(待测)偏大,故B错误;
C.从滴定管读数时,滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=
V(标准)×c(标准)
V(待测),可知c(待测)偏小,故C正确;
D.待测液中指示剂酚酞(有机弱酸)加得太多,消耗的碱增多,造成V(标准)偏大,根据c(待测)=
V(标准)×c(标准)
V(待测),可知c(待测)偏大,故D错误;
故选C.点评:
本题考点: 中和滴定.
考点点评: 本题主要考查了中和滴定操作的计算、误差分析,根据c(待测)=V(标准)×c(标准)V(待测)来分析分析是解答的关键,题目难度不大.1年前查看全部
- 一道分析化学题1.0000mol/L的HAc溶液40.00ml与1.0000mol/L的NaOH溶液20.00ml混合,
一道分析化学题
1.0000mol/L的HAc溶液40.00ml与1.0000mol/L的NaOH溶液20.00ml混合,计算该混合溶液的PH(pKa=4.76) 紫焰麒麟1年前4
紫焰麒麟1年前4 -
 只想混混 共回答了16个问题
只想混混 共回答了16个问题 |采纳率100%我告诉你怎么做,你自己完成吧,醋酸根的浓度会求吧,用4.76除醋酸根的浓度就是氢离子的浓度,求对数就是PH值.
如果相好精确一些,可以设一下氢离子的浓度,根据pKa=4.76,算出酸根浓度,它等于总的醋酸根总浓度减去未电离的醋酸根浓度.做方程就行了.
教材上肯定有醋酸和醋酸钠混合溶液的pH值计算,这道题就是换了一下方式,其实是一个类型.1年前查看全部
- 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 H
 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 HClO溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 HClO溶液所得滴定曲线如图.下列说法正确的是( )
A.点①所示溶液中:c(ClO-)+c(OH-)=c(HClO)+c(H+)
B.点②所示溶液中:c(Na+)=c(HClO)+c(ClO-)
C.点③所示溶液中:c(Na+)>c(OH-)>c(ClO-)>c(H+)
D.滴定过程中可能出现:c(HClO)>c(ClO-)>c(H+)>c(Na+)>c(OH-) 种子289讨力1年前1
种子289讨力1年前1 -
 57161783 共回答了13个问题
57161783 共回答了13个问题 |采纳率100%解题思路:A.根据点①反应后溶液是NaClO与HClO物质的量之比为1:1的混合物,溶液呈酸性,说明HClO电离程度大于ClO-的水解程度,结合电荷守恒进行分析判断;
B.点②pH=7,即c(H+)=c(OH-),c(Na+)=c(ClO-);
C.点③体积相同,则恰好完全反应生成NaClO,利用盐的水解来分析溶液呈碱性,则c(Na+)>c(ClO-)>c(OH-)>c(H+);
D.在滴定中当加入碱比较少时,可能出现c(HClO)>c(ClO-)>c(H+)>c(Na+)>c(OH-)的情况.A.点①反应后溶液是NaClO与HClO物质的量之比为1:1的混合物,HClO电离程度大于ClO-的水解程度,故c(Na+)>c(HClO),由电荷守恒可知:c(ClO-)+c(OH-)=c(Na+)+c(H+),所以c(ClO-)+c(OH-)>c(HClO)+c(H+),故A错误;
B.点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(ClO-)+c(OH-)=c(Na+)+c(H+),故c(Na+)=c(ClO-),故B错误;
C.点③说明两溶液恰好完全反应生成NaClO,因ClO-水解,且程度较小,c(Na+)>c(ClO-)>c(OH-)>c(H+),故C错误;
D.当HClO较多,滴入的碱较少时,则生成NaClO少量,可能出现c(HClO)>c(ClO-)>c(H+)>c(Na+),只要加碱,就会存在c(Na+)>c(OH-),所以可能出现:c(HClO)>c(ClO-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查较酸碱混合的定性判断和计算、离子浓度大小比较,综合考查学生的分析能力和化学基本理论的运用能力,为高考常见题型,难度中等,注意电荷守恒的运用.1年前查看全部
- 用0.1000mol/lHCl滴定20.00ml0.1000mol/l NH3溶液时,计算(1)等量点,(2)等量点前后
用0.1000mol/lHCl滴定20.00ml0.1000mol/l NH3溶液时,计算(1)等量点,(2)等量点前后±0.1%相对误差范围内溶液的PH值.选用何种指示剂?
 品牌专卖1年前2
品牌专卖1年前2 -
 孤单的夜灯 共回答了21个问题
孤单的夜灯 共回答了21个问题 |采纳率95.2%一、化学计量点:
此时NH3全部被中和,生成的氨根发生水解,电离出部分氢离子,此时的CNH4+=00.05mol/l
故根据Kb=1.8*10^-5,有Ka=Kw/Ka=1*10^-9.26,可求得H+=√CKa=5.3*10^-5
所以,PH=5.28
化学计量点是PH为5.28
二、化学计量点前
此时形成的氯化铵和剩余的氨水,溶液显碱性,当滴入19.98ml(-0.1%)HCl时,溶液的[OH-]=Kb*CNH3/CNH4+=1.8*10^-8mol/l
所以PH=14-lg[OH-]=14-7.75=6.25
即化学计量点前PH为6.25
三、化学计量点后,
此阶段盐酸过量,溶液显酸性,当加入20.02ml(+0.1%)HCl时,
此时的[H+]=0.02*0.1/40.02=5*10^-5,
所以,PH=4.30
故化学突跃点从PH6.25到4.30,
可选择甲基红和溴甲酚绿做指示剂
溴甲酚绿指示剂,但pH=3.8时呈黄色,pH=5.4时呈蓝绿色,pH=4.5时开始有颜色的明显变化.
甲基红指示剂:pH变色范围4.4(红)~6.2(黄).1年前查看全部
- 常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L
常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示下列说法不正确的是( ) A.a=20.00 B.滴定过程中,可能存在:c(Cl - )>c(H + )>c(Na + )>c(OH - ) C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定 D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20.00 
 101710171年前1
101710171年前1 -
 花花X2 共回答了22个问题
花花X2 共回答了22个问题 |采纳率95.5%A、NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,故A正确;
B、滴定过程酸过量时,c(Cl - )>c(H + )>c(Na + )>c(OH - ),故B正确;
C、用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时,且30秒内不褪色,停止滴定,故C错误;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,所以滴定到pH=7时,a<20.00,故D错误;
故选CD.1年前查看全部
- 下列选项操作错误或不能达到实验目的的是 A.可用25ml酸式滴定管量取20.00ml KMnO 4 溶液 B.从碘水中提
下列选项操作错误或不能达到实验目的的是
A.可用25ml酸式滴定管量取20.00ml KMnO 4 溶液 B.从碘水中提取单质碘,不能用无水乙醇代替CCl 4 C.石蕊试纸和PH试纸使用前用蒸馏水润湿 D.CO 2 中混有少量SO 2 ,除杂试剂和方法为:KMnO 4 (H + )、浓硫酸,洗气  ACGOAL1年前1
ACGOAL1年前1 -
 greenapplegirl 共回答了21个问题
greenapplegirl 共回答了21个问题 |采纳率85.7%C
1年前查看全部
- (2012•天津模拟)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.10
 (2012•天津模拟)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
(2012•天津模拟)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 0.1000mol/L 盐酸和20.00mL 0.1000mol/L 醋酸溶液,得到2条滴定曲线,如图所示.若以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为 c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A-)>c(Na+)>c(H+)>c(OH-) 清仪欣1年前1
清仪欣1年前1 -
 321054 共回答了23个问题
321054 共回答了23个问题 |采纳率91.3%解题思路:A、根据盐酸和醋酸在滴定开始时的pH来判断;
B、根据溶液中的电荷守恒来判断;
C、根据酸和碱反应的化学方程式来计算回答;
D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答.A、滴定开始时0.1000mol/L盐酸pH=1,0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A错误;
B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒,则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的
n(CH3COOH)=n(HCl),故C错误;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误.
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;弱电解质在水溶液中的电离平衡;离子浓度大小的比较.
考点点评: 本题考查NaOH与CH3COOH、盐酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度做题.1年前查看全部
- 用0.1000mol.L-NaOH溶液滴定20.00ml0.1000mol/L HCOOH溶液,计算化学计量点时pH和p
用0.1000mol.L-NaOH溶液滴定20.00ml0.1000mol/L HCOOH溶液,计算化学计量点时pH和pH突跃范围(已知甲酸Ka=1.8×10-4)
 ljy513201年前1
ljy513201年前1 -
 烂番茄19个 共回答了12个问题
烂番茄19个 共回答了12个问题 |采纳率91.7%答:
【1】突越范围 pH = 6.74 - 9.7 的计算:
1、计量点前(19,98 ml):pH = pKa + lg[(19.98/0.02)] = 3.74+3 = 6.74
2、计量点前(20,02 ml):pH = 14 - pOH = 14- (20.02-20.00/40.02)
=14 - 4.3 = 9.70
【2】化学计量点时pH = 8.22的计算:
pH =14 -pOH = 14 - p(CKa)^0.5p = 14 - p[(0.05x5.6x10^-11)^0.5] = 14 - 5.78 = 8.221年前查看全部
- 用0.10mol/LNaOH标准溶液分别滴定20.00ml的H2SO4和HCOOH溶液,消耗等量的NaOH,则这两种酸的
用0.10mol/LNaOH标准溶液分别滴定20.00ml的H2SO4和HCOOH溶液,消耗等量的NaOH,则这两种酸的浓度关系是什么?
 拿手机砸核桃1年前1
拿手机砸核桃1年前1 -
 雁过惊秋 共回答了13个问题
雁过惊秋 共回答了13个问题 |采纳率100%HCOOH是弱电解质,H2SO4是强电解质,相同浓度的NAOH和其他两种溶液反应消耗更多的HCOOH,所以HCOOH浓度大于硫酸1年前查看全部
- 常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL
常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1CH3COOH溶液
常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
 iii112221年前1
iii112221年前1 -
 火娘鸟 共回答了17个问题
火娘鸟 共回答了17个问题 |采纳率94.1%A、如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,故A错误;
B、根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入的氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00ml,a>b,故B错误;
C、E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度为(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、氢氧化钠和盐酸反应恰好呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D错误;
故选C.1年前查看全部
- (2012•河西区一模)室温下,将1.00mol•Lˉ1盐酸滴入20.00mL 1.00mol•Lˉ1氨水中,
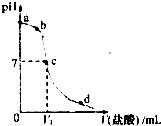 (2012•河西区一模)室温下,将1.00mol•Lˉ1盐酸滴入20.00mL 1.00mol•Lˉ1氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示.下列说法正确的是( )
(2012•河西区一模)室温下,将1.00mol•Lˉ1盐酸滴入20.00mL 1.00mol•Lˉ1氨水中,溶液pH随加入盐酸体积变化的曲线如右图所示.下列说法正确的是( )
A.a点pH=14
B.b点溶液中离子浓度大小等量关系可能为c(NH4+)+c(NH3•H2O)=c(Cl-)
C.c点,消耗盐酸的体积V1<20 mL
D.d点溶液中离子浓度大小关系可能为c(H+)>c(Cl-)>c(OH-)>c (NH4+) 你见过彩虹吗1年前1
你见过彩虹吗1年前1 -
 我大声的哭 共回答了14个问题
我大声的哭 共回答了14个问题 |采纳率85.7%解题思路:根据酸碱滴定过程的图中a、b、c、d点的pH值来分析溶液中离子的浓度或溶液中的溶质,并利用原子守恒、物料守恒和电荷守恒来分析解答.A.一水合氨是弱电解质,在水溶液里存在电离平衡,所以溶液中c(OH-)<c(NH3.H2O),则溶液的pH小于14,故A错误;
B.b点溶液呈碱性,溶质为氯化铵和一水合氨,根据物料守恒知,c(NH4+)+c(NH3•H2O)>c(Cl-),故B错误;
C.C点溶液呈中性,则c(H+)=c(OH-),氯化铵是强酸弱碱盐,其水溶液呈酸性,要使其水溶液呈中性,则氨水应该稍微过量,所以消耗盐酸的体积V1<20 mL,故C正确;
D.d点溶液中溶质为盐酸和氯化铵,根据物料守恒知,c(Cl-)>c(H+),故D错误;
故选C.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查水溶液中的电离平衡以及酸碱中和滴定,明确滴定曲线中各点的pH是解答的关键,并学会利用物料守恒、电荷守恒来解答此类习题.1年前查看全部
- (2011•西安模拟)25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得
(2011•西安模拟)25℃时,20.00mL硫酸和硝酸的混合溶液,加入足量氯化钡溶液,充分反应后过滤、洗涤、烘干,可得0.466g沉淀.滤液跟2mol/l NaOH溶液反应,共用去10.00ml碱液时恰好中和.下列说法中正确的是( )
A. 原混合液中c(SO42-)=0.2mol/L
B. 原混合液中c(NO3-)=0.9mol/L
C. 原混合液中pH=0
D. 原混合液中由水电离出的c(H+)=0.1mol/L 紫叠1年前1
紫叠1年前1 -
 绵阳剑客 共回答了14个问题
绵阳剑客 共回答了14个问题 |采纳率92.9%解题思路:根据反应SO42-+Ba2+=BaSO4↓可计算H2SO4的物质的量,根据反应H++OH-=H2O可计算HNO3的物质的量,进而计算物质的量浓度和溶液的pH.由题意可知0.466g沉淀为BaSO4,n(BaSO4)=[0.466g/233g/mol]=0.002mol,n(H2SO4)=0.002mol,
滤液跟2mol/lNaOH溶液反应,共用去10.00ml碱液时恰好中和,
则由反应H++OH-=H2O可知,n(H+)=n(NaOH)=0.01L×2mol/L=0.02mol,
则n(HNO3)=0.02mol-2×0.002mol=0.016mol,
则c(SO42-)=[0.002mol/0.02L]=0.1mol/L,
c(NO3-)=[0.016mol/0.02L]=0.8mol/L,
c(H+)=[0.02mol/0.02L]=1mol/L,
pH=0,
原混合液中由水电离出的c(H+)=
1×10−14
1mol/L=1×10-14mol/L,
故选C.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查混合物的计算,题目难度不大,注意根据有关反应的方程式,计算时注意从守恒的角度思考.1年前查看全部
- 如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( ) A
如图是向20.00mL盐酸中逐渐滴入NaOH溶液时,溶液pH值变化的图象,根据图象分析,下列结论中不正确的是( ) A.盐酸起始浓度为0.1mol•L-1 B.NaOH溶液浓度为0.08mol•L-1 C.滴入碱量为20mL时,向混合溶液中滴入2滴甲基橙试液,溶液显橙色 D.滴到中和点时,耗NaOH物质的量为0.002mol 
 liuxianhong20011年前1
liuxianhong20011年前1 -
 sam588 共回答了8个问题
sam588 共回答了8个问题 |采纳率100%A.当V(NaOH)=0时,pH=1,则盐酸起始浓度为0.1mol•L -1 ,故A正确;
B.当加入NaOH25mL时,二者恰好完全反应,则有20×10 -3 L×0.1mol•L -1 =25×10 -3 L×c(NaOH),c(NaOH)=0.081mol•L -1 ,故B正确;
C.滴入碱量为20mL时,酸过量,反应后c(H + )=
0.02L×0.1mol/L-0.02L×0.08mol/L
0.04L =0.01mol/L,pH=2,向混合溶液中滴入2滴甲基橙试液,溶液显红色,故C错误;
D.n(HCl)=20×10 -3 L×0.1mol•L -1 =0.002mol,则滴到中和点时,耗NaOH物质的量为0.002mol,故D正确.
故选C.1年前查看全部
- 某弱酸的pKa=9.21,现有其共轭碱NaA溶液20.00ml浓度为0.1000mol/l,当用0.1000mol/l的
某弱酸的pKa=9.21,现有其共轭碱NaA溶液20.00ml浓度为0.1000mol/l,当用0.1000mol/l的HCL去滴定,求滴定突越范围
 habo1101年前1
habo1101年前1 -
 78105 共回答了19个问题
78105 共回答了19个问题 |采纳率89.5%当滴入量在化学计量点前的0.1%时,体系是HA和A-形成的缓冲溶液,此时HA浓度=5×10的-2次方mol/L,A-浓度=5×10的-5次方mol/L,pH=pKa+lg(A-浓度/HA浓度)=6.21,当滴入量在化学计量点后的0.1%时,体系是HCl和HA的混合溶液,pH主要由盐酸决定,此时氢离子浓度=5×10的-5次方mol/L,pH=4.3,所以突跃范围为4.3--6.2.1年前查看全部
- 实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL至于锥形瓶中,用0.10m
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL至于锥形瓶中,用0.10mol/L的HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
A.NaHCO3 B.Na2CO3 C.Ca(OH)2 D.NaCl
老师说用极值法,可是我还是没听懂.到底怎么判断? foxhdl1年前1
foxhdl1年前1 -
 yunshan2 共回答了19个问题
yunshan2 共回答了19个问题 |采纳率100%假如样品是纯的氢氧化钠,则应消耗盐酸20毫升.而目前消耗的只有19ml,那么,杂质提供的氢氧根浓度肯定小于0.1mol/l,从以上杂质看,A.B.D都符合条件,只有C不符合(氢氧化钙相对分子质量为74,提供2个氢氧根),所以答案是c.
你们老师所谓的极值法,估计就是以纯的烧碱、或纯的以下4种物质做比较.1年前查看全部
- 0.1000mol/,NaOH溶液滴定20.00ml 0.1mol/L HCl溶液
 _逍遥1年前2
_逍遥1年前2 -
 空气里的小鱼 共回答了21个问题
空气里的小鱼 共回答了21个问题 |采纳率85.7%答:
【1】 化学计量点时,滴定的体积是20.00 ml
【2】化学计量点时,溶液的PH值是7.00
【3】滴定的 突跃范围 PH 4.30 - 9.70
【4】可以采用甲基橙、酚酞为指示剂1年前查看全部
- 下列有关实验操作的说法正确的是( ) A.可用25ml碱式滴定管量取20.00mlKMnO 4 溶液 B.用pH试纸测
下列有关实验操作的说法正确的是( ) A.可用25ml碱式滴定管量取20.00mlKMnO 4 溶液 B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的
,液体也不能蒸干2 3 D.将金属钠在研体中研成粉末,使钠与水反应的实验更安全  dancewater001年前1
dancewater001年前1 -
 我用一生与你相伴 共回答了20个问题
我用一生与你相伴 共回答了20个问题 |采纳率95%A、KMnO 4 溶液有很强的氧化性,会腐蚀橡皮管,故不能用碱式滴定管来装,应该用酸式滴定管来量取,故A错误;B、若先用蒸馏水润湿会造成溶液浓度的降低,测出值不一定准确,故B错误;C、蒸馏时防止暴沸和意外事故...1年前查看全部
- (2012•闸北区二模)常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.10
(2012•闸北区二模)常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.100mol/L醋酸溶液,得到如图2条滴定曲线,以HA表示酸,下列说法正确的是( )

A.滴定盐酸的曲线是图1
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-) 刘文志1年前1
刘文志1年前1 -
 kittycheng111 共回答了12个问题
kittycheng111 共回答了12个问题 |采纳率100%解题思路:A、根据盐酸和醋酸在滴定开始时的pH来判断;
B、根据溶液中的电荷守恒以及c(H+)=c(OH-)来判断;
C、根据酸和碱反应的化学方程式来计算回答;
D、根据氢氧化钠和醋酸以及盐酸反应的原理来回答.A、滴定开始时0.1000mol/L盐酸pH=1,而0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A正确;
B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故C错误;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误;
故选AB.点评:
本题考点: 中和滴定.
考点点评: 本题主要考查NaOH与强酸、弱酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识,注意利用电荷守恒的角度来解题.1年前查看全部
- (2011•佛山二模)20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是( )
(2011•佛山二模)20.00mL稀氨水中逐滴加入等物质的量浓度的盐酸,下列示意图变化趋势正确的是( )
A.
B.
C.
D.
 Sakura_CN1年前1
Sakura_CN1年前1 -
 linan2 共回答了23个问题
linan2 共回答了23个问题 |采纳率91.3%解题思路:氨水呈碱性,盐酸呈酸性,向氨水中加入盐酸,发生酸碱中和反应导致溶液的PH值降低,当盐酸和氨水的物质的量相等时,恰好生成氯化铵;当继续加盐酸时,盐酸过量,溶液呈酸性.稀氨水中,氨水电离生成铵根离子和氢氧根离子导致溶液中氢氧根离子浓度大于氢离子,所以氨水溶液呈碱性;
盐酸溶液呈酸性,当向氨水溶液中加入盐酸时,盐酸和氨水发生酸碱中和反应导致溶液的PH值降低;
当加入20mL盐酸时,盐酸和氨水的物质的量相等,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性;
继续向溶液中加盐酸,盐酸过量,当盐酸的量远远大于氨水的物质的量时,溶液以盐酸为主,导致溶液的pH值近似于盐酸的pH值,
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱中和反应中pH值的变化图象,难度不大,注意分析特殊点,1是未加盐酸前的pH值,2是酸碱恰好反应时溶液的pH值,3是酸过量时溶液的pH值.1年前查看全部
- 常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.10
常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.100mol/L醋酸溶液,得到如图2
常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.100mol/L醋酸溶液,得到如图2条滴定曲线,以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图1
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
 话是不可以乱说的1年前1
话是不可以乱说的1年前1 -
 行走在xx 共回答了10个问题
行走在xx 共回答了10个问题 |采纳率90%A、滴定开始时0.1000mol/L盐酸pH=1,而0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A正确;
B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故C错误;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误;
故选AB.1年前查看全部
- 20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系
20.00mL一定物质的量浓度的盐酸X,用一定浓度的NaOH溶液Y滴定,滴定过程中溶液pH和所加NaOH溶液的体积的关系如图所示.(体积变化忽略不计)

(1)X、Y的物质的量浓度之比为______.
(2)盐酸的物质的量浓度为______. huxh_0081年前1
huxh_0081年前1 -
 游友天下至尊小白 共回答了27个问题
游友天下至尊小白 共回答了27个问题 |采纳率96.3%解题思路:(1)氢氧化钠与氯化氢都是强电解质,当加入60mL氢氧化钠溶液时溶液的pH=7,说明恰好与20mL的盐酸反应,据此可以计算出盐酸与氢氧化钠溶液的浓度之比;
(2)根据图象可知,加入20mL氢氧化钠溶液时,溶液的pH=2,结合盐酸与氢氧化钠溶液的浓度之比列式计算出二者的浓度即可.(1)根据图象可知,当NaOH溶液体积为60mL时,两溶液恰好反应,设盐酸的体积为x,氢氧化钠溶液的体积为y,则一定满足:0.02L×x=0.06×y,则X、Y的物质的量浓度之比为:x:y=0.06:0.03=3:1,
故答案为:3:1;
(2)设氢氧化钠溶液的浓度为c,则盐酸的浓度为3c,
根据图象可知,加入20mL氢氧化钠溶液时,混合液的pH=2,溶液中氢离子浓度为0.01mol/L,
则:[0.02L×3c−0.02Lc/0.02L+0.02L]=0.01mol/L,
解得:c=0.01mol/L,
即:氢氧化钠溶液的浓度为0.01mol/L,盐酸的浓度为0.03mol/L,
故答案为:0.03mol/L.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,注意掌握溶液酸碱混合的定性判断方法,明确溶液的酸碱性与溶液pH的关系,正确分析滴定曲线为解答本题的关键,试题培养了学生的分析、理解能力及化学计算能力.1年前查看全部
- 取混有NaCl的Na2CO3固体20.0g溶于水配成100mL溶液,取出20.00mL于锥形瓶中,向锥形瓶中逐滴滴入某浓
取混有NaCl的Na2CO3固体20.0g溶于水配成100mL溶液,取出20.00mL于锥形瓶中,向锥形瓶中逐滴滴入某浓度的盐酸直至没有气体放出为止,用去盐酸15.00mL,并收集到672mL CO2(标准状况).试计算:
(1)所用盐酸的物质的量浓度
(2)Na2CO3的质量分数. zyshw19981年前1
zyshw19981年前1 -
 uyghdpbj0728 共回答了21个问题
uyghdpbj0728 共回答了21个问题 |采纳率95.2%解题思路:混合物与盐酸发生反应:Na2CO3+2HCl═2NaCl+CO2↑+H2O,根据n=[V/Vm]计算反应生成的二氧化碳的物质的量,根据二氧化碳的物质的量反应的化学方程式计算相关物理量.n(CO2)=VVm=0.672L22.4mol/L=0.03mol Na2CO3 +2HCl═2NaCl+CO2↑+H2O 106g2mol ...
点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物的有关计算,清楚发生的反应时解题关键,题目难度中等,注意根据方程式进行解答.1年前查看全部
- 2准确移取氯化钠溶液20.00ml,加入铬酸钾指示剂,用0.1000mol/L的硝酸银标准溶液滴定,终点时消耗硝酸银溶液
2准确移取氯化钠溶液20.00ml,加入铬酸钾指示剂,用0.1000mol/L的硝酸银标准溶液滴定,终点时消耗硝酸银溶液25.00ml,计算氯化钠的物质的量浓度及其量浓度.
 语美人1年前1
语美人1年前1 -
 葵葵巫 共回答了20个问题
葵葵巫 共回答了20个问题 |采纳率90%根据反应方程式:
NaCl+AgNO3=AgCl(沉淀)+NaNO3
反应的NaCl和AgNO3的物质的量相等,因此:
氯化钠的物质的量浓度=0.1000*25.00/20.00=0.1250mol/L1年前查看全部
- 实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.10
实验室为标定一种烧碱样品的物质的量浓度,称取该烧碱样品4.0g配成1L溶液,取出20.00mL置于锥形瓶中,用0.10 mol·L -1 HCl标准溶液滴定,恰好完全中和时消耗标准盐酸19.00mL,若烧碱中只含有一种杂质,则不可能是( )
A.NaCl B.Ca(OH) 2 C.Na 2 CO 3 D.NaHCO 3  君子重然诺1年前1
君子重然诺1年前1 -
 thatcafe 共回答了17个问题
thatcafe 共回答了17个问题 |采纳率88.2%B
此题考的是滴定中的计算问题,属于中等难度题型。
若没有杂质则n(样品)=2﹡10 -3 mol。 n(HCl)="C(HCl)*V(HCl)=0.10" mol·L -1 *0.019L=1.9﹡10 -3 mol>2﹡10 -3 mol,如果杂质不与盐酸反应则A正确,如果杂质能与盐酸反应,可用极值法计算,设样品全都是杂质计算求出1L溶液中杂质的质量。0.019mol盐酸中和Ca(OH) 2 的质量为0.7g ,则1L溶液含Ca(OH) 2 3.5g。同理可求得Na 2 CO 3 为5.035g,NaHCO 3 为7.98g。只有当杂质的质量小于4.0g时才符合题意,因此不可能是B选项。1年前查看全部
- 用回流法测定某废水中的 COD.取水样 20.00mL(同时取无有机物蒸馏水 20.00mL 作
用回流法测定某废水中的 COD.取水样 20.00mL(同时取无有机物蒸馏水 20.00mL 作
用回流法测定某废水中的 COD.取水样 20.00mL(同时取无有机物蒸馏水 20.00mL 作 空白试验)放入回流锥形瓶中,加入 10.00mL 0.2500moL / L 重铬酸甲溶液(1/6 K2Cr2O7 = 0.2500mol / L)和 30mL 硫酸 – 硫酸银溶液,加热回流 2h;冷却后加蒸馏水稀释至 140mL,加试亚铁灵指示剂,0.1000mol / L 硫酸亚铁铵溶液[(NH4)2Fe(SO4)2·6H2O = 0.1000mol / L ] 用 回滴至红褐色,水样和空白分别消耗 11.20mL 和 21.20mL.求该水样中的 COD 是多少(mg O2 / L)? whose7号1年前0
whose7号1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 将含有杂质的4.0g 氢氧化钠固体配成1000mL 溶液取20.00mL 装入锥形瓶中用0.1000mol/L 盐酸滴定
将含有杂质的4.0g 氢氧化钠固体配成1000mL 溶液取20.00mL 装入锥形瓶中用0.1000mol/L 盐酸滴定甲基橙作指示剂 消耗盐酸19.00mL则该氢氧化钠中含的杂质可能是
A.Na2O B.Na2CO3 C.NaHCO3 D.Ca(OH)2
可能和不可能都要 泪眼看穿1年前1
泪眼看穿1年前1 -
 mmnn 共回答了25个问题
mmnn 共回答了25个问题 |采纳率96%本题选BC
【解析】
如果是4g不含杂质的NaOH配置成1000ml溶液,则,其浓度为4÷40÷1=0.1mol/L
NaOH + HCl~
1 1
0.1×0.02 a
那么a=0.02=20ml ,既如果是纯净的NaOH配成的溶液,其消耗盐酸的体积应为20ml
也就是说,每 4g消耗3.65gHCl
现在,因为NaOH含有杂质,所以消耗体积为19ml
说明,每4g杂质消耗的HCl质量小于3.65g
所以,消耗HCl的体积才会比纯NaOH溶液消耗的体积小.
所以,只要计算出消耗HCl更少的物质,既是可能存在的杂质.
Na2O 2HCl
62 73
4 b ===> b=4.7 既每4g Na2O消耗HCl 4.7g
Na2CO3 2HCl
106 73
4 c ===> c=2.75 既每4g Na2CO3消耗HCl 2.75g
NaHCO3 HCl
84 36.5
4 d ====> d=1.74 既每4g NaHCO3消耗HCl 1.74g
Ca(OH)2 2HCl
74 73
4 e ====>e=3.95 既每4g NCa(OH)2消耗HCl 3.95g
从计算结果来看,如果杂质是Na2O或Ca(OH)2,则消耗的HCl更多,最终滴定的结果应大于20ml
也就是说,杂质可能是 Na2CO3和NaHCO3~1年前查看全部
- 向20.00mL 0.1mol/L的
向20.00mL 0.1mol/L的
向20.00mL 0.1mol/L的NaOH溶液中逐滴加入0.100mol/LCH 3 COOH溶液,滴定曲线如图下列有关叙述正确的是 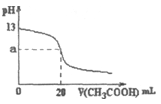
[ ] A.0.100mol/L的CH 3 COOH溶液的pH=1
B.上图a=7
C.当V<20.00mL时,溶液中离子浓度的大小关系可能为: c(CH 3 COO - )>c(Na + )>(OH - )>c(H + )
D.当V=20.00mL时.有c(CH 3 COO - )+c(CH 3 COOH)=c(Na + ) honjin1331年前1
honjin1331年前1 -
 ii老师 共回答了26个问题
ii老师 共回答了26个问题 |采纳率84.6%D1年前查看全部
- 常温下,用0.1000mol·L -1 NaOH溶液滴定20.00mL 0.1000mol·L -1 CH 3 COOH
常温下,用0.1000mol·L -1 NaOH溶液滴定20.00mL 0.1000mol·L -1 CH 3 COOH溶液,滴定曲线如右图。下列说法正确的是

[H + ]>[Na + 」>[OH - ]A.点①所示溶液中:[CH 3 COO - ]+[OH - ]=[CH 3 COOH] +[H + ] B.点②所示溶液中:[Na + ]=[CH 3 COOH]+[CH 3 COO - ] C.点③所示溶液中:[Na + ]>[OH - ]>[CH 3 COO - ]>[H + ] D.滴定过程中可能出现:[CH 3 COOH]>[CH 3 COO - ]>  ainia30001年前1
ainia30001年前1 -
 天之痕31 共回答了19个问题
天之痕31 共回答了19个问题 |采纳率89.5%D
A 错误,应遵循电荷守恒,[CH 3 COO - ]+[OH - ]=[Na + ]+[H + ]
B 错误,点②所示溶液PH=7,显中性,[Na + ]=[CH 3 COO - ]
C 错误,点③所示溶液中:[Na + ]>[CH 3 COO - ]>[OH - ]>[H + ]
D 正确。在CH 3 COOH溶液中开始滴入很少量的NaOH溶液时出现此种情况。1年前查看全部
- 在20.00ml的HCL溶液(0.1000mol/L)中,加入19.50mlNaOH(0.1500mol/L),计算溶液
在20.00ml的HCL溶液(0.1000mol/L)中,加入19.50mlNaOH(0.1500mol/L),计算溶液的PH为多少?
2.为标定HCL滴定液的浓度,称取基准物质Na2CO30.1520g,用去HCL溶液25.20ml,求HCL溶液的浓度. sherwin_zx1年前1
sherwin_zx1年前1 -
 276863040 共回答了22个问题
276863040 共回答了22个问题 |采纳率90.9%1)[OH-]=(0.1500*19.50-0.1000*20.00)/[(20.00+19.50)/1000]=2.34*10^-5mol/L
POH=-log(2.34*10^-5)=4.63
PH=9.37
2)Na2CO3 + 2HCI ——2NaCI + CO2 + H2O
比例:1 2
0.1520/105.99 C*25.20/1000
计算得C=0.1138mol/L
105.99是Na2CO3的摩尔质量1年前查看全部
- 用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如下图.其中①点所示溶液中c(C
用0.1000mol·L-1NaOH溶液滴定20.00mL某未知浓度的醋酸溶液,滴定曲线如下图.其中①点所示溶液中c(CH3COO-)=2c(CH3COOH),③点所示溶液中存在:c(CH3COO-)+c(CH3COOH)=c(Na+).则CH3COOH的电离平衡常数Ka= ,醋酸的实际浓度为(保留四位有效数字).
答案:2×10 -5 mol·L -1;0.1006 mol ·L -1
求详细解答过程.

 a9db1年前2
a9db1年前2 -
 exiaoran 共回答了20个问题
exiaoran 共回答了20个问题 |采纳率90%分析化学的解题思路:
第一题,首先看到1点,确定在1点时候,溶液为缓冲溶液,那么根据定义式
pka=pH+lg(c碱/c酸),题中c(CH3COO-)=2c(CH3COOH),从而得到答案,
第二题,在3点时达到滴定计量点,此时计算浓度为0.1006mol/L
2点什么都不是,滴定恰好完全反应时,醋酸钠是呈碱性的,所以3点才是化学计量点1年前查看全部
- 常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L
 常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示下列说法不正确的是( )
常温下,用0.1000mol/L NaOH溶液滴定20.00mL 0.1000mol/L HCl溶液,滴定曲线如图所示下列说法不正确的是( )
A.a=20.00
B.滴定过程中,可能存在:c(Cl-)>c(H+)>c(Na+)>c(OH-)
C.若用酚酞作指示剂,当滴定到溶液明显由无色变为红色时停止滴定
D.若将盐酸换成同浓度的醋酸,则滴定到pH=7时,a>20.00 萍水相逢莉1年前1
萍水相逢莉1年前1 -
 tt1878 共回答了20个问题
tt1878 共回答了20个问题 |采纳率100%解题思路:A、根据NaOH和HCl恰好反应时生成强酸强碱盐,溶液呈中性;
B、根据滴定过程酸过量来分析;
C、根据滴定终点的判断方法;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,若要呈中性,则醋酸过量.A、NaOH和HCl恰好反应时,消耗20mlNaOH溶液,生成强酸强碱盐,溶液呈中性,故A正确;
B、滴定过程酸过量时,c(Cl-)>c(H+)>c(Na+)>c(OH-),故B正确;
C、用酚酞作指示剂进行中和滴定时,当溶液由无色变为红色时,且30秒内不褪色,停止滴定,故C错误;
D、NaOH和醋酸恰好反应时生成强碱弱酸盐,溶液呈碱性,所以滴定到pH=7时,a<20.00,故D错误;
故选CD.点评:
本题考点: 中和滴定.
考点点评: 本题考查了常见的实验操作,注意过程的分析,难度不大,应注意相关知识的积累.1年前查看全部
- 关于电解质溶液的三大守恒问题 常温下,用0.1000mol/LNaOH溶液滴定20.00ml0.1000mol/LCH3
关于电解质溶液的三大守恒问题
常温下,用0.1000mol/LNaOH溶液滴定20.00ml0.1000mol/LCH3COOH溶液所得滴定曲线
所加NaOH溶液10ml,此时4 快乐傻宝贝1年前1
快乐傻宝贝1年前1 -
 疾风888 共回答了20个问题
疾风888 共回答了20个问题 |采纳率90%溶液中含有的溶质____CH3COOH CH3COONa____
电荷守恒:_c(H+) +c(Na+)=c(OH-)+c(CH3COO-)
物料守恒 c(CH3COOH)+c(CH3COO-)=0.1000mol/L
质子守恒:无
所加NaOH溶液20ml,此时PH>7
溶液中含有的溶质____CH3COONa______________
电荷守恒:c(H+) +c(Na+)=c(OH-)+c(CH3COO-)
物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO-)
质子守恒:c(H+)+C(CH3COOH)=C(OH-)1年前查看全部
- 室温下用0.10mol/L的盐酸滴定20.00ml 0.10mol/L的某碱BOH溶液
室温下用0.10mol/L的盐酸滴定20.00ml 0.10mol/L的某碱BOH溶液

请问B选项 原因是生成强酸弱碱盐 但是本题中BOH指的是未知的碱吧 为什么一定是弱碱 如果是强碱 那么不应该选择B吗 谢谢!
 花飞絮1年前2
花飞絮1年前2 -
 chusiren 共回答了17个问题
chusiren 共回答了17个问题 |采纳率88.2%某碱的溶液为0.1mol/L,若是强碱,在测定前,溶液的PH应该为13,而由滴定曲线可知,滴定前,PH1年前查看全部
- 2012年高一化学竞赛题:把NaOH稀溶液加到20.00mL 0.0215 mol/L Cd(NO3)2溶液,当加入1.
2012年高一化学竞赛题:
把NaOH稀溶液加到20.00mL 0.0215 mol/L Cd(NO3)2溶液,当加入1.10mL NaOH时pH为8.,10,此时生成Cd(OH)2沉淀.
请计算Cd(OH)2饱和溶液中[Cd2+]·[OH-]2 之值—即Ksp.
标答如下:
pH=8.10 pOH=5.90 [OH-]=1.26*10^(-6)mol/L
[Cd2+]=0.0215mol/L*20.00mL/(20.00mL+1.10mL)=2.04*10^(-2)mol/L
[Cd2+][OH-]^2=2.04*10^(-2)*[1.26*10^(-6)]^2=3.2*10^(-14)
请问pOH=5.90,为什么[OH-]=1.26*10^(-6)mol/L 如何求得的? 李艳1年前1
李艳1年前1 -
 时间砂 共回答了21个问题
时间砂 共回答了21个问题 |采纳率100%pH的意思对氢离子浓度值取负对数.pOH的意思就是对氢氧根离子的浓度值取负对数,即-lg[OH-].也就是说-lg[OH-]=5.90.一定要记得是浓度值,不是浓度,因为浓度是有单位的,不能做纯数学计算.
有个计算器,很容易就能求出[OH-]=1.26*10^(-6)mol/L.1年前查看全部
- 用标准NaOH溶液(浓度为0.120mol/L)滴定20.00ml待测盐酸,应选用的指示剂是——
用标准NaOH溶液(浓度为0.120mol/L)滴定20.00ml待测盐酸,应选用的指示剂是——
当指示剂由——色变为——色时,且在——分钟内颜色不在变化,耗用NaOH溶液21.02mL.重复滴定操作,第二次耗用相同标准液体体积为21.10mL,则待测HCL的浓度为——mol/L luoyianzi1231年前2
luoyianzi1231年前2 -
 深入深入 共回答了18个问题
深入深入 共回答了18个问题 |采纳率83.3%用标准NaOH溶液(浓度为0.120mol/L)滴定20.00ml待测盐酸,应选用的指示剂是—酚酞—,当指示剂由—无色—色变为—粉红—色时,且在—0.5—分钟内颜色不在变化,耗用NaOH溶液21.02mL.重复滴定操作,第二次耗用相同标准液体体积为21.10mL,则待测HCL的浓度为—0.126—mol/L.1年前查看全部
- 计算并画出0.1mol /LHCL溶液滴定20.00ml0.1mol/LNaOH溶液的滴定曲线
 xinyuan12211年前0
xinyuan12211年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1
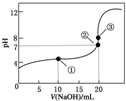 常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1 CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
A.点①所示溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.点②所示溶液中:c(Na+)≜c(CH3COOH)+c(CH3COO-)
C.点③所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) cleopatra1年前1
cleopatra1年前1 -
 柠檬kelly 共回答了17个问题
柠檬kelly 共回答了17个问题 |采纳率94.1%解题思路:A.点①所示溶液中,为等浓度的醋酸和醋酸钠溶液,醋酸的电离程度大于醋酸根离子的水解,溶液显示酸性;
B.点②所示溶液中,NaOH的体积小于20mL,为醋酸和醋酸钠溶液,则c(Na+)<c(CH3COO-)+c(CH3COOH);
C.点③所示溶液,恰好反应生成醋酸钠,水解显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
D.在滴定中当加入碱比较少时,可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-)的情况.A.点①溶液中,加入10mL氢氧化钠溶液,此时溶质为等浓度的醋酸和醋酸钠溶液,由于醋酸的电离程度大于醋酸根离子的水解程度,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒电荷守恒为c(OH-)+c(CH3COO-)=c(Na+)+c(H+)可知,c(CH3COO-)>c(Na+),所以溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.点②pH=7,即c(H+)=c(OH-),由电荷守恒知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则c(Na+)=c(CH3COO-),所以c(Na+)<c(CH3COOH)+c(CH3COO-),故B错误;
C.点③,加入20mL氢氧化钠溶液,两溶液恰好完全反应生成CH3COONa,因CH3COO-水解,溶液显示碱性,且醋酸根离子水解程度较小,溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C正确;
D.当CH3COOH较多,滴入的碱较少时,则生成CH3COONa少量,溶液中可能存在:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故D正确;
故选B.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查酸碱混合溶液中离子浓度的关系,题目难度中等,明确混合后溶液中的溶质是解答的关键,注意电荷守恒、物料守恒及盐的水解在比较离子浓度大小中的应用方法.1年前查看全部
- 取水样100.0ml ,加入20.00mL 0.1120mol/LAgNO3溶液,再用0.1160mol/L NH4SC
取水样100.0ml ,加入20.00mL 0.1120mol/LAgNO3溶液,再用0.1160mol/L NH4SCN溶液滴定过量的AgNO3溶液,用去10.00mL,求水样中氯离子的含量(以mg/L)氯表示,Mc1=35.45g/mol)
 lzdde1年前1
lzdde1年前1 -
 vv沦落侠客 共回答了13个问题
vv沦落侠客 共回答了13个问题 |采纳率100%水样100.0ml中氯离子的物质的量为20.00mL *0.1120mol/L-0.1160mol/L *10.00mL=1.08*10-5mol
则水样中氯离子的物质的量浓度为1.08*10-5mol/0.1L=1.08*10-4mol/L
水样中氯离子的含量1.08*10-4mol/L*35.45g/mol*1000=3.8286mg/L1年前查看全部
- 下列叙述正确的是( )A. 浓硫酸的装运包装箱应贴上如图所示的标识B. 用25ml酸式滴定管量取20.00ml 0.0
下列叙述正确的是( )
A. 浓硫酸的装运包装箱应贴上如图所示的标识
B. 用25ml酸式滴定管量取20.00ml 0.01 mol•L-1的Na2CO3溶液
C. 能使湿润的淀粉一碘化钾试纸变蓝的气体一定是Cl2
D. 从含I-的溶液中提取碘可以先加入稀硫酸与3%的H2O2溶液,再用酒精萃取 三毛781年前1
三毛781年前1 -
 飘雪血飘 共回答了11个问题
飘雪血飘 共回答了11个问题 |采纳率81.8%解题思路:A.根据浓硫酸具有强烈的腐蚀性,结合标志的含义进行分析判断;
B.碳酸钠是强碱弱酸盐,水解呈碱性;
C.湿润的KI淀粉试纸接触某气体而显蓝色,说明气体和碘离子反应把碘离子氧化为单质碘,遇到淀粉变蓝;
D.酒精和水相溶,所以不能用酒精萃取碘水中的碘.A.浓硫酸具有强烈的腐蚀性,故装运浓硫酸的包装箱应贴腐蚀品标志,图中所示标志是腐蚀品标志,故A正确;
B.酸式滴定管是磨口的玻璃活塞,玻璃的主要成分是二氧化硅,碳酸钠是强碱弱酸盐,水解溶液呈碱性,能与玻璃中二氧化硅反应,生成具有黏性的硅酸钠,导致玻璃塞打不开,所以用25ml酸式滴定管量取20.00ml 0.01 mol•L-1的Na2CO3溶液,酸式滴定管被碱腐蚀,故B错误;
C.溴单质溴蒸气可以把碘离子氧化为单质碘,碘单质遇到淀粉变蓝,NO2是强氧化性气体,可以把碘离子氧化为单质碘,碘单质遇到淀粉变蓝,所以能使湿润的淀粉一碘化钾试纸变蓝的气体不一定是Cl2,故C错误;
D.酒精和水是互溶的,不能做萃取剂来萃取点水中的碘单质,可以用四氯化碳来萃取,故D错误;
故选A.点评:
本题考点: 化学试剂的存放;计量仪器及使用方法;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题主要考查了实验操作,注意知识的积累,应注意积累实验操作中的易错点知识,题目难度不大.1年前查看全部
- (1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL
(1)常温下,用0.1000mol/LNaOH浴液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如图所示.

①由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
②a=______mL;
③c(Na+)=c(CH3COO-)的点是______(填B、D或E);
④E点对应离子浓度由大到小的顺序为______.
(2)Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)常温下,Cr(OH)3的溶度积Kap=c(Cr3+)•c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______. hardlystop1年前1
hardlystop1年前1 -
 我是谁哈 共回答了17个问题
我是谁哈 共回答了17个问题 |采纳率94.1%解题思路:(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等;
③根据电荷守恒判断;
④根据溶液的酸碱性及电荷守恒判断离子浓度大小;
(2)根据溶度积常数及铬离子浓度计算溶液中氢氧根离子浓度,再根据水的离子积常数计算氢离子浓度,从而得出溶液的pH.(1)①氯化氢是强电解质,醋酸是弱电解质,等浓度的盐酸和醋酸,醋酸的pH大于盐酸,根据图象知,未加氢氧化钠溶液时,图1的PH小于图2,所以图1是盐酸,故答案为:图1;
②根据图1知,在盐酸溶液中,pH=7时,盐酸和氢氧化钠的物质的量相等,盐酸和氢氧化钠的物质的量浓度相等,要使其物质的量相等,则体积必须相等,所以a=20mL,故答案为:20mL;
③溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),因为c(Na+)=c(CH3COO-),所以c(H+)=c(OH-),则溶液呈中性,为D点,故答案为:D;
④溶液呈碱性,c(H+)<c(OH-),溶液中存在电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),所以则c(Na+)>c(CH3COO-),溶液是盐溶液,所以c(CH3COO-)>c(OH-),则溶液中离子浓度大小顺序是:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故答案为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(2)根据溶度积常数得溶液中c(OH-)=
3
Ksp
c(Cr3+)
=
3
10−32
10−5
mol/L=10-9 mol/L,则溶液中氢离子浓度=
10−14
10−9mol/L=10-5 mol/L,则溶液的pH=5,
故答案为:5.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算.
考点点评: 本题考查了酸碱混合溶液定性判断及溶度积常数的计算等知识点,明确弱电解质电离特点结合电荷守恒来分析解答即可,难度中等.1年前查看全部
大家在问
- 1牛膀有什么作用
- 2我感到,有一股图像的激流把我带到一个宁静的梦里:在大海深处,江河就平静了:什么修辞手法?
- 3小刚和小华在操场上进行往返跑比赛
- 4sin21°cos189°-sin69°sin9°的值为
- 5243()27 9 3 () 括号里应填几?18 36 54()90()找规律
- 6人们对狼的态度要形容词,越多越好
- 7英语翻译Por qué echo a un lado gente que todo tiene que dejarme
- 8照样子写词语火红火红
- 9(2005•宜昌)下列哪种电器设备是利用电磁感应现象制成的是( )
- 10请问图中vin的电压值怎么计算啊
- 11这个算式怎么解1+2分之1 + 1+2+3分之1 + 1+2+3+4分之1……1+2+3+4+5.+100分之1错了 是
- 126000K等于6M么
- 13遥感TM数据对土地利用/覆盖分类中,如何利用土地利用转移概率矩阵,对监督分类 结果进行修正.
- 14若5x-2y=-2,则10的5x次方÷100的y次方=多少?
- 15求此作文材料的立意,只用告诉我立意的关键词就行
