(2014•松江区二模)对于集合A={a1,a2,…,an}(n∈N*,n≥3),定义集合S={x|x=ai+aj,1≤
 hcfcom2022-10-04 11:39:541条回答
hcfcom2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 一村花 共回答了19个问题
一村花 共回答了19个问题 |采纳率78.9%- 解题思路:利用特殊化思想,取特殊的等差数列进行计算,结合类比推理可得S(A)=2n-3.
∵集合A={a1,a2,…,an}(n∈N*,n≥3),定义集合S={x|x=ai+aj,1≤i<j≤n},
记集合S中的元素个数为S(A).
a1,a2,…,an是公差大于零的等差数列,
∴取特殊的等差数列进行计算,
取A={1,2,3,…,n},则S={3,4,5,…,2n-1},
∵(2n-1)-3+1=2n-3,
∴S中共2n-3个元素,
利用类比推理可得
若若a1,a2,…,an是公差大于零的等差数列,则S(A)=2n-3.
故答案为:2n-3.点评:
本题考点: 等差数列的性质.
考点点评: 本题考查集合与元素的位置关系和数列的综合应用,综合性较强,解题时注意特殊化思想和转化思想的运用,解题时要认真审题,仔细解答,避免错误,属基础题. - 1年前
相关推荐
- (2013•松江区二模)水和干泥土的质量均为2千克,温度为15℃,分别对它们加热,使它们的温度都升高10℃,吸收热量较多
(2013•松江区二模)水和干泥土的质量均为2千克,温度为15℃,分别对它们加热,使它们的温度都升高10℃,吸收热量较多的是______(选填“水”或“干泥土”),水吸收的热量为______焦[已知c水=4.2×103焦/(千克•℃),c 干泥土=0.84×103焦/(千克•℃)].这是通过______的方式使水和干泥土的内能增加的.
 April20041年前1
April20041年前1 -
 寻路的人是我 共回答了24个问题
寻路的人是我 共回答了24个问题 |采纳率91.7%解题思路:(1)水的比热容比干泥土的比热容大,说明相同质量的相同的水和干泥土相比,升高相同的温度,水吸热多;
(2)水吸收的热量用公式Q吸=cm△t计算;
(3)改变物体内能的方式有两种:做功和热传递,热传递是能量的转移过程,做功是能量的转化过程.(1)由于水的比热容大,因为Q吸=cm△t,所以质量相同的水和干泥土,升高相同的温度,水吸收的热量多.
(2)水吸收的热量:Q吸=cm△t=4.2×103J/(kg•℃)×2kg×10℃=8.4×104J;
(3)由题意,这是通过热传递的方式使水和干泥土的内能增加的.
故答案为:水;8.4×104;热传递.点评:
本题考点: 热量的计算;热传递改变物体内能.
考点点评: 本题考查了对吸热公式Q吸=cm△t的掌握和运用,难度不大,属于基础知识的考查.1年前查看全部
- (2014•松江区模拟)科学家利用精密的仪器把石墨拆成只有一个或几个原子层厚的“碳片”(示意图如下),碳片是世界上最薄的
 (2014•松江区模拟)科学家利用精密的仪器把石墨拆成只有一个或几个原子层厚的“碳片”(示意图如下),碳片是世界上最薄的材料.下列说法错误的是( )
(2014•松江区模拟)科学家利用精密的仪器把石墨拆成只有一个或几个原子层厚的“碳片”(示意图如下),碳片是世界上最薄的材料.下列说法错误的是( )
A.碳片是一种单质
B.碳片在氧气中完全燃烧的产物是CO2
C.在一定条件下,碳片可还原氧化铁
D.碳片和C60是同一种物质 17k花开花落1年前1
17k花开花落1年前1 -
 qian_john 共回答了10个问题
qian_john 共回答了10个问题 |采纳率80%解题思路:根据题意可知,碳可分为很多单质,但其化学性质是完全相同的进行分析.碳各种单质的物理性质各有不同,但碳的化学性质都是相同的.
A、碳片都是一种原子,即碳原子构成的,所以为单质,故A正确;
B、由于是碳的单质,所以充分燃烧时也是生成二氧化碳,故B正确;
C、由于属于碳的单质,所以化学性质和其他碳单质相同,所以碳片可以还原氧化铁,故C正确;
D、虽然都是有碳原子构成,但是碳原子的组合排列方式不同,所以不属于同一物质,属于同素异形体,故D错误.
故选:D.点评:
本题考点: 碳元素组成的单质;单质和化合物的判别;碳的化学性质.
考点点评: 本题考查碳单质有多种,物理性质不同,但其化学性质都是相同的.1年前查看全部
- (2013•松江区三模)某兴趣小组在“研究物体吸收热量的多少与哪些因素有关”的实验中,提出了以下几种猜想:
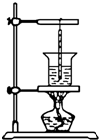 (2013•松江区三模)某兴趣小组在“研究物体吸收热量的多少与哪些因素有关”的实验中,提出了以下几种猜想:
(2013•松江区三模)某兴趣小组在“研究物体吸收热量的多少与哪些因素有关”的实验中,提出了以下几种猜想:
A.与物体升高的温度有关
B.与物体的质量有关
C.与物质的种类有关
为了验证以上猜想,小组同学用如图所示装置做了如下实验,将50克的水装入烧杯中,用酒精灯加热,并利用温度计和计时器测量水的温度随时间的变化情况,数据记录在表一中,然后在烧杯中再加入50克的水,重复上述实验,实验数据记录在表二中.(设水每分钟吸收的热量相等)
表一
表二50克水 时间(分钟) 0 1 2 3 4 5 6 温度(℃) 20 24 28 32 36 40 44 升高温度(℃) 0 4 8 12 16 20 24
表三100克水 时间(分钟) 0 1 2 3 4 5 6 温度(℃) 20 22 24 26 28 30 32 升高温度(℃) 0 2 4 6 8 10 12
①分析比较表一(或表二)中的第一行与第三行的数据及相关条件,可得出的初步结论是:______,吸收的热量与升高的温度成正比.时间(分钟) / / / / / / / 温度(℃) / / / / / / / 升高温度(℃) / / / / / / /
②分析比较表一和表二中第四列、第五列、第六列等有关数据及相关条件,经过推理,可以得出的初步结论是:同种物质(水)吸收相等的热量,______.
③进一步综合分析表一和表二中有关数据及相关条件,归纳得出的结论为:
______.
④为了验证猜想______(选填字母),请你把实验方案的设计填在表三______中.
⑤在整个实验中所用的主要研究方法与下列实验所用方法相同的是______.
A测定物质的密度B研究液体内部的压强与哪些因素有关
C用电流表、电压表测电阻D研究平面镜成像特点. 六分之一的起点1年前1
六分之一的起点1年前1 -
 nikecheng 共回答了15个问题
nikecheng 共回答了15个问题 |采纳率93.3%解题思路:(1)因探究的是“研究物体吸收热量的多少与哪些因素有关”,所以根据控制变量法分析,将可能的影响因素都考虑到,并且控制其它因素不变,只改变一个因素来探究它对吸收热量的影响.
(2)知道吸热的多少是通过加热时间的长短判断,根据探究的要求,分析数据时改变和不变的因素,利用控制变量法设计实验或得出结论.
(3)因本实验主要利用的是控制变量法,从所提供实验中找出利用控制变量法的即可.①表一(或表二)中的第一行与第三行的数据是质量相同,水升高温度不同,加热时间随之的改变,可得出的初步结论是:质量相等的同种物质(水),吸收的热量与升高的温度成正比.
②表一和表二中第四列、第五列、第六列数据是加热时间相同,水的质量和升高的温度都不同,但是质量越小,升高的温度越多,所以可以得出的初步结论是:同种物质(水)吸收相等的热量,质量越小,升高的温度越多.
③进一步分析表一和表二中的数据,虽然吸收的热量、物体质量和升高温度都不同,但经合理的运算,可归纳得出的结论为:同种物质(水),吸收的热量与物体质量和升高温度的乘积的比值是一个确定的值.
④表一和表二中的数据是验证物质的质量和升高温度对吸热多少的影响,还需要验证不同的物质对吸热的影响,即验证猜想C,在表三中就应将利用50克煤油(或100克煤油;或50克或100克的其它液体)进行实验.
⑤在整个实验中所用的主要研究方法控制变量法,而实验研究液体内部的压强与哪些因素有关采用的是控制变量法,所以用方法相同的是B.
故答案为:①质量相等的同种物质(水);②质量越小,升高的温度越多;③同种物质(水),吸收的热量与物体质量和升高温度的乘积的比值是一个确定的值;④C;50克煤油(或100克煤油;或50克或100克的其它液体);⑤B.点评:
本题考点: 比热容的概念;物理学方法.
考点点评: 本题考查物质比热容的实验探究,主要是使用控制变量法来设计实验和得出结论,注意通过加热时间的长短表示物质吸热的多少,这是解答本题的关键.1年前查看全部
- (2014•松江区三模)在极坐标系中,圆C过极点,且圆心的极坐标是(a,[π/2])(a>0),则圆C的极坐标方程是(
(2014•松江区三模)在极坐标系中,圆C过极点,且圆心的极坐标是(a,[π/2])(a>0),则圆C的极坐标方程是( )
A.ρ=-2asinθ
B.ρ=2asinθ
C.ρ=-2acosθ
D.ρ=2acosθ 小寒什么都没失去1年前1
小寒什么都没失去1年前1 -
 dlppeng 共回答了20个问题
dlppeng 共回答了20个问题 |采纳率95%解题思路:先求出求圆的标准方程,再把它化为极坐标方程.由于圆心的极坐标是(a,[π/2]),化为直角坐标为(0,a),半径为a,
故圆的直角坐标方程为 x2+(y-a)2=a2,再化为极坐标方程为ρ=2asinθ,
故选:B.点评:
本题考点: 简单曲线的极坐标方程.
考点点评: 本题主要考查求圆的标准方程,把直角坐标坐标方程化为极坐标方程的方法,属于基础题.1年前查看全部
- (2014•松江区二模)碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂.
(2014•松江区二模)碳酸二甲酯(DMC)是一种低毒性的绿色化学品,可用于代替高毒性的光气(COCl2)作羰基化试剂.DMC的合成流程如下.完成下列填空.
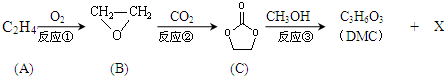
已知:RCOOR′+R″OH→RCOOR″+R′OH
(1)写出反应类型:反应①______反应③______
(2)石油工业上获得C2H4的操作名称为______.
(3)写出结构简式:DMC______; X______
(4)已知物质Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2mol Y能生成1mol分子中含六元环结构的有机物,则Y的结构简式为:______
(5)DMC与双酚(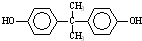 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:______.
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:______.  天下文化1年前1
天下文化1年前1 -
 shinyan 共回答了17个问题
shinyan 共回答了17个问题 |采纳率100%解题思路:由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC(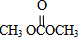 )和X(OHCH2CH2OH),然后结合有机物的结构与性质来解答.
)和X(OHCH2CH2OH),然后结合有机物的结构与性质来解答.
由合成流程可知,反应①为加成反应生成环氧乙烷,反应②为C=O键的加成反应,反应③为C与甲醇的取代反应生成DMC(
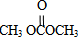 )和X(OHCH2CH2OH),
)和X(OHCH2CH2OH),
(1)由上述分析可知,①为加成反应,③为取代反应,故答案为:加成反应;取代反应;
(2)石油工业上获得C2H4的操作名称为裂解,故答案为:裂解;
(3)DMC为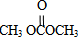 ,X为OHCH2CH2OH,故答案为:
,X为OHCH2CH2OH,故答案为: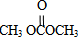 ;OHCH2CH2OH;
;OHCH2CH2OH;
(4)Y与DMC互为同分异构体,Y的水溶液呈酸性,在一定条件下2mol Y能生成1mol分子中含六元环结构的有机物,Y中含1个-COOH,则Y的结构简式为CH3CHOHCOOH,
故答案为:CH3CHOHCOOH;
(5)DMC与双酚(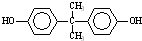 )在一定条件下可生成芳香族聚碳酸酯,反应的化学方程式为2n
)在一定条件下可生成芳香族聚碳酸酯,反应的化学方程式为2n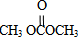 +n
+n →
→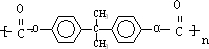 +4nCH3OH,故答案为:2n
+4nCH3OH,故答案为:2n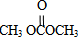 +n
+n →
→ +4nCH3OH.
+4nCH3OH.点评:
本题考点: 有机物的合成;有机物分子中的官能团及其结构;有机化学反应的综合应用.
考点点评: 本题考查有机物合成及结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,为解答该题的关键,易错点为(5),注意把握题给信息.1年前查看全部
- (2010•松江区一模)如图所示的电路中,电源电压保持不变,电键S1闭合、S2断开时,当滑动变阻器的滑片P向右移动,电压
 (2010•松江区一模)如图所示的电路中,电源电压保持不变,电键S1闭合、S2断开时,当滑动变阻器的滑片P向右移动,电压表的示数与电流表的示数的比值将______;若将电键S2也闭合,电压表的示数将______.(均选填“变小”、“不变”或“变大”)
(2010•松江区一模)如图所示的电路中,电源电压保持不变,电键S1闭合、S2断开时,当滑动变阻器的滑片P向右移动,电压表的示数与电流表的示数的比值将______;若将电键S2也闭合,电压表的示数将______.(均选填“变小”、“不变”或“变大”)  lnlbbaby1年前1
lnlbbaby1年前1 -
 adwe23 共回答了22个问题
adwe23 共回答了22个问题 |采纳率86.4%解题思路:当电键S1闭合、S2断开时,电阻R1和滑动变阻器串联,电压表测电阻R1两端的电压,电流表测电路中的电流,根据欧姆定律可知滑片P向右移动,电压表的示数与电流表的示数的比值的变化;若将电键S2也闭合时,电压表测电源的电压,据此判断电压表的示数的变化.当电键S1闭合、S2断开时,电阻R1和滑动变阻器串联,电压表测电阻R1两端的电压U1,电流表测电路中的电流I1;
由欧姆定律可知,电压表的示数与电流表的示数的比值为
U1
I1=R1,所以比值不变;
若将电键S2也闭合,电压表测电源的电压,所以电压表的示数将变大.
故答案为:不变;变大.点评:
本题考点: 欧姆定律的应用;滑动变阻器的使用.
考点点评: 本题考查了欧姆定律的应用和电压表的正确使用,关键是开关闭和、断开时电路图串并联的辨别和把电压表和电流表的比值转化为电阻来处理.1年前查看全部
- (2013•松江区二模)有一表面已被氧化的镁条3.0克,测得其中镁元素含量为80%.把该镁条放入足量的稀硫酸中完全溶解,
(2013•松江区二模)有一表面已被氧化的镁条3.0克,测得其中镁元素含量为80%.把该镁条放入足量的稀硫酸中完全溶解,生成硫酸镁的物质的量为( )
A.0.2mol
B.1mol
C.0.1 mol
D.无法确定 giyao1年前1
giyao1年前1 -
 悠然you自得 共回答了21个问题
悠然you自得 共回答了21个问题 |采纳率85.7%解题思路:根据题意可知Mg和MgO中的镁元素最终都进入到硫酸镁中,因此根据镁元素的质量算出硫酸镁量.有一表面已被氧化的镁条3.0克,测得其中镁元素含量为80%.则镁元素的质量为3.0g×80%=2.4g,其物质的量是[2.4g/24g/mol]=0.1mol,由硫酸镁的化学式为MgSO4可知镁元素的物质的量与硫酸镁的物质的量相同,故生成硫酸镁的物质的量也是0.1mol;
故选C点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 此题是根据化学式计算的考查题,解题的关键是能够分析出反应前镁元素的质量与硫酸镁中镁元素的质量相等;1年前查看全部
- (2014•松江区一模)在图(a)所示的电路中,电源电压为18伏保持不变,电阻R1的阻值为10欧.闭合电键S,电流表A的
(2014•松江区一模)在图(a)所示的电路中,电源电压为18伏保持不变,电阻R1的阻值为10欧.闭合电键S,电流表A的示数如图12(b)所示.求:
①电阻R1两端的电压U1.
②此时滑动变阻器R2连入电路的阻值.
③现有标有“20Ω2A”、“50Ω1A”字样的滑动变阻器可供选择,去替换R2,要求:在移动变阻器滑片P的过程中,定值电阻两端电压的变化量最大.
选择:标有______字样的滑动变阻器.求:定值电阻R1两端电压的最大变化量△U1.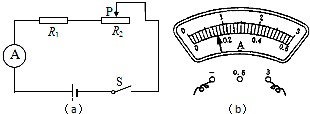
 liudongqun1年前1
liudongqun1年前1 -
 会飞的雄鹰 共回答了20个问题
会飞的雄鹰 共回答了20个问题 |采纳率85%解题思路:由电路图可知,R1、R2串联,电流表测电路中的电流;
(1)根据欧姆定律求出电阻R1两端的电压.
(2)根据串联电路的电压特点求出R2两端的电压,根据欧姆定律电阻R2连入电路的阻值.
(3)但滑动变阻器接入电路中的电阻为0时,定值电阻R1两端电压的最大为电源电压18V,根据欧姆定律求出电路中的最大电流确定滑动变阻器的规格,当滑动变阻器接入电路中的电阻最大时,定值电阻R1两端电压最小,利用电阻的串联和欧姆定律求出电路中的最小电流,再利用欧姆定律求出电压表的最小示数,两者相减即可得出答案.由电路图可知,R1、R2串联,电流表测电路中的电流;
①I1=0.8A,根据欧姆定律得
R1两端的电压U1=I1R1=0.8A×10Ω=8V;
②由U=U1+U2得,U2=U-U1=18V-8V=10V,
I2=I1=0.8A,
R2=
U2
I2=[10V/0.8A]=12.5Ω;
③当滑动变阻器R2接入电路中的电阻为0时,定值电阻R1两端电压的最大为电源电压U1′=18V,
此时电路中的电流:
Imax=
U1max
R1=[18V/10Ω]=1.8A>1A,
故选“20 2A”的滑动变阻器,
所以当R2=20Ω时,Rmax=R1+R2=10Ω+20Ω=30Ω,
I1min=[U
Rmax=
18V/30Ω]=0.6A,
U1=I1R1=0.6A×10Ω=6V;
△U1=U1′-U1=18V-6V=12V.
答:①电阻R1两端的电压U1为8V.
②此时滑动变阻器R2连入电路的阻值为12.5Ω.
③标有“20 2A”字样的滑动变阻器.
定值电阻R1两端电压的最大变化量△U1为12V.点评:
本题考点: 欧姆定律的应用.
考点点评: 本题的综合性较强,不仅考查电流表的读数方法,还考查欧姆定律的应用、串联电路的电压规律.关键是根据R1两端的电压确定电压表的量程和定值定值两端的电压最大示数.1年前查看全部
- (2007•松江区一模)化学反应:2A+B→C+2D,其中20gA和10gB恰好完全反应,生成5gC,假设物质C的摩尔质
(2007•松江区一模)化学反应:2A+B→C+2D,其中20gA和10gB恰好完全反应,生成5gC,假设物质C的摩尔质量为M克/摩尔,则生成物D的摩尔质量N与M的关系是( )
A.N=2M
B.N=5M
C.N=-M
D.2N=5M 连城1年前1
连城1年前1 -
 mouse000 共回答了22个问题
mouse000 共回答了22个问题 |采纳率86.4%解题思路:解答此题需依据质量守恒定律,反应前后质量总和相等,所以参加反应的A和B的质量和等于生成物C和D的质量和,以此为突破口,找出D的质量,再根据化学反应中C和D的质量关系和物质C的摩尔质量为M克/摩尔,生成物D的摩尔质量N可以求得N与M的关系.生成D的质量为20g+10g-5g=25g
根据化学方程式
2A+B=C+2D
M2N
5g 25g
[M/2N=
5g
25g]
[M/N=
2
5]
故选D点评:
本题考点: 质量守恒定律及其应用.
考点点评: 解此题的关键是要知道利用方程式找各物质的质量关系时摩尔质量需要乘以化学计量数.1年前查看全部
- (2013•松江区二模)下列条件变化会使H2O的电离平衡向电离方向移动,且pH<7的是( )
(2013•松江区二模)下列条件变化会使H2O的电离平衡向电离方向移动,且pH<7的是( )
A.将纯水加热到100℃
B.向水中加少量HCl
C.向水中加少量NaOH
D.向水中加少量Na2CO3 klkl1213141年前1
klkl1213141年前1 -
 小寒002 共回答了21个问题
小寒002 共回答了21个问题 |采纳率90.5%解题思路:水的电离平衡:H2O⇌H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度;水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+)增大,则pH减小;水解的盐中阳离子水解促进水的电离,溶液显酸性;加入酸或碱会抑制水的电离,平衡左移.A、常温下水的PH=7,将纯水加热到100℃,水的电离平衡正向进行,氢离子浓度和氢氧根离子浓度增大,水的PH<7,故A符合;
B、向水中加少量HCl,氢离子浓度增大,抑制水的电离,平衡左移,溶液PH<7,故B不符合;
C、向水中加少量NaOH,氢氧根离子浓度增大,抑制水的电离,平衡左移,溶液PH>7,故C不符合;
D、向水中加少量Na2CO3,碳酸根离子水解显碱性,促进水的电离右移,溶液PH>7,故D不符合;
故选A.点评:
本题考点: 水的电离.
考点点评: 本题考查了水的电离平衡影响因素的分析判断,加热促进水的电离,酸碱抑制电离,水解的盐促进水的电离,题目较简单.1年前查看全部
- (2009•松江区二模)以下四个家庭小实验,其中发生化学变化的是( )
(2009•松江区二模)以下四个家庭小实验,其中发生化学变化的是( )
A.糖溶于水
B.用铅笔芯的粉末打开生锈的铁锁
C.利用木炭和棉花净化水
D.点燃蜡烛 gg笔记本1年前1
gg笔记本1年前1 -
 scorer 共回答了19个问题
scorer 共回答了19个问题 |采纳率100%解题思路:化学变化是指有新物质生成的变化.物理变化是指没有新物质生成的变化.化学变化和物理变化的本质区别是否有新物质生成.A、糖溶于水没有新物质生成,属于物理变化.
B、用铅笔芯的粉末打开生锈的铁锁没有新物质生成,属于物理变化.
C、利用木炭和棉花净化水没有新物质生成,属于物理变化.
D、蜡烛燃烧生成二氧化碳和水,属于化学变化.
故选D点评:
本题考点: 化学变化和物理变化的判别;化学变化的基本特征.
考点点评: 本题主要考查了物理变化和化学变化两方面的内容.1年前查看全部
- (2013•松江区二模)如图中“○”、“●”代表不同元素的原子,则图中所示的化学反应属于( )
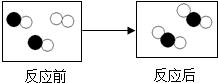 (2013•松江区二模)如图中“○”、“●”代表不同元素的原子,则图中所示的化学反应属于( )
(2013•松江区二模)如图中“○”、“●”代表不同元素的原子,则图中所示的化学反应属于( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应 lingju849151年前1
lingju849151年前1 -
 从不笑 共回答了21个问题
从不笑 共回答了21个问题 |采纳率76.2%解题思路:观察图示,分析反应物、生成物的种类及反应的特点,判断反应的类型.由图示可知反应物是由两种不同的分子构成,而生成物是由一种分子构成,故反应物为两种,生成物是一种,因此符合化合反应“多变一”的特性;
故选A点评:
本题考点: 微粒观点及模型图的应用.
考点点评: 本题属于微观粒子模型的图示题,解答时一定要弄清各微观粒子的构成情况,并能把微观粒子与宏观物质很好的联系起来,才能根据微观粒子来推测物质的种类及反应的类型等.1年前查看全部
- (2014•松江区一模)在图所示的电路中,电源电压为6伏且不变,电阻R2为15欧.
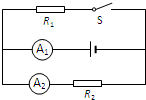 (2014•松江区一模)在图所示的电路中,电源电压为6伏且不变,电阻R2为15欧.
(2014•松江区一模)在图所示的电路中,电源电压为6伏且不变,电阻R2为15欧.
①求:电流表A2的示数I2.
②闭合电键S时,电流表A1的示数变化了0.6安,求:此时电流表A1的示数I和电阻R1. 翅膀在飛1年前1
翅膀在飛1年前1 -
 hase 共回答了23个问题
hase 共回答了23个问题 |采纳率91.3%解题思路:(1)由电路图可知电路为R2的简单电路,A2测通过R2的电流,根据欧姆定律求出电流表A2的示数;
(2)闭合电键S时,因电源的电压不变,所以通过R2的电流不变,从而可知电流表A1示数的变化为通过R1的电流,再根据欧姆定律求出电阻R1的阻值.①电流表A2的示数为:
I2=
U2
R2=[6V/15Ω]=0.4A;
②因电源的电压不变,
所以通过R2的电流不变,故I1=0.6A,
干路电流为I=I1+I2=0.6A+0.4A=1A,即电流表A1的示数为1A;
电阻R1的阻值为R1=
U1
I1=[6V/0.6A]=10Ω.
答:①电流表A2的示数为0.4A;
②闭合电键S时电流表A1的示数为1A,电阻R1的阻值为10Ω.点评:
本题考点: 欧姆定律的应用;并联电路的电流规律.
考点点评: 本题考查了并联电路的特点和欧姆定律的计算,关键是开关闭合前后电路变化的判断以及应用.1年前查看全部
- (2013•松江区二模)属于纯净物的是( )
(2013•松江区二模)属于纯净物的是( )
A.大理石
B.天然气
C.蒸馏水
D.碘酒 gaofei1983021年前1
gaofei1983021年前1 -
 meteor2k 共回答了20个问题
meteor2k 共回答了20个问题 |采纳率95%解题思路:纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质;据此结合常见物质的组成成分逐项分析即可.A、大理石的主要成分是碳酸钙,含有杂质,属于混合物.
B、天然气的主要成分是甲烷,含有杂质气体,属于混合物.
C、蒸馏水中只含有一种物质,属于纯净物.
D、碘酒中含有碘、酒精等物质,属于混合物.
故选C.点评:
本题考点: 纯净物和混合物的判别.
考点点评: 解答本题要充分理解纯净物和混合物的区别,要分析物质是由几种物质组成的,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物.1年前查看全部
- (2011•松江区二模)定义一种运算S=a⊗b,运算原理如图所示,则cos45°⊗sin15°+sin45°⊗cos15
 (2011•松江区二模)定义一种运算S=a⊗b,运算原理如图所示,则cos45°⊗sin15°+sin45°⊗cos15°=−
(2011•松江区二模)定义一种运算S=a⊗b,运算原理如图所示,则cos45°⊗sin15°+sin45°⊗cos15°=−1 2 −.1 2  窗里窗外向日葵1年前1
窗里窗外向日葵1年前1 -
 对付来 共回答了20个问题
对付来 共回答了20个问题 |采纳率80%解题思路:先根据流程图中即要分析出计算的类型,该题是考查了分段函数,再求出函数的解析式,然后根据解析式求解函数值即可.∵运算S=a⊗b中S的值等于分段函数 y=
ab,a≥b
−ba,a<b的函数值,
则cos45°⊗sin15°+sin45°⊗cos15°
=cos45°⊗sin15°-sin45°⊗cos15°
=sin(-30°)=-[1/2].
故答案为:-[1/2].点评:
本题考点: 选择结构;两角和与差的正弦函数.
考点点评: 本题考查判断程序框图的功能即判断出新运算法则.利用运算法则求值.1年前查看全部
- (2012•松江区二模)甲、乙两个实心立方体分别放在水平地面上(ρ甲<ρ乙),它们对水平地面的压强相等.若沿竖直方向将甲
(2012•松江区二模)甲、乙两个实心立方体分别放在水平地面上(ρ甲<ρ乙),它们对水平地面的压强相等.若沿竖直方向将甲、乙两个立方体各切除一部分,且使甲、乙两个立方体剩余部分的厚度相同,再将切除部分分别叠放在各自剩余部分上面,则水平地面受到甲、乙的压强( )
A.p甲>p乙
B.p甲=p乙
C.p甲<p乙
D.以上情况均有可能 疾风识劲草1年前1
疾风识劲草1年前1 -
 ddrr跨dd 共回答了16个问题
ddrr跨dd 共回答了16个问题 |采纳率81.3%解题思路:(1)水平面物体的压力和自身的重力相等,根据G=mg、m=ρV、V=sh和压强公式得出实心立方体对水平地面压强的表达式,根据它们对水平地面的压强相等和密度关系得出甲乙的边长关系;
(2)甲、乙两个立方体各切除一部分并再将切除部分分别叠放在各自剩余部分上面时,它们各自对地面的压力不变,再根据剩余部分的厚度相同得出受力面积,根据压强公式得出表达式,利用条件即可得出此时甲、乙的压强关系.(1)实心立方体对水平地面压强:
p=[F/s]=[G/s]=[mg/s]=[ρVg/s]=[ρshg/s]=ρgh,
∵甲乙对地面的压强相等,
∴ρ甲gh甲=ρ乙gh乙------①
又∵ρ甲<ρ乙,
∴h甲>h乙--------------②
(2)设实心正方体剩余部分的厚度为h,
则底面积为s底=h正方体h,
∵把切掉的部分又放到物体的上方,
∴它们对地面的压力不变,
∴对地面的压强p=
G正方体
s底=
ρ
h3正方体g
h正方体h=
ρ
h2正方体g
h,
即p甲=
ρ甲
h2甲g
h,p乙=
ρ乙
h2乙g
h,
由①②两式可得:ρ甲gh甲2>ρ乙gh乙2,
∴p甲>p乙.
故选A.点评:
本题考点: 压强的大小及其计算;压强大小比较.
考点点评: 解决本题的关键:一是根据G=mg、m=ρV、V=sh和压强公式得出实心立方体对水平地面压强的表达式并根据条件的出变长关系,二是根据题意得出剩余部分物体对水平地面压强的表达式.1年前查看全部
- (2009•松江区二模)对于正整数k,g(k)表示k的最大奇因数,如g(1)=1,g(2)=1,g(3)=3,g(4)=
(2009•松江区二模)对于正整数k,g(k)表示k的最大奇因数,如g(1)=1,g(2)=1,g(3)=3,g(4)=1,…,记f(n)=g(1)+g(2)+g(3)+…+g(2n),其中n为正整数.
(1)分别计算g(1)+g(3)+g(5)+g(7);g(1)+g(2)+g(3)+g(4);g(2)+g(4)+g(6)+g(8);
(2)求证:当n≥2时,f(n)=4n-1+f(n-1);
(3)记an=f(n+1)+k(-1)nf(n),当{an}为递增数列时,求实数k的范围. 穿着汗衫打领带1年前1
穿着汗衫打领带1年前1 -
 131452068 共回答了19个问题
131452068 共回答了19个问题 |采纳率89.5%解题思路:(1)k的最大奇因数是指k的约数当中的最大的奇数,由此定义可得g(1)=1,g(2)=1,g(3)=3,g(4)=1,g(5)=5,g(6)=3,g(7)=7,g(8)=1,代入要求了代数式,即可以得出它们的值;
(2)正整数分为正奇数和正偶数,由此将从1、2、…,到2n的数进行分类,可得当n≥2时,f(n)=g(1)+g(2)+
g(3)+…+g(2n)=g(1)+g(3)+g(5)+…+g(2n-1)+g(2)+g(4)+…+g(2n)=(2n-1)2+g(1)+g(2)+g(3)+…+g(2n-1))=4n-1+f(n-1),等式成立;
(3)在(2)的结论的基础上,可得f(n)-f(n-1)=4n-1,然后分别将n=1、n=2、n=3,…,代入用累加的方法可以求得
f(n)=42+43+…+4n-1+f(2)=
+6=42(1−4n−2) 1−4
成立,由此代入an=f(n+1)+k(-1)nf(n),得出an的表达式.最后讨论{an}为递增数列,说明an+1-an>0在正整数范围内恒成立,可以得出−2<k<4n+2 3
.16 7 (1)g(1)+g(3)+g(5)+g(7)=1+3+5+7=16;
g(1)+g(2)+g(3)+g(4)=1+1+3+1=6;
g(2)+g(4)+g(6)+g(8)=1+1+3+1=6
(2)证明:∵g(2)+g(4)+g(6)+…+g(2k)
=g(2•1)+g(2•2)+g(2•3)+…+g(2•k)=g(1)+g(2)+g(3)+…+g(k)
∴当n≥2时,f(n)=g(1)+g(2)+g(3)+…+g(2n)
=g(1)+g(3)+g(5)+…+g(2n-1)+g(2)+g(4)+…+g(2n)
=1+3+5+…+(2n-1)+g(1)+g(2)+g(3)+…+g(2n-1)
=
1+2n−1
2(2n−1)+f(n−1)=4n-1+f(n-1)
(3)由(2)得,当n≥2时,f(n)=4n-1+f(n-1),即f(n)-f(n-1)=4n-1
∴f(3)-f(2)=42,f(4)-f(3)=43,f(n)-f(n-1)=4n-1
可得f(n)=42+43+…+4n-1+f(2)=
42(1−4n−2)
1−4+6=
4n+2
3
当n=1时,f(1)=g(1)+g(2)=1+1=2也成立,
∴f(n)=
4n+2
3n∈N*
an=f(n+1)+k(−1)nf(n)=
4n+1+2
3+k(−1)n
4n+2
3
∵{an}为递增数列
∴当n∈N*时,an+1-an=
4n+2+2
3+k(−1)n+1
4n+1+2
3−
4n+1+2
3−k(−1)n
4n+2
3=4n+1+
1
3k(−1)n+1(5•4n+4)>0恒成立
当n为正奇数时,k>−
12•4n
5•4n+4=−
12
5+
48
25•4n+20
∵当n=1时,−
12
5+
48
25•4n+20取到最大值-2
∴k>-2;
当n为正偶数时,k<
12•4n
5•4n+4=
12
5−点评:
本题考点: 数列与函数的综合.
考点点评: 本题综合了数列的通项与求和的方法、函数的单调性和不等式恒成立等复杂知识点,属于难题.解题时要注意数列当中的归纳方法与证明不等式恒成立时的放缩的技巧,本题综合性较强,适合基础较好的同学.1年前查看全部
- (2005•松江区模拟)医生给病人输液时,常用葡萄糖注射液.如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
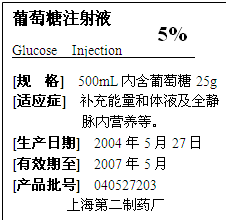 (2005•松江区模拟)医生给病人输液时,常用葡萄糖注射液.如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(2005•松江区模拟)医生给病人输液时,常用葡萄糖注射液.如图为葡萄糖注射液的部分标签图,根据图回答下列问题:
(1)葡萄糖的化学式为C6H12O6,它是由______种元素组成,其相对分子质量(式量)是______.
(2)如果从瓶中取出100g,将它变成饱和溶液比较可靠的方法是______.
(3)某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖______g.. 燕燕的琪琪1年前1
燕燕的琪琪1年前1 -
 apetdoudou 共回答了21个问题
apetdoudou 共回答了21个问题 |采纳率90.5%解题思路:(1)根据葡萄糖化学式的含义、相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.
(2)根据不饱和溶液与饱和溶液的转化方法进行分析解答.
(3)根据题意,500mL内含葡萄糖25g,据此进行分析解答.(1)由葡萄糖化学式的含义可知,葡萄糖是由碳、氢、氧三种元素组成的;其相对分子质量(式量)是12×6+1×12+16×6=180.
(2)从瓶中取出100g,将它变成饱和溶液比较可靠的方法是加入葡萄糖或蒸发溶剂.
(3)根据题意,500mL内含葡萄糖25g,则某病人一天共输入该葡萄糖注射液1500mL,此病人这一天共补充葡萄糖的质量为25g×[1500mL/500mL]=75g.
故答案为:(1)3; 180;(2)加入葡萄糖或蒸发溶剂;(3)75.点评:
本题考点: 标签上标示的物质成分及其含量;饱和溶液和不饱和溶液相互转变的方法;有关溶质质量分数的简单计算;相对分子质量的概念及其计算.
考点点评: 本题难度不大,考查同学们结合标签新信息、灵活运用化学式的有关计算、不饱和溶液与饱和溶液的转化方法进行分析问题、解决问题的能力.1年前查看全部
- (2014•松江区一模)氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损.一定条件下,氮气、
(2014•松江区一模)氮化硅是一种重要的结构陶瓷材料,它是一种超硬物质,本身具有润滑性,并且耐磨损.一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2→Si3N4+12HCl,氮的氢化物肼(N2H4)是航天火箭发射常用的燃料,二氧化氮作氧化剂.
(1)氮原子的最外层电子排布式是______;氮元素有多种化合价,写出含2种价态氮的化合物的化学式______(举一例).
(2)硅原子核外电子排布在______种不同能量的电子亚层上,氮化硅属______晶体.
(3)上述反应中,属于同一周期的元素符号有______,用______事实可以比较它们的非金属性强弱.
(4)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物.NH3分子的空间构型是______;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是______(举一例).
(5)肼作火箭发射燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)→3N2(g)+4H2O(g)+1038.7kJ,若该反应中有4molN-H键断裂,则形成的气体有______mol,其中转移电子数目______.
(6)肼能与硫酸反应生成N2H6SO4,该物质晶体类型与硫酸铵相同,则其溶液PH______7(填>、<或=),原因是______(用离子方程式表示). zhangzhen1年前1
zhangzhen1年前1 -
 yuhaiclo1 共回答了12个问题
yuhaiclo1 共回答了12个问题 |采纳率83.3%解题思路:(1)N元素为7号元素,原子核外有2个电子层;NH4+中N元素为-3价,N元素的含氧酸根中N为正价;
(2)根据硅原子核外电子排布式分析;根据氮化硅的物理性质分析;
(3)Si与Cl都是第三周期元素;元素的氢化物越稳定,对应非金属性越强,或最高价氧化物对应水化物酸性酸性越强,则元素的非金属性越强;
(4)根据氨气中N原子的杂化分析;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是C2H6;
(5)根据氮氢键和生成气体、转移电子之间的关系式计算;
(6)N2H6SO4晶体类型与硫酸铵相同,根据硫酸铵的性质分析.(1)N元素为7号元素,原子核外有2个电子层,其最外层电子排布式是2s22p3;NH4+中N元素为-3价,N元素的含氧酸根中N为正价,所以含2种价态氮的化合物的化学式为NH4NO3或NH4NO2,
故答案为:2s22p3;NH4NO3或NH4NO2;
(2)Si为14号元素,其核外电子排布式为1s22s22p63s23p2,所以其核外电子排布在5种不同能量的电子亚层上;氮化硅有超硬和耐磨性,所以属于原子晶体,
故答案为:5;原子;
(3)一定条件下,氮气、氢气与四氯化硅反应可以制得氮化硅,化学反应方程式为:3SiCl4+6H2+2N2→Si3N4+12HCl,反应中Si、Cl都是第三周期元素;元素的氢化物越稳定,对应非金属性越强,或最高价氧化物对应水化物酸性酸性越强,则元素的非金属性越强,
故答案为:Si、Cl;氢化物稳定性或最高价氧化物对应水化物酸性;
(4)NH3中N原子成3个σ键,有一对未成键的孤对电子,杂化轨道数为4,采取sp3型杂化杂化,孤对电子对成键电子的排斥作用较强,N-H之间的键角小于109°28′,所以氨气分子空间构型是三角锥形;与N2H4分子具有相同电子数的分子有多种,其中具有可燃性的物质是C2H6,
故答案为:三角锥型;C2H6;
(5)若该反应中有4mol N-H键断裂,则有1molN2H4参加反应,生成气体的物质的量=[7/2]mol=3.5mol,转移电子数=[8/2]=4NA,
故答案为:3.5;4NA;
(6)肼能与硫酸反应生成N2H6SO4,该物质晶体类型与硫酸铵相同,已知硫酸铵水解显酸性,所以N2H6SO4的溶液也显酸性,即PH<7;其水解方程式为:N2H62++2H2O⇌N2H4•2H2O+2H+,故答案为:<;N2H62++2H2O⇌N2H4•2H2O+2H+.点评:
本题考点: 原子核外电子排布;化学方程式的有关计算;盐类水解的应用.
考点点评: 本题考查较综合,涉及核外电子排布、空间构型的判断、有关物质的量的计算、盐的水解等知识点,分子空间构型是考试热点,要注重基础知识的积累,题目难度较大.1年前查看全部
- (2008•松江区二模)一双灵巧的手能展现出各种动物造型,今年央视《春晚》上的“手影戏”给人留下了深刻印象.“手影戏”主
(2008•松江区二模)一双灵巧的手能展现出各种动物造型,今年央视《春晚》上的“手影戏”给人留下了深刻印象.“手影戏”主要利用的光学原理是…( )
A.光的直线传播
B.光的反射
C.光的折射
D.光路可逆 11优雅的转身1年前1
11优雅的转身1年前1 -
 句月1 共回答了18个问题
句月1 共回答了18个问题 |采纳率100%解题思路:影子是由于光照射到不透明的物体形成的阴影部分,是由于光的直线传播形成的.光被手遮挡后,在后边形成一个黑色的区域,叫做影子,即手影,这个节目利用了光在均匀介质中沿直线传播的道理.
故选A.点评:
本题考点: 光在均匀介质中直线传播.
考点点评: 本题主要通过手影考查光在同一物质中沿直线传播这一知识点,要会用所学的物理知识解释有关的自然现象.达到学以致用的目的.1年前查看全部
- (2014•松江区一模)如图所示电路中电源电动势E=3.2V,电阻R=30Ω,小灯泡的额定电压3.0V,额定功率4.5W
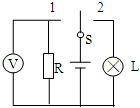 (2014•松江区一模)如图所示电路中电源电动势E=3.2V,电阻R=30Ω,小灯泡的额定电压3.0V,额定功率4.5W,当S接1时,电压表读数3V,当S接到位置2时,小灯泡的发光情况( )
(2014•松江区一模)如图所示电路中电源电动势E=3.2V,电阻R=30Ω,小灯泡的额定电压3.0V,额定功率4.5W,当S接1时,电压表读数3V,当S接到位置2时,小灯泡的发光情况( )
A.很暗,甚至不亮
B.正常发光
C.比正常发光略亮
D.有可能被烧坏 fair1231年前1
fair1231年前1 -
 shb520jy 共回答了19个问题
shb520jy 共回答了19个问题 |采纳率94.7%解题思路:灯泡的电阻不变,发光情况根据实际电流如何变化来判断.当开关接1时,根据闭合欧姆定律,得到电动势与内阻的关系,再根据闭合电路欧姆定律,研究开关接2时,灯泡的电流与额定电流比较,确定发光情况.灯泡的额定电流IL=
PL
IL=
4.5
3A=1.5A,电阻RL=
U2L
PL=
32
4.5Ω=2Ω
当开关接1时,电阻R的电流I=[U/R=
3
30A=0.1A,根据根据闭合电路欧姆定律E=U+Ir=3+0.1r;
当开关接2时,灯泡电流IL′=
3+0.1r
2+r]<1A,小于灯泡的额定电流,实际功率小于额定功率,则灯泡很暗,甚至不亮.故A正确,BCD错误.
故选A点评:
本题考点: 闭合电路的欧姆定律.
考点点评: 本题关键抓住灯泡的电阻不变,比较灯泡明暗变化,把比较实际功率大小,变成比较电流大小就容易了.1年前查看全部
- (2014•松江区二模)正常人体细胞外液酸碱度的变化维持在一个较狭小的范围,通常接近( )
(2014•松江区二模)正常人体细胞外液酸碱度的变化维持在一个较狭小的范围,通常接近( )
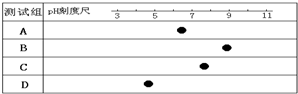
A.A
B.B
C.C
D.D ww_狼1年前1
ww_狼1年前1 -
 wushi123 共回答了15个问题
wushi123 共回答了15个问题 |采纳率100%解题思路:内环境的理化性质主要包括温度、pH和渗透压:
(1)人体细胞外液的温度一般维持在37℃左右;
(2)正常人的血浆接近中性,pH为7.35~7.45.血浆的pH之所以能够保持稳定,与它含有的缓冲物质有关;
(3)血浆渗透压的大小主要与无机盐、蛋白质的含量有关.在组成细胞外液的各种无机盐离子中,含量上占有明显优势的是Na+和Cl-,细胞外液渗透压的90%来源于Na+和Cl-.正常人体细胞外液酸碱度接近中性,如人体血浆pH为7.35~7.45.
故选:C.点评:
本题考点: 内环境的理化特性.
考点点评: 本题知识点简单,考查内环境的理化性质,要求考生掌握内环境的理化性质,尤其是酸碱度,明确正常人细胞外液酸碱度接近中性,再作出准确的判断即可,属于考纲识记层次的考查.1年前查看全部
- (2011•松江区二模)limn→∞(22n+1+222n+1+…+2n2n+1)=______.
 ljb781年前1
ljb781年前1 -
 教九502 共回答了18个问题
教九502 共回答了18个问题 |采纳率88.9%解题思路:利用等比数列求和,求出和后,然后求出表达式的极限.因为[2
2n+1+
22
2n+1+…+
2n
2n+1=
2(1−2 n)/1−2
2n+1]=
2(2n−1)
2n+1;
所以
lim
n→∞(
2
2n+1+
22
2n+1+…+
2n
2n+1)=
lim
n→∞
2(2n−1)
2n+1=2;
故答案为:2.点评:
本题考点: 数列的极限.
考点点评: 本题是基础题,考查数列求和的方法,数列的极限的求法,考查计算能力.1年前查看全部
- 松江区2012届初三英语第一学期期末试卷答案
 lin09161年前2
lin09161年前2 -
 htansyx 共回答了15个问题
htansyx 共回答了15个问题 |采纳率86.7%Part 2 Vocabulary and Grammar
II. 31. B 32. A 33. B 34. B 35. A 36. B 37. C 38. D 39. B 40. C
41. C 42. D 43. A 44. A 45. B 46. D 47. C 48. A 49. B 50. D
III. 51. H 52. F 53. C 54. B 55. G 56. E 57. I 58. A
IV. 59. us 60. teacher 61. easily 62. taller 63. choose 64. wooden 65. success 66. dangerous
V. 67. hasn't, yet 68. Did, send 69. How, long 70. If, don't 71. so, that 72. was, invited 73. when, would
Part 3 Reading and Writing
VI. (A) 74. C 75. C 76. B 77. D 78. D 79. A
(B) 80. C 81. A 82. D 83. C 84. B 85. A
(C) 86. carry 87. loudly 88. news 89. money 90. star 91. other 92. any
(D) 93. It means people don't work in the office but at home.
94. Her job was editing articles for a university.
95. She felt happy.
96. Yes, she did.
97. Because she wasn't going out as much as she did before.
98. Any reasonable answer is ok.
是一模卷吧
希望可以帮到你1年前查看全部
- (2013•松江区二模)如图所示实验装置测定气体摩尔体积,相关叙述正确的是( )
 (2013•松江区二模)如图所示实验装置测定气体摩尔体积,相关叙述正确的是( )
(2013•松江区二模)如图所示实验装置测定气体摩尔体积,相关叙述正确的是( )
A.用CCl4代替水,测得氢气的体积更准确
B.量气管压入漏斗的水过多而溢出,会导致测定失败
C.必须待体系温度降低到0℃时才可进行读数
D.上提水准管,量气管液面高度不断改变,说明装置漏气 zzx6151年前1
zzx6151年前1 -
 tiantang1234 共回答了12个问题
tiantang1234 共回答了12个问题 |采纳率91.7%解题思路:A、根据相似相溶原理作出判断;
B、依据量气管的作用分析判断;
C、实验是常温常压条件下进行的;
D、检查装置气密性原理通常是想办法造成装置不同部位有压强差,并产生某种明显现象,如气泡的生成,水柱生成,液面升降;A、氢气为非极性分子,CCl4为非极性分子,根据相似相溶原理,部分氢气溶在CCl4中,造成测量误差,故A错误;
B、装置中的水有两个作用,封闭量气管内的气体不与大气相通,指示量气管内、漏斗内液面位置,所以溢出对测定无影响,故B错误;
C、锌和硫酸反应是放热反应,必须待体系温度降低到常温时才可进行读数,故C错误;
D、由于此装置属于密闭体系,将水准管上提,造成内外压强不等,静置,若液面高于量气管且不下降,说明装置不漏气,量气管液面高度不断改变,说明装置漏气,故D正确;
故选D.点评:
本题考点: 气体摩尔体积.
考点点评: 本题考查了仪器的创新实用,压强关系的分析应用,量气装置中所用液体一般是水,气体在水中溶解度很小;若气体在水中溶解度较大,可采用其他液体,比如四氯化碳等.1年前查看全部
- (2008•松江区二模)平行四边形ABCD中,若∠B=2∠A,则∠A的度数是______.
 gaohuahuaq1年前0
gaohuahuaq1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•松江区模拟)在等腰Rt△ABC中,∠C=90°,AC=BC,点D在AC边上,DE⊥AB,垂足为E,AD=2D
(2013•松江区模拟)在等腰Rt△ABC中,∠C=90°,AC=BC,点D在AC边上,DE⊥AB,垂足为E,AD=2DC,则S△ADE:S四边形DCBE的值为[2/7][2/7].
 guoshuyan1年前0
guoshuyan1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2009•松江区二模)Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子
(2009•松江区二模)Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小(不包括稀有气体),R、X、Y三种元素的原子核外电子层数相同,同一周期中R的一种单质的熔点最高,Y与Q、R、X、Z均能形成多种常见化合物.
(1)X在周期表中的位置:______,其原子核外有______种不同形状的电子云.这五种元素中,最外层有两个未成对电子的元素是______(用元素符号表示).
(2)ZYQ的电子式是______.
(3)Q分别与X.Y形成的最简单化合物的稳定性______>______(用分子式表示)
(4)Q与R两元素组成的分子构型可能是______(填写序号).
a.直线型b.平面形c.三角锥形d.正四面体
(5)常温下液态化合物甲只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示甲既有氧化性又有还原性2H2O2
2H2O+O2↑MnO2 .2H2O2.
2H2O+O2↑MnO2 . meihuating1年前1
meihuating1年前1 -
 aquarius_zy 共回答了26个问题
aquarius_zy 共回答了26个问题 |采纳率88.5%解题思路:Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小,则Q的原子半径最小,应为H元素,Z的原子半径最大,应为Na元素,R、X、Y三种元素的原子核外电子层数相同,应为同一周期元素,为第而周期元素,第二周期中R的一种单质的熔点最高,则R为C元素,熔点最高的单质为金刚石,Y与Q、R、X、Z均能形成多种常见化合物,则Y为O元素,与其它物质反应形成多种氧化物,根据Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,可知X为N元素,以此解答题中各小问.Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,在短周期的所有元素中Q的原子半径与Z的原子半径之比最小,则Q的原子半径最小,应为H元素,Z的原子半径最大,应为
Na元素,R、X、Y三种元素的原子核外电子层数相同,应为同一周期元素,为第而周期元素,第二周期中R的一种单质的熔点最高,则R为C元素,熔点最高的单质为金刚石,Y与Q、R、X、Z均能形成多种常见化合物,则Y为O元素,与其它物质反应形成多种氧化物,根据Q、R、X、Y、Z是原子序数依次增大的五种短周期元素,可知X为N元素,
(1)X为N元素,位于第二周期第VA族,核外电子排布为1S22S22P3,有S和P两种不同形状的电子云,最外层有两个未成对电子,则最外层的电子排布可能为nP2或nP4,只有C、O两种元素符合,
故答案为:第二周期第VA族;2;C、O;
(2)ZYQ组成的化合物为NaOH,为离子化合物,其电离子式为 ,故答案为:
,故答案为: ;
;
(3)Q分别与X、Y形成的最简单化合物分别为NH3和H2O,元素的非金属性越强,则对应的氢化物的稳定性越强,O元素的非金属性大于N元素的非金属性,则有H2O>NH3,
故答案为:H2O>NH3;
(4)Q与R两元素组成的分子为烃类物质,其中甲烷为正四面体结构,乙烯为平面结构,乙炔为直线形结构,
故答案为:abd;
(5)常温下液态化合物有H2O2和H2O,H2O2分子中原子个数比1:1,在二氧化锰做催化剂条件下发生分解反应生成氧气和水,反应的方程式为2H2O2
MnO2
.
2H2O+O2↑,
故答案为:2H2O2
MnO2
.
2H2O+O2↑.点评:
本题考点: 原子结构与元素周期律的关系;原子核外电子排布.
考点点评: 本题考查原子结构与元素周期律的关系,题目难度不大,正确推断元素的种类是解答本题的关键,要正确把握元素周期律的递变规律.1年前查看全部
- (2010•松江区一模)二氧化钛(TiO2)俗称钛白,是世界上最白的物质之一.二氧化钛中钛元素的化合价为( )
(2010•松江区一模)二氧化钛(TiO2)俗称钛白,是世界上最白的物质之一.二氧化钛中钛元素的化合价为( )
A.-2
B.+2
C.-4
D.+4 东东DBL1年前1
东东DBL1年前1 -
 繁星2002 共回答了21个问题
繁星2002 共回答了21个问题 |采纳率85.7%解题思路:根据物质二氧化钛的化学式TiO2,利用化合物中各元素的化合价代数和为0的原则,由化合物中氧为-2价,计算化合物中钛元素的化合价.设化合物TiO2中钛元素化合价为n价,依化合物中各元素化合价代数和为零的原则,有n+(-2)×2=0,解之得n=+4;
故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 根据化合物中各元素的化合价代数和为0,利用化合物的化学式可计算其中未知的元素化合价.1年前查看全部
- (2011•松江区二模)平面上的光滑平行导轨MN、PQ上放着光滑导体棒ab、cd,两棒用细线系住,开始时匀强磁场的方向如
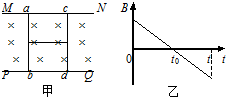 (2011•松江区二模)平面上的光滑平行导轨MN、PQ上放着光滑导体棒ab、cd,两棒用细线系住,开始时匀强磁场的方向如图甲所示,而磁感应强度B随时间t的变化如图乙所示,不计ab、cd间电流的相互作用则细线中张力( )
(2011•松江区二模)平面上的光滑平行导轨MN、PQ上放着光滑导体棒ab、cd,两棒用细线系住,开始时匀强磁场的方向如图甲所示,而磁感应强度B随时间t的变化如图乙所示,不计ab、cd间电流的相互作用则细线中张力( )
A.由0到t0时间内细线中的张力逐渐增大
B.由0到t0时间内两杆靠近,细线中的张力消失
C.由0到t0时间内细线中张力不变
D.由t0到t时间内两杆靠近,细线中的张力消失 ayingying1年前1
ayingying1年前1 -
 2787293 共回答了26个问题
2787293 共回答了26个问题 |采纳率96.2%解题思路:由法拉第电磁感应定律可得出线圈中的电流方向,由楞次定律可判断ab、cd受到的安培力,则可得出张力的变化.0到t0时间内,磁场向里减小,则线圈中磁通量减小,则由楞次定律可得出电流方向沿顺时针,故ab受力向左,cd受力向右,而张力F=BIL,因B减小,故张力将减小,故ABC错误;
由t0到t时间内,线圈中的磁场向外增大,则由楞次定律可知,电流为顺时针,由左手定则可得出,两杆受力均向里,故两杆靠近,细线中张力消失,故D正确;
故选D.点评:
本题考点: 法拉第电磁感应定律;共点力平衡的条件及其应用;安培力;楞次定律.
考点点评: 如果楞次定律的第二种表达掌握好了,本题可以直接利用楞次定律的“来拒去留”进行判断.1年前查看全部
- (2008•松江区二模)在如图所示的○中填入合适的电表符号,使其成为一个正确的电路.
 baixiaoliang1年前0
baixiaoliang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2013•松江区二模)下列有关硝酸盐的说法中正确的是( )
(2013•松江区二模)下列有关硝酸盐的说法中正确的是( )
A.都是强氧化剂
B.受热分解都能生成NO2
C.都是无色晶体
D.溶液都呈中性 调皮小六子1年前1
调皮小六子1年前1 -
 杨明辉yang 共回答了13个问题
杨明辉yang 共回答了13个问题 |采纳率84.6%解题思路:A.最高价的元素只具有氧化性;
B.硝酸盐加热分解不都生成二氧化氮;
C.部分硝酸盐有颜色;
D.强碱的硝酸盐水溶液呈中性,弱碱的硝酸盐其水溶液呈酸性.A.硝酸盐的硝酸根离子中的N元素显最高价,所以硝酸盐具有强氧化性,是强氧化剂,故A正确;
B.不是所有的硝酸盐分解都生成二氧化氮,硝酸钠分解生成亚硝酸盐和氧气,故B错误;
C.不是所有的硝酸盐都是无色晶体,硝酸铜呈蓝色,故C错误;
D.硝酸铜是强酸弱碱盐,其水溶液呈酸性,故D错误;
故选A.点评:
本题考点: 含氮物质的综合应用.
考点点评: 本题考查硝酸盐的性质,难点是判断硝酸盐分解产物,现在教材一般不涉及,难度较大.1年前查看全部
- (2013•松江区一模)已知z∈C,且满足|z|2+(z+.z)i=5+2i.
(2013•松江区一模)已知z∈C,且满足|z|2+(z+
)i=5+2i..z
(1)求z;
(2)若m∈R,w=zi+m,求证:|w|≥1. jerusha171年前1
jerusha171年前1 -
 qqchangheqq 共回答了18个问题
qqchangheqq 共回答了18个问题 |采纳率94.4%解题思路:(1)利用复数模的定义、互为共轭复数的意义及复数相等的定义即可解出;
(2)利用复数模的计算公式即可证明.(1)设z=a+bi(a,b∈R),则|z|2=a2+b2,(z+
.
z)i=2ai,
由|z|2+(z+
.
z)i=5+2i得a2+b2+2ai=5+2i
关键复数相等的定义可得
a2+b2=5
2a=2
解得
a=1
b=2或
a=1
b=−2.
∴z=1+2i或z=1-2i.
(2)当z=1+2i时,|w|=|zi+m|=|(1+2i)i+m|=|−2+i+m|=
(m−2)2+1≥1,
当z=1-2i时,|w|=|zi+m|=|(1−2i)i+m|=|2+i+m|=点评:
本题考点: 复数代数形式的乘除运算;复数求模.
考点点评: 熟练掌握复数模的定义、互为共轭复数的意义及复数相等的定义是解题的关键.1年前查看全部
- 松江区2012物理二模第15题第二空怎么做?原来根本没有变化量,如何比较啊?
松江区2012物理二模第15题第二空怎么做?原来根本没有变化量,如何比较啊?
RT a13521年前1
a13521年前1 -
 chuna012 共回答了18个问题
chuna012 共回答了18个问题 |采纳率88.9%滑动变阻器的滑片P向右移动的过程中,电压表V1 示数的量与电流表A示数的量的比值是滑动变阻器阻值的大小,而电压表V1 示数的变化量与电流表A示数的变化量的比值是滑动变阻器电阻变化值的大小,因滑动变阻器电阻与电阻丝长度成正比,所以不变.1年前查看全部
- (2010•松江区二模)莽草酸(化学式:C7H10O5)是制取抗甲流有效药物奥司他韦(达菲)的基本原料.莽草酸由 ___
(2010•松江区二模)莽草酸(化学式:C7H10O5)是制取抗甲流有效药物奥司他韦(达菲)的基本原料.莽草酸由 ______种元素组成,其摩尔质量是 ______,分子中C、H、O各原子的物质的量比为 ______,其中质量分数最小的元素是 ______;1mol莽草酸中约有 ______个氧原子.
 冰梅子1年前1
冰梅子1年前1 -
 ainana566 共回答了14个问题
ainana566 共回答了14个问题 |采纳率78.6%解题思路:由莽草酸的化学式C7H1005可知,该物质由C、H、O三种元素组成,构成该物质的分子中含有7个C原子、10个H原子和5个O原子;根据物质的化学式,可完成该物质的组成元素种类的判断、摩尔质量的计算、构成中各元素的原子个数比的计算、组成元素的质量分数的计算及一定量的物质中某元素原子个数的推算.由莽草酸的化学式C7H1005可知,该物质由C、H、O三种元素组成;
其摩尔质量=12×7+1×10+16×5=174g/mol;
由莽草酸的化学式C7H1005可知,构成该物质的分子中含有7个C原子、10个H原子和5个O原子,则分子中C、H、O各原子的物质的量比=7:10:5;
组成元素C、H、O的质量比=(12×7):(1×10):(16×5)=42:5:40,则其中质量分数最小的元素是H元素,H元素的质量分数=[1×10/174]×100%≈5.75%;
每个莽草酸分子中含有5个O原子,则1mol莽草酸中O原子的个数=5×6.02×1023个=3.01×1024个;
故答案为:3;174g/mol;7:10:5;H(或氢元素);3.01×1024(或5×6.02×1023).点评:
本题考点: 相对分子质量的概念及其计算;物质的元素组成.
考点点评: 物质的化学式可以表示物质的组成及分子构成,根据物质的化学式可计算相对分子、组成元素质量、组成元素的质量分数等.1年前查看全部
- (2012•松江区a模)用换元法解方程x2−2x−2x2−2x=1时,如设y=x2-2x,则将原方程化为关于y的整式方程
(2012•松江区a模)用换元法解方程x2−2x−
=1时,如设y=x2-2x,则将原方程化为关于y的整式方程是______.2 x2−2x  跟随在风中1年前1
跟随在风中1年前1 -
 ssss 共回答了15个问题
ssss 共回答了15个问题 |采纳率93.3%解题思路:由于方程中含有x2-2x,故设x2-2x=y,代入方程后,把原方程化为整式方程.设52-25=y.
∴y-[2/y]=1,
∴y2-2=y,
∴y2-y-2=0.
故答案为:y2-y-2=0.点评:
本题考点: 换元法解一元二次方程.
考点点评: 此题考查了用换元法解一元二次方程,此题要掌握数学中的换元思想,比较简单.1年前查看全部
- (2014届上海市松江区第一学期期末试题)互为同素异形体的一组物质是 A.氧气和液氧 B.金刚石和石墨 C.一氧化碳和二
(2014届上海市松江区第一学期期末试题)互为同素异形体的一组物质是
A.氧气和液氧 B.金刚石和石墨 C.一氧化碳和二氧化碳 D.水和双氧水  随心的风1年前1
随心的风1年前1 -
 有有成功 共回答了23个问题
有有成功 共回答了23个问题 |采纳率95.7%B
1年前查看全部
- (2013•松江区二模)一体积为0.1×10-3米3的物体完全浸没在水中,求它所受到的浮力.
 vivianlinda1年前1
vivianlinda1年前1 -
 tyqh03 共回答了15个问题
tyqh03 共回答了15个问题 |采纳率100%解题思路:已知物体排开水的体积,利用F浮=ρ液gV排得到受到的浮力.因为物体完全浸没,所以V排=V物=0.1×10-3m3
物体受到的浮力为F浮=ρ液gV排=1.0×103kg/m3×9.8N/kg×0.1×10-3m3=0.98N.
答:物体受到的浮力为0.98N.点评:
本题考点: 阿基米德原理.
考点点评: 此题是关于阿基米德原理应用的基础题目,解决此类问题明确物体体积和排开液体体积的关系是关键.1年前查看全部
- (2013•松江区一模)抗流感的有效药物达菲可用莽草酸(C7H10O5)制取.有关莽草酸的正确说法是( )
(2013•松江区一模)抗流感的有效药物达菲可用莽草酸(C7H10O5)制取.有关莽草酸的正确说法是( )
A.莽草酸由碳、氢、氧三个元素组成
B.每个莽草酸分子里含有5个氢分子
C.莽草酸各元素的质量比为7:10:5
D.莽草酸中碳含量最高 阿飞9161年前1
阿飞9161年前1 -
 kkge2002 共回答了16个问题
kkge2002 共回答了16个问题 |采纳率75%解题思路:物质的化学式可以表示物质的组成和构成,由莽草酸的化学式C7HI0O5可知道该物质的组成元素及构成该物质的分子构成;根据物质的组成可判断物质的组成元素的质量比和各元素的质量分数.A、根据莽草酸的化学式C7HI0O5可知道该物质由C、H、O三种元素组成,不是三个元素,元素不讲个数;故A不正确;
B、根据莽草酸的化学式C7HI0O5可知道,每个莽草酸分子里含有10个氢原子,而莽草酸分子里不含有氢分子;故B不正确;
C、根据莽草酸的化学式C7HI0O5,莽草酸各元素的质量比=(12×7):(1×10):(16×5)≠7:10:5;故C不正确;
D、莽草酸中碳、氢、氧元素质量比为(12×7):(1×10):(16×5)=84:10:80,因莽草酸的化学式量一定,所以根据化合物中元素质量分数公式可知碳元素的质量分数最高,故D正确.
故选D.点评:
本题考点: 化学式的书写及意义;元素质量比的计算;元素的质量分数计算.
考点点评: 构成物质的分子是由原子构成的,分子中含有分子的判断违背了“分子是由原子构成”的事实,一定是错误的判断.1年前查看全部
- (2008•松江区二模)下列化学仪器,能用来直接加热的是( )
(2008•松江区二模)下列化学仪器,能用来直接加热的是( )
A.蒸发皿
B.集气瓶
C.烧杯
D.烧瓶 52105151年前1
52105151年前1 -
 jxz168 共回答了18个问题
jxz168 共回答了18个问题 |采纳率77.8%解题思路:根据实验室中的常用仪器的用途与使用方法解答.A、蒸发皿:用于溶液蒸发或浓缩.能耐高温,但不能骤冷,液体量多时可直接在火焰上加热蒸发.液体量少或粘稠时,要隔着石棉网加热.故本选项正确;
B、集气瓶:集气瓶用于收集或储存少量气体,所以它不能被加热使用.故本选项错误;
C、烧杯:烧杯不能直接燃烧,需要垫石棉网,故本选项错误;
D、烧瓶:用于加热时,应放在石棉网上加热,使其受热均匀,故本选项错误;
故选A.点评:
本题考点: 用于加热的仪器.
考点点评: 本题主要考查了实验室常用于加热的仪器.解答此题时,需要注意:有的仪器能用于加热,有的仪器不能用于加热;有的仪器能直接加热(如试管、蒸发皿、坩埚和燃烧匙),有的仪器需垫上石棉网才能用于加热(如烧杯、烧瓶、锥形瓶);有的仪器也可用于直接加热、也可用于隔着石棉网加热(如蒸发皿).1年前查看全部
- (2012•松江区一模)如图是实验室制取气体的常用装置.
(2012•松江区一模)如图是实验室制取气体的常用装置.
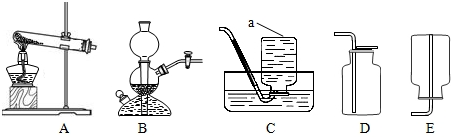
①写出仪器a的名称:a______.
②用氯酸钾和二氧化锰的混合物制取O2可选择的装置组合是______(只写一组).
③实验室用B装置可制CO2气体,反应的化学方程式为:______.B装置图示的是反应______(填“发生”或“停止”).用二氧化锰和双氧水混合制氧气时,
______(填“能”或“不能”)用B装置,理由是______.
④取相同质量的粉末碳酸钙和块状碳酸钙分别与相同质量的稀盐酸在烧杯中混合,绘制出烧杯内物质总质量随反应时间的变化情况,如图所示,则粉末碳酸钙和盐酸反应所对应的曲线是______(填“①”或“②”).
⑤50g过氧化氢溶液和3g MnO2充分反应后,剩余物质52.2g,则产生氧气的质量是______克.
Ⅰ、求参加反应的过氧化氢的物质的量?(写计算过程)
Ⅱ、求过氧化氢溶液溶质的质量分数?(写计算过程)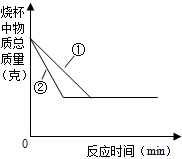
 无著心1年前1
无著心1年前1 -
 Aban00 共回答了23个问题
Aban00 共回答了23个问题 |采纳率87%解题思路:①根据仪器特点判断仪器名称;
②根据反应物状态和反应条件选择发生装置,根据气体的密度和溶解性选择收集装置;
③奇普发生器适合块状固体和液体在常温下反应,并可控制反应速度;
④从影响化学反应速率因素分析,反应物的接触面积越大,反应越快;
⑤根据质量守恒定律求出氧气的质量,根据化学方程式,可求出过氧化氢的物质的量,从而可求出溶液的质量分数.①仪器a名称为:集气瓶;
②氯酸钾和二氧化锰都是固体,反应条件是加热,发生装置选择A,氧气不易溶于水,密度比空气大,可用排水法或向上排空气法收集,故装置选择A,C或A,D;
③装置B适合块状固体和液体常温下反应,并可控制反应速度,可制取二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;B装置图示的反应发生;因为二氧化锰为粉末状固体,
用二氧化锰和双氧水混合制氧气时不能选用装置B;
④同质量的碳酸钙与相同质量的稀盐酸反应时,块状比粉末状固体和盐酸的接触面积小,反应速率慢;所以粉末状反应比较快,斜率大,所以粉末碳酸钙和盐酸反应所对应的曲线是②;
⑤根据质量守恒定律可知:产生氧气的质量=50g+3g-52.2g=0.8g;
Ⅰ、氧气的物质的量=0.8g÷32g/mol=0.025mol;
设生成0.025mol氧气需要过氧化氢的物质的量为x
2H2O2
MnO2
.
2H2O+O2↑
2 1
x 0.025mol
[2/x=
1
0.025mol]
x=0.05 mol;
Ⅱ、H2O2质量为:0.05×34=1.7(g)
H2O2质量分数=[1.7/50]×100%=3.4%.
故答案为:①集气瓶;
②A,C(或A,D);
③CaCO3+2HCl═CaCl2+H2O+CO2↑;发生,不能,二氧化锰是粉末状固体;
④②;
⑤0.8克;
氧气的物质的量=0.8g÷32g/mol=0.025mol;
设生成0.025mol氧气需要过氧化氢的物质的量为x
2H2O2
MnO2
.
2H2O+O2↑
2 1
x 0.025mol
[2/x=
1
0.025mol]
x=0.05 mol;
Ⅱ、H2O2质量为:0.05×34=1.7(g)
H2O2质量分数=[1.7/50]×100%=3.4%.点评:
本题考点: 常用气体的发生装置和收集装置与选取方法;氧气的制取装置;氧气的收集方法;二氧化碳的实验室制法;有关溶质质量分数的简单计算;根据化学反应方程式的计算.
考点点评: 明确气体的发生装置和收集装置选择依据,会根据化学方程式进行计算,在了解影响反应速率的因素的基础上,理解函数图象表示的意义,要能比较两种曲线表示的速率快慢和质量大小.1年前查看全部
- (g008•松江区二模)在如图装置你,光屏上恰能成一个清晰九像,则这个像一定是______(选填“放大”或“缩小”)九.
 (g008•松江区二模)在如图装置你,光屏上恰能成一个清晰九像,则这个像一定是______(选填“放大”或“缩小”)九.若将蜡烛向远离凸透镜方向移动,则光屏应向______(选填“左”或“上”)移动时,才能再次在光屏上呈现清晰九像.
(g008•松江区二模)在如图装置你,光屏上恰能成一个清晰九像,则这个像一定是______(选填“放大”或“缩小”)九.若将蜡烛向远离凸透镜方向移动,则光屏应向______(选填“左”或“上”)移动时,才能再次在光屏上呈现清晰九像.  mengchongguohe1年前1
mengchongguohe1年前1 -
 为你不花 共回答了20个问题
为你不花 共回答了20个问题 |采纳率80%(1)m图,像距大于物距,凸透镜成倒立、放大的实像,
若将蜡烛向远离凸透镜方向移动,物距要增大,像距要减小.因此光屏应向左移动时,才能再次在光屏上呈现清晰的像.
故答案为:放大;左.1年前查看全部
- (2007•松江区)选做题:(1)0.2mol锌含有 ______个锌原子.
(2007•松江区)选做题:(1)0.2mol锌含有 ______个锌原子.
(2)若将0.2mol锌将放入足量的稀硫酸溶液中完全反应,则可生成氢气多少mol?(根据化学方程式列式计算). csilj1年前1
csilj1年前1 -
 NonlinearMan 共回答了20个问题
NonlinearMan 共回答了20个问题 |采纳率85%解题思路:(1)根据1mol的任何物质所含有的该物质的微粒数为6.02×1023个,计算0.2mol锌中所含锌原子数;
(2)根据反应的化学方程式,由反应消耗锌的物质的量可计算生成氢气的物质的量.(1)0.2mol锌含有锌原子=0.2mol×6.02×1023=1.204×1023
故答案为:1.204×1023;
(2)设能生成氢气xmol
Zn+H2SO4=ZnSO4+H2↑
1 1
0.2mol x
[1/1 =
0.2mol
x]
x=0.2mol
答:可生成氢气0.2mol.点评:
本题考点: 根据化学反应方程式的计算.
考点点评: 利用反应的化学方程式表示物质的量的关系,根据反应中某一物质的物质的量可计算反应中其它任何物质的物质的量.1年前查看全部
- (2012•松江区一模)如图为“某地(30°N,120°E)及附近地区大气水平运动俯视示意图”.完成19--21题.
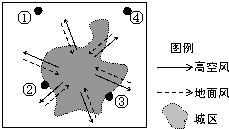 (2012•松江区一模)如图为“某地(30°N,120°E)及附近地区大气水平运动俯视示意图”.完成19--21题.
(2012•松江区一模)如图为“某地(30°N,120°E)及附近地区大气水平运动俯视示意图”.完成19--21题.
19.该地区大气运动系统属于( )
20.影响该环流强弱的主要因素是( )
21.①②③④四地中,最适宜布局钢铁厂的是( )
A.①
B.②
C.③
D.④ kobeyzn1年前1
kobeyzn1年前1 -
 珠珠哦 共回答了12个问题
珠珠哦 共回答了12个问题 |采纳率75%解题思路:(1)热力环流的过程为近地面温度高气体膨胀上升形成低压,高空形成高压;温度低气体收缩下沉形成高压,高空形成低压;大气在水平方向上从高压流向低压,从而形成热力环流.城市风,近地面从郊区吹向城市.
(2)城市由于交通、工业、人口密集等因素排放大量热量,导致城市温度高于农村,即为城市热岛效应.
(3)(30°N,120°E)位于我国东部沿海,盛行东南风和西北风.钢铁厂属于有大气污染的工业企业,应布局在热力环流范围之外,可以排除②和③;该地区位于我国东部沿海,盛行东南风和西北风,有污染的工业企业应布局在盛行风向垂直的郊外,可以排除①;最适宜布局钢铁厂的是④.
故选:D.点评:
本题考点: 大气的受热过程.
考点点评: 本题难度适中,属于知识性试题,解题的关键是掌握热力环流和盛行风向的相关知识.1年前查看全部
- (2014•松江区一模)体积为4×10-3米3的金属块浸没在水中,求金属块受到的浮力F浮.
 David01151年前1
David01151年前1 -
 nanfanglang_2001 共回答了26个问题
nanfanglang_2001 共回答了26个问题 |采纳率92.3%解题思路:知道金属块的体积,并且浸没在水中,求出排开水的体积,利用阿基米德原理求金属块受到水的浮力.∵金属块浸没在水中,
∴V排=V物=4×10-3m3,
F浮=ρ水gV排=1×103kg/m3×9.8N/kg×4×10-3m3=39.2N.
答:金属块受到的浮力为39.2N.点评:
本题考点: 阿基米德原理.
考点点评: 本题考查了学生对阿基米德原理的掌握和运用,利用好隐含条件“物体浸没时,V排=V物”是本题的关键.1年前查看全部
- (2014•松江区二模)某学校高一、高二、高三共有2400名学生,为了调查学生的课余学习情况,拟采用分层抽样的方法抽取一
(2014•松江区二模)某学校高一、高二、高三共有2400名学生,为了调查学生的课余学习情况,拟采用分层抽样的方法抽取一个容量为120的样本.已知高一有820名学生,高二有780名学生,则在该学校的高三应抽取______名学生.
 duoduocherry1年前1
duoduocherry1年前1 -
 chjhenry 共回答了16个问题
chjhenry 共回答了16个问题 |采纳率93.8%解题思路:根据分层抽样的定义即可得到结论.∵高一有820名学生,高二有780名学生,
∴高三有2400-820-780=800名学生,
用分层抽样的方法抽取一个容量为120的样本,则高三应抽取
800
2400×120=40人,
故答案为:40;点评:
本题考点: 分层抽样方法.
考点点评: 本题主要考查分层抽样的应用,比较基础.1年前查看全部
- 2014松江区初三英语二模答案
 FlyXia1年前1
FlyXia1年前1 -
 就剩cc了 共回答了22个问题
就剩cc了 共回答了22个问题 |采纳率77.3%http://wenku.baidu.com/link?url=QFjwpA-7rMLSOtC-vfoYU2ASc-R6dt8shroFY0DPTzdXFjt5OO8DXRG2ykL81Va_acBmWSnBpIS3_yA-l00uKSgHFUsRkNnaw2SA7IyHZBK1年前查看全部
- (2007•松江区模拟)如图所示为2006年世界杯期间,设在慕尼黑“IBC”大厅的大理石足球雕塑“团队之星”.其底座质量
 (2007•松江区模拟)如图所示为2006年世界杯期间,设在慕尼黑“IBC”大厅的大理石足球雕塑“团队之星”.其底座质量约为2200千克,其上部为大理石实心足球,体积约为3米3,若雕塑底座与地面的接触面积为2米2,大理石密度为2.6×103千克/米3.求:
(2007•松江区模拟)如图所示为2006年世界杯期间,设在慕尼黑“IBC”大厅的大理石足球雕塑“团队之星”.其底座质量约为2200千克,其上部为大理石实心足球,体积约为3米3,若雕塑底座与地面的接触面积为2米2,大理石密度为2.6×103千克/米3.求:
(1)该“足球”的质量;
(2)雕塑对地面的压力和压强. 从公主坟到六部口1年前1
从公主坟到六部口1年前1 -
 布衣十四少 共回答了19个问题
布衣十四少 共回答了19个问题 |采纳率89.5%解题思路:(1)已知密度与体积,由密度公式的变形公式可以求出足球的质量.
(2)雕塑对地面的压力等于它的重力,由压强公式求求出它对地面的压强.(1)∵ρ=[m/V],
∴足球的质量:
m球=ρV=2.6×103kg/m3×3m3=7800kg;
(2)雕塑对地面的压力:
F=G=mg
=(7800kg+2200kg)×9.8N/kg=9.8×104N;
雕塑对地面的压强:
p=[F/S]=
9.8×104N
2m2=4.9×104Pa;
答:(1)该“足球”的质量7800kg;
(2)雕塑对地面的压力为9.8×104N,压强为4.9×104Pa.点评:
本题考点: 密度公式的应用;压强的大小及其计算.
考点点评: 本题考查了求质量、压力与压强问题,应用密度公式、压强公式即可正确解题.1年前查看全部
- (2012•松江区二模)计算:2-2=[1/4][1/4].
 夜侵城1年前1
夜侵城1年前1 -
 天狗蚀月 共回答了22个问题
天狗蚀月 共回答了22个问题 |采纳率77.3%解题思路:根据负整数指数幂的定义求解:a-p=
(a≠0,p为正整数)1 ap 2-2=[1
22=
1/4],
故答案为[1/4].点评:
本题考点: 负整数指数幂.
考点点评: 本题考查了负整数指数幂的定义,解题时牢记定义是关键,此题比较简单,易于掌握.1年前查看全部
大家在问
- 1就划线部分提问1.The students can (plant flowers)can the student 2.T
- 2用成语写一段话:骄阳似火、挥汗如雨、欢天喜地、手舞足蹈、情不自禁、神采飞扬
- 3已知△ABC的三边为A.B.C.且满足A+4/3=B+3/2=C+8/4.且A+B+C=12.请问△ABC的形状是?
- 4一个正方体中有多少个平行线段?
- 5如图,将直角三角形ABC沿射线BC的方向平移得到三角形DEF.设图中,AB=8,BE=5,GE=5,求图中阴影部分的面积
- 6日历中20怎么读
- 7一道水管工程奥数题一个水池有甲、乙两个进水管,单开甲管1/6小时能住满水池,单开乙管1/10小时注满水池,如果甲、乙两管
- 8了解科学家探索科学奥秘的故事,能激励同学们更好地学好物理知识,掌握科学方法.
- 9全集为实数集R,集合A={x2+3x+4=0},则CRA=
- 10数论证明,关于质数若2^n+1是质数(n>1),则n是2的方幂!
- 11(10分)阅读材料,回答问题。材料一:河北正定中学的文化活动 材料二:河北正定中学的新课改 请简
- 12lim(x→0)[(3次根号下1+sinx)-1]/ln(1+x+x^2)
- 13关于科罗拉多州的政府~SOS!I want to kown the government of Colorado.(th
- 14冰心认为童年“是回忆是含泪的微笑”的理解
- 15已知R1=R2=R4=5欧,R3=10欧,E=12V,用戴维宁定理求|L
