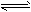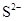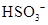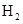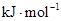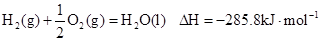电离方程式中哪些种类的物质是不拆开来的?
 Weiven2022-10-04 11:39:541条回答
Weiven2022-10-04 11:39:541条回答我记得有好几样 我记不得了 帮我罗列一下要齐全!

已提交,审核后显示!提交回复
共1条回复
 qqm_lw 共回答了21个问题
qqm_lw 共回答了21个问题 |采纳率81%- 所有的单质、氧化物、沉淀、气体,还有弱酸、弱碱等弱电解质
- 1年前
相关推荐
- 高中化学求解,盐类水解问题.判断用水解方程式还是用电离方程式分析问题,是否根据该盐的酸碱性判断主要用哪条?(当然若是酸式
高中化学求解,盐类水解问题.
判断用水解方程式还是用电离方程式分析问题,是否根据该盐的酸碱性判断主要用哪条?(当然若是酸式就另当别论)
我指的水解与电离不是指整个盐(可溶盐完全电离),是特指发生水解的离子。 彭老七1年前3
彭老七1年前3 -
 __云淡风轻__ 共回答了13个问题
__云淡风轻__ 共回答了13个问题 |采纳率76.9%嗯.
比如碳酸氢钠,如果它电离大于水解,那样它就应该显酸性哦.
再比如亚硫酸氢钠,就是显酸性,它就是电离大于水解的.
一般题会告诉你这两个酸碱反映后溶液PH,通过这就可以判断盐的酸碱性,也可以判断电离和水解的关系咯1年前查看全部
- 1.碳酸钠在水中的电离方程式 2.硫酸 3.硝酸 4.硝酸铜 5.碳酸氢钙 6.硝酸铵 7.硫酸铝 8.高锰酸钾 9.氯
1.碳酸钠在水中的电离方程式 2.硫酸 3.硝酸 4.硝酸铜 5.碳酸氢钙 6.硝酸铵 7.硫酸铝 8.高锰酸钾 9.氯酸钾 10.氢氧化钙 11.磷酸钠 12.硝酸钡 13 氯化铁 14.氯化铵
 wyjie20021年前1
wyjie20021年前1 -
 liulimei 共回答了23个问题
liulimei 共回答了23个问题 |采纳率82.6%1.Na2CO3==2Na++HCO3- 2.H2SO4==2H++SO42- 3.HNO3==H++NO3- 4.Cu(NO3)2==Cu2++2NO3- 5.Ca(HCO3)2==Ca2++2HCO3- 6.NH4NO3==NH4++NO3- 7.Al2(SO4)3==2Al3++3SO42- 8.KMnO4==K++MnO4- 9.KCl==K++Cl- 10.Ca(OH)2==Ca2++2OH- 11.Na3PO4==3Na++PO43- 12.Ba(NO3)2==Ba2++2NO3- 13.FeCl3==Fe3++3Cl- 14.NH4Cl==NH4++Cl-1年前查看全部
- 酸的电离方程式H该怎么处理强酸和弱酸 一元酸和多元酸的
 nancy-lee1年前1
nancy-lee1年前1 -
 adibif 共回答了25个问题
adibif 共回答了25个问题 |采纳率88%给你几个方程式:
多元强酸:H2SO4 = 2H+ + SO42-
多元弱酸:H2CO3 =可逆= H+ HCO3-
HCO3- =可逆= H+ + CO32-
一元强酸:HNO3 = H+ + NO3-
一元弱酸:HAc =可逆= H+ + Ac-1年前查看全部
- 睡谁能给一份高中电解质列表以及化学符号还有电离方程式(包括弱电解质 强电解质等等)求大神们帮忙,
睡谁能给一份高中电解质列表以及化学符号还有电离方程式(包括弱电解质 强电解质等等)求大神们帮忙,
睡谁能给一份高中电解质列表以及化学符号还有电离方程式(包括弱电解质 强电解质等等)求大神们帮忙,我会给最全的一位 上ff飞雪8881年前1
上ff飞雪8881年前1 -
 annliu 共回答了15个问题
annliu 共回答了15个问题 |采纳率93.3%如果都给你列表,你会看的眼花,做题的时候查表也会头疼,给你说一下规律吧,很好记的.化学课本后面都有“难溶物、不溶物”表.可以看出:“固体是不可以电离的”表中对固体不做解释.一、不能电离部分:必须要记住的几种(碳酸钡、碳酸钙、硫酸钡、氯化银等不溶)(记不全了见谅),这部分在方程式中是不能电解的,在任何方程式中不能拆开.二、部分电离部分:1、部分微溶物(例如:硫酸银、硫酸钙等微溶物,注意:所有的带银离子的盐不是难溶就是微溶),这部分电解比例非常少,方程式中不可以拆开.2、弱酸(例如:次氯酸、草酸等)如果是弱酸盐,可以电解,方程式中拆成离子,如果是弱酸,电解非常少,方程式中不可以拆开.3、部分强酸(浓硫酸、浓硝酸)在浓度达到一定程度时是难发生化学反应的.(这部分能不能电解请教你们的老师吧,我记不清楚了.)三、完全电离部分:
除去不溶物和微溶物,金属离子对应的物质‘绝大部分’是完全电离,比如Na+、K+等.1年前查看全部
- 电离方程式和水解方程式的区别RT
 xueyiyou1年前1
xueyiyou1年前1 -
 tyflwq 共回答了15个问题
tyflwq 共回答了15个问题 |采纳率73.3%一个是电离,一个是水解..除了都是方程式,没共同点...1年前查看全部
- 过氧化氢的酸碱性?如果是电解质的话写出在水中的电离方程式得到氢离子?H2O2==H+ 和 H2O?MS配不平……
 只想找个人吧1年前5
只想找个人吧1年前5 -
 SuedeskY 共回答了17个问题
SuedeskY 共回答了17个问题 |采纳率88.2%H2O2=可逆=H++HO2-
H2O2有微弱的酸性,存在电离常数1年前查看全部
- 帮写几个电离方程式1氢氧化铝与盐酸反应2氢氧化铝与氢氧化钠3氢氧化铝与二氧化碳与水反应4铝与盐酸5铝与氢氧化钠6氧化铝与
帮写几个电离方程式
1氢氧化铝与盐酸反应2氢氧化铝与氢氧化钠3氢氧化铝与二氧化碳与水反应4铝与盐酸5铝与氢氧化钠6氧化铝与盐酸7氧化铝与氢氧化钠8氯化铝与氨水 aa大队aa1年前1
aa大队aa1年前1 -
 炽烈的绿炎 共回答了13个问题
炽烈的绿炎 共回答了13个问题 |采纳率84.6%1.OH- + H+ =H2O
2.这个、反应么?、...
3.6(OH)- +3CO2=3(CO3)2- +3H2O
4.2Al+6H-=2Al3- +3H2
5.不反映把...
6.AL2O3 + 6H+ AL(OH)3(沉淀) + 3 NH4
不清楚的话 M我把1年前查看全部
- 硫化氢钾的电离方程式怎么写?
 hbzxb1年前0
hbzxb1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 氯化铵溶于水的电离方程式
 跳跳青丝1年前2
跳跳青丝1年前2 -
 楼主事砣史 共回答了17个问题
楼主事砣史 共回答了17个问题 |采纳率94.1%NH4Cl=NH4+ + Cl-1年前查看全部
- 碳酸钠加入到稀盐酸中,求电离方程式
 阿ken19851年前5
阿ken19851年前5 -
 小羽飞飞 共回答了18个问题
小羽飞飞 共回答了18个问题 |采纳率94.4%电离方程式?是离子方程式吧.
2H+ +CO3 2-=H2O+CO2↑
化学方程式是Na2CO3+2HCl=2NaCl+H2O+CO2↑1年前查看全部
- 强电解质的电离方程式是离子方程式吗?
强电解质的电离方程式是离子方程式吗?
如:NaCl=Na+ +Cl-
NaHSO4=Na+ +H+ +SO42- chachafei1年前1
chachafei1年前1 -
 _sfns526el2_4d4 共回答了21个问题
_sfns526el2_4d4 共回答了21个问题 |采纳率90.5%是 有离子参与的反应1年前查看全部
- 运用相关原理,回答下列各小题:Ⅰ.已知NaHSO4在水中的电离方程式为 NaHSO4=Na++H++SO42-.(1)在
运用相关原理,回答下列各小题:
Ⅰ.已知NaHSO4在水中的电离方程式为 NaHSO4=Na++H++SO42-.
(1)在NaHSO4溶液中c(H+)______ c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7.
(2)将20mLpH=2的NaHSO4溶液逐滴加入到20mL 0.1mol•L-1Na2CO3溶液中,溶液中发生反应的离子方程式为:______;向此反应后的溶液中滴加0.001mol•L-1BaCl2溶液,首先析出的沉淀是______.[KSP(BaSO4)=1.1×10-10mol2•L-2;KSP(BaCO3)=5.1×10-9mol2•L-2]
Ⅱ.(1)工业上电解硫酸锌溶液可实现电解法炼锌(控制条件,使H+难放电、阳极电极不溶解).写出相关的电解化学方程式:2ZnSO4+2H2O
2Zn+O2↑+2H2SO4通电 .2ZnSO4+2H2O.
2Zn+O2↑+2H2SO4通电 .
(2)将干净的铁片浸在熔化的液体锌里可制得热镀锌铁板,这种铁板具有很强的耐腐蚀能力.镀锌铁板的镀锌层一旦被破坏后,锌将作为原电池的______极发生______反应而损耗,铁受到保护. darkmn1年前1
darkmn1年前1 -
 xuziyue 共回答了19个问题
xuziyue 共回答了19个问题 |采纳率94.7%解题思路:Ⅰ、(1)根据溶液中的电荷守恒以及硫酸氢钠与氢氧化钡溶液之间的反应来分析;
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,根据Ksp的含义进行计算;
Ⅱ、(1)根据电解池的工作原理来书写电解方程式;
(2)在原电池中,活泼金属做负极,发生失电子的氧化反应.Ⅰ.(1)根据NaHSO4=Na++H++SO42-,在硫酸氢钠中存在电荷守恒:c(Na+)+c(H+)=2c(SO42-)+c(OH-),因为c(Na+)=c(SO42-),所以c(H+)=c(OH-)+c(SO42-),用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则氢氧化钡中的氢氧根过量,溶液显碱性,pH>7,故答案为:=;>;
(2)碳酸根离子和少量的氢离子反应生成碳酸氢根,不放二氧化碳,即CO32-+H+═HCO3-,向此反应后的溶液中滴加
0.001mol•L-1BaCl2溶液,根据Ksp的含义:越小,越易生成沉淀,所以首先析出的沉淀BaSO4,
故答案为:CO32-+H+═HCO3-;BaSO4;
Ⅱ.(1)电解硫酸锌的原理方程式为:2ZnSO4+2H2O
通电
.
2Zn+O2↑+2H2SO4,
故答案为:2ZnSO4+2H2O
通电
.
2Zn+O2↑+2H2SO4;
(2)镀锌铁板的镀锌层一旦被破坏后,较活泼金属锌将作为原电池的负即,发生失电子的氧化反应,
故答案为:负;氧化.点评:
本题考点: 电解质在水溶液中的电离;电极反应和电池反应方程式;难溶电解质的溶解平衡及沉淀转化的本质;离子浓度大小的比较.
考点点评: 本题考查了学生:电解质的电离、沉淀溶解平衡常数以及原电池的电解池的电极方程式的书写,属于综合知识的考查,难度较大.1年前查看全部
- 用离子方程式或电离方程式表示其显酸碱性的原因
用离子方程式或电离方程式表示其显酸碱性的原因
NaHSO4 NaHCO3 KAL(SO4)2 CuSO4 H2S Na2S NH4NO3
 桃花生1年前1
桃花生1年前1 -
 lkjnpoi 共回答了14个问题
lkjnpoi 共回答了14个问题 |采纳率85.7%NaHSO4===Na+ +H+ +SO42-
HCO3-+H2O===H2CO3+OH-
Al3++3H2O===Al(OH)3+3H+
CuSO4===Cu2++SO42-
H2S===H++HS-
S2-+H2O===HS-+OH-
NH4++H2O====NH3.H2O+H+1年前查看全部
- 某二元酸(化学式用H 2 A表示)在水中的电离方程式是:H 2 A H + +HA - ,HA - H + +A 2-
某二元酸(化学式用H 2 A表示)在水中的电离方程式是:H 2 A 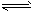 H + +HA - ,HA -
H + +HA - ,HA - 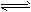 H + +A 2- ,
H + +A 2- ,
回答下列问题:
(1)Na 2 A溶液呈________(填“酸性”、“中性”或“碱性”),理由是:_______________________
(用离子方程式说明) NaHA溶液呈________(填“酸性”、“中性”或“碱性”),理由是:________________________。
(2)已知0.1mol/LNaHA溶液的pH=2,则0.1mol/L的H 2 A溶液中氢离子的物质的量浓度________0.11mol/L(填“<”、“>”或“==”)理由是:______________________________。
(3)0.1mol/LNaHA溶液中各种离子浓度由大到小的顺序是:________________________ 32byk1年前1
32byk1年前1 -
 mi258721877 共回答了10个问题
mi258721877 共回答了10个问题 |采纳率90%1年前查看全部
- 下列电离方程式书写不正确的是( )
下列电离方程式书写不正确的是( )
A.2H2O⇌H3O++OH-
B.H2S⇌H++HS-
C.NaHCO3⇌Na++HCO3-
D.HCO3-+H2O⇌H3O++CO32- 快递员是我1年前1
快递员是我1年前1 -
 iamwang 共回答了16个问题
iamwang 共回答了16个问题 |采纳率93.8%解题思路:A、水是弱电解质,用可逆符号;
B、多元弱酸电离分步完成,以第一步为主;
C、多元弱酸盐的电离强中有弱;
D、多元弱酸的酸式根离子的电离,电离出的氢离子与水生成水合氢离子.A、水是弱电解质,用可逆符号,电离出的氢离子与水形成水合氢离子,正确的电离方程式为2H2O⇌H3O++OH-,故A不选;
B、多元弱酸电离分步完成,以第一步为主,正确的电离方程式为H2S⇌H++HS-,故B不选;
C、多元弱酸盐的电离强中有弱,作盐是完全电离,正确的电离方程式为NaHCO3═Na++HCO3-,故选C;
D、多元弱酸的酸式根离子的电离,电离出的氢离子与水生成水合氢离子,正确的电离方程式为HCO3-+H2O⇌H3O++CO32-,故D不选;
故选C.点评:
本题考点: 电离方程式的书写.
考点点评: 本考电离方程的书写,学生只要掌握电离方程书写的一规律,就能迅速解题了.1年前查看全部
- 溶于水能电离出氢离子的一定是酸对错?举反例再写下电离方程式,
 小冰冰291年前3
小冰冰291年前3 -
 李家丢丢 共回答了15个问题
李家丢丢 共回答了15个问题 |采纳率93.3%不对.NaHSO4在水溶液中也能电离出H+,但它是酸式盐
NaHCO3==Na+ + HCO3-==NA+ +H+ +CO32-1年前查看全部
- 下列说法或表示正确的是( )A.次氯酸的电离方程式:HClO⇌H++ClO-B.只有熵增加的过程才能自发进行C.HS-
下列说法或表示正确的是( )
A.次氯酸的电离方程式:HClO⇌H++ClO-
B.只有熵增加的过程才能自发进行
C.HS-水解离子方程式:HS-+H2O⇌H3O++S2-
D.已知中和热为57.3kJ•mol-1,稀硫酸与氢氧化钠稀溶液反应的热化学方程式:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6 kJ•mol-1 59551301年前1
59551301年前1 -
 冲冠一怒为了钱 共回答了14个问题
冲冠一怒为了钱 共回答了14个问题 |采纳率92.9%解题思路:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式,离子所带电荷数一般可根据它们在化合物中的化合价来判断,所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等.A、次氯酸是弱电解质,存在电离平衡,电离方程式为HClO⇌H++ClO-,故A正确;
B、△G=△H-T△S,如果△G<0 反应可以自发进行,反之则不可以自发进行,如果熵减小,放热反应中且满足△G<0,反应能够自发进行,故B错误;
C、HS-水解结合水电离的氢离子,溶液显示碱性,正确的水解方程式为HS-+H2O⇌OH-+H2S,故C错误;
D、已知中和热为57.3kJ•mol-1,氢离子和氢氧根离子生成1mol液态水放出57.3kJ热量,生成2mol水,放出热量为114.6kJ热量,故D正确;
故选:AD.点评:
本题考点: 电离方程式的书写;离子方程式的书写;热化学方程式.
考点点评: 本题考查学生电离方程式的正误判断方法,是现在考试的热点,注意常见的书写错误的归纳,本题难度不大.1年前查看全部
- 高一化学电离方程式总结 要全
 向日葵的味道1年前1
向日葵的味道1年前1 -
 kksogerxxx 共回答了17个问题
kksogerxxx 共回答了17个问题 |采纳率88.2%离子方程式的书写是中学化学的重要内容之一.要正确书写好离子方程式,必须弄清哪些反应属于离子反应,哪些物质应写分子式.
凡是电解质在水溶液中的反应都属离子反应.也就是说,只要反应是在水中进行的,且反应物中至少有一种是电解质,这样的反应就属于离子反应.如;金属钠与水的反应,既是在水中的反应,反应物中水又属电解质,所以该反应属于离子反应,其离子方程式为:2Na + 2H2O = 2Na+ + 2OH- + H2↑.值得注意的是,浓硫酸和一些固体的反应不属离子反应.因为浓硫酸(98.3%以上)中的水极少,不能算是水溶液,且H2SO4在这种情况下多以分子形式存在,几乎无H+和SO42-,另一方面,固态物质在没有水的情况下也不能电离出离子.所以,这类反应通常不属离子反应.
难溶(或微溶)性物质、难电离的物质、挥发性物质、单质、氧化物等都要写成分子式.
难溶性物质较多,化学课本后面的附录"部分酸、碱和盐的溶解性表"中已列出了不少,这里不再重述.微溶物Ca(OH)2在水中的存在形态问题值得注意:在澄清石灰水中,Ca(OH)2是以Ca2+离子和OH-离子的形式存在,在书写离子方程式时应写成离子形式;若是氢氧化钙悬浊液(石灰乳),Ca(OH)2多以分子形式存在于溶液中所以在书写离子方程式时应写分子式.
难电离的物质,包括一些弱酸、弱碱及其水等弱电解质.如:HClO、HF(氢氟酸)、H2SO3、H3PO4、H2S(氢硫酸)、H2SiO3、NH3oH2O.可溶性盐类,一般说来属易电离的物质,但也有少数可溶性盐难电离,如:Fe(SCN)3、(CH3COO)2Pb等.可溶性盐类中的酸式盐在拆写成离子时,应注意其酸式根离子一般是难电离的,不能进一步拆分,如:NaHCO3只能拆写成 Na+和HCO3- ,
而不能拆写成 Na+、H+和CO32- ,因为HCO3- 离子是难电离的物质.其它难电离的物质还有水、苯酚等等.
挥发性物质,一般是指常温下沸点较低的气态物质.如:Cl2、CO2、SO2、H2S、NH3等.
单质、氧化物也很多,这里不一一列举.
综上所述,凡是电解质在水溶液中的反应都属离子反应,也就是说只要同时满足在水中进行且反应物中至少有一种是电解质的反应即为离子反应;书写离子方程式时,难溶(或微溶)性物质、难电离的物质、挥发性物质、单质、氧化物等都要写成分子式.
有些离子反应,它的离子方程式和化学方程式一样,没有离子符号出现.1年前查看全部
- Ca(HCO3)2的电离方程式
 erickson0201年前1
erickson0201年前1 -
 shuiciwawa 共回答了17个问题
shuiciwawa 共回答了17个问题 |采纳率100%Ca(HCO3)2==Ca2+ + 2HCO3-
HCO3-=可逆符号=H+ + CO3(2-)
()内是上角标1年前查看全部
- 化学电离方程式,写出下列各电解质的电离方程式:1 NH3·H2O2 CH3COOH3 Ca(OH)24 H2CO35 A
化学电离方程式,
写出下列各电解质的电离方程式:
1 NH3·H2O
2 CH3COOH
3 Ca(OH)2
4 H2CO3
5 AL2(SO4)3
写出NaHCO3在水溶液中的电离方程式 精彩山鸡故事1年前1
精彩山鸡故事1年前1 -
 板刀面 共回答了17个问题
板刀面 共回答了17个问题 |采纳率88.2%NH3.H2O不等号NH4(+)+OH(-)
CH3COOH不等号CH3COO(-)+H(+)
Ca(OH)2=Ca(2+)+2OH(-)
H2CO3不等号HCO3(-)+H(+)不等号CO3(2-)+2H(+)
Al2(SO4)3=2Al(3+)+3SO4(2-)
NaHCO3=Na(+)+HCO3(-)1年前查看全部
- 写出下列物质在水溶液中电离方程式:
写出下列物质在水溶液中电离方程式:
H2SO4 Ba(OH)2 KCLO3 NaCO3 NaHCO3 NaHSO4 KAL(SO4)2
硝酸 氢氧化钾 硫酸铜 硝酸铵 氯化亚铁 485552471年前1
485552471年前1 -
 姓感34号 共回答了17个问题
姓感34号 共回答了17个问题 |采纳率100%H2SO4=2H+ + SO42-
Ba(OH)2=Ba2++2OH-
KClO3=K++ClO3-
Na2CO3=2Na++CO32-
NaHCO3=Na++HCO3-
NaHSO4=Na++H++SO42-
KAl(SO4)2=K++Al3++2SO42-
HNO3=H++NO3-
KOH=K++OH-
CuSO4=Cu2++SO42-
NH4NO3=NH4++NO3-
FeCl2=Fe2++2Cl-1年前查看全部
- 下列物质中哪些溶于水后可以电离?写出相应的电离方程式
下列物质中哪些溶于水后可以电离?写出相应的电离方程式
氯化氢 硝酸铵 氯氧化钡 葡萄糖 硝酸银 氯化钡 明矾 半碗鸡饭1年前1
半碗鸡饭1年前1 -
 空心圈儿 共回答了20个问题
空心圈儿 共回答了20个问题 |采纳率85%除了葡萄糖以外溶于水都可以电离
HCl===H++Cl-
NH4NO3===NH4+ + NO3-
Ba(OH)2===Ba2+ +2OH-
AgNO3===Ag++NO3-
BaCl2===Ba2+ + 2Cl-
KAl(SO4)2===K+ +Al3+ +2SO42-1年前查看全部
- 化学选修4水溶液某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A=H++HA- HA- =H++A2-已知0
化学选修4水溶液
某二元酸(化学式用H2A表示)在水中的电离方程式是: H2A=H++HA- HA- =H++A2-
已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1 H2A溶液中氢离子的物质的量浓度可能是 ____ 0.11 mol·L-1(填“〈”,“〉”,或“=”),理由是:
0.1mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是
答案我知道,我只需要详细的解答过程,谢谢~
 爱吃草莓的狸狸1年前1
爱吃草莓的狸狸1年前1 -
 云云aa 共回答了17个问题
云云aa 共回答了17个问题 |采纳率82.4%小于,理由是,已知0.1mol·L-1NaHA溶液的pH=2,0.1mol·LHA-电离约为0.01mol/L-的氢离子,假设一级完全电离,2级电离肯定受抑制,应该是小于。
Na+>HA->H+>A2-,Na+完全电离,浓度就是溶液浓度,HA-存在电离,所以他第二,H+有H2O电离,稍微大于A2-。1年前查看全部
- 写出硝酸,氯化铵,氯化铷,小苏达,灰锰氧,纯碱,烧碱的电离方程式
写出硝酸,氯化铵,氯化铷,小苏达,灰锰氧,纯碱,烧碱的电离方程式
还有硫酸氢娜和草木灰的电离方程式 小小4211年前1
小小4211年前1 -
 Love_Mallory 共回答了15个问题
Love_Mallory 共回答了15个问题 |采纳率80%HNO3 == H+ + NO3-
NH4CL == NH4+ + CL-
NaHCO3 == Na+ +HCO3-
kMnO4 == K+ + MnO4+
NaCO3 == Na+ +CO32-
NaOH == Na+ + OH-
NaHSO4 == Na+ + H+ + SO4 2-
K2CO3 == K+ +CO3 2-
❤您的问题已经被解答~~(>^ω^1年前查看全部
- 偏铝酸钠和过量盐酸反应的电离方程式
 xiasha4761年前0
xiasha4761年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列电离方程式错误的是Acacl2==ca2++cl2-
下列电离方程式错误的是Acacl2==ca2++cl2-
chno3==h++no3-
dkoh==k++o2-+h+ fanwish1年前1
fanwish1年前1 -
 huangyu337 共回答了21个问题
huangyu337 共回答了21个问题 |采纳率90.5%显然是D
KOH==K+ + OH-
不知B选项是什么1年前查看全部
- 硫酸、氢氧化钾、氢氧化钡、硫酸钠、硫酸铝、盐酸在水中发生电离的电离方程式
 火星蟑螂1年前2
火星蟑螂1年前2 -
 全额为如下 共回答了20个问题
全额为如下 共回答了20个问题 |采纳率90%H2SO4=2H++SO42-
KOH=K++OH-
Ba(OH)2=Ba2++2OH-
Na2SO4=2Na++SO42-
Al2(SO4)3=2Al3++3SO42-
HCl=H++Cl-1年前查看全部
- 写一个两种溶液发生复分解反应生成两种沉淀的电离方程式
 csrdhzg1年前2
csrdhzg1年前2 -
 yuxiaohao 共回答了18个问题
yuxiaohao 共回答了18个问题 |采纳率66.7%Ba+2OH+Cu+SO4=Cu(OH)2+BaSO41年前查看全部
- 电离方程式和离子方程式的区别?
 野僧19461年前1
野僧19461年前1 -
 乖囡食饭啦 共回答了21个问题
乖囡食饭啦 共回答了21个问题 |采纳率95.2%电离方程式是物质电离是的化学方程式,前面是化合物后面是离子
离子方程式是化学反应中离子参加的部分,是体现化学反应的本质,通常是前面是离子,后面是产生的气体和沉淀难容性物质1年前查看全部
- 弱酸的酸式盐的电离方程式应该怎么写?
弱酸的酸式盐的电离方程式应该怎么写?
例如 nahco3
那钠离子呢? 台球1年前4
台球1年前4 -
 alyalyaly 共回答了14个问题
alyalyaly 共回答了14个问题 |采纳率100%NaHCO3=Na++HCO3-
HCO3-(可逆符号)H++CO3(2-)1年前查看全部
- 写出下列物质溶于水的电离方程式(1)氢氧化钙(2)硫酸铝(3)硝酸铵(4)硫酸氢钠
 shellyhxh1年前2
shellyhxh1年前2 -
 hzlopo 共回答了15个问题
hzlopo 共回答了15个问题 |采纳率86.7%1:ca+ OH-
2:AL3+ SO4 2-
3:NH4+ NO3-
4:HSO4- NA+1年前查看全部
- 硫酸在水溶液中的电离方程式氢氧化钡在水溶液中的电离方程式
 buyiding1年前3
buyiding1年前3 -
 layla_princess 共回答了22个问题
layla_princess 共回答了22个问题 |采纳率95.5%H2SO4=2H+ + SO42-
Ba(OH)2=Ba2+ +2OH-1年前查看全部
- 小苏打(NaHCO3)和苏打(Na2CO3)在水溶液中的电离方程式是什么?
 焱狼1年前1
焱狼1年前1 -
 gg530 共回答了17个问题
gg530 共回答了17个问题 |采纳率82.4%NaHCO3=Na(+)+HCO3(-)
Na2CO3=2Na(+)+CO3(2-)
其中括号内是化合价.1年前查看全部
- 20℃时,H2S饱和溶液1 L,其浓度为0.1 mol·L-1,其电离方程式为H2SH++HS-,HS-H++S2-,若
20℃时,H2S饱和溶液1 L,其浓度为0.1 mol·L-1,其电离方程式为H2SH++HS-,HS-H++S2-,若要使该溶液c(H+)及c(S2-)都减少,可采取的措施是
[ ]
A.加入适量的水
B.加入适量的NaOH固体
C.通入适量的SO2
D.加入适量的CuSO4固体
求教啊 KONG745201年前1
KONG745201年前1 -
 pikmon 共回答了16个问题
pikmon 共回答了16个问题 |采纳率75%A1年前查看全部
- 下列方程式书写正确的是( ) A.NaHSO 4 在水溶液中的电离方程式:NaHSO 4 =Na + +HSO 4 -
下列方程式书写正确的是( ) A.NaHSO 4 在水溶液中的电离方程式:NaHSO 4 =Na + +HSO 4 - B.H 2 SO 3 的电离方程式:H 2 SO 3 =2H + +SO 3 2- C.CO 3 2- 的水解方程式:CO 3 2- +2H 2 O=H 2 CO 3 +2OH - D.CaCO 3 的电离方程式:CaCO 3 =Ca 2+ +CO 3 2-  ffloev1年前1
ffloev1年前1 -
 ivander 共回答了19个问题
ivander 共回答了19个问题 |采纳率89.5%A、NaHSO 4 在水溶液中的电离方程式:NaHSO 4 =Na + +H + +SO 4 2- ,故A错误;
B、亚硫酸是弱酸,弱酸分步电离,故B错误;
C、碳酸根的水解分两步进行,先水解为碳酸氢根,最后水解为碳酸,故C错误;
D、含碳酸钙是强电解质,能完全电离,即CaCO 3 =Ca 2+ +CO 3 2- ,故D正确.
故选D.1年前查看全部
- 下列物质在水溶液中的电离方程式书写正确的是( )
下列物质在水溶液中的电离方程式书写正确的是( )
A.HF═H++F-
B.Ba(OH)2═Ba2++2OH-
C.H3PO4═3H++PO43-
D.NH3•H2O═NH4++OH- xxyeyu19811年前1
xxyeyu19811年前1 -
 大白条 共回答了27个问题
大白条 共回答了27个问题 |采纳率92.6%解题思路:A.氢氟酸为弱酸,部分电离;
B.氢氧化钡为强电解质,完全电离,用“=”号,电荷守恒、离子符号正确次氯酸为弱酸,部分电离;
C.磷酸是中强酸,分步电离;
D.一水合氨是弱电解质,部分电离.解;A.氢氟酸为弱酸,部分电离,用“⇌”号,其电离方程式为HF⇌H++F-,故A错误;B.Ba(OH)2是强电解质,完全电离,用“=”号,电荷守恒、离子符号正确,电离方程式为Ba(OH)2═Ba2++2OH-,故B正确;C.多元弱酸...
点评:
本题考点: 电离方程式的书写.
考点点评: 本题主要考查电离方程式书写,掌握正确书写电离方程式的方法,并能正确判断电离方程式的正误是解答关键,注意多元弱酸分步电离,题目难度不大.1年前查看全部
- 强、弱电解质的比较,包括定义、化合物类别、电离程度、溶液中微粒的种类和电离方程式?
 cindy_yhy1年前2
cindy_yhy1年前2 -
 SUAD3491 共回答了14个问题
SUAD3491 共回答了14个问题 |采纳率85.7%1、定义
强电解质:在水溶液中能完全电离的电解质.
弱电解质:在水溶液中部分电离的电解质.
注意,区别的标准是能不能完全电离,与溶解度没有关系,与溶液的浓度没有必然关系,与溶液的导电性没有必然关系.
即存在难溶性的强电解质,如CaCO3、BaSO4等等,也存在易溶性的弱电解质,如CH3COOH等.
2、化合物类别
强电解质:离子化合物,部分共价化合物
弱电解质:部分共价化合物
强电解质:强酸,强碱,大多数的盐
弱电解质:弱酸,弱碱,水,极少数的盐
3、电离程度,溶液中微粒的种类,电离方程式
强电解质:完全电离,溶液中只存在离子,电离方程式完全,用=,一步到底
弱电解质,不完全电离,溶液中既有离子,也有分子,电离方程式用可逆符号,多元弱酸的电离分步.1年前查看全部
- 电离方程式与离子方程式有何区别吗?
 majior1年前1
majior1年前1 -
 may_ben 共回答了9个问题
may_ben 共回答了9个问题 |采纳率100%电离方程式表达的是一种电解质的电离过程不表示某个反应,强电解质电离用等号表示,弱电解质电离用可逆符号表示.如:
NaCl==Na+ + Cl-
CH3COOH==CH3COO- + H+ (此处是可逆符号)
离子方程式是用真正参加反应的离子表示一个化学反应方程式的式子,我们讨论的离子方程式往往是指在水溶液中有离子参加的反应,没有等号和可逆之分,如:
NaOH + HCl == NaCl + H2O
因为NaOH、HCl和NaCl都是强电解质,所以拆成离子形式,而水是弱电解质,保留分子形式,最后表示成:
OH- + H+ == H2O1年前查看全部
- (2000•四川)下列电离方程式中,正确的是( )
(2000•四川)下列电离方程式中,正确的是( )
A.H2SO4=H2++SO42-
B.Ca(OH)2=Ca2++2OH-
C.Cu(NO3)2=Cu2++(NO3)2-
D.FeSO4=Fe3++SO42- susan666761年前1
susan666761年前1 -
 scarey 共回答了16个问题
scarey 共回答了16个问题 |采纳率93.8%解题思路:A、根据书写电离方程式时是的角标要变成化学计量数进行分析;
B、根据离子方程式的书写规则进行分析;
C、根据原子团的角标要变成化学计量数进行分析;
D、根据电离前后的化合价不变进行分析.A、书写电离方程式时是的角标要变成化学计量数,正确的电离方程式为:H2SO4=2H++SO42-,故A错误;
B、该电离方程式离子符号书写正确,电荷守恒,故B正确;
C、硝酸根离子的角标要变成化学计量数,正确的电离方程式为:Cu(NO3)2=Cu2++2NO3-,故C错误;
D、铁在硫酸亚铁中显示+2价,电离后带两个单位的正电荷,正确的电离方程式为:FeSO4=Fe2++SO42-,故D错误.
故选B.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析应用的原理是否正确,然后再根据离子方程式的书写规则进行判断.1年前查看全部
- 某二元酸H2A的电离方程式是H2A=H+ +HA-,HA-可逆号A2- +H+.Na2A溶液显碱性,理由是
某二元酸H2A的电离方程式是H2A=H+ +HA-,HA-可逆号A2- +H+.Na2A溶液显碱性,理由是
为什么显碱性?
理由是什么? xu6f1年前6
xu6f1年前6 -
 小瘪三闯xx 共回答了18个问题
小瘪三闯xx 共回答了18个问题 |采纳率88.9%因为第二步是可逆的电离,所以A2-会发生水A2- +H2O=可逆=HA- +OH-
如果是NaHA,溶液是酸性的,因为HA-会发生电离.HA-=H+ +A2-1年前查看全部
- HCL+NaF==NaCL+HF的电离方程式怎么写?
 枫叶5051年前1
枫叶5051年前1 -
 yaohui7775 共回答了21个问题
yaohui7775 共回答了21个问题 |采纳率85.7%HCL+F阴离子==CL阴离子+HF1年前查看全部
- 下列有关化学用语表示正确的是 A. 的结构示意图: B.原子核内有10个中子,8个质子的原子: C. 离子的电离方程式:
下列有关化学用语表示正确的是
A. 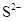 的结构示意图:
的结构示意图: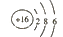
B.原子核内有10个中子,8个质子的原子: 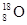
C. 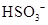 离子的电离方程式:
离子的电离方程式:
D.2g 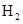 在25℃ 101kpa下燃烧,生成液态的水放出285.8
在25℃ 101kpa下燃烧,生成液态的水放出285.8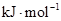 U的热量,则该反应的热化学方程式为:
U的热量,则该反应的热化学方程式为: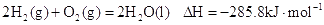
 yoyoyan_198301061年前1
yoyoyan_198301061年前1 -
 gtdx 共回答了15个问题
gtdx 共回答了15个问题 |采纳率86.7%1年前查看全部
- 电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+.下列物质的电离方程式错误的是(
电解质溶液中,阴离子和阳离子均以水合离子形式存在,如H+可以结合一个水分子形成H3O+.下列物质的电离方程式错误的是( )
A.CuSO4═Cu2++SO42−
B.HCl+H2O═H3O++Cl-
C.NaHCO3═Na++HCO3−
D.NaHSO4═Na++HSO+SO4− 科小月1年前1
科小月1年前1 -
 萨娜优啦 共回答了20个问题
萨娜优啦 共回答了20个问题 |采纳率95%解题思路:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式;可根据质量守恒定律及电荷守恒来检查电离方程式书写的正误.A、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
B、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
C、该电离方程式符合电荷守恒、离子符号正确,该电离方程式书写完全正确.
D、硫酸氢钠的电离方程式应为:NaHSO4═Na++HSO4-.
故选D.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题难度不大,考查电离方程式的书写,掌握电离方程式的书写方法是正确解答本题的关键.1年前查看全部
- (1)写出Fe 2 (SO 4 ) 3 在水溶液中的电离方程式:______
(1)写出Fe 2 (SO 4 ) 3 在水溶液中的电离方程式:______
(2)写出下列离子方程式对应的一个化学方程式:2H + +CO 3 2- =H 2 O+CO 2 ↑______
(3)用“双线桥法”标明电子转移的方向和数目.
MnO 2 +4HCl
MnCl 2 +Cl 2 ↑+2H 2 O△ .
该反应中氧化剂与还原剂物质的量之比为______
该反应的离子方程式为______
(4)根据下列四个反应:
①Cl 2 +2KI=2KCl+I 2 ②2FeCl 2 +Cl 2 =2FeCl 3
③2FeCl 3 +2HI=2FeCl 2 +2HCl+I 2 ④H 2 S+I 2 =S+2HI
可以判断FeCl 3 、Cl 2 、I 2 、S四种物质的氧化性由强到弱的正确顺序是______. dulak1年前0
dulak1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 26-3/ 下列电离方程式中正确的是:()?
26-3/ 下列电离方程式中正确的是:()?
(A) H2S ==2H^(+) + S^(2-)
(B) H2S == H^(+) + HS- ; HS- → H+ + S^(2-)
(C) NaHCO3→Na+ + H+ + CO3^(2-)
(D) HF==H+ + F-
注:“==”表示“部分电离”;“→”表示“完全电离”
A、B为什么不对呢?
请具体写出每个选项的详细说明&解释 dszfgsethrfh1年前1
dszfgsethrfh1年前1 -
 林风2007 共回答了13个问题
林风2007 共回答了13个问题 |采纳率84.6%AB应该为
H2S == H^(+) + HS- ; HS- == H+ + S^(2-)
就是两步都是部分电离1年前查看全部
- 碘酸钾在水溶液中的电离方程式
 赤艸1年前1
赤艸1年前1 -
 yinueaaa 共回答了15个问题
yinueaaa 共回答了15个问题 |采纳率86.7%KIO3=K+ +IO3-1年前查看全部
- N4H4(SO4)电离方程式 其含氮质量分数为
N4H4(SO4)电离方程式 其含氮质量分数为
N4H4(SO4)电离方程式 其含氮质量分数为
其不能与 物质混合使用 A K3PO4 B草木灰 CNH4NO3 DNH4Cl
写出N4H4(SO4)与氢氧化钠 反应离子方程式 shuile801年前1
shuile801年前1 -
 linyutingge 共回答了15个问题
linyutingge 共回答了15个问题 |采纳率80%此题只要把N4H4(4+) 类比NH4+,就不难解决了.(前面两问就不解释了.
1、N4是类似白磷分子的正四面体结构,每个N都有一对孤对电子,这跟NH3的N相似
2、NH3+H+=NH4+,同理N4+4H+=N4H4(4+)
3、NH4+ +OH-=NH3+H2O;同理N4H4(4+)+4OH- =N4+4H2O(不加热就会生成水合物)
所以N4H4(4+)+不能与碱性盐(A K3PO4 B草木灰)共存,发生双水解;
离子方程式见3
还有什么资料进这个网站(hlghx后缀是.com),里面的视频和资料对你会有用的1年前查看全部
- 硫酸亚锡Snso4在水中的电离方程式?
硫酸亚锡Snso4在水中的电离方程式?
再加上电解方程式 705天1年前2
705天1年前2 -
 木可不北 共回答了14个问题
木可不北 共回答了14个问题 |采纳率100%SnSO4 =Sn2+ +SO42-
(强电解质,完全电离)
SnSO4水解:
2Sn2+ +SO42- +2H2O =Sn2(OH)2SO4↓+ 2H+
SnSO4 分子量:214.77 性状:无色或白色小结晶.溶于水、乙醇稀硫酸.在不中能水解生成碱式硫酸盐而沉淀.1年前查看全部
大家在问
- 1没有 是没有 没有 是没有 造句
- 2西塞罗说:“事实上有一种真正的法律 ——正确的理性 ——与自然相适应,它适用于所有的人并且是永恒不变的。 …… 它不会在
- 3I'd go for classical music.
- 4教师分一些糖果给小孩,如果每人4个,则多20个.如果每人5个,则差5个
- 5那些年 作文
- 6氧化还原反应在生产、生活中存在广泛,下列过程中,不涉及氧化还原反应的是( )
- 7传感器是一种采集信息的重要器件,如图所示的是一种测定压力的电容式传感器,当待测压力F作用于可动膜片的电极上时,以下说法中
- 8( )a glass有:Worry、break.taste.turn off . Water.fry. Wait.was
- 9( )的鲜花 ( )的大海 ( )的太阳
- 10f(x+y)=f(x)f(y)~这种题最讨厌了.总看不出来
- 11不能用方程解,并说出具体的解题思路
- 12英语书信的“齐头式”正文分段时要顶格吗?
- 13石墨和金刚石各1mol在相同条件下燃烧,哪个放出的热量多?
- 14什么是水玻璃?
- 15写出相应的金属元素符号.①熔点最低的金属元素是______ ②在空气中能自我保护的金属元素是______;③导