水解平衡程度与电离平衡哪个程度大
 rz_zhu2022-10-04 11:39:541条回答
rz_zhu2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 慧雪朦胧 共回答了21个问题
慧雪朦胧 共回答了21个问题 |采纳率95.2%- (1)具体问题,具体分析!
(2)NaHCO3---水解平衡程度 > 电离平衡!PH > 7
(3)NaHSO3---水解平衡程度 < 电离平衡!PH < 7 - 1年前
相关推荐
- 什么叫水解平衡什么叫平衡正向移动
 8805311年前1
8805311年前1 -
 tenqe 共回答了10个问题
tenqe 共回答了10个问题 |采纳率80%水解平衡
盐的水解反应:凡是组成盐的离子与水作用产生弱酸或弱碱,并改变溶液酸度的反应都叫做盐的水解反应.
盐水解产生酸或碱的速率与酸或碱电离的速率相等时即达到水解平衡.
该盐的酸性或者碱性越弱,越容易水解,而且水解的程度越大.
化学平衡你明白吗?
对于可逆反应而言,当正反应速率和逆反应速率相等时就认为反应达到平衡状态
这个时侯改变外界条件,就会不同程度的影响正逆反应速率,如果正反应速率大于逆反应速率,平衡就有利于向正方向进行,从而使正逆反应速率再次相等,达到新平衡!1年前查看全部
- 升高温度弱酸酸式根离子的电离平衡,水解平衡向哪方移动?
升高温度弱酸酸式根离子的电离平衡,水解平衡向哪方移动?
(1)原酸酸式根离子水解程度大于电离程度(如:HPO4-),升温后,向哪边移动?
(2)电离程度大于水解程度(如:HSO3-)呢?
(电离和水解均吸热,该如何判断?) Schat1年前1
Schat1年前1 -
 wusidongdong 共回答了14个问题
wusidongdong 共回答了14个问题 |采纳率92.9%电离,水解都是吸热反应.
升温向电离或水解方向移动.
(1)(HPO4-),升温后电离程度和水解程度都加大,但是总体上不会改变,还是水解大于电离,仍然显碱性.
(2)(如:HSO3-)一样,升温后仍然显酸性,电离大于水解.只是程度都加大了.
主要是由于温度升高,离子积常数也变大.所以,水解出的OH-,电离出的H+都在增加.1年前查看全部
- 往醋酸钠溶液中滴加冰醋酸,会使醋酸钠的水解平衡向什么方向移动?
 densematrix1年前3
densematrix1年前3 -
 chenxua512203 共回答了18个问题
chenxua512203 共回答了18个问题 |采纳率94.4%醋酸钠溶液中的离子方程式:CH3COO(-)+H(+)=CH3COOH
加入的醋酸是弱酸,不易分解,加大了醋酸溶度,使平衡向左移动了.1年前查看全部
- 碳酸钠和碳酸氢钠都存在电离平衡和水解平衡吗?
 tj-透明心情1年前1
tj-透明心情1年前1 -
 ivwsityga 共回答了23个问题
ivwsityga 共回答了23个问题 |采纳率100%都存在 碳酸根水解存在水解平衡 水解后的产物碳酸氢根和碳酸存在电离平衡(不过这个非常微弱了) 碳酸氢跟存在水解平衡生成碳酸 也存在电离平衡生成碳酸根和氢离子1年前查看全部
- 三价铁离子的水解反应 若我们加入铁对于这个水解平衡有什么影响啊 为什么?
三价铁离子的水解反应 若我们加入铁对于这个水解平衡有什么影响啊 为什么?
铁既可以和三价铁离子反应 又可以和氢离子反应 怎么判断啊‘ 宁宁4035651年前1
宁宁4035651年前1 -
 放飞心情393 共回答了18个问题
放飞心情393 共回答了18个问题 |采纳率94.4%fe首先要与三价铁反应,生成二价铁,所以三价铁减少,水解平衡左移.
所谓fe于h+反应是指在酸溶液中,h+非常多,假设,是稀硫酸,我想fe先于h2so4反应生成fe2+,那对fe3+就应该没什么影响了.1年前查看全部
- 为什么说:盐类水解中,溶液中盐的物质的量浓度减少,水解平衡向右移,水解程度增大?
 maqiu-xl1年前2
maqiu-xl1年前2 -
 huihui66 共回答了18个问题
huihui66 共回答了18个问题 |采纳率94.4%你应该指的是加水稀释吧,加水稀释后,盐的物质的量浓度确实减少
假设是醋酸根水解
根据平衡常数K1=C(CH3COOH)*C(OH-)/C(CH3COO-)
假设浓度均变为原来的1/2
此事K2=1/2K1
平衡常数减小,平衡右移1年前查看全部
- Na2CO3溶液中通入CO2,水解平衡向右移动的原因
Na2CO3溶液中通入CO2,水解平衡向右移动的原因
Na2CO3溶液中,有水解平衡,CO3(2-)+H2OHCO3(-)+OH(-),此时通入CO2,书本上说,是因为CO2消耗了OH(-),使平衡向右.
但是,CO2消耗了OH(-)是因为:CO2+OH(-)==HCO3(-),这样,就会一边使OH(-)减少,一边又使HCO3(-)增多,水解反应中的两种生成物一增多一减少,怎么就说平衡向左呢?
又如,在氯化铵溶液中通入氨气,水解平衡NH4(+) + H2O = NH3•H2O + H(+),却又是另一种说法,说氨气入水生成一水合氨,使平衡向左,这里怎么不说氨气消耗了 H(+)使平衡向右呢?
三说,在醋酸钠溶液中加入冰醋酸,水解平衡Ac(-)+ H2O =HAc+OH(-),也说因为HAc浓度的增加,使平衡向左.为什么不说醋酸消耗OH(-),使平衡向右呢? Taireyl1年前3
Taireyl1年前3 -
 楚一天 共回答了14个问题
楚一天 共回答了14个问题 |采纳率92.9%一说.CO2消耗了OH(-)是因为:CO2+OH(-)==HCO3(-),并非是这样消耗的.而是
CO2+H2OHCO3-+H+
H++OH-=H2O
你看,增加了一个HCO3,却失去了H+和OH-,平衡向右合理吧.
二说.生成的NH3•H2O 远大于,NH3•H2O 水解产生的OH-.
三说.也是HAc因为是弱酸,电离出的氢离子远远小于HAc的浓度.1年前查看全部
- 电离平衡,溶解平衡,水解平衡,等效平衡,等五者的【区别】以及常数的计算式
 非常yy1年前3
非常yy1年前3 -
 清影文子 共回答了22个问题
清影文子 共回答了22个问题 |采纳率86.4%看书化学平衡包涵(电离平衡,溶解平衡,水解平衡),等效平衡是化学平衡术语分为等压与恒容 技巧是平衡是头驴,它倔.你向东拉它走但走不多.比如你加反应物时 平衡向正移但不会全移如1A+3B=2D加a的话a的转化率就会降低但平衡正移 .还有记住勒夏特列原理和Ksp 等公式1年前查看全部
- 增大盐溶液的浓度,水解平衡正向移动,水解程度怎么变?为什么变小
 淡淡的明天1年前2
淡淡的明天1年前2 -
 58838875 共回答了32个问题
58838875 共回答了32个问题 |采纳率87.5%水解程度变小,在原溶液中加入溶质,也会水解生成新的离子,新的离子浓度增加会抑制水解,因此水解程度变小1年前查看全部
- 在一定条件下,Na2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.下列说法正确的是
在一定条件下,Na2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.下列说法正确的是
B 通入CO2,平衡朝正反映方向移动
我的疑问是:Na2CO3+CO2+H2O=2NaHCO3不是会增加HCO3-吗,为什么还会向正反应方向移动? 七夕夜雨1年前1
七夕夜雨1年前1 -
 xcvkoipaufpoiasu 共回答了19个问题
xcvkoipaufpoiasu 共回答了19个问题 |采纳率84.2%通入CO2后,
溶液中会发生CO2+H2O=2H2CO3,
而H2CO3与OH-反应,使平衡朝正反应方向移动1年前查看全部
- 化学平衡包括哪四大平衡?不是守恒,貌似是电解平衡,配位平衡,水解平衡等等.其中四个称为化学反应的四大平衡的
 北冰洋lhbzcxc1年前5
北冰洋lhbzcxc1年前5 -
 ada85 共回答了22个问题
ada85 共回答了22个问题 |采纳率95.5%通常说的四大化学平衡为氧化还原平衡、沉淀溶解平衡、配位平衡、酸碱平衡.1年前查看全部
- 化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B)②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m 1 ,醋酸溶液中加入的Zn质量为m 2 ,则m 1 ________m 2 (选填“<”、“=”或“>”)。
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V 1 ,醋酸溶液中加入的水的体积为V 2 ,则 V 1 ______V 2 (填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
(1)上述盐溶液中的阴离子,结合H + 能力最强的是溶质 CH 3 COONa NaHCO 3 Na 2 CO 3 NaClO NaCN C 6 H 5 ONa pH 8.8 9.7 11.6 10.3 11.1 11.3
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN
B.HClO C.C 6 H 5 OH D.CH 3 COOH E.H 2 CO 3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH 3 COOH+ Na 2 CO 3 =NaHCO 3 +CH 3 COONa
B.CH 3 COOH+NaCN=CH 3 COONa+HCN
C.CO 2 +H 2 O+2C 6 H 5 ONa=Na 2 CO 3 +2C 6 H 5 OH
Ⅳ、已知:ZnCl 2 ·xH 2 O易溶于水,且其浓的水溶液呈较强酸性;SOCl 2 (氯化亚砜)极易和水发生如下反应:SOCl 2 +H 2 O=SO 2 +2HCl。实验室中制取无水氯化锌采用ZnCl 2 ·xH 2 O与SOCl 2 混合加热的方法。试回答:
SOCl 2 的作用是___________________________________。 渝报1年前1
渝报1年前1 -
 聊天不如去酒吧 共回答了27个问题
聊天不如去酒吧 共回答了27个问题 |采纳率77.8%Ⅰ.⑴K=c 2 (C)/c 3 (B)c(A)⑵ ③④ ⑶大于。Ⅱ.(1) b , < 。(2) < 。Ⅲ.① CO 3 2 - ,② D , C 。 ③ C 。 Ⅳ 夺去ZnCl 2 ·xH 2 O中的水,同时生成H...1年前查看全部
- 增大盐溶液的浓度 水解平衡向右移动,但水解程度减小 为什么
 冷秋兰1年前2
冷秋兰1年前2 -
 忧蓝SKY 共回答了23个问题
忧蓝SKY 共回答了23个问题 |采纳率95.7%因为你增加的更多啊.勒夏特列原理 平衡只是往阻碍该变化的方向移动 而不能抵消.1年前查看全部
- 在一定条件下,NA2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.通入CO2,平衡朝正反应方向
在一定条件下,NA2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.通入CO2,平衡朝正反应方向移动,为什
HCO3不是会电离出HCO3-吗,生成物浓度增大不就该朝逆反应方向移动吗 小闲鱼1年前3
小闲鱼1年前3 -
 duzy1999 共回答了24个问题
duzy1999 共回答了24个问题 |采纳率91.7%第一种方法:通入二氧化碳,生成碳酸,与碳酸钠水解生成的氢氧根中和,促使平衡正向移动
第二种方法:通入二氧化碳,与碳酸钠反应生成碳酸氢钠,使碳酸钠浓度减小,根据稀释定律,弱酸、弱碱、或者弱酸盐、弱碱盐在浓度减小的时候其电离程度或者水解程度都会增大,即平衡向右移动1年前查看全部
- 水解平衡影响因素醋酸钠和氯化铵为例
水解平衡影响因素醋酸钠和氯化铵为例
醋酸钠的溶液,向其中加入盐酸,平衡如何移动,加入烧碱呢?
氯化铵的溶液同样处理结果如何?
老师说不论加酸加碱都要抑制水解,是水解程度减小。可是好多教参都不是这样说的。这应该怎么办? wch8681年前2
wch8681年前2 -
 shinhigh 共回答了21个问题
shinhigh 共回答了21个问题 |采纳率90.5%CH3COONa+H2O==(可逆)CH3COOH+NaOH 离子方程式是
CH3COO-+H2O===(可逆)CH3COOH+OH- 加入盐酸,是强酸,就是增大H+浓度,会抑制电离,平衡向右移动,加入NaOH是强碱,增大OH-的浓度,平衡向左移动,NH4CL你只要写出其水解的离子方程式,判断即可,你们老师说的不全对,加强酸强碱对有的水解会抑制,但是强酸弱碱,加碱有的也会促进水解,例如Fe3+ +3H2O===(可逆)Fe(OH)3+3H+ 加入NaOH平衡向右移动,但是加HCL平衡向左移动~不同情况都不一样~1年前查看全部
- 在一定条件下,NA2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.通入CO2,平衡朝正反应方向
在一定条件下,NA2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.通入CO2,平衡朝正反应方向移动为什么
通入CO2就如同通入H2CO3,可是第一步电离大于第二步,所以电离的HCO3-大于CO32-,不是应该逆向的嘛 lizhijian1年前1
lizhijian1年前1 -
 katharine_chen 共回答了19个问题
katharine_chen 共回答了19个问题 |采纳率94.7%首先有水解平衡CO32-+H2O=HCO3-+OH-
也有电离平衡H2CO3=H++HCO3-
那麼H2CO3对CO32-相当於有两种效果.1,其电离的H+与OH-反应,促进水解.2,其电离的HCO3-抑制水解.但是,由於H++OH-=H2O的反应趋势非常大,H2O更稳定,因此就算HCO3-会抑制水解,CO32-也还是要水解去产生更多OH-来和H+变成H2O.
化学变化就一个原则,哪里稳定往哪里走.1年前查看全部
- 一定条件下,CH 3 COONa溶液存在水解平衡:CH 3 COO - +H 2 O CH 3 COOH+OH - ,下
一定条件下,CH 3 COONa溶液存在水解平衡:CH 3 COO - +H 2 O
 CH 3 COOH+OH - ,下列说法正确的是
CH 3 COOH+OH - ,下列说法正确的是A.加入少量NaOH固体, c (CH 3 COO - )减小 B.加入少量FeCl 3 固体, c (CH 3 COO - )减小 C.稀释溶液,溶液的pH增大 D.加入适量醋酸,得到的酸性混合溶液: c (Na + )> c (CH 3 COO - )> c (H + )> c (OH - )  seal77781年前1
seal77781年前1 -
 chjing111 共回答了18个问题
chjing111 共回答了18个问题 |采纳率94.4%B
正确答案:B
A.不正确,加入少量NaOH固体,水解平衡逆向移动, c (CH 3 COO - )减大;
B.正确,加入少量FeCl 3 固体,水解呈酸性,促进CH 3 COO ― 水解 c (CH 3 COO - )减小
C.不正确,稀释溶液,促进水解,溶液的pH减小;
D.不正确,加入适量醋酸,得到的酸性混合溶液: c (CH 3 COO - )> c (Na + )> c (H + )> c (OH - )1年前查看全部
- 化学 盐溶液水解时,水解平衡常数是什么?怎么表示?也为温度常数么?!(>_
 woshishui_1年前0
woshishui_1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 浓度减小 水解平衡怎么移动 水解程度怎么和水解产生的离子浓度怎样变化
 liaodanyin1年前1
liaodanyin1年前1 -
 Yorty4 共回答了14个问题
Yorty4 共回答了14个问题 |采纳率92.9%水解方程式A2- + H2O====HA- + OH- K=[OH-][HA-]/[A2-] 加水后各浓度都减小相同的倍数,但由于分子项数多,导致比值减小,即Q1年前查看全部
- 水解平衡常数与哪些因素有关?
 飞翔的时侯1年前3
飞翔的时侯1年前3 -
 坏的光的爷爷1 共回答了16个问题
坏的光的爷爷1 共回答了16个问题 |采纳率93.8%所有可逆反应的平衡常数只与温度有关,而与浓度无关.
因此,可逆反应的平衡常数、弱电解质的电离平衡常数、水解平衡常数、沉淀的溶解平衡常数都只与温度有关.
由于水解吸热,所以温度升高,水解平衡常数变大.1年前查看全部
- 有关盐类的水解 为什么增大盐的浓度 水解平衡向右移动 并且水解的程度还减小了?
 ae6b1年前2
ae6b1年前2 -
 musewater 共回答了15个问题
musewater 共回答了15个问题 |采纳率86.7%平衡移动原理的理解要着重“减弱这种改变……”中的“减弱“,第一次平衡前,如果起始浓度为1mol/L,水解的程度可能为0.1/1=10%,如果这时再加入盐使起始浓度增加1mol/L,由于是”减弱“不是”消除“,再平衡时的水解的程度只可能小于10%,1年前查看全部
- 氯化铁水解平衡的影响为什么加水,水解平衡向右移动,氢离子数增多,pH升高,铁离子的水解率增大
 不喝就醉1年前1
不喝就醉1年前1 -
 sunwei8 共回答了16个问题
sunwei8 共回答了16个问题 |采纳率87.5%FeCl3+3H2O=Fe(OH)3+3HCl
此反应在沸水中进行,是可逆反应
pH越高,胶体越易形成,故水解率增大1年前查看全部
- 水解平衡常数是什么?水解程度又是什么?两者有什么关系?
 抽风00251年前2
抽风00251年前2 -
 maomao0000 共回答了20个问题
maomao0000 共回答了20个问题 |采纳率85%水解的程度可用水解常数的大小来表示,用Kh表示
设一个一元弱酸,HA
HA=H++A-,可逆的,Ka是它的电离常数
因为是弱酸,所以A-会水解
A-+H2O=HA+OH-,也是可逆的,其水解常数是Kb
将两个方程相加,后,得到,H2O=H++OH-,其平衡常数即水的离子积常数Kw
所以Ka*Kb=Kw
即酸的电离常数与它对应的酸根离子的水解常数的乘积等于水的离子积常数1年前查看全部
- 在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O⇌HCO3-+OH-.下列说法正确的是( )
在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O⇌HCO3-+OH-.下列说法正确的是( )
A. 稀释溶液,水解平衡常数增大
B. 通入CO2,平衡不移动
C. 升高温度,c(HCO3-)/c(CO32-)的比值增大
D. 加入NaOH固体,溶液pH减小 炎之苍月1年前2
炎之苍月1年前2 -
 chwxyxk 共回答了17个问题
chwxyxk 共回答了17个问题 |采纳率88.2%解题思路:Na2CO3溶液存在水解平衡:CO32-+H2O⇌HCO3-+OH-,盐类的水解为吸热过程,加热促进水解,当OH-或HCO3-浓度发生变化时,平衡发生移动,平衡常数只受温度的影响.A.平衡常数只受温度的影响,加水稀释,平衡常数不变,故A错误;
B.通入CO2,与OH-反应,平衡正向移动,故B错误;
C.升高温度,平衡向正向移动,则c(HCO3-)/c(CO32-)的比值增大,故C正确;
D.加入NaOH固体,c(OH-)浓度增大,溶液pH增大,故D错误.
故选C.点评:
本题考点: 盐类水解的原理.
考点点评: 本题考查盐类水解的原理,题目难度不大,注意把握影响盐类水解的因素,把握平衡常数的意义.1年前查看全部
- (2012•汕头一模)一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O⇌CH3COOH+OH-,下列
(2012•汕头一模)一定条件下,CH3COONa溶液存在水解平衡:CH3COO-+H2O⇌CH3COOH+OH-,下列说法正确的是( )
A.加入少量NaOH固体,c(CH3COO-)增大
B.加入少量FeCl3固体,c(CH3COO-)减小
C.稀释溶液,溶液的pH增大
D.加入适量醋酸得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) 山那边的海1年前1
山那边的海1年前1 -
 343434343434 共回答了12个问题
343434343434 共回答了12个问题 |采纳率83.3%解题思路:A、加入氢氧化钠溶解后氢氧根离子浓度增大,平衡左移;
B、FeCl3消耗了氢氧根离子,使平衡正移;
C、稀释促进水解,离子浓度减小;
D、根据电荷守恒分析;A、CH3COONa溶液存在水解平衡:CH3COO-+H2O⇌CH3COOH+OH-.加入氢氧化钠溶解后氢氧根离子浓度增大,平衡左移c(CH3COO-) 增大,故A正确;
B、CH3COONa溶液存在水解平衡:CH3COO-+H2O⇌CH3COOH+OH-.FeCl3消耗了氢氧根离子,使平衡正移,醋酸根浓度减小,故B正确;
C、CH3COONa溶液存在水解平衡:CH3COO-+H2O⇌CH3COOH+OH-.稀释溶液,平衡正向进行,平衡状态下氢氧根离子浓度减小,溶液的pH减小,故C错误;
D、根据电荷守恒,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液显酸性c(H+)>c(OH-),所以c(Na+)<c(CH3COO-),所以混合溶液中:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误;
故选:AB.点评:
本题考点: 影响盐类水解程度的主要因素.
考点点评: 本题考查了水解平衡的影响因素分析判断,离子浓度的比较,注意电荷守恒的应用,题目较简单.1年前查看全部
- 在一定条件下,NA2CO3溶液存在水解平衡:CO3 2- +H2O=HCO3 - +OH-.通入CO2PH为什么会减小?
 ywq_0011年前1
ywq_0011年前1 -
 小对 共回答了15个问题
小对 共回答了15个问题 |采纳率86.7%精锐教育老师回答:因为Na2CO3+CO2+H2O=2NaHCO3,Na2CO3溶液有两步水解,水解程度较大,碱性较强,而NaHCO3溶液只有一步水解,水解程度较小,碱性相对较弱.所以PH会减小.1年前查看全部
- 向nabr溶液通入cl2,水解平衡向哪移动
 look_for1年前1
look_for1年前1 -
 angel12341 共回答了22个问题
angel12341 共回答了22个问题 |采纳率90.9%NaBr在水溶液中不水解1年前查看全部
- (2011•琼海一模)在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O⇌HCO3-+OH-.下列说法正确的是
(2011•琼海一模)在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O⇌HCO3-+OH-.下列说法正确的是( )
A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(H+)
B.升高温度,平衡向正反应方向移动
C.稀释溶液,溶液中c(H+)和c(OH-)都减少
D.加入NaOH固体,溶液pH减小 这里的四季是夏天1年前1
这里的四季是夏天1年前1 -
 光光的猪 共回答了19个问题
光光的猪 共回答了19个问题 |采纳率94.7%A、Na2CO3溶液碳酸根离子水解导致溶液显示碱性,其中离子浓度大小顺序是:c(Na+)>c(CO32-)>c(OH-)>c(H+),故A正确;
B、因水解是吸热的,则升温可以促进水解,平衡正向移动,故B正确;
C、稀释溶液,溶液中c(OH-)减少,但是c(H+)增大,故C错误;
D、加入NaOH固体,碱性增强,pH增大,故D错误;
故选:AB.1年前查看全部
- 下列情况哪些用可逆符号和箭头化学反应平衡、电离平衡、水解平衡、沉淀溶解平衡在高中化学选修范围内,这些情况下什么时候要用可
下列情况哪些用可逆符号和箭头
化学反应平衡、电离平衡、水解平衡、沉淀溶解平衡
在高中化学选修范围内,这些情况下什么时候要用可逆符号什么时候等号,什么时候可以加气体符号沉淀符号什么时候不能? haode_12341年前2
haode_12341年前2 -
 侃153座大山 共回答了15个问题
侃153座大山 共回答了15个问题 |采纳率93.3%像强电解质电离、水解、沉淀溶解可以用等号,但弱电解质只能用可逆号.注意沉淀溶解平衡中不一定可溶才用等号,一定要分清几种常见强弱电解质的这些性质,经常用到.
又产生气体或沉淀就可以用气体符号和沉淀符号.1年前查看全部
- 在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,
 在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)
①已知该反应的平衡常数K195℃<K165℃,则该反应的△H______0(填“>”“=”或“<”).
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
=x,如图是氨碳比(x)与CO2平衡转化率(a)的关系.a随着x增大的原因是______.n(NH3) n(CO2)
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2(l)的质量______(填“增加”、“减小”或“不变”).
Ⅱ:(1)某温度下,纯水中c(H+)=2.0×10-7mol/L,该温度下,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=______.
(2)向100mL 0.10mol/L CH3COOH的溶液中加入0.010mol CH3COONa固体,溶液pH增大,主要原因是(请用学过的平衡理论解释)______. yangzhichao1年前1
yangzhichao1年前1 -
 曲中 共回答了22个问题
曲中 共回答了22个问题 |采纳率81.8%解题思路:Ⅰ、(1)①平衡常数K195℃<K165℃,说明温度越高越小,温度升高,平衡逆向进行,逆向是吸热反应,正向为放热反应;
②两种反应物,增大一种物质会提高另一种物质的转化率,依据x含义和图象数据分析结合化学方程式分析氨气转化率;
③恒温恒容条件下,充入稀有气体,反应体系中各组分的浓度不变,平衡不移动;
Ⅱ、(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),先计算出过量的c(OH-),再结合Kw计算c(H+),得出反应后的溶液的pH;
(2)存在CH3COOH⇌H++CH3COO-电离平衡,氢离子浓度减小则pH增大;(1)①平衡常数K175℃<K165℃,温度越高平衡常数越小,说明平衡逆向进行,逆向是吸热反应,正反应是放热反应,△H<0;
故答案为:<;
②c(NH3)增大,平衡正向移动,所以CO2的转化率增大;
故答案为:c(NH3)增大,平衡正向移动,所以CO2的转化率增大;
③达到平衡时,在恒温恒容条件下充入稀有气体,由于各组分的浓度没有变化,则化学平衡不会移动,CO(NH2)2(l)的质量不变;
故答案为:不变;
Ⅱ(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-)=4×10-14,过量的c(OH-)=[0.9V−0.1V/2V]=0.4mol/L,
由该温度下的Kw可知,c(H+)=
4×10−14
0.4mol/L=10-13mol•L-1,所以pH=13,
故答案为:13;
(2)存在CH3COOH⇌H++CH3COO-电离平衡,加入CH3COONa固体,c (CH3COO-)增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大;
故答案为:醋酸溶液中存在电离平衡:CH3COOH⇌H++CH3COO-电离平衡,当加入CH3COONa固体时,CH3COO-浓度增大,使CH3COOH电离平衡逆向移动,H+浓度降低,故pH增大;点评:
本题考点: 热化学方程式;化学平衡的影响因素;弱电解质在水溶液中的电离平衡;pH的简单计算.
考点点评: 本题考查化学平衡的影响因素,平衡常数、转化率的计算,弱电解质电离平衡的分析应用,电解质溶液中离子浓度大小比较,综合性较强,难度较大.1年前查看全部
- (2014•顺义区一模)在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四
(2014•顺义区一模)在高中阶段化学学科中所涉及的平衡理论主要包括:化学平衡、电离平衡、水解平衡和难溶电解质溶解平衡四种,均符合勒夏特列原理,它们在工农业生产中都有广泛的应用.请回答下列问题:
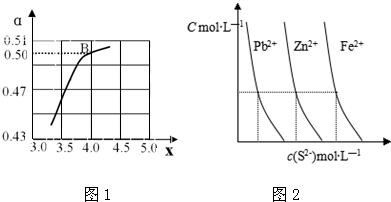
Ⅰ:(1)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l).
①已知该反应的平衡常数K195℃<K165℃,则该反应的△H______0(填“>”“=”或“<”).
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)
=x,图1是氨碳比(x)与CO2平衡转化率(α)的关系.α随着x增大的原因是______;B点处,NH3的体积分数为______%(保留小数点后一位).n(NH3) n(CO2)
③取一定量的NH3和CO2放在一个带活塞的密闭真空容器中在一定温度下反应达平衡,若在恒温、恒容下充入气体He,CO(NH2)2(l)的质量______(填“增加”、“减小”或“不变”).
Ⅱ:(1)某温度下,纯水中c(H+)=2.0×10-7mol/L,该温度下,0.9mol/L NaOH溶液与0.1mol/L HCl溶液等体积混合(不考虑溶液体积变化)后,溶液的pH=______.
(2)向100mL 0.10mol/L CH3COOH的溶液中加入0.010mol CH3COONa固体,溶液pH增大,主要原因是(请用学过的平衡理论解释)______;
已知该混合溶液中c(Na+)<c(CH3COO-),则c(CH3COOH)______c(CH3COO-)(填“>”、“<”或“=”)
Ⅲ:(1)图2为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况.如果向三种沉淀中加盐酸,最先溶解的是______(填化学式).
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀最终会转化为______(填化学式)沉淀. pixiulaile1年前1
pixiulaile1年前1 -
 tingonly 共回答了12个问题
tingonly 共回答了12个问题 |采纳率91.7%解题思路:Ⅰ.①依据平衡常数随温度变化分析判断反应吸热放热;
②增大反应物浓度,平衡正向进行;依据x含义和图象数据分析结合化学方程式换算氨气转化率;
③恒温恒容条件下,充入稀有气体,反应体系中各组分的浓度不变,平衡不移动;
Ⅱ.Ⅱ(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),先计算出过量的c(OH-),再结合Kw计算c(H+),得出反应后的溶液的pH;
(2)存在CH3COOH⇌H++CH3COO-电离平衡,氢离子浓度减小则pH增大;该混合溶液中c (Na+)<c (CH3COO-),则水解小于电离;
Ⅲ.(1)根据图2判断出PbS(s)、ZnS(s)、FeS(s)的溶度积、溶解度大小,溶解度越大,加入盐酸后先溶解;
(2)根据PbS(s)、ZnS(s)、FeS(s)的溶解度大小及难溶物溶解平衡判断沉淀转化情况.Ⅰ:①平衡常数随温度升高减小,说明正反应为放热反应,△H<0,故答案为:<;
②2NH3 (g)+CO2 (g)⇌CO(NH2)2 (l)+H2O (l),图象分析判断,增大氨气浓度平衡正向进行;
B点处x=4,原料气中的NH3和CO2的物质的量之比为4,二氧化碳转化率为0.50,假设氨气为4mol,二氧化碳为1mol,则反应的二氧化碳为0.50mol,
依据化学方程式2NH3(g)+CO2(g)⇌CO(NH2)2(l)+H2O(l)反应消耗的氨气为1mol,
NH3的平衡转化率=[1mol/4mol]×100%=25%,
故答案为:c(NH3)增大,平衡正向移动,CO2转化率增大;25;
③达到平衡时,在恒温恒容条件下充入稀有气体,由于各组分的浓度没有变化,则化学平衡不会移动,CO(NH2)2(l)的质量不变,
故答案为:不变;
Ⅱ(1)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-)=4×10-14,过量的c(OH-)=[0.9V−0.1V/2V]=0.4mol/L,
由该温度下的Kw可知,c(H+)=
4×10−14
0.4mol/L=10-13mol•L-1,所以pH=13,
故答案为:13;
(2)存在CH3COOH⇌H++CH3COO-电离平衡,加入CH3COONa固体,c (CH3COO-)增大,则平衡逆向移动,抑制醋酸电离,溶液氢离子浓度减小则pH增大,
该混合溶液中c (Na+)<c (CH3COO-),则醋酸根离子的水解程度小于其电离程度,所以c(CH3COOH)<c (CH3COO-),
故答案为:醋酸溶液中存在电离平衡:CH3COOH⇌H++CH3COO-电离平衡,当加入CH3COONa固体时,CH3COO-浓度增大,使CH3COOH电离平衡逆向移动,H+浓度降低,故pH增大;<;
Ⅲ.(1)根据图2可知,PbS(s)、ZnS(s)、FeS(s)的溶度积大小关系为:Ksp(CuS)<Ksp(ZnS)<Ksp(FeS),则溶解度PbS<ZnS<FeS,如果向三种沉淀中加盐酸,最先溶解的是溶解度最大的FeS,
故答案为:FeS;
(2)向新生成的ZnS浊液中滴入足量含相同浓度的Cu2+、Fe2+的溶液,由于Ksp(PbS)<Ksp(ZnS)<Ksp(FeS),溶解度PbS<ZnS<FeS,则振荡后,ZnS沉淀会转化为更难溶的PbS,
故答案为:PbS.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡建立的过程;化学平衡的影响因素;难溶电解质的溶解平衡及沉淀转化的本质;离子浓度大小的比较.
考点点评: 本题考查了化学平衡影响因素、酸碱混合定性判断及溶液酸碱性与溶液pH的计算、难溶物溶解平衡及沉淀转化等知识,题目难度较大,试题题量较大,考查较为综合,注意明确水的电离、弱电解质的电离、盐类水解、难溶物溶解平衡等知识即可解答,注意混合后溶液中的溶质判断为解答的关键,试题充分培养了学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.1年前查看全部
- 下列说法正确的是( )A.向Na2CO3溶液通入CO2,可使水解平衡:CO32-十H2O⇌HCO3-+OH一向正反应方
下列说法正确的是( )
A.向Na2CO3溶液通入CO2,可使水解平衡:CO32-十H2O⇌HCO3-+OH一向正反应方向移动,则溶液pH增大
B.室温时,0.1mo1•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4
C.25℃时,pH=13的1L Ba(OH)2溶液中含有的OH一数目为0.2NA
D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH bmcli1年前1
bmcli1年前1 -
 不想再这样下去 共回答了16个问题
不想再这样下去 共回答了16个问题 |采纳率87.5%解题思路:A、二氧化碳结合了溶液中的氢氧根离子,溶液pH减小;
B、根据PH的计算公式计算;
C、pH=13的氢氧化钡溶液中氢氧根离子的浓度为0.1mol/L;
D、pH使用时试纸不能湿润.A、由于碳酸钠和二氧化碳反应,溶液中氢氧根离子浓度减小,溶液pH减小,故A错误;
B、溶液中的氢离子浓度是1×10-4mol/L,pH=4,故B正确;
C、25℃时,pH=13的1L Ba(OH)2溶液中含有0.1mol氢氧根离子,含有的氢氧根离子数目为0.1NA,故C错误;
D、pH试纸使用前不能湿润,湿润后可能会影响测定结果,故D错误;
故选B.点评:
本题考点: 影响盐类水解程度的主要因素;弱电解质在水溶液中的电离平衡.
考点点评: 本题考查了盐的水解、弱电解质的电离、pH试纸使用,涉及知识点较多,难度不大.1年前查看全部
- 下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数
下列关于化学平衡常数(K),电离平衡常数(Ka或Kb),水解平衡常数(Kh),沉淀溶解平衡常数(Ksp),水的离子积常数(Kw)的叙述中错误的是( )
A.K值越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了
B.比较Ksp与离子积Qc的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解
C.K、Ka或Kb、Kh、Ksp、Kw都与温度有关,温度越高,常数值越大
D.弱酸HA的Ka与NaA的Kh、水的离子积常数Kw三者间的关系可表示为:Kw=Ka•Kh lunest1年前1
lunest1年前1 -
 不服就干 共回答了19个问题
不服就干 共回答了19个问题 |采纳率94.7%解题思路:A.K值越大,反应物的转化率越大、生成物的量越大;
B.根据Ksp与离子积Qc的相对大小确定难溶物是否产生或溶解;
C.平衡常数只有温度有关,与浓度无关;
D.Kw=c(H+).c(OH-)=
.c(H+).c(A−) c(HA)
.c(OH−).c(HA) c(A−) A.K值越大,反应物的转化率越大、生成物的量越大,正反应进行的程度越大,一般地说,K>105时,该反应进行得就基本完全了,故A正确;
B.根据Ksp与离子积Qc的相对大小确定难溶物是否产生或溶解,如果Ksp>Qc,则难溶物没有沉淀生成,如果Ksp=Qc,则溶液恰好饱和,如果Ksp<Qc,则有沉淀生成,故B正确;
C.平衡常数只有温度有关,与浓度无关,如果化学反应正反应是放热反应,升高温度化学平衡常数减小,故C错误;
D.Kw=c(H+).c(OH-)=
c(H+).c(A−)
c(HA).
c(OH−).c(HA)
c(A−)=Ka•Kh,故D正确;
故选C.点评:
本题考点: 化学平衡常数的含义.
考点点评: 本题考查了平衡常数的有关知识,知道平衡常数的含义、表达式,平衡常数只与温度有关,弱电解质的电离平衡常数与溶液酸碱性无关、溶液浓度无关,为易错点.1年前查看全部
- 下列关于化学平衡常数(K),电离平衡常数(K a 或K b ),水解平衡常数(K h ),沉淀溶解平衡常数(K sp )
下列关于化学平衡常数(K),电离平衡常数(K a 或K b ),水解平衡常数(K h ),沉淀溶解平衡常数(K sp ),水的离子积常数(K w )的叙述中错误的是
A.K值越大,正反应进行的程度越大,一般地说,K>10 5 时,该反应进行得就基本完全了 B.比较K sp 与离子积Q c 的相对大小,可判断难溶电解质在给定条件下沉淀能否生成或溶解 C.K、K a 或K b 、K h 、K sp 、K w 都与温度有关,温度越高,常数值越大 D.弱酸HA的K a 与NaA的K h 、水的离子积常数K w 三者间的关系可表示为:K w =K a ·K h  Premo_light1年前1
Premo_light1年前1 -
 mailinda5201314 共回答了20个问题
mailinda5201314 共回答了20个问题 |采纳率100%C
1年前查看全部
- 碳酸氢钠和碳酸钠溶液都存在电离平衡和水解平衡吗?
 巫女羽柴1年前1
巫女羽柴1年前1 -
 丰要是要 共回答了20个问题
丰要是要 共回答了20个问题 |采纳率95%存在.前者电离大于水解,后者水解大于电离1年前查看全部
- 能否用水解平衡常数衡量盐的水解程度?
 illott1年前1
illott1年前1 -
 doulove 共回答了19个问题
doulove 共回答了19个问题 |采纳率100%可以啊,同样条件下平衡常数越大水解程度越大
不要要注意水解方程式的形式需相同.1年前查看全部
- 盐类水解平衡的影响因素问题?加大盐的浓度,水解平衡向右移,但水解程度下降; 加水,水解平衡向右移,水解程度加大 这两条.
盐类水解平衡的影响因素问题?
加大盐的浓度,水解平衡向右移,但水解程度下降;
加水,水解平衡向右移,水解程度加大
这两条.. 六稻葱1年前1
六稻葱1年前1 -
 cocowxu1985 共回答了22个问题
cocowxu1985 共回答了22个问题 |采纳率90.9%首先平衡的条件是勒沙特列原理即平衡总是向减小改变的方向移动.盐类水解程度是已水解的盐的物质的量除以总的盐的物质的量.
例如醋酸钠水解,加入了醋酸钠,醋酸钠本身的浓度增加了,所以他的水解方向向着减少醋酸根的浓度方向而进行的.但是水解的醋酸根没有加入的醋酸根多,所以平衡右移而水解程度下降了.
还是同样的原理,加入水后,醋酸根的浓度减小了,所以水解向着增加醋酸跟的方向进行.醋酸跟水解的多了,但是总的醋酸跟并没有增加,所以水解程度增加了,明白了吗?1年前查看全部
- 试用水解平衡移动原理解释:漂白粉溶液中加入少量醋酸会增强漂白效果.
 小嗳1年前3
小嗳1年前3 -
 魔鬼耶和华 共回答了17个问题
魔鬼耶和华 共回答了17个问题 |采纳率94.1%漂白粉中能够产生次氯酸的物质是次氯酸钙,它是一种弱酸弱碱盐,水解会产生次氯酸和氢氧化钙,并很快达到水解平衡.加入少量醋酸会中和氢氧化钙,使溶液中氢氧化钙的量迅速减少,从而打破水解平衡.为维持溶液中各组分的量能达到一定数值,次氯酸钙会继续水解,再次生成次氯酸和氢氧化钙并达到水解平衡,随即产生的氢氧化钙继续被醋酸中和,平衡被打破,重复刚才的过程.
经过达到平衡——平衡被打破——再次达到平衡——平衡再度被打破……这样不断产生氢氧化钙和次氯酸,但是醋酸只中和氢氧化钙,而不消耗次氯酸,导致溶液当中次氯酸的含量比较大,从而漂白效果好1年前查看全部
- 在一定条件下Na2CO3溶液存在水解平衡,下列说法正确的是( )【双选】
在一定条件下Na2CO3溶液存在水解平衡,下列说法正确的是( )【双选】
(A)Na2CO3溶液中:c(Na+)>c(CO3 2-)>c(OH-)>c(H+)
(B)升高温度,平衡向正反应方向移动
(C)稀释溶液,溶液中c(H+)和c(OH-)都减小
(D)加入NaOH固体,溶液pH减小 拉拉梳子1年前8
拉拉梳子1年前8 -
 雪后浮云 共回答了18个问题
雪后浮云 共回答了18个问题 |采纳率94.4%A:正确.显然有(Na+)>c(CO3 2-),和c(OH-)>c(H+),至于c(CO3 2-)>c(OH-),是因为CO3 2-水解程度不太大
B:正确.水解是吸热反应,升温可促进衡向正反应方向移动
C:错误.因为c(H+)*c(OH-)=Kw,不可能同时减小.事实上,稀释后c(OH-)减小,c(H+)增加
D:错误.NaOH加入会抑制Na2CO3的水解,但NaOH本身引入大量OH-,溶液总的c(OH-)增加,pH增大1年前查看全部
- 醋酸钠溶液升温,PH怎么变?直接从水解平衡角度考虑吗?可是升温后水的离子积也增大啊?
 c94536fd000e3c7b1年前1
c94536fd000e3c7b1年前1 -
 xinjian007 共回答了21个问题
xinjian007 共回答了21个问题 |采纳率85.7%盐类水解是吸热的,故升温有利水解平衡向右移动,水解程度增大,CO32- +H2O == HCO3-+OH- OH-增多,PH增大
水不考虑 因为水电离的H+和OH- 始终相等1年前查看全部
- 影响水解的因素有哪些,请详细说下,那些因素怎么变化,水解平衡怎么变化
 fayehadith1年前4
fayehadith1年前4 -
 ypt781024 共回答了19个问题
ypt781024 共回答了19个问题 |采纳率84.2%升温促进水解
稀释促进水解
只要记住这两点1年前查看全部
- 一定条件下,CH 3 COONa溶液存在水解平衡:CH 3 COO - +H 2 O⇌CH 3 COOH+OH - .下
一定条件下,CH 3 COONa溶液存在水解平衡:CH 3 COO - +H 2 O⇌CH 3 COOH+OH - .下列说法正确的是( ) A.加入少量NaOH固体,c(CH 3 COO - ) 减小 B.升高温度,溶液的pH增大 C.稀释溶液,溶液的pH增大 D.通入少量HCl气体,水解平衡常数减小  zhouweidam1年前1
zhouweidam1年前1 -
 青菜大白菜 共回答了24个问题
青菜大白菜 共回答了24个问题 |采纳率100%A、CH 3 COONa溶液存在水解平衡:CH 3 COO - +H 2 O⇌CH 3 COOH+OH - .加入氢氧化钠溶解后氢氧根离子浓度增大,平衡左移c(CH 3 COO - ) 增大,故A错误;B、CH 3 COONa溶液存在水解平衡:CH 3 COO - +H 2...1年前查看全部
大家在问
- 1wish the girl to know 英语翻译 急需 求解
- 2高一数学求下列各式的值log₂5-log₂20
- 3怎么样培养自己的气势?培养自己的气势有哪些方法?
- 4如图,在平行四边形ABCD中,E、F分别是AD、BC上一点且DE=BF,CE、AF的延长线交BA、DC延长线于点G、H,
- 5he not only easily accepts other people's opinions,but he is
- 6四年级作文《感谢我的同班同学》三百字.
- 7.两个数的和是70,它们的最大公因数是7,求这两个数的差是多少?
- 81、梨子比苹果多72千克,苹果比梨子千克少3/5,梨子运来( )千克,苹果( )千克,两种水果共( )千克
- 9stay at somewhere doing还是to do
- 10读《荷塘月色》,划出文中议论和直接抒情的句子,并说出感情变化脉路。
- 11关于函数对称变换的一些问题、有兴趣的来讨论一下吧!
- 12the children piay lots of 急.
- 13五年级1班有42人,2班有48人。各班分组参加植树活动,如果两个班每组人数相同,可以怎样分?每组最多有多少人
- 14已知3x+y=4,x+3y=8,那么x+y的值为?
- 15用正确的单词填空.1.There are ____________ months and ____________ se
