小理对家里的电磁炉进行研究,电磁炉的功率调节范围是120W~2200W,
 rickysp2022-10-04 11:39:541条回答
rickysp2022-10-04 11:39:541条回答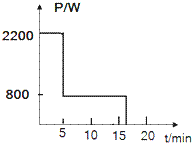 小理对家里的电磁炉进行研究,电磁炉的功率调节范围是120W~2200W,
小理对家里的电磁炉进行研究,电磁炉的功率调节范围是120W~2200W,(1)小理用电磁炉将质量为2kg的水从20℃加热到100℃,消耗了0.22kw•h的电能.水吸收的热量是多少?这时电磁炉的效率是多少?
(2)小理用电磁炉煮粥.先用大火将水开,后用小火煮.这段时间电功率随时间变化如图18所示问第8分钟通过电磁的电流是多少?[水的比热是4.2×103J/(kg•℃),家庭电路的电压为220V].

已提交,审核后显示!提交回复
共1条回复
 活在我的世界里 共回答了14个问题
活在我的世界里 共回答了14个问题 |采纳率57.1%- 解题思路:(1)知道水的质量、水的比热容、水的初温和末温,利用吸热公式Q吸=cm△t求水吸收的热量(有用能量);又知道消耗的电能(总能量),利用效率公式求电磁炉的效率;
(2)从电功率随时间变化图象上得出第8分钟,电磁炉的电功率,利用P=UI求此时通过电磁炉的电流.(1)水吸收的热量:
Q吸=cm△t
=4.2×103J/(kg•℃)×2kg×(100℃-20℃)
=6.72×105J,
消耗的电能:
W=0.22kW•h=0.22×3.6×106J=7.92×105J,
电磁炉的效率:
η=
Q吸
W=
6.72×105J
7.92×105J≈84.8%;
(2)由图知,第8分钟电磁炉的电功率P=800W,
∵P=UI,
∴通过电磁炉的电流:
I=[P/U]=[800W/220V]≈3.64A.
答:(1)水吸收的热量是6.72×105J,这时电磁炉的效率是84.8%;
(2)第8分钟通过电磁的电流是3.64A.点评:
本题考点: 电功与热量的综合计算.
考点点评: 本题是一道电学与热学的综合计算题,考查了热量的计算、电磁炉的效率、电功率公式P=UI的应用,记住是kw•h电功的单位以及与焦耳(J)的关系1kw•h=3.6×106J,能从P-t图象得出相关信息是解本题的关键之一. - 1年前
相关推荐
- 小理同学的质量为50kg,他站立在承平地面时,双脚鞋底与地面接触面积约为0.04m2.g取10N/kg,求:
小理同学的质量为50kg,他站立在承平地面时,双脚鞋底与地面接触面积约为0.04m2.g取10N/kg,求:
(1)小理同学的重力;
(2)小理同学对地面的压强. ak331741年前1
ak331741年前1 -
 夏日的终结 共回答了16个问题
夏日的终结 共回答了16个问题 |采纳率93.8%解题思路:(1)已知小理同学的质量为50kg,g取10N/kg,再利用公式G=mg,计算即可;(2)已知小理同学站立在水平地面,受到的压力等于重力,双脚鞋底与地面接触面积约为0.04m2,最后再利用公式P=FS计算即可;(1)G=mg=50kg×10N/kg=500N;
(2) F=G=500N;
P=[F/S]=
500N
0.04m2=1.25×104Pa;
答:(1)小理同学的重力是500N;
(2)小理同学对地面的压强1.25×104Pa;点评:
本题考点: 重力的计算;压强的大小及其计算.
考点点评: 本题考查有关重力、压强的计算,解题的关键是熟记相关的公式再代入数值计算;当接触面水平时,计算物体对地面的压强时,要找出物体受到的压力等于重力这个条件.1年前查看全部
- 在实验操作考核中,小理同学抽到的题目是“氧气的制取、检验和性质”的实验.小刚同学抽到的题目是“二氧化碳的制取、检验和性质
在实验操作考核中,小理同学抽到的题目是“氧气的制取、检验和性质”的实验.小刚同学抽到的题目是“二氧化碳的制取、检验和性质”的实验.实验室现有高锰酸钾、稀硫酸、稀盐酸、石灰石、棉花、碳酸钠粉末及以下仪器:
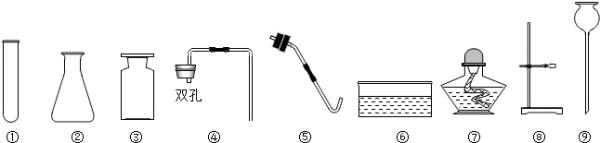
(1)请写出代号⑨的仪器名称______;
(2)小理利用上述药品制取氧气,其中发生装置所需要的仪器有______(填序号);
制取该气体的化学方程式为______;检验氧气的方法是______;
(3)要制取二氧化碳,小刚同学应从以上药品中选择______和______反应.请写出用澄清石灰水检验二氧化碳时发生反应的化学方程式:______.
(4)进行细铁丝在氧气中燃烧的实验,反应的化学方程式是3Fe+2O2
Fe3O4点燃 .3Fe+2O2.
Fe3O4点燃 .
(5)如右图所示,向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的性质是______,且密度比空气的大.因此,二氧化碳可用于______(写出一种用途). hww01271年前1
hww01271年前1 -
 吹泡泡的小妞 共回答了29个问题
吹泡泡的小妞 共回答了29个问题 |采纳率96.6%解题思路:(1)写出常见仪器名称即可;
(2)为实验室利用加热分解高锰酸钾制取氧气选择所需要的仪器,并写出反应的化学方程式和检验方法;
(3)写出实验室制取二氧化碳的所用药品和检验二氧化碳的化学方程式;
(4)细铁丝在氧气中燃烧的产物是四氧化三铁;
(5)根据二氧化碳具有的性质判断二氧化碳可用来灭火.(1)图中⑨是长颈漏斗;
(2)利用高锰酸钾制取氧气时,需要对高锰酸钾进行加热,因此发生装置应由试管、酒精灯、单孔橡胶塞(带导管)、铁架台所组成;由于图中导管所限,收集时只能采取排水法收集,因此还需要集气瓶、水槽等仪器;反应的化学方程式为2KMnO4
△
.
K2MnO4+MnO2+O2↑;
(3)实验室制取二氧化碳时选用块状石灰石或大理石与稀盐酸反应,检验二氧化碳,用澄清石灰水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
(4)细铁丝在氧气中燃烧的产物是四氧化三铁;
(5)向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的性质是不燃烧,不支持燃烧,可用来灭火.
故答案为:
(1)长颈漏斗
(2)①⑤⑦⑧;2KMnO4═K2MnO4+MnO2+O2↑
将带火星的木条伸入瓶中
(3)石灰石、稀盐酸;CO2+Ca(OH)2═CaCO3↓+H2O
(4)3Fe+2O2
点燃
.
Fe3O4.
(5)不燃烧,不支持燃烧;灭火点评:
本题考点: 氧气的制取装置;常用仪器的名称和选用;二氧化碳的实验室制法.
考点点评: 对实验室制取气体的装置进行考查,体现出对发生装置的适用范围及装置的组成的熟练程度.1年前查看全部
- 在体育中考50m跑测试时,小理的成绩是8s,求:他的平均速度是多少?
 我爱厨房厨房爱我1年前1
我爱厨房厨房爱我1年前1 -
 mmderry 共回答了31个问题
mmderry 共回答了31个问题 |采纳率87.1%解题思路:知道运动时间和路程,根据v=[s/t]求出运动速度.已知:路程s=50m,时间t=8s
求:平均速度v=?
他的平均速度v=[s/t]=[50m/8s]=6.25m/s.
答:他的平均速度为6.25m/s.点评:
本题考点: 速度的计算.
考点点评: 此题主要考查的是学生对速度计算公式的理解和掌握,基础性题目.1年前查看全部
- 在实验操作考核中,小理同学抽到的题目是“氧气的制取、检验和性质”的实验.小刚同学抽到的题目是“二氧化碳的制取、检验和性质
在实验操作考核中,小理同学抽到的题目是“氧气的制取、检验和性质”的实验.小刚同学抽到的题目是“二氧化碳的制取、检验和性质”的实验.实验室现有高锰酸钾、稀硫酸、稀盐酸、棉花、碳酸钙及以下仪器:

①(1分)请写出代号⑨的仪器名称______;
②(5分)小理利用上述药品制取氧气,其中发生装置所需要的仪器有______(填序号);制取该气体的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑△ .2KMnO4;检验氧气的方法是______;
K2MnO4+MnO2+O2↑△ .
③(2分)进行细铁丝在氧气中燃烧的实验,反应的化学方程式是3Fe+2O2
Fe3O4点燃 .3Fe+2O2.
Fe3O4点燃 .
④(2分)要制取二氧化碳,小刚同学应从以上药品中选择______和______反应.
⑤(2分)如图所示,向烧杯中倾倒二氧化碳,下层蜡烛先熄灭,上层蜡烛后熄灭,说明二氧化碳具有的性质是______,且密度比空气的大.因此,二氧化碳可用于______(写出一种用途). ydh11231年前1
ydh11231年前1 -
 买撒跌撒 共回答了12个问题
买撒跌撒 共回答了12个问题 |采纳率91.7%解题思路:(1)根据常见的仪器及仪器的名称来回答代号⑨的仪器名称;
(2)根据固体加热装置来选择仪器,利用反应物和生成物来书写化学反应方程式,利用氧气的助燃性来检验氧气;
(3)根据反应物和生成物来书写化学反应方程式;
(4)制取二氧化碳一般利用酸与碳酸盐反应得到,然后利用给出的药品进行选择;
(5)根据蜡烛的熄灭来回答二氧化碳的性质,然后利用性质决定用途来分析解答其用途.(1)由图可知⑨指的是长颈漏斗,故答案为:长颈漏斗;
(2)因用高锰酸钾制取氧气需要加热,则需要铁架台、试管、酒精灯、橡皮塞、导管,收集气体利用排水法时选择集气瓶、水槽,则选择仪器的序号为①③⑤⑥⑦⑧,高锰酸钾加热分解生成锰酸钾、二氧化锰、氧气,因氧气具有助燃性,能使带火星的木条复燃,可用来检验氧气,故答案为:①③⑤⑥⑦⑧;2KMnO4
△
.
K2MnO4+MnO2+O2↑;将带火星木条伸入瓶中,复燃,证明是氧气;
(3)因反应物是铁和氧气,生成物是四氧化三铁,故答案为:3Fe+2O2
点燃
.
Fe3O4;
(4)因酸与碳酸盐能反应生成二氧化碳,给出的药品中酸中因硫酸钙微溶物阻止反应的进行,则可以选盐酸,碳酸盐只有碳酸钙,故答案为:稀盐酸;碳酸钙;
(5)根据蜡烛的熄灭可知,二氧化碳不燃烧也不支持燃烧,则利用此性质可以灭火,故答案为:不能燃烧不支持燃烧;灭火(其它合理答案).点评:
本题考点: 氧气的制取装置;常用仪器的名称和选用;二氧化碳的实验室制法.
考点点评: 本题考查了氧气和二氧化碳的制取,学生应学会利用反应原理来选择仪器和药品,并能利用气体的性质来分析气体的检验及用途等.1年前查看全部
大家在问
- 1如图,两条笔直的公路l 1 、l 2 相交于点O,村庄C的村民在公路的旁边建三个加工厂A、B、D,已知AB=BC=CD=
- 2《三国演义》习题.1.《三国演义》中智者的化身当属军师诸葛亮,他未出茅庐,便知天下三分之事,书中记叙了有关他的许多脍炙人
- 3电热饮水机有加热和保温两种工作状态(由机内温控开关S0自动控制),从说明书上收集到如下表的参数和如图所示的电路原理图.求
- 4根据拼音写出句子括号处应填入的词语。
- 5有一种“24点”游戏,其游戏规则是这样的:(以下内容在问题补充里)
- 6电学部分的.急用!明天交作业,1.灯1的电功率是100W,灯2的电功率是40W,串联在总电压为220V的电路中,哪一个灯
- 7设x,y∈正R.且xy-(x+y)=1.求xy最值,x+y最值
- 8假如没有太阳作文600说明文
- 9《江南春》,作者在描绘江南明媚可爱的春光时,慨叹历史兴亡,流露( )之感,寄托了讽喻之意.
- 10sina=0.889,a角是多少度
- 11油绿色 用英文怎么说?我开始也认为是oil green 可是,有哪位能确切的告诉我到底怎么说呢?
- 12判一判.(1) 4 3 是最简分数.______(2)分母是12的最简分数有5个.______(3) 6 10 = 6÷
- 13美丽的校服 作文
- 14feel differently和feel different的不同
- 15姚明今天得了几分?
