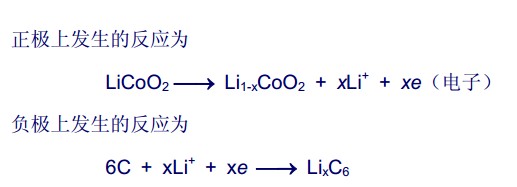Ag(s)|AgI(s)|HI(a1)||HI(a2)|AgI(s)|Ag(s) 电极反应,电池反应,电动势的表达式怎么
 MrJava2022-10-04 11:39:541条回答
MrJava2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 嘿龍马 共回答了18个问题
嘿龍马 共回答了18个问题 |采纳率88.9%- (—)极反应:Ag + I- (a1) - e = AgI
( +)极反应:AgI + e = Ag + I- (a2)
电池反应: I- (a1) = I- (a2) 这是个浓差电池
电动势表达式:E = Eθ - RT/nF ln [a2( I- ) / aθ ]/[a1( I- ) / aθ ] = - RT/nF ln [a2( I- )]/[a1( I- )] - 1年前
相关推荐
- 用两根铜棒做电极,电解硝酸银溶液,跟电源正极相连的一极发生的电极反应是( ) A.Cu-2e - =Cu 2+ B.4
用两根铜棒做电极,电解硝酸银溶液,跟电源正极相连的一极发生的电极反应是( ) A.Cu-2e - =Cu 2+ B.4OH - -4e - =2H 2 O+O 2 ↑ C.2H + +2e - =H 2 ↑ D.Ag + +e - =Ag  zongzhi2251年前1
zongzhi2251年前1 -
 peegcai 共回答了21个问题
peegcai 共回答了21个问题 |采纳率81%用两根铜棒做电极,电解硝酸银溶液,跟电源正极相连的一极为阳极,铜做阳极失电子发生氧化反应,电极反应为Cu-2e - =Cu 2+ ;
故选A.1年前查看全部
- (2009•松江区二模)钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
(2009•松江区二模)钢铁发生吸氧腐蚀时,正极上发生的电极反应是( )
A.2H2O+O2+4e→4OH-
B.Fe-2e→Fe2+
C.2H++2e→H2
D.Fe-3e→Fe3+ humin3511年前1
humin3511年前1 -
 angle97531 共回答了20个问题
angle97531 共回答了20个问题 |采纳率95%解题思路:根据电极材料的活泼性判断正负极,根据电极上发生反应的类型判断电极反应式.钢铁中含有碳、铁,根据原电池工作原理,活泼的金属作负极,不如负极活泼的金属或导电的非金属作正极,所以碳作正极,铁作负极;负极失电子变成离子进入溶液,正极上得电子发生还原反应,钢铁发生吸氧腐蚀时,正极上氧气得电子和水反应生成氢氧根离子.
故选A.点评:
本题考点: 金属的电化学腐蚀与防护.
考点点评: 本题考查了金属的腐蚀与防护;对于钢铁的吸氧腐蚀,正极上电极反应式的书写往往写错,要注意生成的是氢氧根离子,不是其它微粒.1年前查看全部
- 铁和碳在稀硫酸溶液中的电极反应 总反应 以及电极名称 反应类型求解
 Neo_hu1年前5
Neo_hu1年前5 -
 senddaisy 共回答了12个问题
senddaisy 共回答了12个问题 |采纳率66.7%铁为负极,反应式:Fe - 2e-=Fe2-.
碳为正极,反应式:2H - + 2e-=H2.
总反应:Fe+2H + =Fe2+ + H2(气体)
析氢腐蚀.
在溶液中c外电荷为饱和稳定状态 不参与反应 只是在c棒一极有气体生成 在溶液中可观察到有气泡生成
置换反应(有氢气出来)
也可认为是氧化还原反应(有失有得)1年前查看全部
- 总:2H2+O2==2H2O电解质为H2SO4,它的电极反应?
 ttt3e1年前1
ttt3e1年前1 -
 warlunian 共回答了18个问题
warlunian 共回答了18个问题 |采纳率94.4%正极:O2 + 4H+ + 4e==2H2O
负极:2H2 - 4e==4H+
因为是硫酸做电解质,所以是氢离子参与反应1年前查看全部
- 原电池与电解池的比较(一点点)比较:(1)电极名称(2)电极反应(氧化反应,还原反应)(3)电子流向
 xigua17681年前2
xigua17681年前2 -
 wwb1619 共回答了13个问题
wwb1619 共回答了13个问题 |采纳率92.3%原电池负极在电解池叫阴极
原电池正极在电解池叫阳极
原电池的负极发生氧化反应,失电子
电解池的阴极发生还原反应,得电子
以此类推..
原电池电子由负极流向正极
电解池电子也由负极流向正极1年前查看全部
- 写出用惰性电极电解下列物质的电极反应
写出用惰性电极电解下列物质的电极反应
注:阴极反映、阳极反应.总反映
Na2SO4、H2SO4、NaOH、H2O、NaCl、CuSO4 jtwlx1年前1
jtwlx1年前1 -
 JACK0108131 共回答了17个问题
JACK0108131 共回答了17个问题 |采纳率82.4%我给你说在溶液中电解这些溶质的反应:
1,Na2SO4、H2SO4、NaOH、都一样是电解水
阳极:4OH-4e=O2↑+H2O
阴极:4H+4e=2H2 ↑
4OH+4H=O2↑+H2O +2H2 ↑
水中有氢氧根离子和氢离子,有电流通过的时候,氢氧根离子失电子,生成氧气和水;氢离子得电子,生成氢气.
NaCl:
2,2 NaCl + 2 H2O=电解=2 NaOH + Cl2↑+ H2↑
阳极产物:NaOH ,Cl2
阳极反应:2Cl--2e-=Cl2↑
阴极产物:H2
阴极反应:2H++2e-=H2↑
离子方程式为
2Cl-+2H2O=Cl2↑+H2↑+2OH-
3,
CuSO4 :
阴极2Cu2++4e-=2Cu
阳极4OH--4e-=2H2O+O2↑.
2(Cu2+)+4(OH-)=2Cu+O2↑+2H2O
(点写你列的物质一般生成相应单质)1年前查看全部
- 熔融状态无离子定向移动,那为什么有电极反应的离子方程式?
 yoyo开心1年前1
yoyo开心1年前1 -
 shad5555 共回答了15个问题
shad5555 共回答了15个问题 |采纳率93.3%有电源就定向了1年前查看全部
- 惰性电极电解AgNO3溶液的电极反应!
 youchezu1年前2
youchezu1年前2 -
 与你同舟 共回答了21个问题
与你同舟 共回答了21个问题 |采纳率81%阴极是给电子的电极,溶液中可以得到电子的有H+ 和Ag+,根据金属活动顺序,失电子哪里H>Ag,
得电子能力就是H+1年前查看全部
- 银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为&
银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A.锌为正极,Ag2O为负极
B.原电池工作时,正极区PH减小
C.锌为负极,Ag2O为正极
D.原电池工作时,负极区PH增大 liubing7710281年前1
liubing7710281年前1 -
 xzqsq 共回答了20个问题
xzqsq 共回答了20个问题 |采纳率100%解题思路:该原电池中,锌失电子发生氧化反应而作负极,银作正极,正极上氧化银得电子发生还原反应,负极上氢氧根离子参加反应,正极上生成氢氧根离子,根据氢氧根离子浓度变化确定电极附近pH变化,据此分析解答.A.根据电极反应式知,锌失电子发生氧化反应而作负极,氧化银作正极,故A错误;
B.原电池放电时,正极附近生成氢氧根离子,导致氢氧根离子浓度增大,则正极区pH增大,故B错误;
C.根据A知,锌作负极,氧化银作正极,故C正确;
D.原电池放电时,负极上氢氧根离子参加反应,导致负极附近氢氧根离子浓度降低,则pH减小,故D错误;
故选C.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查了原电池原理,根据电极反应式中元素化合价变化来确定正负极,结合正负极附近氢氧根离子浓度变化来确定pH变化,难度不大.1年前查看全部
- 电解Nacl溶液时,阴极的电极反应为2H2O+2e-=2OH-+H2,为什么不是直接2H++2e-=H2
 荆州丫头1年前2
荆州丫头1年前2 -
 咖啡酒honey 共回答了21个问题
咖啡酒honey 共回答了21个问题 |采纳率100%也可以的,因为本质上讲是水电离出的氢离子得到电子的,而水又是弱电解质所以可以不拆1年前查看全部
- 原电池中电极反应的反应物一定来源与电极材料或电解质溶液吗
 jfhzj1年前3
jfhzj1年前3 -
 olegsywh 共回答了29个问题
olegsywh 共回答了29个问题 |采纳率82.8%不一定,看类型,比如燃料电池,常见的甲烷电池,正、负极反应物是CH4和O2,工作时它们都是从正负极通入参与电极反应.正负极材料并不是CH4和O2,而常用石墨等惰性电极,电解质可能是酸、碱、中性的一些物质.1年前查看全部
- 银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为负极:Zn+
银锌钮扣电池的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为负极:Zn+2OH--2e-═ZnO+H2O;正极:Ag2O+H2O+2e-═2Ag+2OH-;总反应为:Ag2O+Zn═2Ag+ZnO,下列判断正确的是( )
A. 锌为正极,Ag2O为负极
B. 锌为阳极,Ag2O为阴极
C. 原电池工作时,负极区pH减小
D. 原电池工作时,负极区pH增大 凉粥1年前4
凉粥1年前4 -
 萧萧烟雨 共回答了30个问题
萧萧烟雨 共回答了30个问题 |采纳率83.3%解题思路:A、原电池中失电子的为负极,得到电子的为正极;
B、依据原电池中,电极名称分别为正极和负极来回答;
C、依据负极电极反应导致氢离子或是氢氧根离子浓度的变化情况来分析;
D、依据负极电极反应导致氢离子或是氢氧根离子浓度的变化情况来分析.A、根据电极反应负极:Zn+2OH--2e-═ZnO+H2O;正极:Ag2O+H2O+2e-═2Ag+2OH-,所以锌为负极,Ag2O为正极,故A错误;
B、根据电极反应负极:Zn+2OH--2e-═ZnO+H2O;正极:Ag2O+H2O+2e-═2Ag+2OH-,所以锌为负极,Ag2O为正极,故B错误;
C、根据负极电极反应为Zn+2OH--2e-═ZnO+H2O,消耗氢氧根离子,所以负极区pH减小,故C正确;
D、原电池工作时,负极电极反应为Zn+2OH--2e-═ZnO+H2O,消耗氢氧根离子,所以负极区pH减小,故D错误;
故选:C.点评:
本题考点: 化学电源新型电池.
考点点评: 本题考查了原电池原理的应用,电池电极反应,离子变化分析,依据电极反应分析判断是解题关键,题目难度中等.1年前查看全部
- 锂电池的负极是电极反应是
 btx881年前1
btx881年前1 -
 无心无眠1 共回答了15个问题
无心无眠1 共回答了15个问题 |采纳率86.7%1年前查看全部
- 两个铜片作电极电解盐酸的两个电极反应怎么写?
两个铜片作电极电解盐酸的两个电极反应怎么写?
2H+ +2e=H2↑阴极为什么是这?总反应怎么写? paulzhou19801年前3
paulzhou19801年前3 -
 詠遠Dê箛獨 共回答了37个问题
詠遠Dê箛獨 共回答了37个问题 |采纳率94.6%阳极:Cu-2e=Cu2+
阴极:2H+ +2e=H2↑
总反应
Cu+ 2H+=Cu2+ +H2↑
注意,这是个电极反应,所以不符合金属活性顺序表中的金属活性定义,因为电极反应中有外加的电能,促进了这个反应1年前查看全部
- 已知氧化还原反应zn+cu2+ =zn2++cu,设计一个原电池(1)写出电极反应 (2)画出原电
已知氧化还原反应zn+cu2+ =zn2++cu,设计一个原电池(1)写出电极反应 (2)画出原电
已知氧化还原反应zn+cu2+
=zn2++cu,设计一个原电池(1)写出电极反应
(2)画出原电池的装置图
 rdrp1年前1
rdrp1年前1 -
 basiteng 共回答了15个问题
basiteng 共回答了15个问题 |采纳率93.3%ZN-2E=ZN2+
CU2+ +2E=CU1年前查看全部
- 图中,两电极上发生的电极反应分别为:a极:2Ag + +2e - =2Ag b极:Fe-2e -
图中,两电极上发生的电极反应分别为:a极:2Ag + +2e - =2Agb极:Fe-2e - =Fe 2+ 下列说法不正确的是( ) A.该装置一定是电解池 B.a、b可能是同种电极材料 C.装置中电解质溶液不一定含有Ag + D.装置中发生的反应方程式一定是Fe+2Ag + =Fe 2+ +2Ag 
 不确啊1年前1
不确啊1年前1 -
 zika1981 共回答了15个问题
zika1981 共回答了15个问题 |采纳率100%A.该装置可为电解池,a为阴极,b为阳极,也可为原电池,a为正极,b为正极,故A错误;B.当该装置为电解池时,a、b可都为铁电极材料,故B正确;C.由a极可知,电解质溶液为硝酸银,故C错误;D.a、b两极反应式相...1年前查看全部
- 某溶液中原来Fe3+与Fe2+的浓度相等,若向溶液中加入KCN固体,使CN-得浓度为1.0mol/L,计算这时电极反应
某溶液中原来Fe3+与Fe2+的浓度相等,若向溶液中加入KCN固体,使CN-得浓度为1.0mol/L,计算这时电极反应
Fe3+ + e- =Fe2+ 的电极电势. yjf9111年前1
yjf9111年前1 -
 mmiuci 共回答了20个问题
mmiuci 共回答了20个问题 |采纳率85%需要知道络合物离子的稳定常数才能计算1年前查看全部
- 纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:
Zn +2OH - -2e - = Zn(OH) 2 Ag 2 O + H 2 O + 2e - = 2Ag +2OH - 下列说法正确的是:()A.溶液中OH - 向正极移动,K + 、H + 向负极移动 B.锌发生还原反应,氧化银发生氧化反应 C.锌是负极,氧化银是正极 D.在电池放电过程中,电解质溶液的酸碱性基本保持不变  lana5261年前1
lana5261年前1 -
 266100 共回答了21个问题
266100 共回答了21个问题 |采纳率71.4%C
1年前查看全部
- 电池的电极反应的化学式怎么书写?
 tsl8661年前1
tsl8661年前1 -
 ujiandong 共回答了17个问题
ujiandong 共回答了17个问题 |采纳率94.1%电池的电极反应本质是氧化还原反应的半反应,负极是失去电子发生的氧化反应,正极的电子发生还原反应.所以,第一步先写出完整的氧化还原反应方程式,二,找到氧化剂和还原剂,算出得失多少电子,三,再利用负极是失去电子发生的氧化反应,正极的电子发生还原反应的原则写出反应式.四、负极加正极是原方程式.1年前查看全部
- 铅蓄电池的电极反应的书写正极反应为什么写成PbO2+4H++SO42-+2e-Pb2++2H2O硫酸铅沉淀的话,为什么参
铅蓄电池的电极反应的书写
正极反应为什么写成PbO2+4H++SO42-+2e-Pb2++2H2O
硫酸铅沉淀的话,为什么参考书上没有写沉淀符号?
这个SO42-为什么要带上?
能总结一些一般规律吗?
问的是PbSO4为什么不加沉淀? wwwice1年前1
wwwice1年前1 -
 lidandan0919 共回答了21个问题
lidandan0919 共回答了21个问题 |采纳率90.5%因为PbO2也是固体所以不加沉淀符号,总的来说书写时要符合客观规律与实际情况,由于环境中存在有大量SO42-所以必定会与还原生成的Pb2-反应结合如果不加SO42-就与实际不符了写电极要随机应变吧,大思路是先找到正负极然后再根据电子转移以及周围离子环境加以配写
为什么不加沉淀是因为反应物二氧化铅也是不溶解于液体的固体沉淀反应前后都是固体所以不加沉淀就像氢气与氮气反应生成氨气前后都是气体所以氨气不用加气体符号一样的道理1年前查看全部
- 铁和银做原电池,硝酸银溶液做电解质,写出电极反应和电池反应
 落地的云1年前3
落地的云1年前3 -
 nb163 共回答了18个问题
nb163 共回答了18个问题 |采纳率88.9%负极:Fe-2e^-=Fe^2+
正极:Ag^++e^-=Ag
总反应:Fe+2AgNO3=Fe(NO3)2+2Ag1年前查看全部
- 电解池的电极反应问题(速回)铂作阳极,碳作阴极.氢氧化钠为电解质.那么电极反应分别是什么?这是电解池,不是问原电池.惰性
电解池的电极反应问题(速回)
铂作阳极,碳作阴极.氢氧化钠为电解质.
那么电极反应分别是什么?
这是电解池,不是问原电池.
惰性电极当然无法得失电子. aaroneer1年前1
aaroneer1年前1 -
 xiqin1983131 共回答了18个问题
xiqin1983131 共回答了18个问题 |采纳率88.9%阳极(Pt):4OH--4e-==O2(气体符号)+2H2O
阴极(C):2H++2e-==H2(气体符号)
总式:2H2O=电解=2H2(气体符号)+O2(气体符号)
钠离子在溶液中不会得电子,所以只能是氢离子得电子生成氢气,电解氢氧化钠就相当于电解水.1年前查看全部
- 铅蓄电池放电的电极反应为?负极------ 正极------ 总反应式------- 都怎么写?
铅蓄电池放电的电极反应为?负极------ 正极------ 总反应式------- 都怎么写?
正极和负极是如何得到的?求详解.讲课用. 仙掌1年前1
仙掌1年前1 -
 漏网之笨鱼 共回答了10个问题
漏网之笨鱼 共回答了10个问题 |采纳率100%铅酸蓄电池放电过程的电化反应l 铅酸蓄电池放电时,在蓄电池的电位差作用下,负极板上的电子经负载进入正极板形成电流I.同时在电池内部进行化学反应.l 负极板上每个铅原子放出两个电子后,生成的铅离子(Pb+2)与电解液...1年前查看全部
- 判断题:“某电极反应A+2e-=A2-,当增大A2-离子浓度时,其电极电势必增大”?
判断题:“某电极反应A+2e-=A2-,当增大A2-离子浓度时,其电极电势必增大”?
判断对错,并说明理由 WFWY20021年前2
WFWY20021年前2 -
 窜上春树 共回答了16个问题
窜上春树 共回答了16个问题 |采纳率93.8%错误.
按照影响电极电势的因素——Nernst方程式来看
还原型物质浓度增大时,会使电极电势值φ(A/A2-)降低(减小).1年前查看全部
- 以铜做负极,碳做正极,氯化钠溶液为电解质能构成原电池吗?能请写出电极反应;不能请说明原因?
 gic7b5e1年前1
gic7b5e1年前1 -
 e点深蓝 共回答了18个问题
e点深蓝 共回答了18个问题 |采纳率77.8%(1)铜负极,碳正极,氯化钠溶液为电解质能构成原电池---吸氧腐蚀!
(2)(-)2Cu - 4e- == 2Cu2+
(3)(+)O2 + 2H2O + 4e- == 4OH-
(4) Cu2+ + 2OH- == Cu(OH)21年前查看全部
- 电解池电池,电解质盐酸的电极反应
电解池电池,电解质盐酸的电极反应
要想复原加什么 坏坏的囡囡1年前1
坏坏的囡囡1年前1 -
 孤蓝 共回答了17个问题
孤蓝 共回答了17个问题 |采纳率94.1%阳极若为Ag活比Ag活泼的金属,则为Ag=Ag+加e-(其他金属一样)
若为惰性电极
则阳极:2Cl-—2e-=Cl2↑
阴极:2H++2e-=H2↑
复原加氯化氢(绝不能说加盐酸)1年前查看全部
- 1,在碱性锌锰干电池和锌银电池中锌作负极,电极反应为ZN-2e+2oh-=zn(oh)2,为什么不能写Zn-2e=Zn2
1,在碱性锌锰干电池和锌银电池中锌作负极,电极反应为ZN-2e+2oh-=zn(oh)2,为什么不能写Zn-2e=Zn2+
2.在氢氧燃料电池中为什么O2在正极得电子就变成了OH-?而且为什么反应式是O2+4e+2h2o=4oh- 为什么有h2o? 888888zh1年前6
888888zh1年前6 -
 林间过客 共回答了14个问题
林间过客 共回答了14个问题 |采纳率85.7%书写电极反应式,需考虑环境(介质)对生成物的影响.Zn2+不能稳定存在于碱性介质中,会生成Zn(OH)2.
O2在正极得电子,按说会变为O2- ,但氧离子只存在高温下.常温下,O2-+H2O=2OH-
所以反应式是O2+4e- +2H2O=4OH-
两题都是介质的问题.1年前查看全部
- 图中,两电极上发生的电极反应分别为:a极:Ag + +e - =Ag
图中,两电极上发生的电极反应分别为:a极:Ag + +e - =Ag b极:Fe-2e - =Fe 2 + ;下列说法不正确的是()

A.a、b可能是同种电极材料 B.该装置一定是电解池 C.装置中电解质溶液一定含有Ag + D.装置中发生的反应方程式一定是Fe+2Ag + ==Fe 2+ +2Ag  sd30246781年前1
sd30246781年前1 -
 unif1967 共回答了23个问题
unif1967 共回答了23个问题 |采纳率82.6%B
1年前查看全部
- 如何由电极反应写出电池表示?以及电池表示该怎么写?
 zise501年前4
zise501年前4 -
 mickeylhl 共回答了17个问题
mickeylhl 共回答了17个问题 |采纳率94.1%书写燃料电池电极反应式一般分为三步:第一步,先写出燃料电池的总反应方程式;第二步,再写出燃料电池的正极反应式;第三步,在电子守恒的基础上用燃料电池的总反应式减去正极反应式即得到负极反应式.下面对书写燃料电池电极反应式“三步法”具体作一下解释.
1、燃料电池总反应方程式的书写
因为燃料电池发生电化学反应的最终产物与燃料燃烧的产物相同,可根据燃料燃烧反应写出燃料电池的总反应方程式,但要注意燃料的种类.若是氢氧燃料电池,其电池总反应方程式不随电解质的状态和电解质溶液的酸碱性变化而变化,即2H2+O2=2H2O.若燃料是含碳元素的可燃物,其电池总反应方程式就与电解质的状态和电解质溶液的酸碱性有关,如甲烷燃料电池在酸性电解质中生成CO2和H2O,即CH4+2O2=CO2+2H2O;在碱性电解质中生成CO32-离子和H2O,即CH4+2OH-+2O2=CO32-+3H2O.
2、燃料电池正极反应式的书写
因为燃料电池正极反应物一律是氧气,正极都是氧化剂氧气得到电子的还原反应,所以可先写出正极反应式,正极反应的本质都是O2得电子生成O2-离子,故正极反应式的基础都是O2+4e-=2O2-.正极产生O2-离子的存在形式与燃料电池的电解质的状态和电解质溶液的酸碱性有着密切的关系.这是非常重要的一步.现将与电解质有关的五种情况归纳如下.
⑴电解质为酸性电解质溶液(如稀硫酸)
在酸性环境中,O2-离子不能单独存在,可供O2-离子结合的微粒有H+离子和H2O,O2-离子优先结合H+离子生成H2O.这样,在酸性电解质溶液中,正极反应式为O2+4H++4e-=2H2O.
⑵电解质为中性或碱性电解质溶液(如氯化钠溶液或氢氧化钠溶液)
在中性或碱性环境中,O2-离子也不能单独存在,O2-离子只能结合H2O生成OH-离子,故在中性或碱性电解质溶液中,正极反应式为O2+2H2O +4e-=4OH-.
⑶电解质为熔融的碳酸盐(如LiCO3和Na2CO3熔融盐混和物)
在熔融的碳酸盐环境中,O2-离子也不能单独存在,O2-离子可结合CO2生成CO32-离子,则其正极反应式为O2+2CO2 +4e-=2CO32-.
⑷电解质为固体电解质(如固体氧化锆—氧化钇)
该固体电解质在高温下可允许O2-离子在其间通过,故其正极反应式应为O2+4e-=2O2-.
综上所述,燃料电池正极反应式本质都是O2+4e-=2O2-,在不同电解质环境中,其正极反应式的书写形式有所不同.因此在书写正极反应式时,要特别注意所给电解质的状态和电解质溶液的酸碱性.
3、燃料电池负极反应式的书写
燃料电池负极反应物种类比较繁多,可为氢气、水煤气、甲烷、丁烷、甲醇、乙醇等可燃性物质.不同的可燃物有不同的书写方式,要想先写出负极反应式相当困难.一般燃料电池的负极反应式都是采用间接方法书写,即按上述要求先正确写出燃料电池的总反应式和正极反应式,然后在电子守恒的基础上用总反应式减去正极反应式即得负极反应式.1年前查看全部
- N2H4和氧气组成燃料电池,N2H4一级的电极反应怎么写?
N2H4和氧气组成燃料电池,N2H4一级的电极反应怎么写?
我的问题是生成的N2要不要加气体符号.因为如果写总反应的话是没有气体符号的,但是如果只写一级的电极反应的话要不要加上气体符号? 巫婆蕾ww1年前5
巫婆蕾ww1年前5 -
 熊猫EL960 共回答了16个问题
熊猫EL960 共回答了16个问题 |采纳率68.8%我们这不用写,应该以你当地的教科书为基准,—–一个地区一个样1年前查看全部
- Cu做阳极,Cu做阴极电解Na2SO4溶液,电极反应是什么
Cu做阳极,Cu做阴极电解Na2SO4溶液,电极反应是什么
好多说的阳极反应是4OH- - 4e- = O2 +2H2O.(2007重庆高考答案)为什么不是Cu-2e-=Cu2+
3.如图所示,下列叙述正确的是(A ).
A.Y为阴极,发生还原反应
B.X为正极,发生氧化反应
C.Y与滤纸接触处有氧气生成
D.X与滤纸接触处变红
 lxsjsgky1年前1
lxsjsgky1年前1 -
 qq哈哈 共回答了18个问题
qq哈哈 共回答了18个问题 |采纳率77.8%你没有分清问题,首先左边是原电池,右边是电解池,阳极是电解池的,也就是说你把原电池的正极与电解池的阳极混为一谈,先把概念搞懂!
解A,Y与锌连接,锌是负极,所以Y是阴极,电解池发生的是电解水的反应2H+2e=H2还原反应
B,X与Cu连接所以为阳极,而不是正极!
C,有氢气生成
D,4OH- - 4e- = O2 +2H2O,所以不会有变红的现象出现,仍然是无色1年前查看全部
- 电镀铜时,阳极采用铜板和铅板,电极反应是否相同?最好用哪个,为什么?
 阿修罗之飞天1年前6
阿修罗之飞天1年前6 -
 你睇钨见我11 共回答了26个问题
你睇钨见我11 共回答了26个问题 |采纳率84.6%电镀铜,就是把阳极上的粗铜转移到阴极(精铜等)上,
如果阳极是铅版的话,
阳极:Pb-2e^-=Pb2+
阴极:Pb2+2e^-=Pb
而是铜板的话
阳极:Cu-2e^-=Cu2+
阴极:Cu2+2e^-=Cu
所以电极反应是不一样的.
但如果是铜板与铅版一起的话,
那么首先阳极反应是Pb-2e^-=Pb2+,然后过一段时间是Cu-2e^-=Cu2+
但阴极始终是Cu2+得到电子,Cu2+2e^-=Cu1年前查看全部
- 电池Ag(s)竖AgO竖OH-(a)竖O2(g)竖Pt(s)的电极反应怎么写?
 bbm11151年前1
bbm11151年前1 -
 weif0814 共回答了16个问题
weif0814 共回答了16个问题 |采纳率93.8%银失电子跟氢氧根反应变成水和氧化银,
氧得电子跟水反应生氢氧根.1年前查看全部
- 能否讲一下惰性电极电解电解质溶液的规律?尤其是不同情况下电极反应(式)
 dj1314ldf1年前1
dj1314ldf1年前1 -
 英雄战斗 共回答了15个问题
英雄战斗 共回答了15个问题 |采纳率93.3%请你把此表填写完,就能看出规律了.(阳极、阴极均采用惰性电极)(我只写一个)
类型
实例
电极反应及特点
总反应
电解质浓度
pH
恢复原溶液
电解水型
NaOH
阴极:2H++2e-=H2
正极:4OH--4e-=O2+2H2O
就是电解水
2H2O=电解=2H2+O2
增大
增大
加H2O
H2SO4
Na2SO4
分解电解质型
HCl
CuCl2
放H2生成碱型
NaCl
放O2生成酸型
CuSO41年前查看全部
- 以下原电池的电极反应(正极、还有负极):
以下原电池的电极反应(正极、还有负极):
Fe、C作电极,FeCl3做电解质溶液,Fe会和FeCl3反应吗?正负极都怎么反应的?
Cu、Ag做电极,Cu(NO3)2做电解质 caoru_10281年前0
caoru_10281年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 请问大家原电池的电极反应怎么写?
请问大家原电池的电极反应怎么写?
比如氢氧燃料电池,锌锰干电池 及其他一些电池 书上说写的时候先写总反应式 再拆成2个电极反应是 还要考虑h+ oh- h2o参与反应的可能 关键是最后“考虑h+ oh- h2o参与反应” 栈弈1年前1
栈弈1年前1 -
 绝色泪痕 共回答了19个问题
绝色泪痕 共回答了19个问题 |采纳率94.7%根据电解质溶液(或者说电荷传递体系)来确定.如果是碱性溶液,则用H2O、OH-来配平;如果是酸性溶液,则用H+、H2O来配平1年前查看全部
- 用铜电极电解氯化镁溶液的电极反应怎么写?
 定格角度1年前1
定格角度1年前1 -
 弄月书生 共回答了20个问题
弄月书生 共回答了20个问题 |采纳率80%阳极:Cu-2e-=Cu2+
阴极:2H20+2e-=H2+2OH-
总反应要把Cu2+和OH-写成Cu(OH)21年前查看全部
- 乙醇电池若用酸性电解质氢离子作溶剂,电极反应为?
乙醇电池若用酸性电解质氢离子作溶剂,电极反应为?
H由什么极向什么极移动 无妻徒刑841年前1
无妻徒刑841年前1 -
 wys188 共回答了14个问题
wys188 共回答了14个问题 |采纳率85.7%C2H5OH=C2H5O-+H+,向正极移动,因为正极上是有电子的,会生成氢气1年前查看全部
- Mg棒和Fe棒放入到NH4Cl溶液中,用导线相连,能形成原电池,电极反应怎么写?
 天气551年前3
天气551年前3 -
 SwissCH 共回答了16个问题
SwissCH 共回答了16个问题 |采纳率93.8%Mg=Mg2+ + 2 e-
2NH4+ + 2e- = 2NH3 + H21年前查看全部
- 镁和铝的原电池(氢氧化钠做电解质)的电极反应及原电池反应方程式
镁和铝的原电池(氢氧化钠做电解质)的电极反应及原电池反应方程式
正极和负极都写上! 谢克刚1年前1
谢克刚1年前1 -
 13453dac430208b7 共回答了16个问题
13453dac430208b7 共回答了16个问题 |采纳率100%镁负极,铝正极,但最好把铝换成铜1年前查看全部
- 电解质溶液是氢氧化钠的原电池,负极是铝,正极是镁,他的电极反应怎么写啊
 mentoo1年前1
mentoo1年前1 -
 hjjsunv 共回答了13个问题
hjjsunv 共回答了13个问题 |采纳率100%Al和Mg的金属活泼性是Mg比较活泼,但若浸在NaOH溶液中,则由于Mg不溶于NaOH溶液显出化学反应的惰性,而Al可以溶解显示反应的活性,所以在此条件下,Mg是电池的正极,Al是负极失电子以AlO2-的形式而溶解,是H2O在正极得电子放出H2.
电极反应式是:负极.2Al - 6e- + 8OH- = 2AlO2- + 4H2O ;
正极.6 H2O + 6e- =3H2↑ + 6OH- .
总的电池反应; 2Al + 2OH- +2H2O = 2AlO2- +3H2 ↑ .1年前查看全部
- 铜为电极电解稀硫酸的电极反应PH变化
 蓝色的幻想天空1年前1
蓝色的幻想天空1年前1 -
 guofucheng6677 共回答了22个问题
guofucheng6677 共回答了22个问题 |采纳率95.5%若铜在阳极,则阳极铜变成铜离子,阴极氢离子变成氢气,酸度降低,PH会增加;若铜在阴极,则就相当于电解水,整体的PH不变.1年前查看全部
- 把锌片和银片放稀硫酸中组成原电池锌片发生的电极反应?银片的电极反应?
 zenghu1年前1
zenghu1年前1 -
 maxkinglee 共回答了19个问题
maxkinglee 共回答了19个问题 |采纳率89.5%锌失电子变成锌离子 银片上氢离子被还愿生成氢气
记得采纳啊1年前查看全部
- 鉄铜原电池,氯化铁作电解质,电极反应和化学反应?
 没超疯团_秋水1年前1
没超疯团_秋水1年前1 -
 woo8 共回答了23个问题
woo8 共回答了23个问题 |采纳率100%总反应2Fe(3+)+ Fe=3Fe(2+)
负极反应2Fe(3+)+Cu=2Fe(2+)+Cu(2+)
正极反应Cu(2+)+Fe=Cu+Fe(2+)1年前查看全部
- 析氢和吸氧的电极反应发生后,均能使该电极附近的电解质溶液的PH增大,因而工作后,X极附近PH增大了,说明X极为正极
析氢和吸氧的电极反应发生后,均能使该电极附近的电解质溶液的PH增大,因而工作后,X极附近PH增大了,说明X极为正极
这是为什么? 电视栏目rrrr1年前2
电视栏目rrrr1年前2 -
 dongfengpo 共回答了29个问题
dongfengpo 共回答了29个问题 |采纳率86.2%吸氧腐蚀:
O2+2H2O+4e-=4OH-
析氢腐蚀:
2H+ +2e-=H2
都是发生在正极的原电池反应,且PH都是增大的.
对应的负极的反应有:Fe-2e=Fe2+1年前查看全部
- PbO2接电源负极,Pb接电源正极,H2SO4为电解液,电极反应为?
 jordanagan1年前2
jordanagan1年前2 -
 leoro 共回答了24个问题
leoro 共回答了24个问题 |采纳率79.2%正极:PbO2+H2SO4+2e+2H+=PbSO4+2H2O
负极:Pb+H2SO4-2e=PbSO4+2H+
总反应:Pb+PbO2+2H2SO4=PbSO4+2H2O
还有什么不明白的可以追问我1年前查看全部
- 电子表和计算机的电源是微型银锌电池,其电极材料分别为Ag2O和Zn,电解液为KOH溶液,电极反应
电子表和计算机的电源是微型银锌电池,其电极材料分别为Ag2O和Zn,电解液为KOH溶液,电极反应
为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2 O+2e-=2Ag+2OH-,下列说法中正确的是()
A.Zn为正极,Ag2O为负极
B.电子由锌极经外电路流人Ag2O极
C.Zn为负极,Ag2O为正极
D.工作一段时间后,Zn的质量减少,Ag2O的质量增加
(化学原电池8) tyzhangzhr1年前2
tyzhangzhr1年前2 -
 joe407 共回答了14个问题
joe407 共回答了14个问题 |采纳率100%BC
在这个反应中,Zn失去电子,电路中规定流出电子的一极为负极,因此A错误,C正确.你看看这两个电极方程式就知道B是对的.D中,氧化银的质量也会减少.
我不知道你是哪个省的,有没有多选题1年前查看全部
- 图甲中电极均为石墨电极,下列叙述中正确的是 A.电子沿a→d→c→d路径流动 B.b极的电极反应为O 2 +4e - +
图甲中电极均为石墨电极,下列叙述中正确的是
A.电子沿a→d→c→d路径流动 B.b极的电极反应为O 2 +4e - +4H + =2H 2 O C.通电初期乙中的总反应为Cu+H 2 SO 4  CuSO 4 +H 2 ↑
CuSO 4 +H 2 ↑D.反应过程中,甲、乙装置中溶液的pH都逐渐减小  honcen1年前1
honcen1年前1 -
 bxf365 共回答了24个问题
bxf365 共回答了24个问题 |采纳率87.5%C
电子可以沿着导线流动,在电解质溶液中是阴阳离子的移动产生电流,即电子沿a→d、c→b路径流动;电池电解质为NaOH,所以b电极的电极反应为O 2 +4e - +2H 2 O=4OH - ;反应过程中,甲装置中产生水,所以溶液的pH减小,但是乙装置中由于H + 被消耗,所以pH增大。1年前查看全部
- 用惰性电极电解FeBr2的电极反应分别是
 陈琪qiqi1年前1
陈琪qiqi1年前1 -
 小月99 共回答了18个问题
小月99 共回答了18个问题 |采纳率100%主反应:阴极 Fe2+ + 2e = Fe,阳极 2Br- -2e = Br2.但反应得到的Br2会氧化Fe2+.方程式不写了.副反应:阴极 2H+ +2e = H2(与极化电压,就是电解电压,以及电极材料有关系),阳极Fe2+ -e = Fe3+1年前查看全部
大家在问
- 1为啥选D,是虚拟语气主句和从句时态的问题吗,请说详细一点,
- 2科学发现当气温在多少度时人们感觉最舒服?
- 3door clean and the shut floor the 连词成句
- 4多项式Hxy-xy的二次方的次数及最高一次项的系数分别是
- 5四阶魔方拼第一面和旁边T字时的时候为什么最后会有两个颜色拼不起来啊
- 6如图,在平行四边形ABCD中,分别延长AB、BC、CD、DA至点G、H、E、F,使BG=CH=DE=FA.
- 7他那题错了 尾数为80 7+7^2+7^3.+7^19+7^20=(7+7^20)*20/2=70*(1+7^19) 尾
- 8一列波先后通过相距4m的A,B两点,用时0.01s ,已知A,B两质点运动方向始终相反,问:(1)这列波...
- 9人民币表面都有些什么微生物?主要的,常见的知道的大神请告诉下,小弟感激不尽!
- 10宇宙到底有无边界?或许宇宙类似一个物,而各个星球或许是这个物里的小构件,而构件里的生物或许是类似的细胞.在这个物的外面就
- 11化学实验中的有效数字一个已经纯化的有机物(醇类或醚类)试样(含碳60.0%;氢13.3%).已知该有机物的一分子内的碳数
- 12英语翻译同上
- 13《孩子,我为什么打你》阅读答案1.读一读画横线的句子,从中你体会到了什么?2.对于这位母亲打孩子的感受,你能理解吗?谈谈
- 14甲乙两人年收入之比为10:7,年支出之比为3:2,已知今年甲盈余8000元,乙盈余6000元,求甲今年的收入和支出
- 15Listen! Who ________?