D.80mL 10mol/L浓盐酸与足量MnO2反应,转移电子数为0.4NA
 xhrj992022-10-04 11:39:541条回答
xhrj992022-10-04 11:39:541条回答错在哪里

已提交,审核后显示!提交回复
共1条回复
 mouser317 共回答了21个问题
mouser317 共回答了21个问题 |采纳率90.5%- 随着反应进行,盐酸变稀了就不反应了,不能转移0.4NA
- 1年前
相关推荐
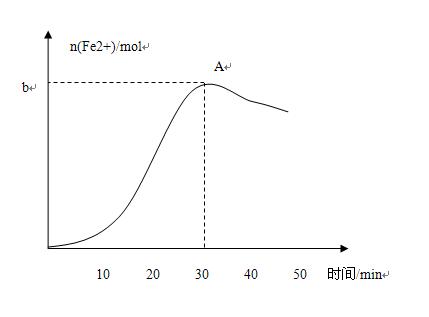
- 一道学业水平测试题一位同学取出ag黑色固体(含Fe3O4和Fe),在烧杯中用12mol/L浓盐酸溶解(微热),30min
一道学业水平测试题
一位同学取出ag黑色固体(含Fe3O4和Fe),在烧杯中用12mol/L浓盐酸溶解(微热),30min时固体全部溶解.图中粗略地表示了溶解过程中溶液里n(Fe2+)随时间的变化.
①为保证固体全波溶解,加入的12mol/L的浓盐酸体积应大于_______mL(用含a的代数式表示)
②图中,30min以后n(Fe2+)减小的原因可能是_______
③若A点时的溶液滴入KSCN溶液后未出现血红色,则可推知原黑色固体中Fe3O4的物质的量为________(用含a、b的代数式表示)
答案:①125a/42
②Fe2+被空气中的氧气氧化
③(a-56b)/64
请讲解一下②③问,谢谢不好意思,打错了,是①③问
 tshangyao1年前1
tshangyao1年前1 -
 咯年民连 共回答了14个问题
咯年民连 共回答了14个问题 |采纳率92.9%2. 二价铁被空气中氧气氧化成为三价铁
3. A点时,滴入KSCN溶液后未出现血红色,说明溶液中全为Fe2+,
设Fe3O4的物质的量为x mol,则n(Fe3+)=2x mol,n(Fe2+)=x mol,n(Fe)=(a-232x)/56
最终所有铁元素转化为Fe2+,利用物料守恒,得
2x + x + (a-232x)/56 = b
求得 x = (a-56b)/641年前查看全部
- 有是几个物理题 计算题某同学用10mol/L浓盐酸配制500mL 1mol/L的稀盐酸,并进行有关实验.取所配制的稀盐酸
有是几个物理题 计算题
某同学用10mol/L浓盐酸配制500mL 1mol/L的稀盐酸,并进行有关实验.取所配制的稀盐酸200mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为1.12L ,写出计算过程
1,则参加反应的锌的质量为多少?
2,设反应厚的溶液的体积仍为200mL ,则反应后溶液中的物质的量浓度为多少? 肉兔子1年前2
肉兔子1年前2 -
 hpy68226 共回答了27个问题
hpy68226 共回答了27个问题 |采纳率88.9%简单拉
1 Zn+2Hcl= H2♂ +Zncl2
65 2 136
X 1.12L*H密度 Y
可求反应锌质量
2 求Y后,用Y/200-1.12*H密度就好了1年前查看全部
- 已知实验室制取氯气的反应,取10.44g二氧化锰跟100mL 12mol/L浓盐酸充分反应
已知实验室制取氯气的反应,取10.44g二氧化锰跟100mL 12mol/L浓盐酸充分反应
(1)在标准状况下生成多少升氯气?
(2)发生氧化反应的HCL的物质的量是多少?
(3)向反应的溶液中加入过量的AgNO3溶液,则能生成多少克的白色沉淀?
已知实验室制氯气的化学方程式为MnO2+4Hcl(浓)=MnCl2+Cl2+2H2O chmandhy1年前2
chmandhy1年前2 -
 _粲 共回答了18个问题
_粲 共回答了18个问题 |采纳率83.3%浓盐酸1.2MOL过量,且反应后盐酸浓度还属于浓盐酸范围,故以0.12MOL二氧化锰计算,易得出氯气为0.12MOL,发生氧化的HCL的物质的量即为0.24MOL,向反应的溶液中加入硝酸银生成的氯化银的物质的量1.2-0.12=1.08MOL1年前查看全部
- 将足量的二氧化锰与40ml 10mol/L浓盐酸反应产生的氯气,同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比(
将足量的二氧化锰与40ml 10mol/L浓盐酸反应产生的氯气,同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比( )
A. 前者产生的氯气多
B. 一样多
C. 后者产生的氯气多
D. 无法比较 阴暗Barbie1年前1
阴暗Barbie1年前1 -
 零点七公分的距离 共回答了14个问题
零点七公分的距离 共回答了14个问题 |采纳率100%解题思路:二氧化锰与浓盐酸反应生成氯气,随反应进行浓盐酸变为稀盐酸,二氧化锰不与稀盐酸反应,
对于反应一:将足量的二氧化锰与含HCl 0.4mol浓盐酸反应产生的氯气,HCl不能完全反应,假定HCl完全反应,计算生成的氯气的物质的量,实际氯气小于该值,
对于反应二:将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据二氧化锰结合方程式计算生成的氯气的物质的量,据此比较.对于反应一:将足量的二氧化锰与含HCl物质的量为10mol/L×0.04L=0.4mol,与浓盐酸反应产生的氯气,HCl不能完全反应,假定HCl完全反应,根据MnO2+4HCl(浓)△. MnCl2+Cl2↑+2H2O可知,...
点评:
本题考点: 氯气的实验室制法;氧化还原反应.
考点点评: 本题考查氯气的实验室制备、浓度对物质性质的影响等,难度不大,注意中学常见与浓度、反应条件、先后顺序有关的反应.1年前查看全部
- 实验室要配制0.5mol/L盐酸溶液200mL,需要用10mol/L浓盐酸的体积是( ) A.1mL B.10L C.1
实验室要配制0.5mol/L盐酸溶液200mL,需要用10mol/L浓盐酸的体积是( ) A.1mL B.10L C.10mL D.20mL
 山山哥哥1年前1
山山哥哥1年前1 -
 姚明的眼神 共回答了14个问题
姚明的眼神 共回答了14个问题 |采纳率100%0.5*200/10=10mL
C1年前查看全部
- 100mL 10mol/l浓盐酸与足量二氧化锰 转移电子数为0.5NA,为什么错了
 coolingman1年前2
coolingman1年前2 -
 铮静 共回答了19个问题
铮静 共回答了19个问题 |采纳率84.2%因为随着反映进行,盐酸浓度下降,变成稀盐酸,无法继续反应,所以实际转移电子要小于这个值1年前查看全部
- 在实验室中MnO2跟足量12.0mol/L浓盐酸反应制得2.24L氯气(标准状况下).
在实验室中MnO2跟足量12.0mol/L浓盐酸反应制得2.24L氯气(标准状况下).
(1)请写出上述过程中发生反应的化学方程式4HCl(浓)+MnO2
MnCl2+Cl2↑+2H2O△ .4HCl(浓)+MnO2;
MnCl2+Cl2↑+2H2O△ .
(2)该反应的氧化剂为______;氧化产物为______;
(3)消耗MnO2的质量为______g;
(4)被氧化的HCl的物质的量为______mol;
(5)若原浓盐酸的体积为50mL,将反应后的溶液冷却至室温后稀释至250mL,(假设整个过程中由于挥发而损失的HCl的物质的量为0.2mol),求稀释后溶液中Cl-的物质的量的浓度为______mol/L. 毕二1年前1
毕二1年前1 -
 痛83 共回答了19个问题
痛83 共回答了19个问题 |采纳率100%解题思路:(1)MnO2跟足量浓盐酸加热下反应制得氯气,同时生成氯化锰和水,据此书写方程式;
(2)化合价降低的元素所在的反应物是氧化剂,对应产物是还原产物,化合价升高的元素所在的反应物是还原剂,对应的产物是氧化产物;
(3)根据化学方程式进行计算即可;
(4)在参与反应的4mol盐酸中,一半被氧化,做还原剂;
(5)根据稀释前后氯离子的物质的量不变结合c=[n/V]来计算.(1)MnO2跟足量浓盐酸加热下反应制得氯气,同时生成氯化锰和水,方程式为:4HCl(浓)+MnO2
△
.
MnCl2+Cl2↑+2H2O,故答案为:4HCl(浓)+MnO2
△
.
MnCl2+Cl2↑+2H2O;
(2)化合价降低的Mn元素所在的反应物MnO2是氧化剂,化合价升高的Cl元素所在的反应物HCl是还原剂,对应的产物Cl2是氧化产物;故答案为:MnO2;Cl2;
(3)反应制得2.24L氯气(标准状况下)物质的量是0.1mol,设消耗的二氧化锰物质的量是x,
4HCl(浓)+MnO2
△
.
MnCl2+Cl2↑+2H2O
1 1
x 0.1mol
即x=0.1mol,所以二氧化锰的质量是0.1mol×87g/mol=8.7g,故答案为:8.7;
(4)4HCl(浓)+MnO2
△
.
MnCl2+Cl2↑+2H2O
4 1 1
0.1mol
生成0.1mol氯气,消耗盐酸0.4mol,在参与反应的0.4mol盐酸中,一半被氧化,做还原剂,即被氧化的HCl的物质的量为0.2mol,故答案为:0.2;
(5)原浓盐酸的体积为50mL,浓度是:12.0mol/L,则物质的量是0.6mol,假设整个过程中由于挥发而损失的HCl的物质的量为0.2mol,所以稀释后溶质的物质的量是0.4mol,体积250mL所以稀释后溶液中Cl-的物质的量的浓度c=[n/V]=[0.4mol/0.25L]=1.6mol/L,故答案为:1.6.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题以二氧化锰和盐酸的反应为载体,考查学生氧化还原反应的概念以及化学方程式的计算知识,难度不大.1年前查看全部
- 实验室用62.5g含 CaCO3 80%的大理石与足量10mol/L浓盐酸完全反应(杂质不参加反应)
实验室用62.5g含 CaCO3 80%的大理石与足量10mol/L浓盐酸完全反应(杂质不参加反应)求:
①参加反应浓盐酸的体积.
②生成CO2的体积(标况下).(要有计算过程) 亮度1年前1
亮度1年前1 -
 hhodi1965 共回答了20个问题
hhodi1965 共回答了20个问题 |采纳率95%解题思路:碳酸钙和盐酸反应生成氯化钙,二氧化碳和水,在足量盐酸溶液中碳酸钙全部反应,质量换算物质的量结合化学方程式的定量关系计算列式得到;计算关系主要有n=[m/M]=
;V Vm 62.5g含 CaCO3 80%的大理石中含碳酸钙物质的量n(CaCO3)=[62.5g×80%/100g/mol]=0.5mol;反应消耗氯化氢物质的量,生成二氧化碳气体的物质的量依据化学方程式定量关系计算得到:
CaCO3+2HCl=CaCl2+H2O+CO2↑
1 2 1
0.5mol 1mol 0.5mol
反应消耗盐酸的体积=[n/c]=[1mol/10mol/L]=0.1L=100ml;
反应生成二氧化碳再标准状况下的体积=n×22.4L/mol=0.5mol×22.4L/mol=11.2L;
故答案为:100ml;11.2L;点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查了质量换算物质的量,结合化学方程式计算溶液中溶质物质的量和气体物质的量,根据浓度和溶质物质的量计算溶液体积,根据气体摩尔体积计算气体体积,题目较简单.1年前查看全部
- 将足量的二氧化锰与40ml 10mol/L浓盐酸反应产生的氯气,同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比(
将足量的二氧化锰与40ml 10mol/L浓盐酸反应产生的氯气,同0.1mol二氧化锰与足量的浓盐酸反应产生的氯气相比( )
A. 前者产生的氯气多
B. 一样多
C. 后者产生的氯气多
D. 无法比较 一百零一度1年前2
一百零一度1年前2 -
 rrcgy 共回答了13个问题
rrcgy 共回答了13个问题 |采纳率92.3%解题思路:二氧化锰与浓盐酸反应生成氯气,随反应进行浓盐酸变为稀盐酸,二氧化锰不与稀盐酸反应,
对于反应一:将足量的二氧化锰与含HCl 0.4mol浓盐酸反应产生的氯气,HCl不能完全反应,假定HCl完全反应,计算生成的氯气的物质的量,实际氯气小于该值,
对于反应二:将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据二氧化锰结合方程式计算生成的氯气的物质的量,据此比较.对于反应一:将足量的二氧化锰与含HCl物质的量为10mol/L×0.04L=0.4mol,与浓盐酸反应产生的氯气,HCl不能完全反应,假定HCl完全反应,根据MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O可知,含HCl0.4mol浓盐酸完全反应生成氯气为0.4mol×[1/4]=0.1mol,实际氯气小于0.1mol,
对于反应二:将0.1mol二氧化锰与足量的浓盐酸反应产生的氯气,二氧化锰完全反应,根据MnO2+4HCl(浓)
△
.
MnCl2+Cl2↑+2H2O可知,生成氯气为0.1mol,
故反应二生成的氯气大于反应一生成的氯气,
故选C.点评:
本题考点: 氯气的实验室制法;氧化还原反应.
考点点评: 本题考查氯气的实验室制备、浓度对物质性质的影响等,难度不大,注意中学常见与浓度、反应条件、先后顺序有关的反应.1年前查看全部
- 将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应
将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应
生成的Cl2的体积(标准状况
参加反应的浓盐酸的物质的量.
第二问的答案是0.67L吗,如果不是是什么 一次即兴演讲1年前1
一次即兴演讲1年前1 -
 爱上Q 共回答了18个问题
爱上Q 共回答了18个问题 |采纳率72.2%23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量=23.2*75%/87=0.2mol
MnO2+4HCl=MnCl2+Cl2↑+2H2O
1 4 1
0.2 x y x=0.8 y=0.2
(1)生成的Cl2的体积 0.2*22.4=4.48L
(2)参加反应的浓盐酸的物质的量:0.8mol 如果是求体积,则0.8mol/12mol/L=0.067L=67mL1年前查看全部
- 将50gMnO2质量分数为87%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).计算
将50gMnO2质量分数为87%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).计算
将50gMnO2质量分数为87%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).计算:
参加反应的浓盐酸的体积
生成的氯气的体积(标准状况)
刚刚看见某位同学答了.于是顺利做出来了.但是答案一刷新就没了. mistletal1年前1
mistletal1年前1 -
 shuangjiao0536 共回答了25个问题
shuangjiao0536 共回答了25个问题 |采纳率92%MnO2 + 4HCl(浓) = MnCl2 +Cl2 +2H2O
87g 4mol 22.4L
50gx87% A B
87xA =4x50x87% A=2mol 87xB =22.4x50x87% B=11.2L
所以浓盐酸的体积V=2mol / (12mol/L)= 1/6 L
产生的氯气体积为11.2L1年前查看全部
- 8.将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).
8.将23.2g含MnO2的质量分数为75%的软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应).
(1)参加反应的浓盐酸的物质的量.
(2)生成的Cl2的体积(标准状况).
这题怎么算啊? bhula1年前1
bhula1年前1 -
 foot1211 共回答了24个问题
foot1211 共回答了24个问题 |采纳率95.8%根据化学方程式:MnO_2 + 4HCl ==== MnCl_2 + Cl_2↑ + 2H_2O
m(MnO_2)= 23.2 * 75% = 17.4g
n(MnO_2)= m(MnO_2)/M(MnO_2) = 17.4/(55+16*2) = 0.2mol
根据方程式知:
n(HCl) = 4n(MnO_2) = 0.2*4 = 0.8mol
n(Cl_2) = n(MnO_2) = 0.2mol
V(Cl_2) = n(Cl_2) * V_m = 0.2*22.4 = 4.48L1年前查看全部
- 18、取13.05g二氧化锰跟100mL12mol/L浓盐酸充分反应.试计算:
18、取13.05g二氧化锰跟100mL12mol/L浓盐酸充分反应.试计算:
(1)可以生成氯气多少升(标准状况)?
(2)反应后,溶液中H+的物质的量浓度是多少(假设溶液的总体积不变) lswtx1年前1
lswtx1年前1 -
 leijjww 共回答了13个问题
leijjww 共回答了13个问题 |采纳率92.3%MnO2物质的量:13.05/87=0.15mol
MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O
所以生成的Cl2物质的量为0.15mol
Cl2体积:0.15mol×22.4L/mol=3.36L
因为HCl一共反应:0.15×4=0.6mol,所以H+减少了0.3mol
原溶液中H+物质的量:12mol/L×0.1L=1.2mol
反应后溶液中H+物质的量:1.2-0.6=0.6mol
所以溶液中H+的物质的量浓度:0.6mol/0.1L=6mol/L1年前查看全部
- 简单的化学计算题,在线等答案欲配制0.20mol/L盐酸溶液1000ml应取12mol/L浓盐酸多少毫升?需要过程,谢谢
 feng1wu1年前3
feng1wu1年前3 -
 111一意孤行 共回答了19个问题
111一意孤行 共回答了19个问题 |采纳率94.7%假设需要12mol/L浓盐酸v毫升,根据物料守恒有:
0.20mol/L×1000mL=12mol/L×v mL
解得 v=16.7mL1年前查看全部
大家在问
- 1一个几何体的三视图如下图所示,其中正视图和侧视图均是腰长为6的等腰直角三角形,则它的体积为
- 2英语造句1.I can……2.I can't……3.can I……
- 3一辆摩托车原来以10m/s的速度匀速直线行驶.某时刻摩托车突然加速,加速度恒为2m/s2,求:
- 4已知二次函数Y=-X+2BX+B的图像的顶点在X轴的负半轴上,求出此二次函数的解析式拜托了各位
- 5从词类活用角度看,下列各句加点词分类正确的一项是 ( )(3分)
- 6这句话有没有语法毛病We feel sad for the people who suffered
- 7(1)5分之2化成小数是什么?(2)4分之3化成小数是什么?(3)25分之12化成小数是什么?(4)8分之1化成小数是什
- 8如图,已知菱形ABCD的周长为16cm,∠ABC=60°,对角线AC和BD相交于点O,求AC和BD的长.
- 9阅读诗歌,完成下面问题。(6分)
- 10孟子译文(急)!孟子曰:夫人必自辱,然后人辱之;家必自毁,而后人毁之;国必自伐,而后人伐之.疑问怎么译啊~很着急的!当然
- 11她想来参加你的生日聚会吗的英语有道翻译
- 12短文改错,注意要求,
- 13一道英语IQ题,有智者前来啊What is it that is found in the very centre of
- 14下图为欧洲某山地垂直自然带分布示意图。读图回答下列各题。
- 15一段均匀导线对折两次后并联在一起,测得其电阻为0.5Ω,导线原来的电阻多大?若把这根导线的一半均匀拉长为三倍,另一半不变
