速率 = lim△S/△t △t->0 =dv/dt=d的平方x/dt的平方
 站住O举起手来2022-10-04 11:39:541条回答
站住O举起手来2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 痛苦的边缘 共回答了14个问题
痛苦的边缘 共回答了14个问题 |采纳率92.9%- 是微分的思想 你可以理解为△t 极短极短的时间就用dt表示时间差
- 1年前
相关推荐
- 100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
100mL浓度为2mol•L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol•L-1的盐酸
B.加入适量的氯化钠溶液或降温
C.加入适量CH3COOK溶液
D.加入2滴氯化铜溶液或碳粉 david_cao1年前1
david_cao1年前1 -
 咆哮狼 共回答了14个问题
咆哮狼 共回答了14个问题 |采纳率85.7%解题思路:过量的锌片,盐酸完全反应,则加快反应速率又不影响生成氢气的总量,可增大氢离子浓度或增大金属的接触面积、构成原电池等,不改变其氢离子物质的量即可,以此来解答.A.加入适量的6 mol•L-1的盐酸,反应速率加快,生成氢气增多,故A不选;
B.加入适量的氯化钠溶液,浓度减小,则反应速率减慢,降温,反应速率减小,故B不选;
C.加入适量CH3COOK溶液,生成弱酸,氢离子浓度减小,反应速率减小,故C不选;
D.加入2滴氯化铜溶液或碳粉,锌置换出铜,可形成原电池反应,反应速率增大,氢气的物质的量不变,故D选.
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,注意把握浓度、接触面积对反应速率的影响即可解答,注重基础知识的考查,注意Zn过量盐酸完全反应,题目难度不大.1年前查看全部
- (2011•三亚模拟)今年山东省部分地区遭遇百年大旱,随着干旱时间持续,作物叶片开始发黄,光合速率下降,植株生长缓慢,甚
(2011•三亚模拟)今年山东省部分地区遭遇百年大旱,随着干旱时间持续,作物叶片开始发黄,光合速率下降,植株生长缓慢,甚至死亡.请回答有关问题:
(1)在干旱的环境中,农作物的根系不能从土壤中吸水,这是由于______.
(2)研究发现在干旱条件下某种植物激素能够刺激植物体增加脯氨酸、甜菜碱等物质的含量,这些物质是重要的渗透压调节物质,有助于细胞保水.该小组推测这种激素可能是脱落酸,并且在一定浓度范围内随着脱落酸浓度的增加植物抗旱能力不断增强.请选择下列材料设计实验,以验证上述推测.
材料用具:生长状态一致且良好的大豆盆栽幼苗若干株、高浓度的脱落酸溶液、蒸馏水、喷壶等.
①实验步骤:
第一步:将盆栽幼苗均分为四组,每组多株,编号l、2、3、4(1号为对照组);
第二步:______;
第三步:将盆栽幼苗进行______(条件)处理后,______,
第四步:______.
②预期结果及结论:______. 忘川水无痕1年前1
忘川水无痕1年前1 -
 guoyandou 共回答了16个问题
guoyandou 共回答了16个问题 |采纳率100%解题思路:对照实验的一般步骤:(1)分组编号;(2)做不同的处理(单一变量原则);(3)培养一段时间;(4)观察记录.(1)当土壤溶液浓度(或渗透压)大于根细胞液浓度(或渗透压) 时,农作物的根系会发生失水现象.
(2)该实验探究的是:脱落酸是否能够刺激植物体增加脯氨酸、甜菜碱等物质的含量.故实验自变量:脱落酸溶液浓度,同时要注意该实验要满足对照原则、单一变量原则,据此作答.
①实验步骤:
第一步:将盆栽幼苗均分为四组,每组多株,编号l、2、3、4(1号为对照组);
第二步:配制适宜浓度范围内的脱落酸溶液A、B、C(A<B<C);
第三步:将盆栽幼苗进行干旱(条件)处理后,向2、3、4组分别喷施适量且等量的A、B、C的溶液,向第 1 组喷施等量的蒸馏水.
第四步:在其他条件相同且适宜的条件下培养一段时间后,测量细胞内脯氨酸、甜菜碱量及细胞的渗透压..
②预期结果及结论:1、2、3、4组细胞内脯氨酸、甜菜碱量依次增多,细胞内的渗透压依次增大.
故答案为:(1)土壤溶液浓度(或渗透压)大于根细胞液浓度(或渗透压)
(2)①第二步:配制适宜浓度范围内的脱落酸溶液A、B、C(A<B<C)
第三步:干旱 向2、3、4组分别喷施适量且等量的A、B、C的溶液,向第 1 组喷施等量的蒸馏水.
第四步:在其他条件相同且适宜的条件下培养一段时间后,测量细胞内脯氨酸、甜菜碱量及细胞的渗透压.
②1、2、3、4组细胞内脯氨酸、甜菜碱量依次增多,细胞内的渗透压依次增大点评:
本题考点: 植物激素的作用;物质进出细胞的方式的综合.
考点点评: 本题考查学生的实验设计能力,重点是对照实验、和变量的掌握.1年前查看全部
- 生物真正光合速率等于呼吸量加表光合速率里的呼吸量是指什么?怎么看图知道呼吸量
 yanghongfei251年前1
yanghongfei251年前1 -
 蟠间乞食 共回答了28个问题
蟠间乞食 共回答了28个问题 |采纳率85.7%在黑暗条件下,一定温度下,测氧气的生成量,或有机物的消耗量1年前查看全部
- 甲、乙丙三图分别表示探究几个环境因素对马铃薯光合作用速率影响的实验结果.下列分析中正确的是( )
甲、乙丙三图分别表示探究几个环境因素对马铃薯光合作用速率影响的实验结果.下列分析中正确的是( )
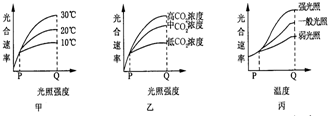
A. 甲图所示实验主要研究光照强度和温度对马铃薯光合作用速率的影响
B. 甲图P 点时,限制马铃薯光合作用速率的因素为光照强度和温度
C. 乙图 Q 点时高CO2浓度条件下,可通过进一步增加光照强度来提高马铃薯光合作用速率
D. 丙图 Q 点之后三条曲线的走势为保持平稳 v176371年前4
v176371年前4 -
 j1i0a 共回答了18个问题
j1i0a 共回答了18个问题 |采纳率88.9%解题思路:甲图中的自变量是光照强度和温度,该图表示光照强度和温度对光合作用速率的影响;乙图的自变量是光照强度和二氧化碳浓度,该图是二氧化碳浓度和温度对光合作用速率的影响,丙图的自变量是温度和光照强度,该图表示温度和光照强度对光合作用速率的影响.A、甲图中,自变量有两种,光照强度和温度,所以A研究了光照强度和温度对光合速率的影响,A正确;
B、甲图中P点时,光合速率在几种温度下都一样,只随光照强度的增高而升高,故此时光合速率不受温度,B错误;
C、Q点后,光合速率没随着光照强度增加而增加,此时不再受光照强度影响,因此增加光照强度不能提高马铃薯光合作用速率,C错误;
D、当温度超过最适温度后,酶的活性降低,光合速率下降,D错误;
故选:A.点评:
本题考点: 影响光合作用速率的环境因素.
考点点评: 分析题图曲线获取信息是解题的突破口,对于光照强度、温度、二氧化碳浓度对光合作用的综合影响的理解把握知识点间的内在联系是解题的关键.1年前查看全部
- 下列关于化学反应速率的说法错误的是( )
下列关于化学反应速率的说法错误的是( )
A.化学反应速率是用于衡量化学反应进行快慢的物理量
B.决定化学反应速率的主要因素是反应物本身的性质
C.Al在氧气中燃烧,将Al粉改为Al片可加快反应速率
D.Zn与稀硫酸反应时,适当提高溶液的温度可加快反应速率 smdxf1年前1
smdxf1年前1 -
 hwhua1001 共回答了16个问题
hwhua1001 共回答了16个问题 |采纳率87.5%解题思路:A、利用化学反应速率来定量表示化学反应进行的快慢;
B、反应物本身的性质是决定化学反应速率的主要因素;
C、反应物接触面积越大,反应速率越快.
D、温度越高,反应速率越快,无论该反应是放热反应还是吸热反应.A、化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;
B、反应物本身的性质是决定反应速率的主要因素,如火药爆炸、食物腐败,故B正确;
C、铝在氧气中燃烧,将Al粉改为Al片,反应物的接触面积变小,反应速率降低,故C错误.
D、温度越高,反应速率越快,所以锌与稀硫酸反应时,适当提高溶液的温度可加快反应速率,故D正确.
故选C.点评:
本题考点: 化学反应速率的影响因素;化学反应速率的概念.
考点点评: 本题考查影响化学反应速率的因素,较简单,注意影响反应速率的因素有内因和外因,常见的外因有浓度、温度、压强、催化剂等,但起决定作用的是内因.1年前查看全部
- 对于可逆反应来说,正反应速率的减小等于逆反应速率的增加,
 whlzhjwh1年前1
whlzhjwh1年前1 -
 g523523 共回答了24个问题
g523523 共回答了24个问题 |采纳率91.7%不一定,温度降低,正逆反应速率都减小.1年前查看全部
- 某课外兴趣小组对H 2 O 2 的分解速率做了如下实验探究。
某课外兴趣小组对H 2 O 2 的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H 2 O 2 )分解速率的因素时采集的一组数据:
用10mL H 2 O 2 制取150mLO 2 所需的时间(秒)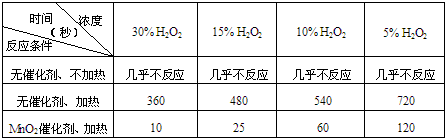
①该研究小组在设计方案时。考虑了浓度、__________________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响___________________________。
(2)将质量相同但聚集状态不同的MnO 2 分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下
①写出H 2 O 2 发生的化学反应方程式___________________________。
②实验结果说明催化剂作用的大小与_______________有关。 yingxuan20041年前1
yingxuan20041年前1 -
 honeyshi 共回答了26个问题
honeyshi 共回答了26个问题 |采纳率84.6%1年前查看全部
- 室温下,用铁片与1mol•L-1稀硫酸反应制取氢气时,改用下列措施不能使氢气生成速率加快的是( )
室温下,用铁片与1mol•L-1稀硫酸反应制取氢气时,改用下列措施不能使氢气生成速率加快的是( )
A.改用热的稀硫酸
B.改用98%的浓硫酸
C.改用铁粉
D.改用2 mol•L-1硫酸 yoat1年前1
yoat1年前1 -
 荔枝后援1号 共回答了21个问题
荔枝后援1号 共回答了21个问题 |采纳率90.5%解题思路:增大反应速率可增大浓度、升高温度或增大固体的表面积,注意不能用浓硫酸,也可形成原电池反应,以此解答.A.改用热的稀硫酸,温度升高,活化分子的百分数增大,反应速率增大,故A不选;
B.改用98%的浓硫酸,铁在室温下与浓硫酸发生钝化反应,不能加快生成氢气的反应速率,故B选;
C.改用铁粉,固体表面积增大,反应速率增大,故C不选;
D.改用2 mol•L-1硫酸,浓度增大,且不影响硫酸的性质,反应速率增大,故D不选.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查化学反应速率的影响因素,为高考高频考点,侧重于学生的分析能力的考查,注意浓硫酸与铁发生钝化反应的性质,为易错点.1年前查看全部
- 100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影
100mL 6mol•L-1 H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量:①Na2CO3(s)②BaCl2(aq)③KNO3(aq)④CH3COONa固体⑤NaCl(aq),其中组合正确的是( )
A.①②③
B.②④⑤
C.③④⑤
D.①③④ 小P乖1年前1
小P乖1年前1 -
 13强 共回答了18个问题
13强 共回答了18个问题 |采纳率88.9%解题思路:过量的锌粉反应,硫酸完全反应,为了减缓反应速率但又不影响生成氢气的总量,可减小氢离子浓度但不改变其物质的量,以此来解答.①加入碳酸钠,与硫酸反应生成二氧化碳,减缓反应速率,硫酸不足,且影响生成氢气的总量,故①错误;
②加入氯化钡溶液对硫酸的物质的量没有影响,不影响生成氢气的总量,但H+离子浓度降低,减缓反应进行的速度,故②正确;
③加入硝酸钾,由于酸性条件下硝酸根离子具有强氧化性,不能生成氢气,故③错误;
④加入醋酸钠固体,生成弱电解质醋酸,溶液氢离子浓度减小,反应速率减小,但不影响生成氢气的总量,故④正确;
⑤加入氯化钠溶液,对硫酸的物质的量没有影响,不影响生成氢气的总量,但H+离子浓度降低,减缓反应进行的速度,故⑤正确.
故选B.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,为高频考点,注意信息中Zn过量及浓度对反应速率的影响即可解答,注重基础知识的考查,题目难度不大.1年前查看全部
- 增加或减少化学平衡时的反应物或生成物浓度对反应有影响吗?如果有反应速率怎么变?麻烦讲得通俗点,谢谢
 844920351年前2
844920351年前2 -
 ss燃烧 共回答了25个问题
ss燃烧 共回答了25个问题 |采纳率88%这应该是高中化学反应速率的题,增加或减少化学平衡时的反应物或生成物浓度时可能有影响,也可能没有影响,要看反应物或生成物是固体还是气体,对于气体和固体来说,固体没有影响(对于高中来说),对于气体和气体来说,一定有影响,记住一个口诀对于气体来说无论是反应物还是生成物对反应速率,一定有影响,固体和液体不一定(很少有影响的),还得看具体的题1年前查看全部
- 匀『速』、匀变『速』是指:速率?
匀『速』、匀变『速』是指:速率?
速率是标量,速度是矢量.请结合圆周运动、直线运动、曲线运动分析.曲线运动是一种变速运动.
有没有匀速曲线运动?
匀速圆周运动算不算是匀速曲线运动 laoyemen1年前7
laoyemen1年前7 -
 小猫爱老猫 共回答了20个问题
小猫爱老猫 共回答了20个问题 |采纳率100%速率只是速度的大小,而速度则包含了大小和前进的方向.
比如你在走路,你的速率只能反映出你走路有多快,不能反映出你在向哪个方向走,而速度则不仅反映出你的快慢,还把你的前进方向通过箭头给标明了出来.
圆周运动是变速运动,所谓的匀速圆周运动其实只是物体的速率不变而已,方向每时每刻都在变化,这种称呼其实不很科学.
没有匀速曲线运动.匀速指的是速度大小和方向都不会发生变化.只要是曲线运动,速度方向就在变化,而速度是由大小和方向两部分构成,任何一部分变化,都不能称之为匀速.1年前查看全部
- 压强对化学反应速率的影响中 压强指的是什么压强
 cx8911年前1
cx8911年前1 -
 wyhbg 共回答了18个问题
wyhbg 共回答了18个问题 |采纳率83.3%是反应物的压强呀,有些反应加压一般是减慢反应速度的,而且些则加速反应.
例如碳酸的分解反应,加压会减慢分解反应速度.相反,水与二氧化碳生成碳酸的反应会因加压而加快.欢迎追问!QQ70492561年前查看全部
- 小六生-速率+圆周问题.如果自行车以平均速率3.2m/s行驶了157秒,后轮共转了多少圈?已知前轮的直径为50,后轮直径
小六生-速率+圆周问题.
如果自行车以平均速率3.2m/s行驶了157秒,后轮共转了多少圈?
已知前轮的直径为50,后轮直径为100.取π为3.14. mic2181年前2
mic2181年前2 -
 iky_b7ddu__0eef 共回答了19个问题
iky_b7ddu__0eef 共回答了19个问题 |采纳率89.5%行驶距离为 3.2×157=502.4 m
后轮直径为100(单位假定应该是cm吧,没有明确),则后轮周长为 3.14×100cm=3.14 m
因此,后轮总共转了 502.4 m / 3.14 m= 160 圈1年前查看全部
- 高一物理 瞬时速度和速率速率不是瞬时速度的大小吗?可瞬时速度是用位移除以时间,速率是用路程除以时间啊.怎么理解速率是瞬时
高一物理 瞬时速度和速率
速率不是瞬时速度的大小吗?可瞬时速度是用位移除以时间,速率是用路程除以时间啊.怎么理解速率是瞬时速度的大小这句话,位移不等于路程啊 戏__子1年前1
戏__子1年前1 -
 zazaaz 共回答了20个问题
zazaaz 共回答了20个问题 |采纳率95%1,速度表示物体运动的快慢程度.速度是矢量,有大小和方向.
2,速度的大小也称为“速率”.速率是标量,只有大小没有方向.
3,运动物体在某一时刻或某一位置时的速度,叫做瞬时速度,简称速度.瞬时速度是矢量,某一时刻(或经某一位置时)瞬时速度的方向,即是这一时刻(或经过一位置时)物体运动的方向.
4,做变速运动的物体其位移与时间的比值不是恒定不变的,这时我们可以用一个速度粗略的描述物体在这段时间内的运动的快慢情况,这个速度就叫做平均速度.
通用的公式是=总位移/总时间
5,加速度是速度变化量与发生这一变化所用时间的比值(△V/△t),是描述物体速度改变快慢的物理量.
区分这几个概念的方法是记住每个概念的比值关系.
高中物理学习最重要的是领悟老师讲的重点,物理中的定义一定要记准,公式记牢,多做习题,公式做到活学活用,另外就是把几个物理实验弄懂就可以了.
手机打字辛苦,1年前查看全部
- 物体沿两个半圆轨道以恒定的速率v运动,圆弧半径均为r,求物体由a运动到b过程中的平均速度?
 acgcn1年前1
acgcn1年前1 -
 gggqq00 共回答了23个问题
gggqq00 共回答了23个问题 |采纳率95.7%平均速度=位移除以时间
时间t=2πr/v
位移x=4r
平均速度v=x/t=4rv/2πr=2v/π1年前查看全部
- 我想请问,假如我在赤道上向东和西跑,速率分别为多少?
我想请问,假如我在赤道上向东和西跑,速率分别为多少?
假设赤道长40000km
对不起,
我曾在多啦a梦中,看到大雄玩问答,其中就问如何才能在地球上以时速高於某一速率行走,其答案就是在赤道上向某一方向跑。(抱歉,"某"是因为我忘记了上所说的速率和时间) 索果1年前4
索果1年前4 -
 阿曼塔 共回答了17个问题
阿曼塔 共回答了17个问题 |采纳率88.2%速率是指一个物体在某个参照物下单位时间内移动的距离.
当你以地球为参照物时,速率等于一个值比如为V1.
如果以太阳为参照物,即使你站在地球上不动,你也在随地球一起运动.如果你在移动,那么,你的移动的速率就是你随地球移动的速度与你走动的速度的和,速度是有大小和方向的,速率只表示大小.
如果你以银河系为参照物,要把太阳的运动考虑进去.
如果你以宇宙背景为参照物,还要把银河系的运动考虑进去.1年前查看全部
- 书上说对于固体的化学反应速率的影响因素是表面积,与它们的量无关,可是我怎么觉得增加量增加了表面积?
书上说对于固体的化学反应速率的影响因素是表面积,与它们的量无关,可是我怎么觉得增加量增加了表面积?
假设一块铁56g,1块铁与73g的稀盐酸反应,反应速率一定,如果增加1块铁的话,反应速率应该会增加吧.. 知路遥1年前2
知路遥1年前2 -
 幻想浪漫 共回答了13个问题
幻想浪漫 共回答了13个问题 |采纳率92.3%你可能理解都点狭隘,增加量不一定能增加表面积,比如说你把铁皮上加一个铁块,然后用铁皮把铁块包裹起来,这样表面积是减低的,但是铁的质量是增加的,反应速度很明显慢.
又如我把1个铁块切成若干铁片放入盐酸中的速率是有可能比2个铁块的速率快1年前查看全部
- 某人从原点从发,经20秒向东走了40米,又经15秒向北走了30米,再经15秒向西走了20米,则的平均速率为多少
 看不清晰1年前4
看不清晰1年前4 -
 仙剑3 共回答了20个问题
仙剑3 共回答了20个问题 |采纳率90%概念
物体的路程和通过这段路程所用时间的比,叫做这段路程的平均速率.
平均速率=路程/时间
公式
v=△s∕△t
平均速率与平均速度的区别
平均速率在习惯上称平均速度,但与平均速度却有很大的区别.平均速度是物体通过的位移和通过该位移所用时间的比.
平均速率是标量,平均速度是矢量,所以平均速率和平均速度不是同一个物理量.
但在单向的匀速直线运动中,平均速率和平均速度的大小是相等的,平均速率强调平均速度的大小,不强调平均速度的方向.
他所走的路程等于根号2下1300m,用的时间是45秒,则平均速率:0.72米每秒.1年前查看全部
- 热学]关于温度,下说法正确么:物体若失去一批速率大的分子,则物体的温度必然下降.
 雁鹜起琼田1年前4
雁鹜起琼田1年前4 -
 催文小分队gg 共回答了10个问题
催文小分队gg 共回答了10个问题 |采纳率100%温度一定减小
因为温度是分子平均动能的标志
当失去N个速率大的分子时,分子失去的分子动能肯定大于N*分子平均动能,剩下的分子的动能的平均值一定会减小,所以温度会降低,实际上是物体内部分子热运动的剧烈程度下降了1年前查看全部
- 小球从h高处自由落下,碰地后又竖直弹起,每次弹起的速率均为碰地前瞬时速率的2/3,空气阻力忽略不计.求小球从释放到停下所
小球从h高处自由落下,碰地后又竖直弹起,每次弹起的速率均为碰地前瞬时速率的2/3,空气阻力忽略不计.求小球从释放到停下所经历的总路程.
 终极代码1年前1
终极代码1年前1 -
 没有墓碑 共回答了16个问题
没有墓碑 共回答了16个问题 |采纳率93.8%由机械能守恒 mgh=1/2mv^2 得 2gh=v^2
结合题意可知每次碰地前后的高度之比为h/h'=9/4
即第1次弹起高度 h1=4h/9
第3次弹起高度 h2=4h1/9=(4/9)^2*h
.
第n次弹起高度 hn=(4/9)^n*h
所以小球从释放到停下所经历的总路程.
s=h+2h1+2h2+...2hn
=h+(4/9)*2h+(4/9)^2*2h+...(4/9)^n*2h
=h+2h*4/5=13h/51年前查看全部
- 为什么碳酸氢钠与盐酸反应速率比碳酸钠与盐酸快
 flfl7581年前1
flfl7581年前1 -
 忆雪儿 共回答了20个问题
忆雪儿 共回答了20个问题 |采纳率90%碳酸钠与酸的反应是分两步的,先与酸生成碳酸氢钠,再由碳酸氢钠与酸反应生成气体1年前查看全部
- 一阶RC电路的时间常数与传输速率的关系?
 干哥哥1年前1
干哥哥1年前1 -
 红尘过客-只要你 共回答了16个问题
红尘过客-只要你 共回答了16个问题 |采纳率100%还得看信号源频率,时间常数大于周期,速率就慢;基本上都是时间常数越小,传输速率越快1年前查看全部
- 压强对化学反应速率,方向的影响,包括有固体和液体存在时,各是怎样的?
 yunhai66881年前3
yunhai66881年前3 -
 地瓜稀饭 共回答了24个问题
地瓜稀饭 共回答了24个问题 |采纳率100%比如3A(s)+B(g)=2C(g) 考虑时应忽略固体和液体,比如此时压强增大平衡应左移1年前查看全部
- 下列说法正确的是( )A. 在合成氨反应中,相同条件下有催化剂时(a)和无催化剂时(b)速率时间图象可用图1表示B.
下列说法正确的是( )
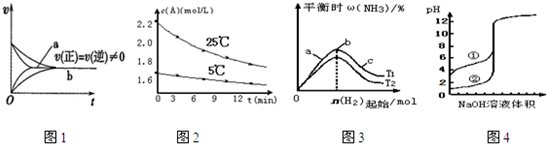
A. 在合成氨反应中,相同条件下有催化剂时(a)和无催化剂时(b)速率时间图象可用图1表示
B. 已知:A+H2O⇌B+C两份初始浓度不同的A溶液得到c(A)随时间变化如图2.由图可以充分说明A的水解反应速率随温度升高而增大
C. 图3表示合成氨反应在其他条件不变的情况下,改变n(H2)起始对平衡的影响.由此可知,N2的转化率最高的是b点
D. 用0.1000 mol/L NaOH溶液分别滴定浓度相同的两种一元酸①和②,由图4曲线可确定酸性:②强于① 诸葛火逍遥1年前1
诸葛火逍遥1年前1 -
 逸然930 共回答了23个问题
逸然930 共回答了23个问题 |采纳率91.3%解题思路:A.加入催化剂,反应速率增大;
B.应在浓度相同的条件下比较;
C.氮气的转化率最大的是c;
D.浓度相同的两种一元酸①和②,pH越小,酸的电离程度越大.A.加入催化剂,反应速率增大,a、b的反应速率不等,故A错误;
B.比较温度对反应速率的影响,应在同浓度下比较,否则不具有可比性,故B错误;
C.增大氢气的浓度,平衡向正向移动,氢气的起始量越大,氮气的转化率越大,故C错误;
D.浓度相同的两种一元酸①和②,pH越小,酸的电离程度越大,故D正确.
故选D.点评:
本题考点: 酸碱混合时的定性判断及有关ph的计算;化学反应速率的影响因素;化学平衡的影响因素.
考点点评: 本题考查较为综合,涉及化学反应速率的影响、平衡移动以及酸碱混合的定性判断等知识,为高考常见题型,侧重于学生的分析能力的考查,难度中等,注意相关基础知识的积累.1年前查看全部
- 虚线框abcd内的正方形区域内有竖直向下的匀强电场,如图所示.一束速率相同的氕核、氘核和氚核从a处垂直电场方向进入电场,
虚线框abcd内的正方形区域内有竖直向下的匀强电场,如图所示.一束速率相同的氕核、氘核和氚核从a处垂直电场方向进入电场,氕核、氘核和氚核的质量分别为m、2m、3m,电荷量都为q,若其中氘核正好从c点射出,则以下判断正确的是
A.氕核从bc边射出,氚核从cd边射出
B.氕核和氚核也是从c点射出
C.氘核和氚核在电场中的运动时间相同,大于氕核在电场中的运动时间
D.氕核在电场中的运动时间最短,氚核在电场中的运动时间最长
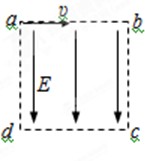
 huangqiufeng1年前1
huangqiufeng1年前1 -
 今色 共回答了15个问题
今色 共回答了15个问题 |采纳率100%D1年前查看全部
- 一个动量物理题A.B两船质量均为M,都静止在水面上,今有A船上质量为二分之M的人,以对地水平速率V从A船跳到B船上,再从
一个动量物理题
A.B两船质量均为M,都静止在水面上,今有A船上质量为二分之M的人,以对地水平速率V从A船跳到B船上,再从B船跳到A船上,重复若干次,最终人停在B船上,则:A.A、B(包括人)两船速率之比为2:3
B.A、B(包括人)两船动量大小之比为1:1
C.A、B(包括人)两船动能之比为3:2
D.以上均不正确 6300861年前2
6300861年前2 -
 哈哈敖 共回答了18个问题
哈哈敖 共回答了18个问题 |采纳率88.9%MV1'-(M+M/2)V2'=(M=M/2)V1-MV2
解得 V1'/V2'=(M+M/2)/M=3/2
所以A错
根据上面的式子A的动量减去B的动量 等于0所以B对
因为速度的比为3/2所以动能的比应该为3的平方比2的平方所以C错.所以本题应该选B1年前查看全部
- 电路中可以用这个公式v=根号下2Uq/m计算电子定向运动的速率吗?为什么?
 云端之上下1年前1
云端之上下1年前1 -
 寳寶 共回答了19个问题
寳寶 共回答了19个问题 |采纳率68.4%不能,因为这个公式是根据动能定理得来的,及△Ek=1/2mv²-0²=Uq,然而在电路中存在电阻R,那么实际上△Ek=1/2mv²-0²=Uq-W.W=其他能量耗损.1年前查看全部
- 为了加快固体溶解速率,常用热水溶解CuSO4,但会产生浑浊,原因是什么?如何得到澄清的CuSO4溶液?
 剑啸梅雪1年前2
剑啸梅雪1年前2 -
 lanytian 共回答了16个问题
lanytian 共回答了16个问题 |采纳率93.8%Cu离子在水中存在水解平衡,Cu离子+水=氢氧化铜+H离子,反应吸热.热水会导致平衡右移,促进水解,产生氢氧化铜沉淀,向溶液中添加H离子则可抑制水解,为了不引入杂质,应该加入稀硫酸1年前查看全部
- 利用光波 电磁波 超声波来提高化学反应速率只是提供能量吗?除了提供能量之外还是否影响了其他别的方面,
利用光波 电磁波 超声波来提高化学反应速率只是提供能量吗?除了提供能量之外还是否影响了其他别的方面,
譬如说,声波是否影响了原子间的斥力与引力?希望详尽一点.(>_ 封我也要说1年前2
封我也要说1年前2 -
 尖椒炒肥腸 共回答了16个问题
尖椒炒肥腸 共回答了16个问题 |采纳率93.8%这些波都可以成为机械波,都有机械能吧.超声波是靠振动改变物体分子间运动的速率.
超声波换能器是将电能转换成机械能(超声波)的器件,其中最成熟可靠的是以压电效应实现电能与声能相互转换的器件,称为压电换能器.1年前查看全部
- 向2L密闭容器中加入2molN2、10molH2,发生反应,2min后N2剩1mol,求生成物和反应物的反应速率.
 dawei3291年前1
dawei3291年前1 -
 aomama 共回答了18个问题
aomama 共回答了18个问题 |采纳率83.3%v(N2)=0.25mol/L·min
v(H2)=0.75mol/L·min
v(NH3)=0.5mol/L
N2反应掉的物质的量是2-1=1mol
变化浓度是1/2=0.5mol
反应速率v=△c/t=0.5/2=0.25mol/L·min
反应速率之比等于化学计量数之比.
v(N2)/1=v(H2)/3=v(NH3)/2
v(H2)=0.75mol/L·min
v(NH3)=0.5mol/L1年前查看全部
- 如图所示,匀强磁场的感应强度为B,宽度为d,两平行边界为CD和EF.一电子从CD边界外侧以速率v0垂直匀强磁场射入,入射
如图所示,匀强磁场的感应强度为B,宽度为d,两平行边界为CD和EF.一电子从CD边界外侧以速率v0垂直匀强磁场射入,入射方向与CD边界间夹角为θ.已知电子的质量为m,电荷量为e,为使电子能从磁场的另一侧EF射出,求电子的速率v0至少多大?(不计电子的重力)

 bruce9451年前0
bruce9451年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 一物体以6m/s的初速度从A点沿AB圆弧下滑到B点,速率仍为6m/s,若物体以5m/s的初速度从A点沿同一路线滑到B点,
一物体以6m/s的初速度从A点沿AB圆弧下滑到B点,速率仍为6m/s,若物体以5m/s的初速度从A点沿同一路线滑到B点,则到B点时的速率为什么大于5m/s
 月光ee1年前1
月光ee1年前1 -
 bobo_319 共回答了22个问题
bobo_319 共回答了22个问题 |采纳率81.8%这里主要考察的是摩擦力做功的问题.以6米速度运动时,摩擦力做功等于A位置的势能(以B为0势能点).当以5米速度运动时,由于速度低,离心力小,所以物体对轨道的压力也减小,摩擦力也会减小,其做的功也减小,这样摩擦力做的总功小于A点势能,从而在B点物体的动能比要大于A点的动能.1年前查看全部
- 催化剂能使反应速率逐渐加快吗?h202中mno2
 juzihlyl1年前2
juzihlyl1年前2 -
 jiapeng521 共回答了18个问题
jiapeng521 共回答了18个问题 |采纳率94.4%能加快双氧水的分解速率,但不是逐渐加快的.1年前查看全部
- 反应:3Fe+4H2O=Fe3O4+4H2在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是.A增加
反应:3Fe+4H2O=Fe3O4+4H2在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是.A增加Fe的量.B将容器体积缩小一半.C保持体积不变,冲入N2使体系压强增大.D保持压强不变,充入N2使容器体积增大.
 xiaopiao_cool1年前1
xiaopiao_cool1年前1 -
 雨隆 共回答了17个问题
雨隆 共回答了17个问题 |采纳率94.1%A的话,固体一般不考虑其作为反应物时对反应速率的影响;C的话,影响H2的反应时H2的分压,和N2没有关系1年前查看全部
- 什么是吸附动力学谁能说下概念,包括那些方程?吸附平衡时间,吸附速率、吸附等温线,都属于动力学吗?
 whiteblue1年前1
whiteblue1年前1 -
 海角的海 共回答了22个问题
海角的海 共回答了22个问题 |采纳率81.8%吸附动力学主要是研究一些表面能比较大的物质(比如活性炭)的吸附速率的影响因素,比如温度,反应条件等等的作用.
至于方程式,因为有太多,没法一一列举,而且符号的意义不看书不可能理解,建议还是买本书看.
补充:吸附等温线是热力学的,平衡时间和速率是动力学的,热力学主要是研究吸附可行性的.1年前查看全部
- 总光和速率可用单位时间内单位叶面积上光合作用吸收的CO2量?
总光和速率可用单位时间内单位叶面积上光合作用吸收的CO2量?
如题,不是..总光合=叶片积吸收的CO2量+线粒体释放的CO2量吗? hh饕餮1年前1
hh饕餮1年前1 -
 就是要烦你 共回答了19个问题
就是要烦你 共回答了19个问题 |采纳率94.7%.总光合速率=叶片净吸收的CO2量(即测得的)+呼吸释放的释放的CO2量1年前查看全部
- 有关香农公式用香农公式计算,假定信道带宽为3100Hz,最大信息传输速率35kps,若要将最大信息传输速率增加60%,信
有关香农公式
用香农公式计算,假定信道带宽为3100Hz,最大信息传输速率35kps,若要将最大信息传输速率增加60%,信噪比S/N要增大到多少?
如果在刚才的基础上将信噪比S/N再增大10倍,问最大信息传输速率能否再增加20%?
这是课本上的一道题.我算出来的结果怎么和书后面的答案不一样.书后面的答案是100;不能,最多加18.5%.
我的计算结果为108倍和29%. 第七道封印1年前1
第七道封印1年前1 -
 zestmate 共回答了12个问题
zestmate 共回答了12个问题 |采纳率91.7%楼主我帮你算了一下,按照香农公式C = W log2 (1+S/N)计算:
第一小题,我算出来也是约为108倍
第二小题,我算了一下是不能,如果要再增加20%,必须在刚才的基础上再增加约12倍
不知道我计算有无失误,纯粹参考1年前查看全部
- 测定呼吸速率有何意义
 打帖匠1年前1
打帖匠1年前1 -
 xiaolsimon 共回答了22个问题
xiaolsimon 共回答了22个问题 |采纳率86.4%1、了解其影响因素,可以用于保鲜蔬菜、果实等,也可以用于大棚蔬菜的种植,1年前查看全部
- 催化剂只能改变化学反应速率(包括——和 —— 两种作用)不能增大或渐少生成物的——
 江西玉米0521年前1
江西玉米0521年前1 -
 wu2636686 共回答了20个问题
wu2636686 共回答了20个问题 |采纳率100%催化剂只能改变化学反应速率(包 括[改变正反应速率] 和 [改变逆反应速率]两种作用)
不能增大或渐少生成物的(质量)1年前查看全部
- 与硝酸银醇溶液反应,速率最大的是
与硝酸银醇溶液反应,速率最大的是
A、CH2=CHCl B、CH2=CHCH2Cl
C、CH3CH2Cl qbb10271年前1
qbb10271年前1 -
 yinxiaoming 共回答了19个问题
yinxiaoming 共回答了19个问题 |采纳率68.4%卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃和烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀.
所以应该选择B选项.1年前查看全部
- 好人回答下`简便运算,决不食言人在运动时心跳速率通常和人的年龄有关,如果用A表示一个人的年龄,用B表示正常情况下这个在运
好人回答下`简便运算,决不食言
人在运动时心跳速率通常和人的年龄有关,如果用A表示一个人的年龄,用B表示正常情况下这个在运动时所能承受的每分钟心跳的最高次数,那么B=0.8(220-A) 正常情况下在运动了时一个14岁的少年所能承受的每分钟心跳最高次数是多少?一个56岁的人在运动是,10秒心跳的次数为22次请问他需要去医院吗为什么? OMG2151年前1
OMG2151年前1 -
 wwyswwys 共回答了17个问题
wwyswwys 共回答了17个问题 |采纳率94.1%(一)
B=0.8(220-14)=164.8=164
(二)
B=0.8(220-56)=131.2=131
22×60÷10=132
刚刚超过承受极限,还是去医院检查一下为好.1年前查看全部
- 对于密闭容器中进行的反应:N2+O2=2NO,下列条件中哪些能加快反应速率(假定改变下列条件时温度不变)
对于密闭容器中进行的反应:N2+O2=2NO,下列条件中哪些能加快反应速率(假定改变下列条件时温度不变)
A缩小容器体积使压强增大
B压强不变,充入N2使容器体积增大
C容器体积不变充入氦气使压强增大
D增大容器的体积 feng833525551年前2
feng833525551年前2 -
 clivia0429 共回答了14个问题
clivia0429 共回答了14个问题 |采纳率92.9%A1年前查看全部
- 化学反应具有条件性,影响化学反应速率因素有哪些
 PeTeR--猪1年前4
PeTeR--猪1年前4 -
 cyp536 共回答了24个问题
cyp536 共回答了24个问题 |采纳率83.3%内因:反应物的性质
外因:浓度
压强
温度
是否有催化剂
其他(不常见):反应物间的接触面积,电磁波,超声波,磁场等1年前查看全部
- 可逆反应中,如果在一定容器中充入稀有气体,是否影响反应速率?是否影响平衡?
可逆反应中,如果在一定容器中充入稀有气体,是否影响反应速率?是否影响平衡?
还有,保持压强不变的情况下呢?对于速率和平衡是否有影响?为什么? 魏晨的YY女王1年前2
魏晨的YY女王1年前2 -
 y9wn7x 共回答了19个问题
y9wn7x 共回答了19个问题 |采纳率89.5%恒容的时候都不影响.压强的话看情况.速率肯定是变慢了,平衡分类讨论1年前查看全部
- 我知道-纯液体或固体物质量改变却不会影响化学反应速率,但纯气体为什么会受影响?跟纯液体不一样是常数吗
 锦山人1年前2
锦山人1年前2 -
 sadoi789 共回答了11个问题
sadoi789 共回答了11个问题 |采纳率100%气体化学反应速率的计算,受状态影响,质量减少而体积不变,压力就要随之减少;液体基本不受这个影响.固体反应速率其实受颗粒状态影响的,固体与液体反应时,颗粒小,表面积大,反应速率也就大.1年前查看全部
- 曲线运动中,平均速度和平均速率可能等于零吗?平均速度的大小可能比平均速率大吗?求原因!
 hyt_331年前2
hyt_331年前2 -
 天堂小子 共回答了19个问题
天堂小子 共回答了19个问题 |采纳率84.2%平均速度可以,平均速率不行.因为当位移等于零是,比如一个物体绕了一圈后又绕回原地.此时平均速度就等于零(平均速度等于位移比时间),但平均速率不为零,因为平均速率等于路程比时间.路程不为零1年前查看全部
- 1.:100ml 2mol/l盐酸跟过量的锌片反应,为了加快反应速率,又不影响生成氢气总量,可采用的方法是( )
1.:100ml 2mol/l盐酸跟过量的锌片反应,为了加快反应速率,又不影响生成氢气总量,可采用的方法是( )
A 加入适量6mol/l盐酸 B加入数滴氯化铜溶液
C 加入适量蒸馏水 D加入实力氯化钠溶液
刚才的人说下话我加你分我要走了

 fly19911年前1
fly19911年前1 -
 紫色年代 共回答了18个问题
紫色年代 共回答了18个问题 |采纳率100%希望答案对您有所帮助!
答案选B,因为Zn是过量的,这就保证可以和CuCl2发生置换反应生成Cu.从而得到了铜锌原电池.而铜又不会和盐酸反应,只会加快反应速率,所以选B!
PS:A会增加氢气总量的
C会减缓反应速度
D也是减缓反应速度1年前查看全部
- 反应物均为气体,保持容积不变,通入b mol氖气,反应速率怎么变化,为什么会这样变呢?求大师
 xiujing_pp1年前6
xiujing_pp1年前6 -
 我是那么那么的想 共回答了11个问题
我是那么那么的想 共回答了11个问题 |采纳率90.9%反应速率不变.
因为氖气是稀有气体,不参加反应,通入后,由于保持容积不变,所以反应物浓度不变,化学反应速率不变.1年前查看全部
- 举例说明溶液中进行的化学反应比固体之间发生的化学反应速率快
举例说明溶液中进行的化学反应比固体之间发生的化学反应速率快
要固体间反应的实物例子 VCD555DCV1年前1
VCD555DCV1年前1 -
 yantra 共回答了18个问题
yantra 共回答了18个问题 |采纳率77.8%例如:硫酸铜溶液跟氯化钡溶液反应就比它们固体之间反应速率快!1年前查看全部
大家在问
- 1甲数是a,比乙数的3倍多b,表示乙数的算式是( )
- 2能反应的写出化学方程式,不反应的说出理由
- 3综合练习一
- 4公园里有一棵大树,树干周长是3.454米,这棵大树树干的横截面面积大约是多少?(结果保留两位小数)
- 5下列加点字用法不同的一项是( ) A.忽啼求【之】 B.邑人奇【之】 C.不能称前时【之】闻 D.于舅家见【之】
- 6小学升中英语动词不规则过去式大全
- 727.5 75 37.5 38 36.9 49.9 42.8 这7个单价倍数后相加等于1万、 麻烦看清楚题~·
- 8成语中的“口”
- 9排列组合平均分组重复问题排列组合问题中用组合公式平均分组会有重复.例如十个球平均分5组用组合公式结果还要除以5的全排列,
- 10已知3sin平方a+2sin平方b=2sina.则cos平方a+cos平方b的取值范围
- 11在一张比例尺是20:1的精密仪器图纸上量得一零件的长是54mm,这零件的实际长度是多长?求过程。快拜托了
- 12列竖式计算0.697+0.72321.05-7.310-0.871.3-0.506.
- 13在还原糖、脂肪、蛋白质的鉴定实验中,对实验材料选择的叙述,错误的是( )
- 14已知定义在R上的偶函数f(x)满足f(1+x)=f(1-x),且x∈[0,1]时,f(x)=−78x,则方程f(x)=(
- 15人体那个器官含水最大?

