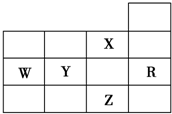
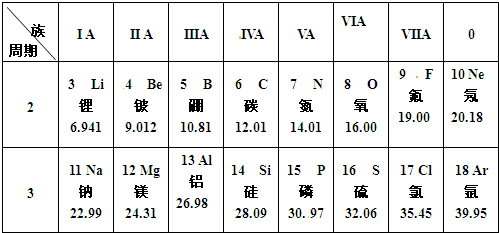
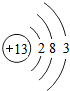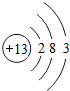下表是元素周期表主族元素的一部分,短周期元素X的最高正化合价是+5,Y的单质可在空气中燃烧.
 阿虎杰08272022-10-04 11:39:541条回答
阿虎杰08272022-10-04 11:39:541条回答| W | X | Y |
| Z |
(1)Z的元素符号是______,写出Z的原子结构示意图:______.
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,该反应的离子方程式为______.
(3)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中Z用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2ZO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |

已提交,审核后显示!提交回复
共1条回复
 MP4素绅 共回答了21个问题
MP4素绅 共回答了21个问题 |采纳率81%- 解题思路:短周期元素X的最高正化合价是+5,处于ⅤA族,Y的单质可在空气中燃烧,结合元素在周期表的位置可知,X为P、W为Si、Y为S、Z为Se,
(1)Se比S原子核外多18个电子,根据S的原子结构示意图即可写出Se的原子结构示意图;
(2)二氧化硅与氢氧化钠反应生成硅酸钠与水;
(3)H2SeO3与H2SO3相似,具有氧化性、还原性和酸性;
(4)由C、O和S三种元素组成的化合物COS中,所有原子的最外层都满足8电子结构,则C原子与O原子之间形成2对个共用电子对、C原子与S原子之间形成2对共用电子对.短周期元素X的最高正化合价是+5,处于ⅤA族,Y的单质可在空气中燃烧,结合元素在周期表的位置可知,X为P、W为Si、Y为S、Z为Se,
(1)由上述分析可知,Z为Se;Se比S原子核外多18个电子,根据S的原子结构示意图可知Se的原子结构示意图为: ,
,
故答案为:Se; ;
;
(2)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应离子方程式为:SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(3)H2SeO3与H2SO3相似,具有氧化性、还原性和酸性,如反应:2H2SeO3+O2═2H2SeO4(或Br2+H2SeO3+H2O═H2SeO4+2HBr)中表现还原性,反应H2SeO3+2NaOH═Na2SeO3+2H2O表现酸性,
故答案为:
1 还原性 2H2SeO3+O2═2H2SeO4
(或Br2+H2SeO3+H2O═H2SeO4+2HBr)
2 酸性 H2SeO3+2NaOH═Na2SeO3+2H2O;
(4)由C、O和S三种元素组成的化合物COS中,所有原子的最外层都满足8电子结构,则C原子与O原子之间形成2对个共用电子对、C原子与S原子之间形成2对共用电子对,COS的电子式为: ,
,
故答案为: .
.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构性质位置关系应用,推断元素是解题关键,难度不大,(3)注意根据同主族元素化合物性质的相似性解答. - 1年前
相关推荐
- 元素周期表中之间存在特殊关系的元素 如对角线关系
元素周期表中之间存在特殊关系的元素 如对角线关系
能否告诉我除对角线关系外是否还有其他像这样的关系及这些关系中所包含的元素 灯下的雨1年前1
灯下的雨1年前1 -
 lluashuijiao 共回答了20个问题
lluashuijiao 共回答了20个问题 |采纳率90%Li、Mg,Be、Al,Be、Al
元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”.查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这些元素的电负性解释对角线规则.
Li、Mg在空气中燃烧产物分别为Li2O、MgO,Be(OH)2、Al(OH)3均为两性氢氧化物,硼和硅的含氧酸均为弱酸,由此可以看出对角线规则的合理性.Li、Mg的电负性分别为1.0、1.2,Be、Al电负性均为1.5,B、Si的电负性分别为2.0、1.8数值相差不大,故性质相似.1年前查看全部
- (2014•南宁)广西矿产资源丰富,铟的生产规模居世界同类企业首位,图1是元素周期表中铟元素的信息,图2是铟原子的结构示
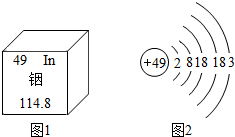 (2014•南宁)广西矿产资源丰富,铟的生产规模居世界同类企业首位,图1是元素周期表中铟元素的信息,图2是铟原子的结构示意图,回答下列问题:
(2014•南宁)广西矿产资源丰富,铟的生产规模居世界同类企业首位,图1是元素周期表中铟元素的信息,图2是铟原子的结构示意图,回答下列问题:
(1)铟元素属于______元素,其原子核外共有______个电子层.
(2)在化学反应中,铟原子容易______电子形成铟离子,铟离子的化学符号为
______.
(3)画出第13号元素的原子结构示意图______.该元素与铟元素在元素周期表中处于同一个______(填“周期”或“族”) 阳关月1年前1
阳关月1年前1 -
 木瓜jtys 共回答了17个问题
木瓜jtys 共回答了17个问题 |采纳率88.2%1年前查看全部
- 根据中学化学教材所附元素周期表判断,下列叙述不正确的是( ) A.第16列元素的最高价氧化物的化学式为RO 3 B.第
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( ) A.第16列元素的最高价氧化物的化学式为RO 3 B.第2列元素中一定没有非金属元素 C.第15列元素的最高价氧化物对应水化物的化学式均为H 3 RO 4 D.在18列元素中,第3列元素种类最多  jelfson1年前1
jelfson1年前1 -
 tangyu568 共回答了10个问题
tangyu568 共回答了10个问题 |采纳率90%A.第16列元素为ⅥA族元素,最高价为+6价,则元素的最高价氧化物的化学式为RO 3 ,故A正确;
B.第2列元素为ⅡA族元素,为碱土金属元素,全为金属元素,则没有非金属元素,故B正确;
C.第15列元素为ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO 3 ,故C错误;
D.在18列元素中,第3列为ⅢB族,有镧系和锕系,则元素种类最多,故D正确;
故选C.1年前查看全部
- 下表是元素周期表的一部分: 族周期 ⅠA 0 一 1 H1.008 ⅡA ⅢA ⅣA V A ⅥA ⅦA 2 He4.0
下表是元素周期表的一部分:
(1)12号元素的元素符号为______;Be元素的相对原子质量为______.族
周期ⅠA 0 一 1 H
1.008ⅡA ⅢA ⅣA V A ⅥA ⅦA 2 He
4.003二 3 Li
6.9414 Be
9.0125 B
10.8l6 C
12.017 N
14.0l8 O
16.009 F
19.0010 Ne
20.18三 11 Na
22.9912 Mg
24.3113 Al
26.9814 Si
28.0915 P
30.9716 S
32.0617 Cl
35.4518 Ar
39.95
(2)相对原子质量为22.99的元素属______(填“金属”或“非金属”);Ne的化学性质______;F元素最外层电子数为______.
(3)表中不同种元素最本质的区别是______(填字母).
A.质子数不同B.相对原子质量不同C.中子数不同
(4)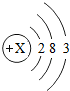 为某元素的原子结构示意图,该元素位于周期表中第______周期.
为某元素的原子结构示意图,该元素位于周期表中第______周期. laoyumaoa1年前1
laoyumaoa1年前1 -
 swf0705 共回答了19个问题
swf0705 共回答了19个问题 |采纳率94.7%(1)从元素周期表中可查得12号元素的元素符号为 Mg,Be元素的相对原子质量为 9.012,
故答案为:Mg;9.012;
(2)从元素周期表中可查得相对原子质量为22.99的元素是钠 Na,根据化学元素汉字名称的偏旁可辨别元素的种类,金属元素名称一般有“金”字旁,因此该元素属金属元素;Ne从元素周期表中可知是稀有气体,它的化学性质稳定;F元素位于第二周期有两个电子层,原子序数=质子数=核外电子数=9,第一层有2 个电子,则最外层电子数为7;
故答案为:金属;稳定;7;
(3)元素是具有相同核电荷数(即核内质子数)的一类原子的总称,不同种元素之间的本质区别是质子数不同,表中不同种元素最本质的区别是 A质子数不同,
故选A;
(4)根据元素周期律电子层数与周期数相同,由原子结构示意图可知该元素位于周期表中第三周期,
故答案为:三.1年前查看全部
- 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
 如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.W元素的第一电离能小于Y元素的第一电离能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素 11xiaobai111年前1
11xiaobai111年前1 -
 出道者 共回答了19个问题
出道者 共回答了19个问题 |采纳率100%解题思路:图为元素周期表前四周期的一部分,由位置可知,X为F,W为P,Y为S,Z为Br,R为Ar,
A.W的3p电子半满为稳定结构;
B.Y的阴离子有3个电子层,而Z的阴离子有4个电子层;
C.p能级未成对电子最多为3个,只有W符合;
D.上述元素中F的非金属性最强.图为元素周期表前四周期的一部分,由位置可知,X为F,W为P,Y为S,Z为Br,R为Ar,
A.W的3p电子半满为稳定结构,则W元素的第一电离能大于Y元素的第一电离能,故A错误;
B.Y的阴离子有3个电子层,而Z的阴离子有4个电子层,则Y的阴离子电子层结构与R原子的相同,故B错误;
C.p能级未成对电子最多为3个,只有W符合,故C错误;
D.上述元素中F的非金属性最强,则X元素是电负性最大,故D正确;
故选D.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查位置、结构、性质的关系及应用,明确元素在周期表中的位置及元素的性质、电子排布是解答的关键,注意p电子半满为稳定结构,题目难度中等.1年前查看全部
- 根据中学化学教材所附元素周期表判断,下列叙述不正确的是( ) A.第16列元素的最高价氧化物的化学式为RO 3 B.第
根据中学化学教材所附元素周期表判断,下列叙述不正确的是( ) A.第16列元素的最高价氧化物的化学式为RO 3 B.第2列元素中一定没有非金属元素 C.第15列元素的最高价氧化物对应水化物的化学式均为H 3 RO 4 D.在18列元素中,第3列元素种类最多  沤沤非1年前1
沤沤非1年前1 -
 tomato_fang 共回答了18个问题
tomato_fang 共回答了18个问题 |采纳率72.2%A.第16列元素为ⅥA族元素,最高价为+6价,则元素的最高价氧化物的化学式为RO 3 ,故A正确;
B.第2列元素为ⅡA族元素,为碱土金属元素,全为金属元素,则没有非金属元素,故B正确;
C.第15列元素为ⅤA族元素,最高价为+5价,N元素的最高价氧化物对应水化物的化学式为HNO 3 ,故C错误;
D.在18列元素中,第3列为ⅢB族,有镧系和锕系,则元素种类最多,故D正确;
故选C.1年前查看全部
- (p00n•北碚区)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中七号~七8号元素原子核外电子排布,我对它
(p00n•北碚区)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中七号~七8号元素原子核外电子排布,我对它进行研究:
(七)第七七号元素名称是______,它属于______元素(填“金属”或“非金属”),它在化学反应中容易______(填“1”或“失”)电子,它的离子符号为______.
(p)从上表中我还可以探究出以下规律:原子核外电子数=原子序数=______=______.
(3)研究表明:第二周期从3号~了号元素的原子电子层数相同,核电荷数逐渐增9,核对核外电子的引力逐渐增9,故原子半径逐渐减小.我分析第三周期从七七号~七7号元素原子半径变化规律是______. blestgod1年前1
blestgod1年前1 -
 hotcozeQQ 共回答了19个问题
hotcozeQQ 共回答了19个问题 |采纳率89.5%解题思路:(1)根据元素周期表可知,第11号元素名称、由其汉语名称可知其元素种类、由最外层电子数可知得失电子情况;
(2)熟记规律:“原子序数=核内质子数=核外电子数=核电荷数”;
(3)总结规律:“第二周期从3号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小”,利用知识迁移,则可知第三周期从11号~17号元素原子半径变化规律.(1)根据元素周期表可知,第11号元素名称是钠元素,它属于金属元素,它在化学反应中容易失电子,它的离子符号为N4+;
(2)从上表中还可以探究出以下规律:原子核外电子数=原子序数=核电荷数=核内质子数;
(如)研究表明:第我周期从如号~9号元素的原子电子层数相同,核电荷数逐渐增大,核对核外电子的引力逐渐增大,故原子半径逐渐减小.利用知识迁移,则可分析第三周期从11号~1f号元素原子半径变化规律是原子半径逐渐减小.
故答为:(1)钠;金属;失;N4+;(2)核电荷数;核内质子数(此两空不分顺序);(如)原子半径逐渐减小点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的符号及其意义.
考点点评: 了解元素周期表的特点及其应用;核外电子在化学反应中的作用;了解元素的符号及其意义.1年前查看全部
- 短周期元素A、B、C、D、E在元素周期表中的位置如图所示:
短周期元素A、B、C、D、E在元素周期表中的位置如图所示:
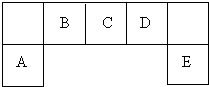
(1)A、C、D元素简单离子的半径由大到小为(填微粒符号)______.
(2)E的氢化物与其最高价氧化物的水合物的钾盐共热能发生反应,生成气体单质E反应的化学方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O△ .8HCl+KClO4.
KCl+4Cl2↑+4H2O△ .
(3)C可形成单质C2,C2分子中σ键和π键的个数比为______.
(4)F与D同主族且相邻,请说明D的氢化物比F的氢化物稳定的根本原因:______.
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强的氧化性的阳离子,试写出阳离子的电子式:______.写出该阳离子与F氢化物的水溶液反应的离子方程式:______. 凝子1年前1
凝子1年前1 -
 wolingmeng 共回答了19个问题
wolingmeng 共回答了19个问题 |采纳率94.7%解题思路:周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键;
(4)F与D同主族且相邻,则F为S元素,非金属性越强,氢化物越稳定;
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水.周期表中ⅡA、ⅢA不相邻,图中为相邻的5个主族,只能为ⅢA~ⅦA元素,由短周期主族元素A、B、C、D、E在元素周期表中的位置,可知A为Al,B为C,C为N,D为O,E为Cl.
(1)N3-、O2-、Al3+具有的核外电子排布,核电荷数越大,离子半径越小,则离子半径N3->O2->Al3+,故答案为:N3->O2->Al3+;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO4,二者发生氧化还原反应生成氯气、水、KCl,反应的方程式为8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O,
故答案为:8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O;
(3)N2分子结构式为N≡N,三键中含有1个σ键、2个π键,N2分子中σ键和π键的个数比为1:2,
故答案为:1:2;
(4)F与D同主族且相邻,则F为S元素,非金属性O>S,故水比硫化氢稳定,
用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,应为H2O+,电子式为: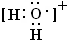 ,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
,该阳离子与H2S水溶液反应生成为S,由电荷守恒可知还生成H+,同时生成水,反应离子方程式为:2H2O++H2S=S↓+2H2O+2H+,
故答案为:氧的非金属性比硫强;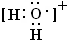 ;2H2O++H2S=S↓+2H2O+2H+.
;2H2O++H2S=S↓+2H2O+2H+.点评:
本题考点: 元素周期律和元素周期表的综合应用;转化率随温度、压强的变化曲线.
考点点评: 本题考查结构、性质、位置关系应用,根据元素的位置推断元素是解题的关键,涉及微粒半径比较、化学键、电子式、化学方程式等知识点,难度中等.1年前查看全部
- 右表为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( ) X Y Z R W
右表为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
X Y Z R W
A.五种元素可能都是金属元素
B.X的氢化物的沸点一定比Z的氢化物的沸点高
C.R的最高价氧化物对应的水化物一定是强酸
D.五种元素的原子最外层电子数一定都大于2 苦茶一杯1年前1
苦茶一杯1年前1 -
 woi5566 共回答了14个问题
woi5566 共回答了14个问题 |采纳率85.7%解题思路:图为元素周期表前四周期的一部分,由元素在周期表中的位置可知,应是周期表的2、3、4周期,由于周期表中ⅡA、ⅢA之间相隔10列,且X、Y、Z、R和W均为主族元素,故Y只能为ⅢA族或ⅣA族元素,若Y为ⅢA族,则Y为Al、Z为Si、X为C、R为P、W为Se;若Y为ⅣA族元素,则Y为Si、Z为P、X为N、R为S、W为Br,结合元素化合物性质解答.图为元素周期表前四周期的一部分,由元素在周期表中的位置可知,应是周期表的2、3、4周期,由于周期表中ⅡA、ⅢA之间相隔10列,且X、Y、Z、R和W均为主族元素,故Y只能为ⅢA族或ⅣA族元素,若Y为ⅢA族,则Y为Al、Z为Si、X为C、R为P、W为Se;若Y为ⅣA族元素,则Y为Si、Z为P、X为N、R为S、W为Br,
A、Y可能是ⅢA族或ⅣA族元素,当Y位于ⅢA族时,是Al元素,其它元素不可能为金属元素,故A错误;
B、当Y位于ⅢA族时,X、Z是ⅣA的C、Si,CH4的沸点比SiH4的低,故B错误;
C、当Y位于ⅢA族时,X、Z是ⅣA的C、Si,R是ⅤA族的P,H3PO4是中强酸,故C错误;
D、Y可能是ⅢA族或ⅣA族元素,则五种元素的原子最外层电子数一定都大于2,故D正确,
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查结构性质位置关系应用,需要学生熟练掌握元素周期表的结构,关键明确周期表中ⅡA、ⅢA之间相隔10列,难度不大.1年前查看全部
- 下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题
下列为元素周期表的一部分,表中阿拉伯数字(1、2…)是原周期表中行或列的序号.请参照元素A~I在表中的位置,回答下列问题.
(1)B、C两元素中非金属性较强的是______(写出元素名称),请设计一个简单的实验证明这一结论______.纵行 1 18 横行 1 A 2 13 14 15 16 17 2 B C D E 3 F G H I
(2)表中某元素能形成两性氧化物,写出该氧化物溶于氢氧化钠溶液的离子反应方程式
______
(3)表中某元素的单质在常温下为气态,该元素能与A~I中的一种元素构成原子个数比为1:1和1:2的两种共价化合物X和Y,该元素还能与A~I中的另一种元素构成离子个数比为1:1和1:2的两种离子化合物Z和M.写出Z与Y反应的化学方程式:______.
(4)I元素在周期表里的位置在第______周期、第______族.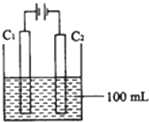
实验室中采用如图所示装置模拟工业上同时制取元素A和I的单质过程:
①写出电极C 1 上发生反应的电极反应式______.
②当电极上产生112mL(标准状况)元素I单质气体时(假设气体完全逸出,溶液体积不变),烧杯中溶液的pH=______.(K W =1.00×10 -14 ) fiank21年前1
fiank21年前1 -
 叔梁圪 共回答了13个问题
叔梁圪 共回答了13个问题 |采纳率84.6%根据元素周期表知,A是H元素,B是C元素,C是N元素,D是O元素,E是F元素,F是Na元素,G是Al元素,H是Si元素,I是Cl元素;
(1)B、C两元素中非金属性较强的是氮元素,非金属的非金属性越强,其最高价氧化物的水化物酸性越强,用碳酸钠或碳酸氢钠与稀硝酸反应,观察是否有有无色无味的气体产生,如果能产生无色无味的气体,则说明氮元素的非金属性大于碳元素,
故答案为:氮;取碳酸钠或碳酸氢钠溶液置于试管中,向其中滴加稀硝酸,观察是否有无色无味的气体产生,HNO 3 +NaHCO 3 ═NaNO 3 +H 2 O+CO 2 ↑,或2HNO 3 +Na 2 CO 3 ═2NaNO 3 +H 2 O+CO 2 ↑;
(2)氧化铝是两性氧化物,氧化铝和氢氧化钠反应生成偏铝酸钠和水,离子反应方程式为:Al 2 O 3 +2OH - ═2AlO 2 - +H 2 O,故答案为:Al 2 O 3 +2OH - ═2AlO 2 - +H 2 O;
(3)氧元素和氢元素能形成原子个数比为1:1和1:2的两种共价化合物H 2 O 2 和H 2 O,氧元素元素还能钠元素构成离子个数比为1:1和1:2的两种离子化合物Na 2 O 2 和Na 2 O,过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na 2 O 2 +2H 2 O═4NaOH+O 2 ↑,故答案为:2Na 2 O 2 +2H 2 O═4NaOH+O 2 ↑;
(4)氯元素的原子结构示意图为: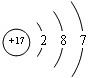
,所以氯元素处于第三周期,第VIIA族,故答案为:三;VIIA;
①电解时阳极上氯离子放电生成氯气,电极反应式为:2Cl - -2e - =Cl 2 ↑,故答案为:2Cl - -2e - =Cl 2 ↑;
②设氢氧根离子浓度为xmol/L,电池反应式为:
2Cl - +2H 2 O=H 2 ↑+Cl 2 ↑+2OH -
22.4L 2mol
0.112L0.1xmol
x=
0.112L×2mol
22.4L×0.1mol =0.1,溶液中c(H + )=
1 0 -14
0.1 mol/L=10 -13 mol/L,所以pH=13,
故答案为:13.1年前查看全部
- 元素周期表中,非金属元素间的反应规律
 Tripod-1年前1
Tripod-1年前1 -
 topline 共回答了13个问题
topline 共回答了13个问题 |采纳率69.2%主要根据氧化还原性来反应的
同族之间,从上到下,氧化性减弱,还原性增强1年前查看全部
- 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
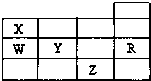 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.原子半径:X>W>Y
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.Y元素的最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 yinamd11年前1
yinamd11年前1 -
 lingse 共回答了17个问题
lingse 共回答了17个问题 |采纳率94.1%解题思路:由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.同周期自左而右原子半径减小,电子层越多原子半径越大;
B.S2-离子核外电子数为18,有3个电子层,而Br-离子有4个电子层;
C.非金属性越强,氢化物越稳定;
D.非金属性越强,最高价含氧酸的酸性越强.由元素在周期表中位置,可知X为氮,W为磷,Y为硫,Z为Br,R为Ar.
A.同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径:W>Y>X,故A错误;
B.S2-离子核外电子数为18,有3个电子层,与Ar原子电子层结构相同,而Br-离子有4个电子层,与Ar原子电子层结构不相同,故B错误;
C.非金属性X>W,非金属性越强,氢化物越稳定,故氢化物稳定性X>W,故C错误;
D.非金属性Y>W,非金属性越强,最高价含氧酸的酸性越强,故最高价含氧酸的酸性:Y>W,故D正确,
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表与元素周期律,难度不大,注意对元素周期律的理解掌握.1年前查看全部
- 原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数
原子序数依次增大的ABCDE都是元素周期表中前20号元素,BCD同周期,AD同主族,且A的原子结构中最外层电子数是电子层数的3倍。E和其他元素既不在同周期也不再同主族,D的最高价氧化物对应的水化物为强酸,且BCD的最高价氧化物对应的水化合物两两混合均能发生反应生成盐和水。则ABCDE分别为哪几种元素_________. 脏ル1年前2
脏ル1年前2 -
 cafe5420 共回答了24个问题
cafe5420 共回答了24个问题 |采纳率87.5%首先,你要把原题写清楚吧 这才能解题
等你1年前查看全部
- 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题:
(1)B、C、D元素的非金属性由大到小的顺序为______;(填元素符号)B C D A E
(2)E的氢化物与其最高价氧化物对应水化物的钾盐共热能发生反应,生成一种气体单质.反应的化学方程式为______;
(3)C有多种氧化物,其中甲的相对分子质量最小,在一定条件下2L甲气体与0.5L氧气相混合,若该气体混合物被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是______;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,又知一定条件下,A的单质能将B从它的最高价氧化物中置换出来.若此置换反应生成3mol B的单质,则该反应在298K下的△H______(注:题中所设单质的为稳定单质).
(5)要证明与D同主族且相邻的元素的非金属性与E的非金属性强弱,正确、合理的实验操作及现象是______. 绿叶和树1年前1
绿叶和树1年前1 -
 那里呀 共回答了14个问题
那里呀 共回答了14个问题 |采纳率78.6%由短周期主族元素A、B、C、D、E在元素周期表中的位置可知,B、C、D位于第二周期,则B为C,C为N,D为O,A为Al,E为Cl,
(1)同周期从左向右非金属性在增强,则非金属性为O>N>C,故答案为:O>N>C;
(2)E的氢化物为HCl,其最高价氧化物对应水化物的钾盐为KClO 4 ,二者发生氧化还原反应生成氯气、水、KCl,该反应为8HCl+KClO 4
△
.
KCl+4Cl 2 ↑+4H 2 O,
故答案为:8HCl+KClO 4
△
.
KCl+4Cl 2 ↑+4H 2 O;
(3)甲的相对分子质量最小,则为NO,一定条件下2L甲气体与0.5L氧气相混合,生成NO 2 ,且剩余NO,且二者等量,被碱液吸收发生氧化还原反应为NO+NO 2 +2NOH=2NaNO 2 +H 2 O,
则该盐为NaNO 2 ,故答案为:NaNO 2 ;
(4)在298K下,A、B的单质各1mol 完全燃烧,分别放出热量aKJ和bKJ,则①Al(s)+
3
4 O 2 (g)=
1
2 Al 2 O 3 (s)△H=-aKJ/mol,②C(s)+O 2 (g)=CO 2 (g)△H=-bKJ/mol,
由盖斯定律可知,则①×4-②×3可得4Al(s)+3CO 2 (g)=3C(s)+2Al 2 O 3 (s),其反应热△H=(-aKJ/mol)×4-(-bKJ/mol)×3=-(4a-3b)KJ/mol,
故答案为:-(4a-3b)KJ/mol;
(5)与D同主族且相邻的元素的非金属为S,则将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成可证明S和Cl的非金属性强弱,故答案为:将氯气(或氯水)滴入硫化钠溶液中,有淡黄色沉淀生成.1年前查看全部
- 元素周期表是学习和研究化学的重要工具.请据表(元素周期表的部分内容)回答有关问题:
元素周期表是学习和研究化学的重要工具.请据表(元素周期表的部分内容)回答有关问题:
(1)请从表中查出关于硼元素的一条信息:______;族
周期ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA VIIA 0 2 3 Li
锂
6.9414 Be
铍
9.0125 B
硼
10.816 C
碳
12.017 N
氮
14.018 O
氧
16.009 F
氟
19.0010 Ne
氖
20.183 11 Na
钠
22.9912 Mg
镁
24.3113 Al
铝
26.9814 Si
硅
28.0915 P
磷
30.9716 S
硫
32.0617 Cl
氯
35.4518 Ar
氩
39.95
(2)第3周期(横行)中属于金属元素的是______(填一种),其阳离子是______;
(3)第11号元素与第17号元素组成的化合物化学式是______,构成该物质的微粒是______(选填“分子”、原子”或“离子”);
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是______(填标号).
a.C和Neb.Be和Mgc.Al和Sid.F和Cl. sh_stockboy1年前1
sh_stockboy1年前1 -
 紫叶李 共回答了18个问题
紫叶李 共回答了18个问题 |采纳率94.4%解题思路:(1)根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量.
(2)金属元素名称一般有“钅”字旁,据此进行分析解答.
(3)第11号元素与第17号元素分别是钠元素和氯元素,组成的化合物是氯化钠.
(4)根据题意,同一族(纵行)的元素具有相似的化学性质,据此进行分析解答.(1)由硼元素元素周期表的一格可知,硼元素的原子序数为5,相对原子质量为10.81等.
(2)第3周期(横行)中属于金属元素的是钠、镁、铝,如钠元素可形成钠离子,其离子符号为Na+(合理即可).
(3)第11号元素与第17号元素分别是钠元素和氯元素,组成的化合物是氯化钠,其化学式为:NaCl;氯化钠是由钠离子和氯离子构成的.
(4)根据题意,同一族(纵行)的元素具有相似的化学性质,Be和Mg、F和Cl属于同一族(纵行),化学性质相似.
故答案为:(1)硼元素的原子序数为5等;(2)钠;Na+(合理即可);(3)NaCl;离子;(4)bd.点评:
本题考点: 元素周期表的特点及其应用;化学式的书写及意义;化学符号及其周围数字的意义.
考点点评: 本题难度不大,考查学生灵活运用元素周期表中元素的信息、化学式的书写、常见物质的粒子构成等进行分析解题的能力.1年前查看全部
- 下列说法中正确的是( )A.CO2、NH3、CCl4、N2中,所有原子都满足最外层8电子的稳定结构B.在元素周期表中金
下列说法中正确的是( )
A.CO2、NH3、CCl4、N2中,所有原子都满足最外层8电子的稳定结构
B.在元素周期表中金属和非金属交界处可以找到半导体材料
C.共价化合物可能含离子键
D.第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键 元江镍业1年前1
元江镍业1年前1 -
 永失我心1 共回答了11个问题
永失我心1 共回答了11个问题 |采纳率81.8%解题思路:A.氢原子最多满足最为最外层两电子结构;
B.在金属元素与非金属元素的分界线附近的元素,通常既具有金属性又具有非金属性,可以找到半导体材料;
C.含离子键的化合物一定是离子化合物,共价化合物中一定不存在离子键;
D.氢和第ⅦA族元素的原子之间形成共价键.A.氢原子最多满足最为最外层两电子结构,故氨气中氢原子没达到8电子稳定结构,故A错误;
B.在金属元素和非金属元素交接区域的元素通常既具有金属性又具有非金属性,可以用来做良好的半导体材料,如硅等,故B正确;
C.含离子键的化合物一定是离子化合物,共价化合物中一定不存在离子键,故C错误;
D.第ⅠA族氢元素和第ⅦA族元素的原子之间形成共价键,故D错误;
故选B.点评:
本题考点: 质子数、中子数、核外电子数及其相互联系;元素周期表的结构及其应用;离子化合物的结构特征与性质;共价键的形成及共价键的主要类型.
考点点评: 本题考查了原子结构、元素周期表应用及化学键类型判断,中等难度.注意氢元素原子结构的特殊性及氢元素在周期表的位置.1年前查看全部
- 我国科学家在世界上首次合成铪元素的一种原子.已知铪元素在元素周期表中的原子序数是72,相对原子质量为185.下列说法错误
我国科学家在世界上首次合成铪元素的一种原子.已知铪元素在元素周期表中的原子序数是72,相对原子质量为185.下列说法错误的是( ) A.该元素的原子有72个质子 B.该元素是金属元素 C.该元素的原子有113个电子 D.该元素原子的中子数为113  落228片叶子1年前1
落228片叶子1年前1 -
 悠_着 共回答了12个问题
悠_着 共回答了12个问题 |采纳率91.7%在原子中质子数=核电荷数=核外电子数=原子序数,已知铪元素在元素周期表中的原子序数是72,故其质子数=核外电子数=原子序数=72,所以A正确,C错误;
铪元素的汉语名称的偏旁为金字旁,应为金属元素,所以B正确.
根据相对原子质量≈质子数+中子数,铪元素原子的相对原子质量为185,其中子数为185-72=113,所以D正确.
故选C.1年前查看全部
- 元素周期表中【与水反应剧烈程度】如何判断?
元素周期表中【与水反应剧烈程度】如何判断?
最好能有相关例子. 思梦的滋味1年前1
思梦的滋味1年前1 -
 mingming521006 共回答了15个问题
mingming521006 共回答了15个问题 |采纳率93.3%原子序数越靠前反应就越剧烈
比如吧,Na投入水中剧烈反应
Mg投入水中需要加热才反应~1年前查看全部
- 元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,表中所列字母A、B、D、F、G、H、Q、M、R、N、
元素周期表是学习物质结构和性质的重要工具,如图是元素周期表的一部分,表中所列字母A、B、D、F、G、H、Q、M、R、N、T、U分别代表某种化学元素.请依据这12种元素回答下列问题.
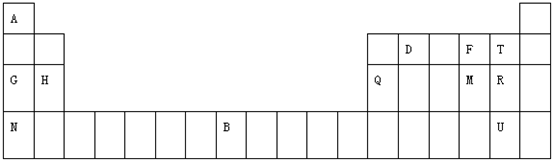
(1)非金属性最强的元素是______,金属性最强的元素是______;(均填元素符号)
(2)元素的非金属性:M______R(填“>”或“<”),用化学方程式证明这一事实:______; (3)表格中12种元素的最高价氧化物对应的水化物中,碱性最强的是______(用化合物的化学式表示,下同),酸性最强的是______,属于两性氢氧化物的是______;
(4)用电子式表示HR2的形成过程:______;
(5)将R单质通入U与N组成的化合物中,发生反应的离子方程式是______,说明单质的氧化性R单质比U单质______(填“强”或“弱”);
(6)B的三价强酸盐溶液可以用于腐蚀电路板,则离子方程式为2B3++Cu=2B2++Cu2+,根据该反应选择适宜的材料和试剂设计一个原电池.①画出装置图,在图中指明材料及电解质溶液:
②写出电极反应式:正极:______;负极:______.
 呵呵呵呸呸呸1年前1
呵呵呵呸呸呸1年前1 -
 银叶玫瑰 共回答了14个问题
银叶玫瑰 共回答了14个问题 |采纳率85.7%解题思路:根据元素在周期表中的位置知,A、B、D、F、G、H、Q、M、R、N、T、U分别是H、Fe、C、O、Na、Mg、Al、S、Cl、K、F、Br元素,
(1)非金属性最强的元素在周期表的右上角,金属性最强的元素在周期表的左下角;
(2)同一周期元素,元素的非金属性随着原子序数的增大而增强,氯气能氧化硫化氢生成硫单质;
(3)表格中12种元素的最高价氧化物对应的水化物中,金属的金属性越强,则其相应碱的碱性越强;
非金属的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F除外;属于两性氢氧化物的是氢氧化铝;
(4)HR2是氯化镁,氯原子和镁原子通过得失电子形成离子键;
(5)R单质是氯气,U和N组成的化合物是溴化钾,二者发生置换反应;
氧化剂的氧化性大于氧化产物的氧化性;
(6)三价铁离子具有氧化性,能和铜发生氧化还原反应,离子方程式为2Fe3++Cu=2Fe2++Cu2+,根据元素化合价知,铜失电子作负极、不如铜活泼的金属或导电的非金属作正极,可溶性的铁盐溶液作电解质溶液;
②负极上铜失电子发生氧化反应、正极上铁离子发生还原反应.根据元素在周期表中的位置知,A、B、D、F、G、H、Q、M、R、N、T、U分别是H、Fe、C、O、Na、Mg、Al、S、Cl、K、F、Br元素,
(1)非金属性最强的元素在周期表的右上角,金属性最强的元素在周期表的左下角,所以非金属性最强的元素是F、金属性最强的元素是K,故答案为:F;K;
(2)同一周期元素,元素的非金属性随着原子序数的增大而增强,所以非金属性S<Cl,氯气能氧化硫化氢生成硫单质,反应方程式为Cl2+H2S=S+2HCl,
故答案为:<;Cl2+H2S=S+2HCl;
(3)表格中12种元素的最高价氧化物对应的水化物中,金属的金属性越强,则其相应碱的碱性越强,这几种元素中金属性最强的是K,则KOH的碱性最强;
非金属的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F除外,所以元素最高价氧化物的水化物酸性最强的是HClO4;属于两性氢氧化物的是Al(OH)3;
故答案为:KOH;HClO4;Al(OH)3;
(4)HR2是氯化镁,氯原子和镁原子通过得失电子形成离子键,其形成过程为 ,
,
故答案为: ;
;
(5)R单质是氯气,U和N组成的化合物是溴化钾,二者发生置换反应,离子方程式为Cl2+2Br-═Br2+2Cl-;氧化剂的氧化性大于氧化产物的氧化性,所以R单质的氧化性比U单质的强,故答案为:Cl2+2Br-═Br2+2Cl-;强;
(6)①三价铁离子具有氧化性,能和铜发生氧化还原反应,离子方程式为2Fe3++Cu=2Fe2++Cu2+,根据元素化合价知,铜失电子作负极、不如铜活泼的金属或导电的非金属作正极,如石墨,氯化铁溶液作电解质溶液,其图象为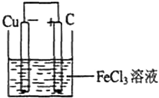 ,故答案为:
,故答案为: ;
;
②正极上铁离子发生还原反应,电极反应式为2Fe3++2e-═2Fe2+;负极上铜失电子发生氧化反应,电极反应式为Cu-2e-═Cu2+,
故答案为:2Fe3++2e-═2Fe2+;Cu-2e-═Cu2+.点评:
本题考点: 元素周期律和元素周期表的综合应用;设计原电池.
考点点评: 本题考查了元素周期表和元素周期律的综合应用,涉及原电池设计、元素周期律、氧化还原反应等知识点,根据元素周期表中的位置确定元素,再根据物质的性质及物质之间的反应来分析解答,题目难度中等.1年前查看全部
- 下列说法正确的是 A.Li是最活泼金属,F是最活泼非金属 B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族
下列说法正确的是
A.Li是最活泼金属,F是最活泼非金属 B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 C.X 2+ 的核外电子数目为18,则X在第四周期第ⅡA族 D.Mg(OH) 2 碱性比Ca(OH) 2 强  曹小月1年前1
曹小月1年前1 -
 wallimn 共回答了23个问题
wallimn 共回答了23个问题 |采纳率91.3%C
1年前查看全部
- 元素周期表是学习化学的重要工具。下图是元素周期表中的一格,从中获取的信息中不正确的是 [
元素周期表是学习化学的重要工具。下图是元素周期表中的一格,从中获取的信息中不正确的是 
[ ]
A. 该元素的原子序数为18
B. 该元素的原子核外有18个电子
C. 该元素属于金属元素
D. 该元素的相对原子质量为39.95 Hacker881年前1
Hacker881年前1 -
 枕着忧伤入睡 共回答了20个问题
枕着忧伤入睡 共回答了20个问题 |采纳率95%C1年前查看全部
- 下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
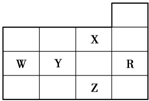
A.其气态氢化物的稳定性是X>Y>W>Z
B.其最高价氧化物对应的水化物的酸性:Y>W
C.电负性、第一电离能的大小顺序都是X>Y>W
D.Y、Z的阴离子电子层结构都与R原子的相同 希望崖1年前1
希望崖1年前1 -
 普通话下 共回答了19个问题
普通话下 共回答了19个问题 |采纳率100%解题思路:由元素在周期表中位置可知,X为氟、W为磷、Y为硫、R为Ar,Z为Br.
A.非金属性越强,氢化物越稳定;
B.非金属性越强,最高价含氧酸的酸性越强;
C.同周期自左而右电负性增强,同主族自上而下电负性减弱,P元素原子3p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
D.S2-离子核外电子数为18,核外有3个电子层,而Br-离子有4个电子层.由元素在周期表中位置可知,X为氟、W为磷、Y为硫、R为Ar,Z为Br.
A.非金属F>Br>S>P,故氢化物越稳定:HF>HBr>H2S>PH3,故A错误;
B.同周期自左而右非金属性增强,最高价氧化物大于水化物的酸性增强,故B正确;
C.同周期自左而右电负性增强,同主族自上而下电负性减弱,故电负性X>Y>W,P元素原子3p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S,故C错误;
D.S2-离子核外电子数为18,与Ar原子电子层结构相同,而Br-离子有4个电子层,与Ar原子电子层结构不相同,故D错误,
故选B.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表与元素周期律应用,难度不大,注意理解同周期元素第一电离能发生突变原因.1年前查看全部
- 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
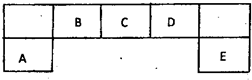 短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
短周期元素A、B、C、D、E在元素周期表中的位置如下图所示,其中B元素形成的化合物在自然界中的种类最多.请回答下列问题
(1)描述D在元素周期表中的位置:______
(2)比较A、C、D元素简单离子半径的大小:______>______>______(填微粒符号)
(3)F与D同主族且相邻,请说出D的氢化物比F的氢化物稳定的根本原因:______
(4)C的氢化物与其最高价氧化物对应的水化物反应,产物溶于水呈______性,用离子方程式解释原因______.
(5)D原子与氢原子可形成10电子阳离子,写出该阳离子的电子式______
(6)E的最高价氧化物的水化物的化学式为______.E的氢化物与其最高价氧化物的水化物的钾盐共热能发生反应,生成一种气体单质,该反应的化学反应方程式为8HCl+KClO4
KCl+4Cl2↑+4H2O△ .8HCl+KClO4.
KCl+4Cl2↑+4H2O△ . 老妖刀1年前1
老妖刀1年前1 -
 chenlei519 共回答了22个问题
chenlei519 共回答了22个问题 |采纳率95.5%解题思路:短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,然后利用元素及其单质、化合物的性质来解答.短周期元素A、B、C、D、E,B元素形成的化合物在自然界中的种类最多,则B为C元素,由元素在周期表中的位置依次推出C为N,D为O,A为Al,E为Cl,
(1)O元素在周期表中第二周期第ⅥA族,故答案为:第二周期第ⅥA族;
(2)A、C、D元素简单离子具有相同的电子排布,则原子序数大的离子半径小,所以离子半径为N3->O2->Al3+,故答案为:N3-;O2-;Al3+;
(3)F与D同主族且相邻,则F为S,因非金属性O>S,则O的氢化物比S的氢化物稳定,故答案为:N的非金属性比S强;
(4)C的氢化物为氨气,与其最高价氧化物对应的水化物硝酸,二者反应生成硝酸铵,因铵根离子水解使溶液显酸性,水解离子反应为NH4++H2O⇌NH3.H2O+H+,
故答案为:酸;NH4++H2O⇌NH3.H2O+H+;
(5)D原子与氢原子可形成10电子阳离子为H3O+,其电子式为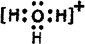 ,故答案为:
,故答案为: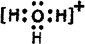 ;
;
(6)E的最高价为+7价,则最高价氧化物的水化物的化学式为HClO4,E的氢化物为HCl,其最高价氧化物的水化物的钾盐为KClO4,二者共热能发生反应生成一种气体单质为Cl2,由质量守恒定律可知还生成KCl和水,
化学反应为8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O,故答案为:HClO4;8HCl+KClO4
△
.
KCl+4Cl2↑+4H2O.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查元素周期表和元素周期律,元素的推断是解答的关键,并熟悉非金属的比较、半径的比较、水解、电子式、化学反应等知识点来解答,难度不大.1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是依据元素周期表画出的1-18号元素的原子结构示意图.请结合
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是依据元素周期表画出的1-18号元素的原子结构示意图.请结合所学知识回答下列问题:
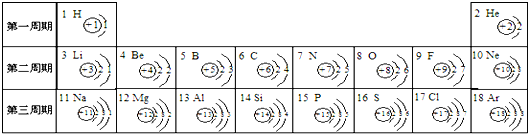
(1)原子序数为12的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为16的元素属于______元素(填“金属”或“非金属”).
(2)______元素与氯元素化学性质相似,该元素与钠元素形成的化合物的化学式为______.
(3)我发现如下规律:①原子序数与元素原子核电荷数在数值上相等;
②______;
③______. 深蓝沫沫1年前1
深蓝沫沫1年前1 -
 后来又 共回答了14个问题
后来又 共回答了14个问题 |采纳率92.9%解题思路:(1)原子序数为17的元素为Cl,写出名称即可;根据原子结构示意图的特点:金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;进行解答;
(2)最外层电子数相同的化学性质相似,氯元素与氟元素的最外层电子数相同,故氯元素与氟元素的化学性质相似,根据化合价代数和为零的原则书写化学式;
(3)根据元素周期律及图表中的信息进行分析解答.(1)原子序数为12的名称为镁; 根据原子结构示意图的特点:金属元素的最外层电子数一般少于4;易失去电子;原子序数为16的元素为氧元素,属于非金属元素;
(2)氯元素与氟元素的最外层电子数相同,故氯元素与氟元素的化学性质相似;根据在化合物中化合价代数和为零的原则,氟的化合价为--1价,钠的化合价为+1价,故形成的化合物的化学式为NaF;
(3)根据元素周期律及图表中的信息可总结:
电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;
答案:(1)镁;失; 非金属;(2)F,NaF;
(3)②电子层数与元素所在周期数相等;
③同一周期最外层电子数依次增加.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.1年前查看全部
- (2012•南安市质检)元素周期表是学习和研究化学的重要工具,它的内容十分丰富.某同学从该表获取的信息中,你认为不正确的
(2012•南安市质检)元素周期表是学习和研究化学的重要工具,它的内容十分丰富.某同学从该表获取的信息中,你认为不正确的是( )
A.元素的原子序数
B.元素名称和元素符号
C.元素在自然界的分布
D.元素的相对原子质量 qblj1年前1
qblj1年前1 -
 寒星VS宇宙浪子 共回答了16个问题
寒星VS宇宙浪子 共回答了16个问题 |采纳率100%解题思路:根据元素周期表可以获取的信息有原子序数、元素名称、元素符号、相对原子质量及元素性质的变化规律等,进行解答.A、由元素周期表可以查出元素的原子序数,故A不符合题意;
B、由元素周期表可以查出元素名称和元素符号,故B不符合题意;
C、元素在自然界的分布在元素周期表中是不可以查出的,故C符合题意;
D、由元素周期表可以查出元素的相对原子质量,故D不符合题意.
故选C.点评:
本题考点: 元素周期表的特点及其应用.
考点点评: 本题考查学生对元素周期表知识的理解与掌握,并能在解题中灵活应用的能力.1年前查看全部
- 铋是放射性元素吗?人教版新课标 物理3-5上说:“原子序数大于或等于83的都是放射性元素",可我在化学书元素周期表上明明
铋是放射性元素吗?
人教版新课标 物理3-5上说:“原子序数大于或等于83的都是放射性元素",可我在化学书元素周期表上明明看到铋不是放射性元素,
一问老师,它说:"铋虽然不是,但它的同位素是的"
不,我说错了!应该是:“原子序数大于或等于83的都是天然放射性元素,”
铋是天然放射性吗? aabbcc3691年前1
aabbcc3691年前1 -
 半点心-001 共回答了17个问题
半点心-001 共回答了17个问题 |采纳率94.1%对的,有很多放射性元素的同位素没有放射性;也有很多元素的同位素具有放射性;
所以,某元素有没有放射性是一个笼统的概念,通常指的是这个元素自然状态下的特性.
简单的例子,钾K-39是稳定的,但是其同位素K-40具有β放射性,半衰期1.277×10^9年;还有很多这样的例子.
因此上述两种说法都是正确的哦.
希望能帮到你1年前查看全部
- 已知元素周期表中第三周期各元素原子结构示意图如下,请回答:
已知元素周期表中第三周期各元素原子结构示意图如下,请回答:
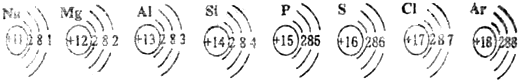
(1)元素的化学性质与原子结构中的______数关系密切;
(2)从原子结构方面看:同一周期的元素具有相同的______数;
(3)在此周期中,各元素的原子结构呈现的变化规律是:______依次递增. 珉勋1年前1
珉勋1年前1 -
 365807608 共回答了14个问题
365807608 共回答了14个问题 |采纳率100%解题思路:(1)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,进行解答;
(2)根据元素周期律和第三周期各元素原子结构示意图进行解答;
(3)根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,进行解答.(1)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,故答案为:最外层电子;
(2)根据元素周期律和第三周期各元素原子结构示意图可知:同一周期的元素具有相同的 电子层数;故答案为:电子层;
(3)根据元素周期律,同一周期中,随质子数或原子序数的递增(或从左到右)各原子的(最外层)电子数依次增多,
故答案为:从左到右各原子的质子数.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题主要考查学生对元素周期律知识的理解与掌握,并能在解题中灵活应用.1年前查看全部
- 元素周期表是学习和研究化学的重要工具.请根据下表(元素周期表的部分内容)回答有关问题:
元素周期表是学习和研究化学的重要工具.请根据下表(元素周期表的部分内容)回答有关问题:
(1)请从上表中查出关于硼元素的一条信息:______.
(2)第3周期(横行)中属于金属元素的是______(填一种),其离子符号是______.
(3)第11号元素与第17号元素组成的化合物的化学式是______,构成该物质的微粒是______(选填“分子”、“原子”或“离子”).
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质.则下列各组元素具有相似化学性质的是______(填标号).
a.C和Neb.Be和Mgc.Al和Sid.F和Cl. 伟祥1年前1
伟祥1年前1 -
 草原斑马 共回答了16个问题
草原斑马 共回答了16个问题 |采纳率87.5%解题思路:(1)根据元素周期表中每一小方格中的信息分析;
(2)通过金属元素一般都带“金”字旁解决此题;
(3)根据元素周期表结合化学式的写法以及构成物质的微粒分析;
(4)根据同一纵行化学性质相似分析;(1)元素周期表中每一小方格中左上角数字表示原子序数即核电荷数,符号表示元素符号,下方数字表示相对原子质量,因此关于硼元素的一条信息为硼的元素符号为B;故答案为:硼的元素符号为B;(2)根据化学元素汉字名...
点评:
本题考点: 元素周期表的特点及其应用;化学式的书写及意义.
考点点评: 本题考查学生根据元素周期表中所给信息应用到实际中解题的能力和有关化学用语的书写,难度较小.1年前查看全部
- 下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:(1)画出A的原子结构示意
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:(1)画出A的原子结构示意
下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题: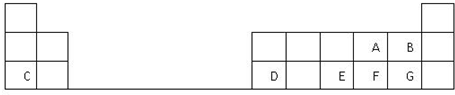
(1)画出A的原子结构示意图______.
(2)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是______(填化学式).
(3)D在元素周期表中的位置是第3周期第______族.
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是______(填化学式).
(5)写出C和F形成的化合物的电子式______.
(6)A、C、D 的离子半径大小关系是______ (用离子符号表示)
 星宇20071年前1
星宇20071年前1 -
 xiepei 共回答了17个问题
xiepei 共回答了17个问题 |采纳率88.2%根据元素在周期表中的分布知识,可以知道A是O,B是F,C是Na,D是Al,E是P,F是S,G是Cl.
(1)根据原子结构示意图的画法,氧原子结构示意图为: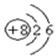 ,故答案为:
,故答案为: ;
;
(2)同主族元素的原子从上到下,氢化物的稳定性逐渐减弱;同周期元素的原子从左到右,氢化物的稳定性逐渐增强,所以O、F、P、S、Cl五种元素所形成的气态氢化物最不稳定的是
PH3,故答案为:PH3;
(3)根据元素周期表中周期和族的划分可以确定Al元素在周期表中的第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(4)P、S是周期表中同一周期元素,从左到右元素最高价氧化物对应水化物的酸的酸性逐渐增强,所以酸性:H2SO4>H3PO4,故答案为:H2SO4;
(5)C和F形成的化合物是硫化钠,硫化钠是钠离子和硫离子之间通过离子键形成的离子化合物.电子式为: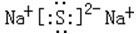 ,故答案为:
,故答案为: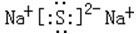 ;
;
(6)微粒电子层越多半径越大,S2->O2-、Na+,核外电子排布一样,核电荷数越多半径越小,即O2->Na+,故答案为:S2->O2->Na+.1年前查看全部
- 氧位于元素周期表中的第 ( )周期 第( )族
 绝对不重名1年前2
绝对不重名1年前2 -
 梦飞云舞 共回答了23个问题
梦飞云舞 共回答了23个问题 |采纳率82.6%第二周期 第 VIA 族
一定要用符号,不能写“第六主族”1年前查看全部
- 下列关于元素周期表的说法正确的是
下列关于元素周期表的说法正确的是
A.在元素周期表中,每一列就是一个族
B.主族元素都是短周期元素
C.副族元素都是金属元素
D.元素周期表每个长周期包含32种元素 禁锢之躯1年前1
禁锢之躯1年前1 -
 jinnait 共回答了21个问题
jinnait 共回答了21个问题 |采纳率85.7%答案C
A不正确,其中8、9、10三列都是第Ⅷ.B不正确,例如钾钙等.周期表中自上而下,每一周期含有的元素种类分别是2、8、8、18、18、32、32(未排满),所以正确的答案是C.1年前查看全部
- 如表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
如表为元素周期表中某一周期元素的原子结构示意图.请回答下列问题:
(1)表中磷原子的核电荷数X=______;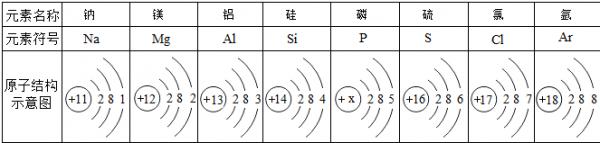
(2)表中具有相对稳定结构的元素是______;
(3)在化学反应中,每个铝原子失去______个电子形成铝离子;
(4)表中元素在周期表中处于第______周期,它们属于同一周期的原因是______. re431年前1
re431年前1 -
 haytngabcabc 共回答了21个问题
haytngabcabc 共回答了21个问题 |采纳率100%(1)在原子中,原子序数=核电荷数=质子数=核外电子数,表中磷原子的核电荷数X=2+8+5=15
(2)表中具有相对稳定结构的元素是最外层电子数为8的原子,即氩.
(3)由表可知,铝原子最外层电子数为3,易失去电子;故在化学反应中,每个铝原子失去3个电子形成铝离子;
(4)表中元素都有三个电子层,故在周期表中处于第三周期,它们属于同一周期的原因是电子层数相同.
故答案为:(1)15;(2)氩;(3)3;(4)三;电子层数相同.1年前查看全部
- 元素周期表的分布有什么特点?从同一组,同一周期来分析.元素之间有什么内在联系
 大盘预测1年前3
大盘预测1年前3 -
 苏延年 共回答了13个问题
苏延年 共回答了13个问题 |采纳率76.9%首先你要理解 核电荷数=质子数=和外电子书=原子序数
元素周期表中的排列依据就是按照原子的核电荷数,按这顺序编号就是原子序数.
好,明白这个,周期分为三种:长周期,短周期和不完全周期.
同一组最外层电子数相同,同一周期的电子层数相同,从左到右原子序数递增,周期的序数就是该元素的电子层数.(同楼上的仁兄,只是这是书上的原话)
族分为:主族,副族,第八族和0族.
非金属元素与该周期的关系:8-周期数1年前查看全部
- 关于化学中的几个元素化学书中的元素周期表中原子序数110至114中的元素符号分别为Uun,Uuu,Uub,Uuq没有中文
关于化学中的几个元素
化学书中的元素周期表中原子序数110至114中的元素符号分别为Uun,Uuu,Uub,Uuq没有中文名称,那怎么读这四个东西,还有介绍一下这四个的化学性质 等待是最初的苍老1年前5
等待是最初的苍老1年前5 -
 abandonment 共回答了17个问题
abandonment 共回答了17个问题 |采纳率94.1%没有标注是因为还没有中文权威机构对此作出命名,故不能采取统一的中文读音,可根据英文发音,性质吗,因为这些元素都有超强的放射性很不稳定,人们观察到的时间很有限,所以不能确定其明确的性质1年前查看全部
- 关于化学元素周期表的问题高中化学课本的元素周期表中,元素名称和相对原子质量之间那行数字和字母表示什么,象f d s p和
关于化学元素周期表的问题
高中化学课本的元素周期表中,元素名称和相对原子质量之间那行数字和字母表示什么,象f d s p和前面的系数以及右上角的数字各是什么含义? 张辰雨1年前1
张辰雨1年前1 -
 vertuqd 共回答了17个问题
vertuqd 共回答了17个问题 |采纳率88.2%你是刚上高中的学生吗?那么你的知识层面还没达到,这是高中竞赛以及大学的内容.
我们都知道原子由原子核及核外电子组成,而核外电子依据其能量和运动情况可以分为若干个电子层,即K,L,M,N...等等,越往后的离核越远,一个电子层最多可容纳电子数为2乘以n的平方个(n=K时取1,L时取2,依次类推).
这只是一种粗略的分层方法,实际上,每一电子层内部还有能量及运动状态的区别,以此每一电子层内部还可细分为诸如s,p,d,f...为名称的电子亚层,你看到的即是某一元素原子最外层电子层的亚层的分布状况,系数表明这是第几电子层的亚层,角标表明该亚层里容纳了几个电子.每一电子亚层里最多可容纳电子数为2*(2n-1)个(n取s时为1,依次类推,但还要考虑一个电子层内最多会有几个亚层,根据上一段就能知道).
在高等化学中,对这些概念都有特殊规定,电子所在电子层称为主量子数,所在亚层称为角量子数,所在轨道称为磁量子数,自旋方向称为自旋量子数.是描述核外电子运动的四大重要特征,将其代入著名的薛定谔方程可以求得电子核外的运动波形.至于磁量子数和自旋量子数,在这里不赘述了.
如果你有兴趣,可以翻阅高中化学读本或高等教育出版社的无机化学,当然,也可以去参加化学竞赛小组,限于篇幅,我只说这么多了.希望对你有所帮助.1年前查看全部
- 很多科学家对元素周期表的发现和完善做出了很大贡献,请你写出一位科学家的名字!
 pyhar1年前2
pyhar1年前2 -
 color81 共回答了21个问题
color81 共回答了21个问题 |采纳率90.5%门捷列夫 1869年,门捷列夫发现了元素周期律和元素周期表,在元素周期律的指导下,利用元素之间的一些规律性知识来分类学习物质的性质,就使化学学习和研究变得有规律可循.现在,化学家们已经能利用各种先进的仪器和分析技术对化学世界进行微观的探索,并正在探索利用纳米技术制造出具有特定功能的产品,是化学在材料、能源、环境和生命科学等研究上发挥越来越重要的作用
现代化学的元素周期律是1869年俄国科学家德米特里·伊万诺维奇·门捷列夫(Dmitri Ivanovich Mendeleev )首先整理,他将当时已知的63种元素依原子量大小并以表的形式排列,把有相似化学性质的元素放在同一行,就是元素周期表的雏形.利用周期表,门捷列夫成功的预测当时尚未发现的元素的特性(镓、钪、锗).1913年英国科学家莫色勒利用阴极射线撞击金属产生X射线,发现原子序越大,X射线的频率就越高,因此他认为核的正电荷决定了元素的化学性质,并把元素依照核内正电荷(即质子数或原子序)排列,经过多年修订后才成为当代的周期表.1年前查看全部
- (2009•南昌二模)A、B、C、D、E是元素周期表中前20号元素,已知:B元素原子K和L层电子数与其它电子层电子数之和
(2009•南昌二模)A、B、C、D、E是元素周期表中前20号元素,已知:B元素原子K和L层电子数与其它电子层电子数之和相等;A是形成化合物种类最多的元素;C、D、E同周期,它们最高价氧化物对应水化物两两混合均能反应生成盐和水;E的正负化合价代数和为最大.
(1)B原子结构示意图:______;E离子的电子式______;
(2)B与E的离子半径:rB______rE(填“>”,“<”,“=”);
(3)写出D单质与C的最高价氧化物对应水化物溶液反应的离子方程式:______
(4)C与D最高价氧化物的熔沸点______高于______(填“C”或“D”)
(5)B能与A形成B2A3离子化合物,它遇水能发生强烈反应,写出B2A3与水反应的化学方程式:______. dear_baoba1年前0
dear_baoba1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 元素周期表中的铁、钴、镍三个纵行的,每一个纵行都是一族吗?
 樱花雪飘飘1年前1
樱花雪飘飘1年前1 -
 价值观 共回答了22个问题
价值观 共回答了22个问题 |采纳率81.8%与铁、钴、镍一纵行的元素,它们最外层的电子数相同吗?说说它们每一纵行元素的最外层电子数1年前查看全部
- 用化学用语填空:(1)空气中含量最多的物质(2)锶的原子结构示意图如图所示,其元素符号为 Sr.你认为它与我们元素周期表
用化学用语填空:
(1)空气中含量最多的物质
(2)锶的原子结构示意图如图所示,其元素符号为 Sr.你认为它与我们元素周期表中 11-18号元素中______(写元素符号)的化学性质可能相似;氢氧化锶也能与稀盐酸反应,其反应的方程式为______.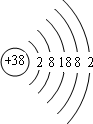
 sukersun19851年前1
sukersun19851年前1 -
 3331456 共回答了12个问题
3331456 共回答了12个问题 |采纳率100%(1)氮气是空气中含量最多的物质,化学式是N 2 .故填:N 2 .
(2)由锶的原子结构示意图可知,锶的最外层电子数是2,和镁原子的最外层电子数相同,具有相似的化学性质.故填:Mg.
氢氧化锶能与稀盐酸反应生成氯化锶和水,反应的化学方程式为:Sr(OH) 2 +2HCl═SrCl 2 +2H 2 O.1年前查看全部
- 已知溴(Br)是元素周期表中第四周期ⅦA族元素,关于溴的性质判断肯定不正确的是( ) A.溴的非金属性比氯强 B.溴的
已知溴(Br)是元素周期表中第四周期ⅦA族元素,关于溴的性质判断肯定不正确的是( ) A.溴的非金属性比氯强 B.溴的含氢化合物以HBr形式存在 C.溴的氢化物的稳定性比氯化氢差 D.溴的最高价氧化物对应水化物的化学式是HBrO 4  ynzybaxz1年前1
ynzybaxz1年前1 -
 zangjuan 共回答了23个问题
zangjuan 共回答了23个问题 |采纳率91.3%A、同主族元素从上到下,元素的非金属性逐渐减弱,所以溴的非金属性比氯弱,故A错误;
B、溴的含氢化合物有多种,可以是含氧酸,也可以是溴化氢,以HBr形式存在,故B正确;
C、元素的非金属性越强,对应的氢化物的稳定性就越强,因非金属性Cl>Br,则溴的氢化物的稳定性比氯化氢差,故C正确;
D、溴的最外层电子数为7,最高价为+7价,所对应的最高价氧化物对应水化物的化学式是HBrO 4 ,故D正确.
故选A.1年前查看全部
- 如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
如图是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素E的基态原子电子排布式______;
(2)F、G两元素的部分电离能数据列于下表:
比较两元素的I2、I3,气态F2+、G2+中,______(元素符号表示)更难失去电子变为+3价气态离子;请用原子结构理论解释原因______.元素 F G 电离能
kJ•mol-1I1 717 759 I2 1509 1561 I3 3248 2957
(3)在标准状况下,根据M=
测定B的气态氢化物的相对分子质量,结果发现,测定结果总比理论值偏高,其原因是______.m n
(4)C、D的单质中,______(用元素符号表示)熔点更高、硬度更大. syj1122331年前1
syj1122331年前1 -
 飞舞的猪 共回答了19个问题
飞舞的猪 共回答了19个问题 |采纳率100%解题思路:根据元素周期表来解题,根据在元素周期表中的位置,可以确定元素的种类,并可以写出元素的原子电子排布式,在书写副族元素的电子排布式时,对d电子层半充满和全充满的情况会有所调整,形成离子时,半充满结构较稳定;氟元素形成的氢化物氟化氢很稳定,是因为形成了分子氢键,分子氢键使分子的聚合度增大,质量与物质的量的比值会增大;常见元素镁和铝的物理性质中铝元素的熔点较高、硬度较大.(1)元素E为铬元素,位于第四周期,第ⅥB族,价电子有6个,其中5个填充在d电子层上,形成半充满结构,半充满结构比较稳定,
其基态原子电子排布式为1s22s22p63s23p63d54s1,故答案为:1s22s22p63s23p63d54s1;
(2)F、G两元素失去三个电子形成+3价离子,比较两者的第三电离能,可以看出锰较铁元素的数值大,说明锰失去第三个电子比较困难,Mn2+更难失去电子变为+3价气态离子,锰元素的原子电子排布式为1s22s22p63s23p63d54s2,Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;而铁的原子电子排布式为1s22s22p63s23p63d64s2,Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子,
故答案为:Mn2+;Mn2+的外围电子排布为3d5,是半满状态较稳定,再失电子较难;Fe2+为3d6,失去一个电子后为半充满状态,因而相对易失去一个电子;
(3)B元素为氟元素,形成的氢化物为氟化氢,因HF分子间会形成氢键,使分子发生聚合,使得质量与物质的量的比值增大,故答案为:因HF分子间会形成氢键;
(4)C为镁元素,D为铝元素,Al原子的半径小,电荷多,金属键强,则Al的熔点更高、硬度更大,故答案为:Al.点评:
本题考点: 元素周期律和元素周期表的综合应用;原子核外电子排布;元素电离能、电负性的含义及应用.
考点点评: 本题考查了元素周期表中元素的位置,知道元素的位置反过来推测元素的种类和元素的核外电子排布,核外电子排布对副族元素来说要考虑d电子的半充满结构,形成离子时形成半充满结构较稳定,氟元素的化学性质和镁铝元素的物理性质.1年前查看全部
- 下图是两种元素在元素周期表中的信息和4种粒子的结构示意图。请回答下问题: (1)C、D、E、F中,属于同种元素的是___
下图是两种元素在元素周期表中的信息和4种粒子的结构示意图。请回答下问题: 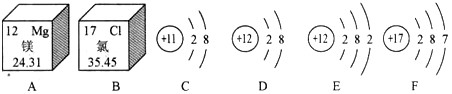
(1)C、D、E、F中,属于同种元素的是________(填字母序号,下同),最容易得到电子的是_______。
(2)A和B形成的化合物的化学式是_________。
(3)写出一条从图A中获得的信息_____________。 apai731年前1
apai731年前1 -
 赤血盐 共回答了24个问题
赤血盐 共回答了24个问题 |采纳率91.7%(1)D、E;F
(2)MgCl 2
(3)镁原子序数为12(合理答案均可)1年前查看全部
- (2009•兖州市模拟)下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
(2009•兖州市模拟)下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
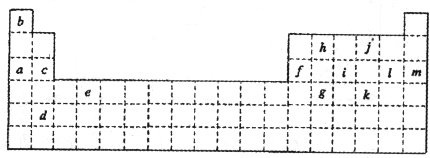
(1)写出g元素在周期表中的位置:______.
(2)下列______(填写编号)组元素的单质可能都是电的良导体.
①a、c、h②b、g、k③c、h、l④d、e、f
(3)现有下列短周期元素性质的数据:
试回答下列问题:元素编号
元素性质① ② ③ ④ ⑤ ⑥ ⑦ 原子半径(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 最高增化合价 +2 +1 +5 +7 +1 +5 最低化合价 -2 -3 -1 -3
I.上述元素中①、②、⑥分别为______,上述元素中处于第二周期的有______(以上均用元素符号表示).
II.元素④与元素⑦相比较,气态氢化物较稳定的是______(填化学式).
III.工业上获取⑤单质的主要化学反应方程式为:2NaCl+2H2O
2NaCl+Cl2↑+H2↑通电 .2NaCl+2H2O.
2NaCl+Cl2↑+H2↑通电 .
IV.⑤和⑥形成的化合物中化学键是______.
V.⑦的最高价氧化物的水化物和其氢化物反应生成的盐溶液显酸性的原因是什么?(用必要的离子方程式说明). 唏嘘哦1年前1
唏嘘哦1年前1 -
 QQ28440 共回答了19个问题
QQ28440 共回答了19个问题 |采纳率78.9%解题思路:(1)根据元素周期表中元素的分布知识来回答;
(2)根据元素周期表中元素周期和族的分布知识来回答;
(3)Ⅰ、元素的最高正价=最外层电子数,最高正价+|最低负价|=8,结合原子半径的递变规律来确定元素,并确定所在的周期;
Ⅱ、同周期元素原子,从左到右氢化物的稳定性逐渐增强,同主族从下到上氢化物的稳定性逐渐增强;
Ⅲ、电解饱和食盐水获得氢氧化钠、氯气以及氢气;
Ⅳ、根据形成化合物的成键元素来确定化学键类型:活泼金属和活泼非金属间形成的化学键大多为离子键;
Ⅴ、硝酸铵中的铵根离子水解,导致溶液显酸性.(1)在周期表中,g位于第四行,第14列,所以是第四周期,第ⅣA族的元素,故答案为:第四周期,第ⅣA族;
(2)根据元素在周期表中的分布,可知a是Na,c是Mg,f是Al,h是C,e是Ti,d是Sr,这些均能导电,故答案为:①④;
(3)+1价的③、⑥,一定是碱金属Li和Na,而原子半径⑥>③,故③应为IA族第二周期的Li,⑥为三周期的Na元素;④和⑦最高正价均为+5,负价一致,故为VA族元素,因原子半径④>⑦,故④为第三周期第VA族的P元素,⑦为N元素;从化合价可推出⑤属于卤素,由于短周期F元素无正价,故⑤为氯元素,位于第VIIA族第三周期;⑧最高正价+3价,无负价,只能是IIIA族元素,而原子半径⑧>④,故⑧只能是位于第三周期第IIIA族的Al元素;①的最低负价为-2价,无正价,则①应为第二周期的O元素,②最高正价+2价,无负价,只能是ⅡA族元素,且原子半径⑧<②<⑥,为第三周期的Mg元素.
Ⅰ、上述元素中①、②、⑥分别为O、Mg、Na,处于第二周期的有Li、N、O,故答案为:O、Mg、Na;Li、N、O;
Ⅱ、同一主族元素原子氢化物的稳定性从上到下逐渐减弱,所以稳定性是NH3>PH3,故答案为:NH3;
Ⅲ、工业上获取氯气是通过电解饱和食盐水的方法来获得,化学反应方程式为:2NaCl+2H2O
通电
.
2NaCl+Cl2↑+H2↑,故答案为:2NaCl+2H2O
通电
.
2NaCl+Cl2↑+H2↑;
Ⅳ、氯化钠是含有离子键的离子化合物,故答案为:离子键;
Ⅴ、N最高价氧化物的水化物硝酸和其氢化物氨气反应生成的硝酸铵盐溶液因为铵根离子水解显酸性,故答案为:该盐是硝酸铵,因为其中的铵根离子发生水解反应NH4++H2O⇌NH3•H2O+H+而导致溶液显酸性.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查学生元素周期表中元素的分布和元素周期律知识,可以根据所学知识进行回答,难度不大.1年前查看全部
- 怎么在元素周期表上分辨强和弱酸碱性
怎么在元素周期表上分辨强和弱酸碱性
比如说我自己觉得过渡段向右两个是弱酸,第三个开始向右就是强酸,这个想法对吗? chen7yun1年前1
chen7yun1年前1 -
 zh浅浅 共回答了14个问题
zh浅浅 共回答了14个问题 |采纳率100%同周期从左至右,元素的最高氧化物的水化物酸性增强,碱性减弱;同主族从上至下,元素的最高氧化物的水化物碱性增强,酸性减弱.
过渡元素性质相近,规律性不强,难以区别.1年前查看全部
- 元素周期表的13原子怎么读?二氧化猛制取氧气的化学方程式
 fei天堆堆猪1年前2
fei天堆堆猪1年前2 -
 娃哈哈ql685 共回答了15个问题
娃哈哈ql685 共回答了15个问题 |采纳率86.7%是铝吗? 读“吕”
二氧化锰可以和氯酸钾加热制氧气
2KCLO3(二氧化锰催化加热)=2KCL+3O2
望采纳~~1年前查看全部
- 科学家通过对默写元素的化合物进行研究,寻找高效农药.这些元素往往位于元素周期表的()
科学家通过对默写元素的化合物进行研究,寻找高效农药.这些元素往往位于元素周期表的()
A.左下角区域
B.右上角区域
C.左上角区域
D.右下角区域 zhangying1131年前1
zhangying1131年前1 -
 whitelily1 共回答了25个问题
whitelily1 共回答了25个问题 |采纳率96%B.右上角区域1年前查看全部
- 伦敦力和元素周期表的关系.为什么在纵列中,往下,伦敦力越大,在横的中,从左往右就越来越大.顺便问问什么事伦敦力.我不确定
伦敦力和元素周期表的关系.
为什么在纵列中,往下,伦敦力越大,
在横的中,从左往右就越来越大.
顺便问问什么事伦敦力.
我不确定.
因为我在国外.
所以有些知识连接不上,希望大家回答仔细点.
希望大家不要抄百度上面的,因为我看了,而且看不懂。 kissanxiang1年前1
kissanxiang1年前1 -
 迦绫频伽 共回答了16个问题
迦绫频伽 共回答了16个问题 |采纳率100%现在在国内已经不叫London力了.现在叫它色散力,属于Van De Waals力(范德华力)的一种.从强弱上来讲是属于次级键(就是比化学键若许多的一种力).
至于和元素周期表的关系完全可以和原子半径的大小有关.可以形象的理解,原子半径越大就越容易发生形变,因为核外电子云分布更大,所以受外电场就能造成更大的影响.那么电子所受的回复力(即偏离原轨道范围而力图恢复的力)就越大.如果核外电子越多,发生变形的几率就会更大,那么整体上形变的程度会由于共振的影响加强.在元素周期表中就可以理解为原子半径越大的元素的色散力就越大,原子核外电子越多的电子色散力就越大.1年前查看全部
- 元素周期表中过渡元素包括几列 全是什么元素 其单质具有良好的什么性
 Misszhutou1年前1
Misszhutou1年前1 -
 电刑湿冷 共回答了11个问题
电刑湿冷 共回答了11个问题 |采纳率90.9%元素周期表中过渡元素包括10列,即副族(7列)和第VII族(3列),全是金属元素,单质具有良好的导电性导热性延展性等.1年前查看全部
- 元素周期表第2,3族的元素具有对角线规则是什么意思?说清楚点
 scnksunny1年前2
scnksunny1年前2 -
 受伤的丁丁虫 共回答了32个问题
受伤的丁丁虫 共回答了32个问题 |采纳率93.8%就是讲Li与Mg,Be与Al,B与Si这三对元素的相似性,不指其他元素.相似性指的是金属性和非金属性,并且对角线规则不是官方定律、定则,而是通用说法、习惯说法.资料参见:http://baike.baidu.com/view/968396.htm1年前查看全部
大家在问
- 11平方等于多少厘米
- 2问一个导数问题请问f(x)在x0处可导能不能推出f(x)在x0的领域内可导,我是这样认为了,f(x)在x0处的导数表示的
- 3(2014•普陀区二模)如图,电路中的5个灯泡完全相同,闭合电键后,灯泡都比较暗,不能正常发光.现调节滑动变阻器,使电路
- 4仿写句子这些花在微风中摇动着,带着孩子似的娇羞.可爱的大南瓜,笑呵呵的躺在地上,享受着园中这一片宁静.
- 5蝉这篇文章先写蝉的聒噪和病蝉的微弱,细小和生命的短暂,再写蝉生命的意义,这种写作手法是
- 6I'm very tired;I often dream about hard work的意思
- 7二十年后的地球 作文
- 8一道英语题,问一下,请快回答!急!~~谢谢~
- 9(2012•西城区二模)已知集合A={x|log2x<1},B={x|0<x<c,其中c>0}.若A∪B=B,则c的取值
- 10求与思索(想的)相近的词语要三个词语,是词语不是成语,两个字的,是有关想的,是与思索相近的词语!
- 11(3020•金坛市模拟)用“分子的观点”解释下列现象,不正确的是( )
- 12请先找出正三边形、正四边形、正五边形等正多边形的对称轴的条数,再猜想正n边形对称轴的条数为______.
- 13参加数学建模需要哪些必备的数学知识
- 14设函数f(x)=ax^2-bx+2(a≠0),对于任意实数x,都有f(1/a+x)=f(1/a-x)成立
- 154.The grammar books ___ again and again by bus.A.is read B.a