0.100mol/L KCN溶液的PH
 简单茶1632022-10-04 11:39:541条回答
简单茶1632022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 大巴mm 共回答了17个问题
大巴mm 共回答了17个问题 |采纳率76.5%- 答:
【1】已知 KCN 的pKa= 9.14 pKb= 4.86
【2】[OH-] = (cKb) ^1/2 = (10^-1 x 10^-4.86 )^1/2 = (10^-5.86 )^1/2 = 10^-2.93
【3】PH = 14 - POH = 14-2.93 = 11.07 - 1年前
相关推荐
- 欲由HAc和NaOH两溶液配制pH=5.0的缓冲溶液,问需0.100mol.L-1(-1是上标)HAc溶液与0.100m
欲由HAc和NaOH两溶液配制pH=5.0的缓冲溶液,问需0.100mol.L-1(-1是上标)HAc溶液与0.100mol.L-1NaOH溶液的体积比.已知HA pKa=4.75
 美丽信子1年前1
美丽信子1年前1 -
 0000851 共回答了17个问题
0000851 共回答了17个问题 |采纳率94.1%设需要HAcV1L;NaOH V2L;
混合后:HAc浓度=(0.1V1-0.1V2)/(V1+V2); NaAc浓度=(0.1V2)/(V1+V2);
pH=pKa+lg(c(NaAc)/c(HAc));
5=4.75+lg((0.1V2)/(0.1V1-0.1V2));
V2/(V1-V2)=1.78;
V1/V2=1.56;1年前查看全部
- 计算0.100mol/1hac 的溶液的ph
 cong-12341年前1
cong-12341年前1 -
 蝴蝶的缠绵 共回答了19个问题
蝴蝶的缠绵 共回答了19个问题 |采纳率94.7%0.100mol/1hac 的溶液的ph为3.
正常来讲题目中的信息是不全的,因为HAc是弱电解质,不能完全电离,所以,想知道氢离子浓度需要知道他的电离度的.氢离子浓度等于0.100X电离度,然后再求其负对数1年前查看全部
- 过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等.现向50mL浓度为0.100mol
过渡元素高价化合物在酸性条件下有较强的氧化性,如KMnO4、Na2WO4(钨酸钠)等.现向50mL浓度为0.100mol/L的FeCl2溶液中加入25mL浓度为0.0400mol/L的KMnO4,在滴加少量的H2SO4后,两者恰好完全反应.则氧化剂KMnO4的还原产物可能为( )
A. K2MnO4
B. MnO2
C. MnCl2
D. Mn 忧郁的洋1年前6
忧郁的洋1年前6 -
 atjbk 共回答了21个问题
atjbk 共回答了21个问题 |采纳率100%解题思路:n(FeCl2)=0.05L×0.1mol/L=0.005mol,反应后被氧化生成Fe3+,Fe元素化合价升高1价,
n(KMnO4)=0.025L×0.04mol/L=0.001mol,根据氧化还原反应中氧化剂和还原剂之间得失电子数目相等计算.n(FeCl2)=0.05L×0.1mol/L=0.005mol,反应后被氧化生成Fe3+,Fe元素化合价升高1价,
n(KMnO4)=0.025L×0.04mol/L=0.001mol,设被还原后Mn元素的化合价为+x,
则0.005mol×(3-2)=0.001mol×(7-x),
x=2,
故选C.点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的计算,明确氧化还原反应中元素的化合价升降及电子守恒是解答本题的关键,题目难度不大.1年前查看全部
- C(1/2NaS2O3)=0.100mol/l与C(Na2S2O3)=0.100mol/l是否一样?如果不一样,那么
C(1/2NaS2O3)=0.100mol/l与C(Na2S2O3)=0.100mol/l是否一样?如果不一样,那么
要用C(Na2S2O3)=0.100mol/l配制成C(1/2NaS2O3)=0.100mol/l该怎么配制? I-like1年前1
I-like1年前1 -
 消失在昆山的海勇 共回答了17个问题
消失在昆山的海勇 共回答了17个问题 |采纳率88.2%显然不一样.选择的的基本单元不同,其摩尔质量不同,浓度亦不同.
他们之间的相互转换公式cNa2SO3=1/2cNa2SO31年前查看全部
- (2009•韶关二模)I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100mol
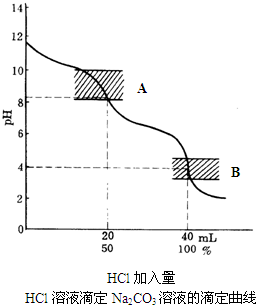 (2009•韶关二模)I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)⇌2SO3(g);△H=-196.6kJ•mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为______;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”)______容器A中SO2的平衡转化率;达到平衡的时间(填“A”或“B”)______容器比较短;
(2009•韶关二模)I.将0.050molSO2和0.030molO2放入容积为1L的密闭容器A中;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,反应:2SO2(g)+O2(g)⇌2SO3(g);△H=-196.6kJ•mol-1,恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,则容器A中SO2的平衡转化率为______;容器B中SO2的平衡转化率(填“大于”、“小于”或“等于”)______容器A中SO2的平衡转化率;达到平衡的时间(填“A”或“B”)______容器比较短;
II.滴定分析法是化学分析法中的重要分析方法之一.滴定分析法就是将一种已知准确浓度的试剂溶液(即标准溶液),由滴定管滴加到被测定的物质的溶液(即试液)中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积,就可以求得被测组分的含量.
(1)已知用0.10mol/L HCl滴定20.00ml 0.10mol/L Na2CO3的滴定曲线如图所示:
①A处选用______作指示剂比较合适;
②当滴定至混合液pH接近4时,为了防止终点出现过早,减少实验的误差,应剧烈地摇动溶液或加热一会溶液,冷却后再继续滴定,这样做的理由是:______;如果是采用加热溶液的操作,应如何进行?______;
(2)EDTA是乙二胺四乙酸的英文名称的缩写,它是一种常用的滴定剂,市售试剂是其二水合二钠盐.下表是EDTA与一些常见金属离子形成络合物(用MY表示)的稳定常数(温度25℃):
lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离.阳离子 lgKMY 阳离子 lgKMY Na+ 1.66 Mn2+ 13.87 Ca2+ 10.96 Pb2+ 18.04
根据上表给出的数据和你所学的知识,解释为什么用CaY溶液可以排除体内的铅?______. 苏诺安安1年前1
苏诺安安1年前1 -
 雅珂熙 共回答了14个问题
雅珂熙 共回答了14个问题 |采纳率100%解题思路:Ⅰ、恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,依据化学反应焓变计算反应的二氧化硫物质的量,根据转化率概念计算得到二氧化硫转化率;分析可知A容器是恒温恒容容器,B容器为恒温恒压容器,达到平衡过程中B中压强大于A中的压强,平衡正向进行,反应速率增大分析判断;Ⅱ、(1)①A处在碱性条件下变色;②溶液中含有H2CO3;(2)依据图表数据分析Pb2+与(EDTA)2-形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离;Ⅰ.恒温恒容下达到平衡时,测得容器A中放出3.932kJ的热量,依据2SO2(g)+O2(g)⇌2SO3(g);△H=-196.6kJ•mol-1,计算可知,二氧化硫反应的物质的量=[2mol×3.932KJ/196.6KJ]=0.04mol,则二氧化硫转化率=[0.04mol/0.05mol]×100%=80%;将0.100molSO2和0.060molO2放入容积为1L的密闭容器B中,相当于两次加入0.050molSO2和0.030molO2放入容积为1L的密闭容器A中,增大压强,平衡正向进行,二氧化硫的转化率增大,容器B中SO2的平衡转化率大于容器A中SO2的平衡转化率,B容器中压强大于A,所以到达平衡所需时间较短;
故答案为:80%;大于; B;
Ⅱ.(1)①A处在碱性条件下变色,所以选用酚酞,故答案为:酚酞;
②溶液中含有H2CO3,加热或振荡加快H2CO3的分解,除去溶液中过多的CO2,如果是采用加热溶液的操作,则将锥形瓶放在石棉网上用酒精灯加热(或将锥形瓶放在盛有热水的烧杯中水浴加热一段时间);
故答案为:加快H2CO3的分解,除去溶液中过多的CO2;将锥形瓶放在石棉网上用酒精灯加热(或将锥形瓶放在盛有热水的烧杯中水浴加热一段时间)
(2)lgKMY值越大,表明金属离子与EDTA形成的络合物越稳定,越难电离,图表数据分析Pb2+与(EDTA)2-形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,Ca(EDTA)2-电离出的(EDTA)2-能与Pb2+结合形成更稳定的络合物Pb(EDTA)2-,从而达到排除体内铅的目的;
故答案为:Pb2+与(EDTA)2-形成络合物的稳定常数大于Ca2+与(EDTA)2-形成络合物的稳定常数,所以Ca(EDTA)2-电离出的(EDTA)2-能与Pb2+结合形成更稳定的络合物Pb(EDTA)2-,从而达到排除体内铅的目的.点评:
本题考点: 化学平衡的计算;中和滴定.
考点点评: 本题考查了化学平衡影响因素的分析判断,化学平衡计算应用,中和滴定实验的分析判断,题干信息的应用和理解是解题关键,题目难度中等.1年前查看全部
- ,向10.0mL 0.100mol·L-1的CuSO4溶液中加入10.0mL 0.150mol·L-1的NaOH溶液,生
,向10.0mL 0.100mol·L-1的CuSO4溶液中加入10.0mL 0.150mol·L-1的NaOH溶液,生成了一种蓝色沉淀.
经检验溶液中Cu2+和OH-已沉淀完全则下列物质可能是该沉淀主要成分的是 怀念朋友5211年前1
怀念朋友5211年前1 -
 暧d第7小调 共回答了12个问题
暧d第7小调 共回答了12个问题 |采纳率83.3%生成的蓝色沉淀是氢氧化铜.1年前查看全部
- 如果工业废水含有cd2 为0.100mol
如果工业废水含有cd2 为0.100mol
如果工业废水含有cd2+为0.100mol/dm3,此外还含有fe2+,fe3+,逐步加入消石灰
1) 当Cd(OH)2开始沉淀时,Fe2+,Fe3+是否已沉淀完全?
2)当Cd2+排放达标时,Fe2+,Fe3+是否已沉淀完全?
(浓度<10∧-5/dm3即为沉淀完全) 看贴揍aa都不回1年前1
看贴揍aa都不回1年前1 -
 陈红萍 共回答了22个问题
陈红萍 共回答了22个问题 |采纳率100%【】1) 当Cd(OH)2开始沉淀时,Fe2+,Fe3+是否已沉淀完全?答:Fe3+ 已沉淀完全
【】2)当Cd2+排放达标时,Fe2+,Fe3+是否已沉淀完全?答:Fe2+, 已沉淀完全1年前查看全部
- c(1/2NaS2O3)=0.100mol/lL的硫代硫酸钠与c(NaS2O3)=0.100mol/lL浓度是否相同,不
c(1/2NaS2O3)=0.100mol/lL的硫代硫酸钠与c(NaS2O3)=0.100mol/lL浓度是否相同,不同的是各自的浓度是多少
1、那请问上面的问题中各自的浓度是多少呀,并且我要配制这两种溶液的过程,请问前者是0.05mol/L,后者是0.100mol/L吗,本人是初学者,对这此有点迷惘,请指点迷津.
2、在室内检测甲醛与氨时,对硫代硫酸钠的分子式有不同的写法,
c(1/2NaS2O3)=0.100mol/L
c(Na2S2O3)=0.100mol/L请问上式中Na和Na2是怎么一回事呀,还有1/2NaS2O3和Na2S2O3究竟是怎么区别的,请邦助一下,我需要一个正确的解释. 专砸傻子vv1年前1
专砸傻子vv1年前1 -
 1215jinjin 共回答了10个问题
1215jinjin 共回答了10个问题 |采纳率70%物质的量n的数值取决于基本单元的选择,表示物质的量浓度时,必须指明基本单元.选择不同的基本单元,其摩尔质量就不同,浓度亦不相同.
他们之间的转换有一个通式1年前查看全部
- 在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得
在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得
在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
(1)该反应的平衡常数表达式为时间(s) 0 20 40 60 80 c(N2O4)/mol?L-1 0.100 c1 0.050 c3 c4 c(NO2)/mol?L-1 0.000 0.060 c2 0.120 0.120 [NO2]2 [N2O4] ;从表中分析:[NO2]2 [N2O4]
c1______c2,c3______c4(填“>”、“<”或“=”).
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为______mol?L-1?s-1.
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是______(填字母序号).
A.扩大容器的容积B.再充入一定量的N2O4C.分离出一定量的NO2D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为______.
 传说中的潜水员1年前1
传说中的潜水员1年前1 -
 peggi 共回答了12个问题
peggi 共回答了12个问题 |采纳率91.7%(1)N2O4(g)?2NO2(g),反应的平衡常数K=
[NO2]2
[N2O4];
20s时c(NO2)=0.060mol/L
N2O4?2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4?2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:
[NO2]2
[N2O4];<;=;
(2)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4?2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=[0.060mol/L/60s]=0.001mol/(L?s);
故答案为:0.001;
(3)N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A、增大容器体积,各组分浓度均减小,故A错误;
B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故选B;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
0.122
0.04=0.36
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=[1/0.36]
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
K=[0.5x
(0.080?x)2=
1/0.36]
x=0.020mol/L
则达到平衡时N02气体的转化率=[0.020/0.080]×100%=25%,
故答案为:25%.1年前查看全部
- 在100mlca2+溶液中添加0.100mol/lca2+标准溶液1.0ml后,电动势有4mv增加,求原来溶液中的ca2
在100mlca2+溶液中添加0.100mol/lca2+标准溶液1.0ml后,电动势有4mv增加,求原来溶液中的ca2+的浓度.
 0fengzi1年前1
0fengzi1年前1 -
 haohaogaibian 共回答了12个问题
haohaogaibian 共回答了12个问题 |采纳率91.7%增加的浓度ΔC=0.1*1/100=0.001mol/L
由能斯特方程得
电动势E=E0+0.059/2㏒C
ΔE=0.059/2[㏒(C1+ΔC)-㏒C1]
即0.004=0.059/2[㏒(C1+0.001)-㏒C1]
解得C1=0.00273mol/L
即为所求1年前查看全部
- 化学实验计算题1. 用凯氏定氮法处理0.300g某食物试样,生成的NH3收集在硼酸溶液中.滴定消耗0.100mol/LH
化学实验计算题
1. 用凯氏定氮法处理0.300g某食物试样,生成的NH3收集在硼酸溶液中.滴定消耗0.100mol/LHCl溶液25.00mL.计算试样中蛋白质的质量分数.(N的摩尔质量为14)
2. 准确称取无水Na2CO3试样0.1060g,溶于适量水中.以甲基橙为指示剂,用HCl滴定至终点时,消耗25.00mL.计算HCl溶液的准确浓度.(Na2CO3的摩尔质量为106)
3. 测定固体饮料中的总酸度,称取样品5.000g,置于研钵中,加少量无CO2蒸馏水研磨成糊状,用无CO2蒸馏水加入250mL容量瓶中充分摇动过滤.准确移取上述滤液50.00mL,加酚酞指示剂3滴,用0.1000mol/LNaOH标准溶液滴至微红色30s不退色,消耗体积为5.00mL.计算该固体样品的总酸度.(以草酸的百分含量表示,草酸的摩尔质量为90)
 ramguy1年前1
ramguy1年前1 -
 bao_1975 共回答了26个问题
bao_1975 共回答了26个问题 |采纳率100%第一题:提问不准确,应该是问试样中N的质量百分比含量:
0.100*0.025*14/0.300=11.67%
第二题:
(2*0.1060/106)/0.025=0.0800mol/L
第三题:
0.1000*0.00500*90/(5.000*50/250)=4.50%1年前查看全部
- 在0.100mol • L-1 HAc溶液中,加入固体NaAc使其浓度为0.100mol• L-
在0.100mol • L-1 HAc溶液中,加入固体NaAc使其浓度为0.100mol• L-1,求次混合溶液中C(H+)和HAc的解离度
设C(H+)为x mol• L-1
HAc====H+ + Ac-
平衡浓度/mol• L-1 0.100-x x 0.100+x
Ca (H+)(Ac-)
---------- > 400 ------------------- ==Ka x=1.76
ka ( HAc)
想问下 0.100-x x 0.100+x这一步是为什么?
0.100-x不就是(Ac-)的浓度吗?为什么要放在 HAc的下面?
HAc====H+ + Ac-
平衡浓度/mol• L-1 0.100-x x 0.100+x xiaomak1年前1
xiaomak1年前1 -
 拽的风 共回答了22个问题
拽的风 共回答了22个问题 |采纳率100%0.1-x并不是Ac-的浓度,因为溶液是HAc-NaAc的混合溶液,所以Ac-的来源并不只有HAc,还有NaAc.
x是H+的浓度,同时也近似代表电离了的HAc的浓度(忽略了水的电离),所以未电离的HAc的浓度就是0.1-x.同理,Ac-的来源有两个部分,其中NaAc提供0.1,而HAc提供x,所以Ac-的浓度就是0.1+x.1年前查看全部
- 配制c(1/6KIO3)=0.100mol/L的标准溶液1000ml,应如何配置,
 狮子与兔子1年前1
狮子与兔子1年前1 -
 楼主懂个屁 共回答了20个问题
楼主懂个屁 共回答了20个问题 |采纳率90%KIO3 按其摩尔质量的六分之一计,物质的量浓度为 0.1mol/L.也就是1升该溶液中含有0.1mol(1/6KIO3) 即0.1/6mol KIO3 .
碘酸钾的摩尔质量为214克/摩尔
需要碘酸钾的质量为214×0.1/6=3.567克
取纯碘酸钾3.567克,加水搅拌定容至1000毫升即可.1年前查看全部
- 在烧杯中盛放20mL 0.100mol/L 氨水溶液,逐步加入0.1mol/L HCl溶液.(已知氨水的Kb=1.77×
在烧杯中盛放20mL 0.100mol/L 氨水溶液,逐步加入0.1mol/L HCl溶液.(已知氨水的Kb=1.77×10∧-5,pKb=4.75),试计算:=1.77×10∧-5,pKb=4.75),试计算:
(1)当加入10.00mL HCl后,混合溶液的pH,
(2) 当加入20.00mL HCl后,混合溶液的pH,
(3) 当加入30.00mL HCl后,混合溶液的pH. swallow4201171年前1
swallow4201171年前1 -
 wolflingfdasg 共回答了15个问题
wolflingfdasg 共回答了15个问题 |采纳率100%(1)[OH-]=Kb[NH3.H2O]/[NH4+]=Kb;[H+]=Kw/[OH-];pH=-lg[H+]=14-4.75=9.25
(2)[H+]={Kh[NH4+]}^1/2={Kw*0.05/Kb}^1/2;pH=-lg[H+]
(3)[H+]=0.1*10/50;pH=-lg[H+]1年前查看全部
- 在室温下0.100mol/LNH3•H2O的解离度为1.34%,计算NH3•H2O的Kb和溶液的
在室温下0.100mol/LNH3•H2O的解离度为1.34%,计算NH3•H2O的Kb和溶液的pH.
 certificate1年前1
certificate1年前1 -
 天上下着小雪 共回答了19个问题
天上下着小雪 共回答了19个问题 |采纳率94.7%根据离解率得kb=c(OH-)c(NH4+)/c(NH3*H2O)=(0.1mol/LX1.34%)(0.1mol/LX1.34%)/[0.1-(0.1mol/LX1.34%)]=0.0000017956/0.09866≈1.82X10^-5,kw/c(OH-)≈7.46x10^-12,PH=-lgc(H+)=-lg[kw/c(OH-)]≈12-lg7.46≈12-0.87≈11.131年前查看全部
- 判断题:用0.100mol.L-1 NaOH滴定0.100mol.L-1的HAc溶液,可用甲基橙作指示剂
判断题:用0.100mol.L-1 NaOH滴定0.100mol.L-1的HAc溶液,可用甲基橙作指示剂
终点时,溶液由红色变为黄色.
1.对
2.错 修水在线1年前1
修水在线1年前1 -
 手机手机手机 共回答了20个问题
手机手机手机 共回答了20个问题 |采纳率100%对!甲基澄的使用:酸色,红色(PH4.4)1年前查看全部
- 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
试填空:时间/s
浓度mol•L-10 20 40 60 80 100 c(N2O4)mol•L-1 0.100 c1 0.050 c3 a b c(NO2)/mol•L-1 0.000 0.060 c2 0.120 0.120 0.120
(1)达到平衡时N2O4的转化率为______%,表中c2______c3,a______b (选填“>”“<”“=”).
(2)20s的四氧化二氮的浓度c1=______mol•L-1,在0s~20s内四氧化二氮的平均反应速率为______mol•(L•s)-1.
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是______mol•L-1. shengsp1年前1
shengsp1年前1 -
 苟洞西 共回答了22个问题
苟洞西 共回答了22个问题 |采纳率95.5%解题思路:(1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;
根据方程式计算,计算c2、c3,据此解答;
60s后反应达平衡,反应混合物各组分的浓度不变.
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);
根据v=[△c/△t]计算v(N2O4).
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4⇌2 NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N2O4的转化率为[0.06mol/L/0.1mol/L]×100%=60%;
c3=0.1mol/L-0.06mol/L=0.04mol/L,
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4⇌2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c3;
60s后反应达平衡,反应混合物各组分的浓度不变,所以a=b.
故答案为:60;>;=
(2)由表可知,20s时,c(NO2)=0.060mol/L,所以
N2O4⇌2 NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=[0.03mol/L/20s]=0.0015mol•(L•s)-1.
故答案为:0.07mol/L;0.0015mol•(L•s)-1.
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.
所以 N2O4⇌2 NO2,
0.1mol/L 0.20mol/L
故答案为:0.20mol/L点评:
本题考点: 化学平衡的计算.
考点点评: 考查化学平衡的有关计算、等效平衡等,难度中等,注意基础知识的积累掌握.1年前查看全部
- 在100℃时,将0.100mol的N 2 O 4 气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到
在100℃时,将0.100mol的N 2 O 4 气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
试填空:时间/s
浓度mol•L-10 20 40 60 80 100 c(N2O4)mol•L-1 0.100 c1 0.050 c3 a b c(NO2)/mol•L-1 0.000 0.060 c2 0.120 0.120 0.120
(1)达到平衡时N 2 O 4 的转化率为______%,表中c 2 ______c 3 ,a______b (选填“>”“<”“=”).
(2)20s的四氧化二氮的浓度c 1 =______mol•L -1 ,在0s~20s内四氧化二氮的平均反应速率为______mol•(L•s) -1 ;.
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是______mol•L -1 . llpprr1年前1
llpprr1年前1 -
 一起去打炮 共回答了19个问题
一起去打炮 共回答了19个问题 |采纳率94.7%(1)由表可知,60s时反应达平衡,c(NO 2 )=0.120mol/L,
N 2 O 4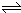
2 NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N 2 O 4 的转化率为
0.06mol/L
0.1mol/L ×100%=60%;
c3=0.1mol/L-0.06mol/L=0.04mol/L,
由表可知,40s时,c(N 2 O 4 )=0.050mol/L,
N 2 O 4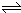
2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c3;
60s后反应达平衡,反应混合物各组分的浓度不变,所以a=b.
故答案为:60;>;=
(2)由表可知,20s时,c(NO 2 )=0.060mol/L,所以
N 2 O 4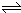
2 NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c 1 =0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N 2 O 4 )=
0.03mol/L
20s =0.0015mol•(L•s) -1 .
故答案为:0.07mol/L;0.0015mol•(L•s) -1 .
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N 2 O 4 一边,满足c(N 2 O 4 )为0.100mol/L.
所以 N 2 O 4
2 NO2,
0.1mol/L 0.20mol/L
故答案为:0.20mol/L1年前查看全部
- 在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.
在溶液中,反应A+2B  C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L。反应物A的浓度随时间的变化如下图所示。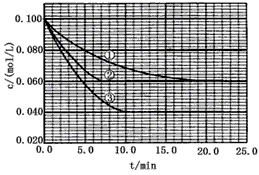
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是: ②_______________; ③_______________;
(2)实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;
(3)该反应的△H_________0,判断其理由是__________________________________;
(4)该反应进行到4.0min时的平均反应速率:实验②:v B =__________________________________;实验③:v C =__________________________________。 rat02111年前1
rat02111年前1 -
 nawok 共回答了24个问题
nawok 共回答了24个问题 |采纳率95.8%(1)②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小
(2)40%(或0.4);0.06mol/L
(3)﹥;升高温度向正方向移动,故该反应是吸热反应
(4)0.014mol(L·min) -1 ; 0.008mol(L·min) -11年前查看全部
- 精英2讲12疑惑,将0.195g锌粉加入到20ml的0.100mol.L-1MO2+溶液中,
精英2讲12疑惑,将0.195g锌粉加入到20ml的0.100mol.L-1MO2+溶液中,
恰好完全反应,则还原产物可能是
A M B M2+ C M3+ DMO2+
老师设MO2+中M由+5价降到+X价,这样来做的,为什么要设成降到+X价,万一它降到负价了呢? 没西1年前1
没西1年前1 -
 810218 共回答了15个问题
810218 共回答了15个问题 |采纳率93.3%没有万一啊.选项中最低价位是0价.
而且,应该是假设它被还原后,化合价为X,这个X也是可正可负的.
具体解题过程貌似我记得昨晚回答过了.
本题选B
【解析】0.195g锌粉物质的量为0.003mol
其被氧化后,变为Zn2+,失去电子0.003×2=0.006mol
20ml的0.100mol.L-1MO2+中,含有MO2+ 0.02×0.1=0.002mol
MO2+中,M的化合价为+5,
因为恰好反应,说明MO2+得到电子也是0.006mol,说明,MO2+总共得到电子3个.
所以还原产物中,M的化合价应该是+5+(-1×3)=+2
于是选B
通过Zn的失去电子个数×Zn的物质的量=M得到电子的个数×M的物质的量
2 × 0.003 = X × 0.002
所以解得 X=3
所以MO2+中M得到 3个电子,被还原为M2+
p.s.如果Zn物质的量为0.006,其他不变,那么解出X=6,这样的话,M的化合价=+5-6=-1了
所以说,就算降到负的也不怕、、、
回答请采纳满意1年前查看全部
- 将0.095克锌粉加入到20.0ml的0.100mol·l-1MO2+溶液中,恰好完全反应,则还原产物可能是?
 afdsafe1年前1
afdsafe1年前1 -
 duzy1999 共回答了24个问题
duzy1999 共回答了24个问题 |采纳率91.7%0.095g的锌粉是0.00146mol,若被氧化,失去0.00292mol电子,所以对于20*10^-3*0.1=2*10^-3mol的MO2+,得到0.00292mol约是0.003mol的电子1年前查看全部
- 高一化学电子守恒问题已知25.0ml 0.100mol/L的Na2S2O3溶液恰好把标况下224mLCl2完全还原成Cl
高一化学电子守恒问题
已知25.0ml 0.100mol/L的Na2S2O3溶液恰好把标况下224mLCl2完全还原成Cl-,则S2O32-将转化为( )
A.S2- B.S C.SO32- D.SO42- stgydfhdfjgfk1年前2
stgydfhdfjgfk1年前2 -
 raul_shy 共回答了15个问题
raul_shy 共回答了15个问题 |采纳率86.7%选A
因为224mLCl2完全还原成Cl-,所以转移的电子数为0.02摩尔
Cl2被还原,所以S离子被氧化,是升化合价.
此题中的S2O3离子,S为正2加,若25.0ml 0.100mol/L有0.0025摩尔Na2S2O3,0.005摩尔S离子,若转化成S-2价时,转移电子也为0.02摩尔
所以S2O32转化成了S2-1年前查看全部
- 用0.100mol/L的KOH标准溶液滴定未知浓度的盐酸,判断到达滴定终点的实验现象是(酚酞溶液由无色变为浅
用0.100mol/L的KOH标准溶液滴定未知浓度的盐酸,判断到达滴定终点的实验现象是(酚酞溶液由无色变为浅
红色)为什么,到达滴定终点时不是显中性吗,此时不是无色吗 hantu19751年前4
hantu19751年前4 -
 ymwawa 共回答了20个问题
ymwawa 共回答了20个问题 |采纳率80%只有出现浅红色,且半分钟后不褪色,才到达滴定终点.
KOH过量一点点儿,误差是非常小的,可以计算出误差才为千分之几,这样的实验完全允许的.KOH过量一点点儿才能说明盐酸全部反应,误差又非常小,又能批示滴定终点,何乐而不为.
祝新年快乐!1年前查看全部
- 准确称取氯化钠样品1.000g,溶于水后,加入铬酸钾指示剂,用0.100mol/L的硝酸银标准溶液滴定,终点时消硝酸银溶
准确称取氯化钠样品1.000g,溶于水后,加入铬酸钾指示剂,用0.100mol/L的硝酸银标准溶液滴定,终点时消硝酸银溶化19.60ml,计算氯化钠样品的含量
 tirlon1年前2
tirlon1年前2 -
 white1504 共回答了19个问题
white1504 共回答了19个问题 |采纳率100%属于沉定滴定~1年前查看全部
- 计算0.100mol/L硫化钠的pH怎么算 大学无机化学
 DoDu1年前2
DoDu1年前2 -
 宁河号子111 共回答了15个问题
宁河号子111 共回答了15个问题 |采纳率100%解析:
H2S的 K1 = 1.07 × 10^-7,K2 = 1.26 × 10^-13
Na2S在溶液中水解,方程式为:
2- + H2O = - + -(=表示可逆符号)
此反应的平衡常数用到了K2
K = c(生成物1)* c(生成物2) / c (反应物1)* c(反应物2)
根据方程式有:c - = c - ,c = 1
所以设c - = x mol/L
则K = c- * c- / c 2-
1.26 × 10^-13 = x^2 / 0.1
解得:x = 1.122 × 10^-6 mol/L
此时溶液中c+ = (10 ^-14 / 1.122 × 10^-6 )mol/L = 8.909 × 10^-9 mol/L
pH = -lg[H+] = -lg(8.909 × 10^-9) = 8.9501年前查看全部
- 元素守恒的25ml 0.100mol/L的大苏打(Na2S2O3)溶液恰好把0.224L标况下的氯气转化为Cl-,则硫代
元素守恒的
25ml 0.100mol/L的大苏打(Na2S2O3)溶液恰好把0.224L标况下的氯气转化为Cl-,则硫代硫酸根离子将转换为
A S2- B S
C (SO3)2- D (SO4)2- fuguoli1年前2
fuguoli1年前2 -
 风清若兮 共回答了21个问题
风清若兮 共回答了21个问题 |采纳率95.2%0.224L 对应了 0.01mol
0.01mol CL2 全部变成cl- 得到0.01*2*1mol=0.02mol 电子
大苏打的物质的量=25/1000*0.1=0.0025ml
所以其中S元素的物质的量为0.0025*2=0.005mol
因为CL2 得到了0.02mol 电子
所以S元素总共应该失去0.02mol 电子
所以平均下来1molS元素失去了 0.02/0.005=4mol电子
所以即是S 生高了4价
由于原来Na2S2O3 中S 的平均化合价为 +2价
上升4价就变成+6价
所以答案选D.
如果有问题 请楼下的指正1年前查看全部
- 1:将40ml0.100mol/L 硝酸银溶液加到25.00ml氯化钡溶液中,剩余硝酸银溶液,需用15.00Ml0.09
1:将40ml0.100mol/L 硝酸银溶液加到25.00ml氯化钡溶液中,剩余硝酸银溶液,需用15.00Ml0.09800ml/L NH4SCN溶液返滴定,问25.00ml氯化钡溶液中含有氯化钡质量为多少?
2:称取纯NaCl 0.1169g,加水溶液后,以K2CrO4为指示剂,用硝酸银溶液滴定时共用去20.00ml,求该硝酸银溶液 的溶度?
感谢回答
 wodeyong1年前2
wodeyong1年前2 -
 vilinsh 共回答了21个问题
vilinsh 共回答了21个问题 |采纳率95.2%1.硝酸银和NH4SCN的反应计量比是1:1
所以,被返滴定的硝酸银的物质的量为
15.00e-3*0.09800=1.470e-3mol
而原硝酸银的物质的量为40e-3*0.100=4.00e-3mol
所以参与氯化钡反应的硝酸银的物质的量为4.00e-3-1.47e-3=2.53e-3mol
BaCl2~2AgNO3
n(BaCl2)=1/2n(AgNO3)=1.265e-3mol
m(BaCl2)=208*1.265e-3=0.263g
2.n(Cl-)=0.1169/58.5=0.001998mol
n(AgNO3)=n(Cl-)
c(AgNO3)=n/V=0.001998/20e-3=0.0999mol/L1年前查看全部
- 混合溶液中HAc和NaAC的浓度均为0.100mol/l,试求该溶液的pH值
 岳阳的云1年前2
岳阳的云1年前2 -
 水的开不煮 共回答了14个问题
水的开不煮 共回答了14个问题 |采纳率85.7%K=[H][Ac-]/[HAc]=[H+]=1.8E-5
pH=4.7441年前查看全部
- 硫代硫酸钠(Na2S2O3)可以作为脱氯剂.已知25.00mL,0.100mol/L的Na2S2O3被Cl2氧化成Na2
硫代硫酸钠(Na2S2O3)可以作为脱氯剂.已知25.00mL,0.100mol/L的Na2S2O3被Cl2氧化成Na2SO4,而Cl2被还原成Cl-(这个是氯离子),求消耗的Cl2在标准状态下的体积.
 魅魃魑1年前2
魅魃魑1年前2 -
 yijifeng 共回答了17个问题
yijifeng 共回答了17个问题 |采纳率94.1%Na2S2O3被氧化为Na2SO4,S由正二价升到正六价,两个硫就应该得到8个电子,Cl2由零价降到负一价,两个氯失去2个电子,根据得失电子守恒,那么反应的Cl2的物质的量应为Na2S2O3的4倍,Na2S2O3的物质的量为0.1*0.025=0.0025mol,所以Cl2的物质的量应为0.0025*4=0.01mol,体积为0.01*22.4=0.224L1年前查看全部
- 化10.硫代硫酸钠(Na2S2O3)可作为脱氧剂,已知25.0mL 0.100mol·L(-1)Na2S2O3溶液恰好把
化10.硫代硫酸钠(Na2S2O3)可作为脱氧剂,已知25.0mL 0.100mol·L(-1)Na2S2O3溶液恰好把224mL(标准状况)

 jackroy811年前1
jackroy811年前1 -
 雪不语 共回答了12个问题
雪不语 共回答了12个问题 |采纳率100%解析:
224ml=0.224L=0.01mol=0.02mol的电子
25ml*0.100=0.0025mol,S的化合价为+2价,那么硫代硫酸根会0.02mol/(0.0025*2)=4,得到硫酸根,答案选择D
不懂问吧1年前查看全部
- 在浓度为0.100mol/l的HCl及0.0010mol/l的Pb(NO3)2混合溶液中,通入H2S至饱和,是否有沉淀形
在浓度为0.100mol/l的HCl及0.0010mol/l的Pb(NO3)2混合溶液中,通入H2S至饱和,是否有沉淀形成?
Ksp[PbS]=9.04×10^(-29)
H2S的Ka1=9.1×10^(-8)
Ka2=1.1×10^(-12) 第一封情书1年前1
第一封情书1年前1 -
 hljwhq 共回答了25个问题
hljwhq 共回答了25个问题 |采纳率88%0.100mol/l的HCl及0.0010mol/l的Pb(NO3)2混合溶液中,通入H2S至饱和,
0.100mol/l的HCl c(H+)=0.100mol/l
H2S至饱和 浓度约为1mol/l H2S的Ka1=9.1×10-8 Ka2=1.1×10^(-12)
硫氢根离子浓度=9.1×10-8/0.1=9.1×10-7
硫离子浓度=Ka2×HS-/C(H+)=1.1×10^(-12).9.1×10-7/0.1=1×10-17
0.0010mol/l的Pb(NO3)2 Pb2+浓度=0.0010mol/l
1×10-17×0.0010mol/l大于9.04×10^(-29) 所以有沉淀1年前查看全部
- 将0.195g锌粉加入到20ml的0.100mol/L的MO2+溶液中,恰好完全反应,则还原产物是
 wxbfly1年前2
wxbfly1年前2 -
 理想永远在前面 共回答了12个问题
理想永远在前面 共回答了12个问题 |采纳率91.7%0.195/65=0.003mol锌,它到+2价,转移电子数是0.003*2=0.006mol
现在有0.02*0.1=0.002mol的MO2+,其中M是+5价,化合价应该降低,设生成的产物中M的化合价是x,根据得失电子守恒,就有0.002*(5-x)=0.006mol,所以X就是2,你就在答案中去找M的化合价是+2价的,就行了.1年前查看全部
- 精英2讲12,将0.195g锌粉加入到20ml的0.100mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是
精英2讲12,将0.195g锌粉加入到20ml的0.100mol.L-1MO2+溶液中,恰好完全反应,则还原产物可能是
A M B M2+ C M3+ DMO2+ 开花的扁豆1年前3
开花的扁豆1年前3 -
 marudy 共回答了16个问题
marudy 共回答了16个问题 |采纳率81.3%根据得失的电子守恒来算.
0.195glZn由0-----+2,失去0.195/65*2=0.006mol电子.
0.02*0.1molMnO2+,M由+5到X.得到0.002*(5-X)mol电子.
0.006=0.002*(5-X)
解得X=2,所以得到的还原产物,可能是M2+
选B.1年前查看全部
- (2010•湖北)在溶液中,反应A+2B⇌C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/
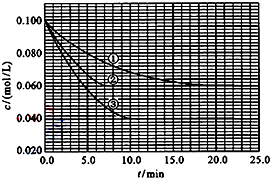 (2010•湖北)在溶液中,反应A+2B⇌C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
(2010•湖北)在溶液中,反应A+2B⇌C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L 及 c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.
请回答下列问题:
(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:
②______;______.
③______;______.
(2)实验②平衡时B的转化率为______;实验③平衡时C的浓度为______;
(3)该反应的△H______0,其判断理由是______
(4)该反应进行到4.0min时的平均反应速率:
实验②:vB=______
实验③:vc=______. lltccznn1年前1
lltccznn1年前1 -
 聊息无风法魔 共回答了12个问题
聊息无风法魔 共回答了12个问题 |采纳率100%解题思路:(1)在溶液中,压强对化学平衡无影响,且起始浓度不变,应为催化剂与温度对反应的影响,根据催化剂、温度对化学反应速度率和化学平衡的影响;
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,计算A的浓度变化量,再利用方程式计算B的浓度变化量,进而计算平衡时B的转化率;
实验③平衡时A的浓度为0.04mol/L,计算A的浓度变化量,再利用方程式计算C的浓度变化量,进而计算平衡时C的浓度;
(3)温度升高,A的浓度降低,平衡向正反应方向移动,据此判断;
(4)根据v=[△c/△t]计算vA,利用速率之比等于速率之比实验②中vB,实验③中vc.(1)与①比较,②缩短达到平衡的时间,因催化剂能加快化学反应速度率,化学平衡不移动,所以②为使用催化剂;
与①比较,③缩短达到平衡的时间,平衡时A的浓度减小,因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,
故答案为:②加催化剂;达到平衡的时间缩短,平衡时A的浓度未变;③温度升高;达到平衡的时间缩短,平衡时A的浓度减小;
(2)由图可知,实验②平衡时A的浓度为0.06mol/L,故A的浓度变化量0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知B的浓度变化量为0.04mol/L×2=0.08mol/L,故平衡时B的转化率为[0.08mol/L/0.2mol/L]×100%=40%;
实验③平衡时A的浓度为0.04mol/L,故A的浓度变化量0.1mol/L-0.04mol/L=0.06mol/L,由方程式可知C的浓度变化量为0.06mol/L,故平衡时C的浓度为0.06mol/L,
故答案为:40%;0.06mol/L;
(3)因③温度升高,平衡时A的浓度减小,化学平衡向吸热的方向移动,说明正反应方向吸热,即△H>0,
故答案为:>;温度升高,平衡向正反应方向移动;
(4)实验②中,vA=[0.1mol/L−0.072mol/L/4min]=0.007mol(L•min)-1,所以vB=2vA=0.014mol(L•min)-1;
实验③中,vA=[0.1mol/L−0.064mol/L/4min]=0.009mol(L•min)-1,所以vC=vA=0.009mol(L•min)-1,
故答案为:0.014mol(L•min)-1;0.009mol(L•min)-1.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查化学平衡浓度-时间图象、化学反应速率计算、化学平衡影响因素等,注意细心读取图象中物质的浓度,浓度不大.1年前查看全部
- 在100℃时,将0.100mol的N 2 O 4 气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到
在100℃时,将0.100mol的N 2 O 4 气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:时间/s
浓度mol·L -10 20 40 60 80 100 c(N 2 O 4 )mol·L -1 0.100 c 1 0.050 c 3 a b c(NO 2 )/mol·L -1 0.000 0.060 c 2 0.120 0.120 0.120
(1)达到平衡时N 2 O 4 的转化率为 %,表中c 2 c 3 ,a b (选填“>”“<”“=”)。
(2)20s的四氧化二氮的浓度c 1 = mol·L -1 ,在0s~20s内四氧化二氮的平均反应速率为 mol·(L·s) -1 ;。
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是 mol·L -1 。 sam1982cn1年前1
sam1982cn1年前1 -
 zhenghuifang 共回答了14个问题
zhenghuifang 共回答了14个问题 |采纳率92.9%(1)60,>,="" (2)0.070,0.0015 (3)0.200
略1年前查看全部
- 在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行
在100℃时,将0.100mol N2O4气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内物质的浓度进行分析得到如表数据:
(1)该反应的平衡常数表达式为时间(s) 0 20 40 60 80 c(N2O4)/mol•L-1 0.100 c1 0.050 c3 c4 c(NO2)/mol•L-1 0.000 0.060 c2 0.120 0.120 [NO2]2 [N2O4] ;从表中分析:[NO2]2 [N2O4]
c1______c2,c3______c4(填“>”、“<”或“=”).
(2)在上述条件下,从反应开始直至达到化学平衡时,N2O4的平均反应速率为______mol•L-1•s-1.
(3)达平衡后下列条件的改变可使NO2气体浓度增大的是______(填字母序号).
A.扩大容器的容积B.再充入一定量的N2O4C.分离出一定量的NO2D.再充入一定量的He
(4)若在相同条件下,起始时只充入0.080mol NO2气体,则达到平衡时NO2气体的转化率为______. 6299841年前1
6299841年前1 -
 xuzhh1314 共回答了24个问题
xuzhh1314 共回答了24个问题 |采纳率91.7%解题思路:(1)平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,根据方程式计算c2、c1,据此解答;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=[△c/△t]计算得到;
(3)依据化学平衡原理分析改变条件提高NO2转化率的选项;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=[消耗量/起始量]×100%;(1)N2O4(g)⇌2NO2(g),反应的平衡常数K=
[NO2]2
[N2O4];
20s时c(NO2)=0.060mol/L
N2O4⇌2 NO2,
浓度变化 0.030mol 0.060mol/L
c1=0.10mol/L-0.03mol/L=0.070mol/L;
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4⇌2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c1;
故答案为:
[NO2]2
[N2O4];<;=;
(2)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4⇌2 NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=[0.060mol/L/60s]=0.001mol/(L•s);
故答案为:0.001;
(3)N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A、增大容器体积,各组分浓度均减小,故A错误;
B、再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C、减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D、再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故选B;
(4)依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4⇌2 NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
K=
0.122
0.04=0.36
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,2 NO2=N2O4 ,K=[1/0.36]
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
K=[0.5x
(0.080−x)2=
1/0.36]
x=0.020mol/L
则达到平衡时N02气体的转化率=[0.020/0.080]×100%=25%,
故答案为:25%.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡的有关计算、化学平衡的影响因素,题目综合性较大,注意基础知识的积累掌握.1年前查看全部
- 设计实验方案:用0.100mol/L盐酸配制250mL0.010mol/L盐酸
 tomato45671年前1
tomato45671年前1 -
 地球1979 共回答了13个问题
地球1979 共回答了13个问题 |采纳率84.6%250mL的0.010mol/L盐酸中含有0.010mol/L*0.25L=0.0025mol的HCl(也就是说,需要取0.0025mol的盐酸)
那么就应该取0.0025mol÷0.100mol/L=0.025L的待稀释盐酸(因为这么多盐酸中含有的HCl量在最后稀释到250mL时浓度为0.010mol/L)
1、取一洁净的250ml容量瓶(如果要求不精确,也可以用量筒)
2、用移液管取25mL的0.100mol/L盐酸放入容量瓶中(最好用25ml的胖肚移液管)
3、加水至250mL刻度线
4、混匀(盖上容量瓶塞后,倒立,让气泡处在瓶底,剧烈摇晃,并多次颠倒混匀)1年前查看全部
- 20mL0.100mol/LHCl溶液与10mL0.100mol/LNaOH溶液混合后,溶液的pH是多少?
 redhunter1年前2
redhunter1年前2 -
 非霏霏 共回答了13个问题
非霏霏 共回答了13个问题 |采纳率84.6%c(H+)=(20×0.1-10×0.1)/30=0.0333mol/L;
pH=-lgc(H+)=1.48;
有问题请追问~~1年前查看全部
- c(1/2NaS2O3)=0.100mol/lL的硫代硫酸钠与c(NaS2O3)=0.100mol/lL浓度是否相同,不
c(1/2NaS2O3)=0.100mol/lL的硫代硫酸钠与c(NaS2O3)=0.100mol/lL浓度是否相同,不同的是各加多少硫代硫酸
1、那请问上面的问题中各自的浓度是多少呀,并且我要配制这两种溶液的过程,05mol/lL,后者是0.100mol/lL吗,本人是初学者,对这此有点迷惘,
2、在室内检测甲醛与氨时,对硫代硫酸钠的分子式有不同的写法,
c(1/2NaS2O3)=0.100mol/L
c(Na2S2O3)=0.100mol/L请问上式中Na和Na2是怎么一回事呀,还有1/2NaS2O3和Na2S2O3究竟是怎么区别的,我需要一个正确的解释。 wangfengaas1年前1
wangfengaas1年前1 -
 zzoung 共回答了25个问题
zzoung 共回答了25个问题 |采纳率92%不同.C(1/2NaS2O3)=1/2C(NaS2O3).前者加每升溶液加入26克硫代硫酸钠.后者加入52克硫代硫酸钠每升溶液.1年前查看全部
- 实验室里需要480mL 0.100mol/L的CuSO4溶液,先选取500mL容量瓶进行配置,以下操作正确的是
实验室里需要480mL 0.100mol/L的CuSO4溶液,先选取500mL容量瓶进行配置,以下操作正确的是
A.称取7.68gCuSO4,加入50mL水
B.称取12.0g胆矾,配成500mL溶液
C.称取8.0gCuSO4,配成500mL溶液
D.称取12.5g胆矾,配成500mL溶液
麻烦把每个答案为什么错 应该怎么改说一下 长发鱼1年前2
长发鱼1年前2 -
 小山888 共回答了14个问题
小山888 共回答了14个问题 |采纳率100%先要配置500mL 0.100mol/L的CuSO4溶液,然后从中取480ml.因此需要0.05molCu元素
如果用CuSO4,则需要0.05molCuSO4,即8g
如果用CuSO4.5H2O,则需要0.05molCuSO4.5H2O,即12.5g
所以可以排除AB选项.
由于是双项选择题,所以就选CD了1年前查看全部
- 常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.10
常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.100mol/L醋酸溶液,得到如图2
常温下,用0.100mol/L NaOH溶液分别滴定20.00mL 0.100mol/LHCl和20.00mL 0.100mol/L醋酸溶液,得到如图2条滴定曲线,以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图1
B.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0mL<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
 话是不可以乱说的1年前1
话是不可以乱说的1年前1 -
 行走在xx 共回答了10个问题
行走在xx 共回答了10个问题 |采纳率90%A、滴定开始时0.1000mol/L盐酸pH=1,而0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A正确;
B、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),则两溶液中离子浓度均为 c(Na+)=c(A-),故B正确;
C、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故C错误;
D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误;
故选AB.1年前查看全部
- 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如下表格:
试填空:时间/s
浓度mol•L-10 20 40 60 80 100 c(N2O4)mol•L-1 0.100 c1 0.050 c3 a b c(NO2)/mol•L-1 0.000 0.060 c2 0.120 0.120 0.120
(1)达到平衡时N2O4的转化率为______%.
(2)20s的四氧化二氮的浓度c1=______mol•L-1,在0s~20s内四氧化二氮的平均反应速率为______mol•(L•s)-1;. surewheel1年前1
surewheel1年前1 -
 奶_瓶 共回答了22个问题
奶_瓶 共回答了22个问题 |采纳率86.4%解题思路:(1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;60s后反应达平衡,反应混合物各组分的浓度不变;
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);根据v=[△c/△t]计算v(N2O4).(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4⇌2 NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N2O4的转化率为[0.06mol/L/0.10mol/L]×100%=60%,
故答案为:60;
(2)由表可知,20s时,c(NO2 )=0.060mol/L,所以
N2O4⇌2 NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)[0.03mol/L/20s]═0.0015mol•(L•s)-1,
故答案为:0.07;0.0015.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算应用,主要是平衡转化率、反应速率概念的计算应用,难度中等,注意基础知识的积累掌握.1年前查看全部
- 配制 250mL 0.100mol/L的铬酸溶液 如何计算要称取铬多少克?还有计算公式也公式一下谢谢
 askingasking1年前1
askingasking1年前1 -
 jade12003 共回答了22个问题
jade12003 共回答了22个问题 |采纳率81.8%m(H2CrO4)=0.25*0.1*M(H2CrO4)1年前查看全部
- 配制KI(0.100mol·L-1)–I2的水溶液,用0.100mol·L-1 Na2S2O3标准溶液测得c(I2)=4
配制KI(0.100mol·L-1)–I2的水溶液,用0.100mol·L-1 Na2S2O3标准溶液测得c(I2)=4.85×10-3 mol·L-1.量取50.0mL KI-I2溶液和50.0mL CCl4置于分液漏斗中振荡达平衡,分液后测知CCl4相中c(I2)=2.60×10-3 mol·L-1.已知实验温度下CCl4从水溶液中萃取I2的分配比为85 :1.求水溶液中I2+I¯=I¯3的平衡常数
设萃取平衡时,水溶液中c(I2)为x c(I2,CCl4)/c(I2,H2O)=2.60x10-3 mol·L-1/x=85
x=2.60x10-3 mol·L-1/85=3.06×10-5 mol·L-1 (2分)
水溶液中 I2 +I¯ = I3¯
平衡浓度(mol·L-1):
I2:3.06×10-5 ; I¯ :0.100-2.22×10-3=0.098 (1分) (1分)
I¯3:(4.85-2.60)×10-3-3.06×10-5=2.22×10-3 (1分)
K=2.22×10-3 mol·L-1/(0.098 mol·L-1×3.06×10-5 mol·L-1)=7.4×102 L·mol-1(不写单位不扣分)(1分)
我看不懂 I- :0.100-2.22×10-3=0.098这里为什么只减i2的浓度,水相里不应该还有i3-么,同样道理I-3:(4.85-2.60)×10-3-3.06×10-5=2.22×10-3 这里只减了ccl4和水里i2的浓度,没有减去i-的浓度 坚持到明天1年前2
坚持到明天1年前2 -
 rivaldo118 共回答了19个问题
rivaldo118 共回答了19个问题 |采纳率84.2%06年初赛题啊~
是这样,你的思考方法是有问题的,I2和I-是分别与I3-发生关系的.可以看这样一个式子:
I2 + I- = I3-
起始 C11 C12 0
平衡 C21-X C12-X X
转化 略 X X (略=C11-C21+X)
K=[X]/[C12-X][C21-X],
C21-X=2.60x10-3 mol·L-1/85=3.06×10-5 mol·L-1,
而损失的I2的量就是转化为I3-的量(由反应式,I2只会转化为I3-,且变化量是1:1,所以损失掉的I2都转化为了I3-【水中的和CCl4中的I2和与原始浓度的差】),即 (4.85-2.60)×10-3-3.06×10-5(I2与I3-的转化是1:1的关系,I2的减少量就是I3-的增
加量)
同样,I-与I2的转化也是1:1的关系,也就是说I3-的增量就是I-的减量,则C12-X= 0.100-2.22×10-3=0.098
你所说的“这里只减了ccl4和水里i2的浓度,没有减去i-的浓度”是你想错了,I2与I-不是互相转化的,虽然它们的减量总是相等
,但他们的减量是直接与I3-相关的,因为他们均与I3-保持1:1的转化比,即每生成1MOL I3-就用掉1MOL I2,1MOL I-.
我觉得你对平衡常数的理解可能有偏差,物料守恒确实是基础,但是更重要的是搞清楚变化之间的关系.建议看看无机化学上吧.
我们老师下午讲这道题的时候我就没听,但看几眼就明白了.初赛的分析题都是很简单的,基本上就是基础知识的运用,没有什么复杂的运算.所以要打好基础.
还有,这道题本身有问题,应该是“分配系数”,不是“分配比”(答案是按照分配系数给的)
我希望我说清楚了,没说清楚的话发PM1年前查看全部
- (9分)实验室用Na 2 SO 4 ·10H 2 O配制500ml,0.100mol/L的Na 2 SO 4 溶液
(9分)实验室用Na 2 SO 4 ·10H 2 O配制500ml,0.100mol/L的Na 2 SO 4 溶液
(1)所需主要仪器为:药匙、托盘天平、烧杯、胶头滴管、 、 。
(2)本实验须称量硫酸钠晶体(Na 2 SO 4 ·10H 2 O)为 g。
(3)用Na 2 SO 4 ·10H 2 O 配制标准溶液的正确顺序是 。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不变”)A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.移液
①没有洗涤烧杯和玻璃棒。 。
②定容时俯视容量瓶的刻度线。 。 dxh821年前1
dxh821年前1 -
 hans7062 共回答了15个问题
hans7062 共回答了15个问题 |采纳率100%(1)500mL容量瓶(2分)玻璃棒(1分)(2) 16.1 (2分)
(3)B E A G C D F(2分)(4)①偏低② 偏高(各1分)
略1年前查看全部
- 在100℃时,将0.100mol的四氧化二氮气体充入1L抽空的密闭容器中.隔一定时间对该容器内的物质浓度进行分析得到如下
在100℃时,将0.100mol的四氧化二氮气体充入1L抽空的密闭容器中.隔一定时间对该容器内的物质浓度进行分析得到如下表数据:
时间(S) 0 20 40 60 80
c(N2O4)/mol/L 0.100 a 0.050 c d
c(NO2)/mol/L 0.000 0.06 b 0.120 0.120
(1).20s时N2o4浓度a=( ) ;在0-20s内N2O4的平均反应速率为( );
表中b()c()d (填>.<.= )
(2.)该反应到达平衡时N2O4的转化率为( ) 平衡时容器内压强与开始时压强之比是() 衔杯袒腹1年前2
衔杯袒腹1年前2 -
 ay2137 共回答了23个问题
ay2137 共回答了23个问题 |采纳率82.6%一个N2O4可逆变成两个NO2,20S时产生NO2 0.06mol/l,
因此消耗N2O4 0.03mol/l.还剩0.07mol/l.即a=0.07,同理b=0.1,c=d=0.04.
然后根据各个问的定义进行计算即可.1年前查看全部
- 在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
在100℃时,将0.100mol的N2O4气体充入1L抽空的密闭容器中,隔一定时间对该容器内的物质进行分析,得到如表格:
试填空:时间/s
浓度mol•L-10 20 40 60 80 100 c(N2O4)mol•L-1 0.100 c1 0.050 c3 a b c(NO2)/mol•L-1 0.000 0.060 c2 0.120 0.120 0.120
(1)达到平衡时N2O4的转化率为______%,表中c2______c3,a______b (选填“>”“<”“=”).
(2)20s的四氧化二氮的浓度c1=______mol•L-1,在0s~20s内四氧化二氮的平均反应速率为______mol•(L•s)-1.
(3)若在相同情况下最初向该容器充入的是二氧化氮气体要达到上述同样的平衡状态,二氧化氮的起始浓度是______mol•L-1. yueliang5201年前1
yueliang5201年前1 -
 杨念 共回答了22个问题
杨念 共回答了22个问题 |采纳率90.9%解题思路:(1)由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),根据转化率计算平衡时N2O4的转化率;
根据方程式计算,计算c2、c3,据此解答;
60s后反应达平衡,反应混合物各组分的浓度不变.
(2)由△c(NO2),根据方程式计算△c(N2O4),20s的四氧化二氮的浓度=起始浓度-△c(N2O4);
根据v=[△c/△t]计算v(N2O4).
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.(1)由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4⇌2 NO2,
浓度变化:0.06mol/L 0.120mol/L
所以平衡时N2O4的转化率为[0.06mol/L/0.1mol/L]×100%=60%;
c3=0.1mol/L-0.06mol/L=0.04mol/L,
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4⇌2 NO2,
浓度变化:(0.1-0.05)mol/L 0.10mol/L
所以c2=0.10mol/L
所以c2>c3;
60s后反应达平衡,反应混合物各组分的浓度不变,所以a=b.
故答案为:60;>;=
(2)由表可知,20s时,c(NO2)=0.060mol/L,所以
N2O4⇌2 NO2,
浓度变化:0.03mol/L 0.060mol/L
所以20s的四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;
在0s~20s内四氧化二氮的平均反应速率为v(N2O4)=[0.03mol/L/20s]=0.0015mol•(L•s)-1.
故答案为:0.07mol/L;0.0015mol•(L•s)-1.
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边,满足c(N2O4)为0.100mol/L.
所以 N2O4⇌2 NO2,
0.1mol/L 0.20mol/L
故答案为:0.20mol/L点评:
本题考点: 化学平衡的计算.
考点点评: 考查化学平衡的有关计算、等效平衡等,难度中等,注意基础知识的积累掌握.1年前查看全部
大家在问
- 1人体中铁元素是二价的还是三价的?
- 2一灯泡标有“220v 100w”当把该灯接入380v后正常工作,应接多大的电阻
- 3He is not kind of the person that----in the comdey.In life,b
- 4酸碱盐溶液里溶质的粒子是离子 可是不是说酸是分子晶体的吗
- 5勤能补拙是良训 一分辛苦一分才 急~~~~~~
- 6A南违23.5度东经180度,B南纬20度东经170度,A、B两点哪点先看到日出
- 7快慢车同时从两地相对开出,快车每小时行65km,慢车每小时行60km,经过8小时两车相遇,两地相距多少千米?
- 8写作文头脑空白不知写什么写作文的时候不知道写什么.找不到事例,书上说要多观察生活,可是我觉得每天没什么不一样啊.也不知道
- 9勾股定理计算在等腰直角三角形ABC中,角C=90度,BC=a,AC=b,AB=c.(1)已知a=b,c=4,求a; (2
- 10九年级下册人教版、9 10 11 单元预习笔记
- 11过故人庄的题目译文
- 12星期天,小明和小华到省图书馆查阅资料.他们早上8点20分出发,在路上看到了一位盲人老爷爷,两人就把老爷爷送回了家,这是一
- 13His hard work_____his great success A.led to B.lead to C.led
- 14here is the photo( )my family.选择:in,on,for,of,under,between,
- 15求证:有一组对边平行,和一组对角相等的四边形是平行四边形.(请画出图形,写出已知、求证并证明)
