将1mol X和1mol Y充入1L密闭容器中发生反应:X(g)+3Y(g)⇌2Z(g)+a
 X二愣子2022-10-04 11:39:541条回答
X二愣子2022-10-04 11:39:541条回答A.平衡时X的浓度为0.2 mol/L
B.a的值为2
C.Y的转化率为60%
D.反应速率v(Y)=0.3 mol/(L•min)

已提交,审核后显示!提交回复
共1条回复
 eduok01 共回答了23个问题
eduok01 共回答了23个问题 |采纳率73.9%- 解题思路:A.根据n=cV计算生成的Q的物质的量,再根据物质的量之比等于化学计量数之比计算a的值;
B.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的X的物质的量,进而计算平衡时X的物质的量,再根据c=[n/V]计算;
C.根据生成的n(Z),利用物质的量之比等于化学计量数之比计算参加反应的Y的物质的量,再根据转化率定义计算;
D.根据v=
计算v(Y).△n V △t A.平衡时生成0.4molZ,则参加反应的X的物质的量为0.4mol×[1/2]=0.2mol,故平衡时X的物质的量为1mol-0.2mol=0.8mol,平衡时X的浓度为[0.8mol/1L]=0.8mol/L,故A错误;
B.平衡时生成0.4mol Z,测得Q的浓度为0.4mol•L-1,则生成的n(Q)=0.4mol•L-1×1L=0.4mol,所以2:a=0.4mol:0.4mol,解得a=2,故B正确;
C.平衡时生成0.4molZ,则参加反应的Y的物质的量为0.4mol×[3/2]=0.6mol,故Y的转化率为[0.6mol/1mol]×100%=60%,故C正确;
D.反应速率v(Y)=
0.6mol
1L
2min=0.3mol/(L•min),故D正确;
故选A.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的有关计算,难度不大,注意对基础知识的理解掌握. - 1年前
相关推荐
- 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g
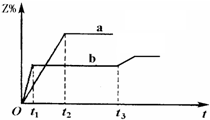 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t3时刻改变了某一实验条件.相关判断正确的是( )
A.曲线a是500℃时的图象
B.正反应是吸热反应
C.t3时刻可能是升高了温度
D.t3时刻可能是减小了压强 上海YY1年前1
上海YY1年前1 -
 海燕佳 共回答了15个问题
海燕佳 共回答了15个问题 |采纳率86.7%解题思路:根据图象判断,b曲线先到达平衡,反应速率大,温度较高,而温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应放热;
t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,据此结合温度、压强对平衡影响进行解答.A、图象判断,b曲线先到达平衡,反应速率大,说明b曲线的反应温度高,应是500℃时的图象,故A错误;
B、温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应是放热反应,故B错误;
C、t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是放热反应,可能为降低温度,不可能是升高温度,故C错误;
D、t3时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是气体体积增大的反应,减小压强,平衡向正反应移动,故可能是减小了压强,故D正确;
故选D.点评:
本题考点: 物质的量或浓度随时间的变化曲线;化学平衡的影响因素.
考点点评: 本题考查化学平衡图象题,难度中等,根据到达平衡的时间判断不同温度下的曲线是解题的关键.1年前查看全部
- 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A.若增大压强,则物质Y的转化率减小
B.将容器体积变为20 L,Z的平衡浓度变为原来的[1/2]
C.以X的浓度变化表示的反应速率为0.001 mol/(L•s)
D.若升高温度,X的体积分数增大,则该反应的△H>0 小天天-小浅1年前1
小天天-小浅1年前1 -
 lb196411 共回答了19个问题
lb196411 共回答了19个问题 |采纳率89.5%解题思路:A、正反应气体体积减小,增大压强平衡正向进行;
B、将容器体积变为20L,依据增大一倍,浓度减小一半,压强减小平衡逆向进行;
C、反应速率v=[△c/△t]计算分析;
D、升温平衡向吸热反应方向进行.依据化学平衡三段式可知,
2X(g)+Y(g)=Z(g)
起始量(mol) 1 1 0
变化量(mol) 0.6 0.3 0.3
平衡量(mol) 0.4 0.7 0.3
A、正反应气体体积减小,增大压强平衡正向进行,物质Y的转化率增大,故A错误;
B、将容器体积变为20L,依据增大一倍,浓度减小一半,压强减小平衡逆向进行,Z的平衡浓度小于原来的[1/2],故B错误;
C、X浓度变化表示的反应速率v=[△c/△t]=
0.6mol
10L
60s=0.001mol/(L•S),故C正确;
D、升温平衡向吸热反应方向进行,若升高温度,X的体积分数增大,说明平衡逆向进行,正反应为放热反应,则该反应的△H<0,故D错误;
故选C.点评:
本题考点: 化学平衡的影响因素.
考点点评: 本题考查了化学平衡计算分析,主要是影响平衡因素的分析判断,化学反应速率计算应用,掌握基础是关键,题目较简单.1年前查看全部
- 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A. 以X浓度变化表示的反应速率为0.001mol/(L•s)
B. 将容器体积变为20L,Z的平衡浓度变为原来的[1/2]
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则正反应的△H>0 weimin76781年前1
weimin76781年前1 -
 tyzlm 共回答了19个问题
tyzlm 共回答了19个问题 |采纳率89.5%解题思路:A、根据化学反应速率之比等于化学质量数之比计算反应速率;
B、体积变为20L,体系的压强减小,平衡向逆反应方向移动;
C、增大压强平衡向正反应方向移动,反应物Y的转化率增大;
D、根据升高温度平衡向逆反应方向移动判断反应热.A、经60s达到平衡,生成0.3molZ,则Z的反应速率等于v(Z)=
0.3mol
10L
60s=0.0005mol/(L•s),根据化学反应速率之比等于化学质量数之比,由方程式可知,v(X)=2v(Z)=2×0.0005mol/(L•s)=0.00lmol/(L•s),故A正确;
B、反应前后气体的化学计量数之和不相等,体积变为20L,体系的压强减小,平衡向逆反应方向移动,Z的平衡浓度小于原来的[1/2],故B错误;
C、增大压强平衡向正反应方向移动,反应物Y的转化率增大,故C错误;
D、升高温度,X的体积分数增大,说明升高温度平衡向逆反应方向移动,则正反应的△H<0,故D错误.
故选A.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡问题,题目难度不大,本题注意外界条件对化学平衡的影响,根据化学反应速率之比等于化学质量数之比计算反应速率.1年前查看全部
- 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应: 2X (g)+Y (g) Z(g),经30s
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应: 2X (g)+Y (g)  Z(g),经30s达到平衡,生成0.3mol Z。下列说法正确的是 [ ]
Z(g),经30s达到平衡,生成0.3mol Z。下列说法正确的是 [ ]A.以X浓度变化表示的反应速率为0.02mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数减小,则该反应的△H>0 庹庹芳1年前1
庹庹芳1年前1 -
 hjkl741 共回答了25个问题
hjkl741 共回答了25个问题 |采纳率92%D1年前查看全部
- 一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应2X(g)+Y(g)⇌Z(
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.达到平衡时X浓度为0.04 mol/L
B.将容器体积变为20 L,Z的平衡浓度变为0.015mol/L
C.若增大压强,平衡向正方向移动,平衡常数变大
D.若升高温度,X的体积分数增大,则该反应的△H>0 巡回1年前1
巡回1年前1 -
 芬迪2006 共回答了17个问题
芬迪2006 共回答了17个问题 |采纳率82.4%解题思路:A、根据生成的Z的量求出转化的X的量,再求出平衡时X的浓度;
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、平衡常数只随温度的变化而变化;
D、升高温度化学平衡向吸热的方向移动.A、经60s达到平衡,生成0.3mol Z,则消耗的X为0.6mol,所以达到平衡时X浓度为
(1−0.6)mol
10L=0.04 mol/L,故A正确;
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的 [1/2],但是压强减小时,平衡向左移动,Z浓度小于原来的 [1/2],即Z的平衡浓度小于0.015mol/L,故B错误;
C、平衡常数只随温度的变化而变化,所以若增大压强,则平衡常数不变,故C错误;
D、若升高温度,X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故D错误.
故选:A.点评:
本题考点: 化学平衡建立的过程;化学平衡的影响因素.
考点点评: 本题主要考查化学平衡移动的影响因素,根据反应物浓度、压强、温度等因素对平衡移动的影响,可以做出准确的判断,题目难度中等.1年前查看全部
- 一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g),经60s达到
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L•s)
B.将容器体积变为20L,Z的平衡浓度变为原来的[1/2]
C.若升高温度Y的转化率减小,则正反应为吸热反应
D.达到平衡时,X与Y 的浓度相等 kennethchan1年前1
kennethchan1年前1 -
 32614715 共回答了17个问题
32614715 共回答了17个问题 |采纳率88.2%解题思路:2X(g)+Y(g)⇌Z(g),
开始1mol1mol 0
转化0.6mol0.3mol 0.3mol
平衡0.4mol0.7mol 0.3mol
结合反应速率的计算及平衡移动的影响因素来解答.2X(g)+Y(g)⇌Z(g),
开始1mol1mol 0
转化0.6mol0.3mol 0.3mol
平衡0.4mol0.7mol 0.3mol
A.以X浓度变化表示的反应速率为
0.6mol
10L
60s=0.001mol/(L•s),故A正确;
B.将容器体积变为20L,压强减小,平衡逆向移动,则Z的平衡浓度小于原来的[1/2],故B错误;
C.若升高温度Y的转化率减小,则升高温度,平衡逆向移动,故C错误;
D.达到平衡时,X的浓度为0.04mol/L,Y的浓度为0.07mol/L,二者不相等,故D错误;
故选A.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,明确化学平衡的三段法计算及影响平衡的因素即可解答,题目难度中等.1年前查看全部
- 在一定温度下向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应X(g)
在一定温度下向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应X(g)+Y(g)⇌2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:1:2
D.单位时间内消耗0.1 mol X同时生成0.2 mol Z 芊芊文1年前1
芊芊文1年前1 -
 厦门贝壳 共回答了17个问题
厦门贝壳 共回答了17个问题 |采纳率94.1%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.A、反应前后气体体积不变,恒温恒容容器中,压强始终不变,所以压强不变不能作为平衡标志,故A错误;
B、各物质的浓度不变,说明正逆反应速率相等,反应达到平衡状态,故B正确;
C、平衡时各物质的浓度之比决定于开始加入反应物的多少及转化率有关,与是否平衡无关,故C错误;
D、消耗X生成Z都是指正反应速率,无法判断正逆反应速率相等,故D错误;
故选B.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等.1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g) 不能说明该反应已达到平衡的标志是( )
A. 容器内X、Y、Z的物质的量浓度之比为1:2:2
B. 容器内各物质的物质的量浓度不随时间变化
C. 容器内气体的压强不随时间变化
D. 单位时间内消耗0.1mol X同时消耗0.2mol Z rl_11101年前1
rl_11101年前1 -
 gong_yue 共回答了13个问题
gong_yue 共回答了13个问题 |采纳率100%解题思路:可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答,A.反应达到平衡时各物质的浓度与反应的初始物质的量以及反应的转化程度有关,所以不能确定是否达到平衡,故A错误;
B.容器内各物质的物质的量浓度不随时间变化,说明到达平衡,故B正确;
C.反应前后气体的体积不等,当达到平衡状态时,压强不变,故C正确;
D.单位时间消耗0.1molX同时消耗0.2molZ,说明反应v正(X)=2v逆(Y),说明达平衡,故D正确;
故选A.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意理解平衡状态的本质与判断依据.1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g).此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1 mol X的同时生成0.2 mol Z 日出dong方亮1年前1
日出dong方亮1年前1 -
 IKEA_BB 共回答了16个问题
IKEA_BB 共回答了16个问题 |采纳率93.8%解题思路:由X(g)+2Y(g)⇌2Z(g)可知,该反应前后的化学计量数之和不等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.A、反应达平衡时,各物质的浓度不再随时间改变,所以压强不再变化,故A正确;
B.当容器内各物质的浓度不随时间变化时,该反应达到平衡状态,故B正确;
C.当容器内X、Y、Z的浓度之比为1:2:2时,该反应可能达到平衡状态也可能没有达到平衡状态,与反应初始浓度和转化率有关,故C错误;
D.无论该反应是否达到平衡状态,只要单位时间消耗0.1 mol X的同时就生成0.2 molZ,所以不能判断该反应达到平衡状态,故D错误;
故选AB.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查化学平衡状态的判断,明确只有“反应前后能改变的物理量”才能作为判断依据,难度中等.1年前查看全部
- (8分)如下图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时A、B的体积均为a
(8分)如下图所示,向A中充入1mol X和1mol Y,向B中充入2mol X和2mol Y,起始时A、B的体积均为a L,在相同温度和有催化剂条件下,两容器中各自发生反应:
X(g)+Y(g) ⇌2Z(g)+W(g)(正反应为放热反应)达到平衡时A容器的体积为1.2a L。
(1) A中X的转化率α A =
(2) A、B中X的转化率α A α B (填 >、< 或 = )
(3) 打开K,一段时间又达到平衡时A的体积为 L(连通管中气体体积忽略不计)
(4) 在(3)达到平衡后,同时等幅升高A、B的温度,达到新平衡后,A的体积 (填变大、变小或不变) piaoyi10001年前1
piaoyi10001年前1 -
 玉马行空 共回答了17个问题
玉马行空 共回答了17个问题 |采纳率76.5%(1)40%(2)> (3)2.6a L (4)变小
(1)X(g)+Y(g) ⇌2Z(g)+W(g)
起始量(mol) 1 1 0 0
转化量(mol)x x 2x x
平衡量(mol) 1-x 1-x 2x x
因为体积之比是物质的量之比
所以
解得x=0.4
即转化率是40%
(2)A保持恒压,B保持恒容。正反应是体积增大的反应,压强大转化率低。在反应过程中B中的压强大于A中的。所以A中的转化率大于B中的转化率。
(3)打开之后相当于保持恒压,因此平衡和A是等效的,即转化率是相同的。则平衡时的总体积是1.2aL×3=3.6aL,所以A的体积为3.6aL-aL=2.6aL。
(4)反应是放热反应,升高温度,平衡向逆反应方向移动,体积减小。1年前查看全部
- (2014•安徽一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(
 (2014•安徽一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(g)+Y(g)⇌mZ(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
(2014•安徽一模)一定温度下,将1mol X和1mol Y气体充入2L恒容密闭容器,发生反应X(g)+Y(g)⇌mZ(g)+Q(s),t1时达到平衡.在t2、t3时刻分别改变反应的一个条件,测得容器中气体Z的浓度随时间变化如图所示.下列说法正确的是( )
A.反应方程式中的m=1
B.t2时刻改变的条件是使用催化剂
C.t3时刻改变的条件是移去少量物质Q
D.t1~t3间该反应的平衡常数均为4 meidengke1年前1
meidengke1年前1 -
 cheesegirl123 共回答了22个问题
cheesegirl123 共回答了22个问题 |采纳率77.3%解题思路:A、由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,反应前后气体的化学计量数之和相等,据此解答;
B、催化剂不能影响物质的浓度;
C、Q是固体,改变Q的用量,不影响平衡移动,t3时刻改变的条件,瞬间Z的浓度不变,平衡向正反应移动,可能是增大反应物的浓度或升高温度;
D、t1~t3间温度相同,利用三段式计算t1平衡时各物质的浓度,代入平衡常数表达式计算.A、由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,反应前后气体的化学计量数之和相等,故m=1+1=2,故A错误;
B、催化剂不能影响物质的浓度,由图可知,t2时刻Z的浓度增大,但平衡不移动,故改变的条件应是增大压强,故B错误;
C、Q是固体,改变Q的用量,不影响平衡移动,t3时刻改变的条件,瞬间Z的浓度不变,平衡向正反应移动,可能是增大反应物的浓度或升高温度,故C错误;
D、t1~t3间温度相同,由图可知t1时刻平衡时,c(Z)=0.5mol/L,则:
X(g)+Y(g)⇌2Z(g)+Q(s),
开始(mol/L):0.50.5 0
变化(mol/L):0.25 0.25 0.5
平衡(mol/L):0.25 0.25 0.5
故平衡常数为[0.5×0.5/0.25×0.25]=4,故D正确;
故选D.点评:
本题考点: 物质的量或浓度随时间的变化曲线.
考点点评: 本题考查化学平衡有关计算、化学平衡图象等,难度中等,判断t2时刻改变条件是关键,注意C选项中升高温度不一定向正反应移动.1年前查看全部
- 在一容积可变的密闭容器中,通入1mol X和3mol Y,在一定条件下发生如下反应 X (g) + 3 Y (g) 生成
在一容积可变的密闭容器中,通入1mol X和3mol Y,在一定条件下发生如下反应 X (g) + 3 Y (g) 生成2 Z (g),到达平衡后,Y的转化率为a %,然后再向容器中通入2 molZ,保持在恒温恒压下反应,当达到新的平衡时,Y的转化率为b %.则a与b的关系是什么?
答案是a=b 若我把通入2molZ改为通入1molZ,那么结果还是一样吗?若我把容积可变改为容积不变,那么A、B浓度增大,体积分数减小.C的浓度增大,体积分数增大,请问为什么A.B体积分数会减小?C的体积分数会增大? nbba83751年前1
nbba83751年前1 -
 简体中文版本 共回答了17个问题
简体中文版本 共回答了17个问题 |采纳率94.1%你需要牢记这一条:所谓可逆反应,只是对于某化学反应的一种主观约定而已,x + 3y ←→ 2z 和2z ←→ x + 3y其实描述的是完全相同的
笼统地描述一个可逆反应:
aA + bB ←→ cC + dD
对于这个反应,放入a mol A加b mol B 和放入c mol C 加d mol D,相同条件下平衡后,容器内气体各参数是完全一致的.
而就题目中的这个反应,由于是恒温恒压且正反应产物只有一种,那么正反应反应物只要物质的量之比为1:3,那么无论放入多少摩尔z ,其最终各气体转化率都是一样的,因为加入的z 等于是在前者平衡后,另开的一个小灶而已,二者反应平衡系数完全一致,那么平衡率自然是一致的了.
对于你的几个问题:
1、“若把通入2molZ改为通入1molZ” 这个问题前面已经给你回答了,在恒温恒压下,无论你改为10mol 100mol还是10000mol都是完全一样的.
2、“如果将容器改为恒容” 若你增大X 浓度,X 转化率减小,Y转化率增大(增大压强,平衡固然是正向移动,但是是大付出,小回报,所以X转化率减小,而Y沾光转化率增大)对于体积分数,就恰好相反了,X体积分数增大,Y、Z体积分数减小(X高付出低回报,所以其体积分数增大,相对的,其他气体体积分数也就降低了)
这是单纯地增大X,单纯地增大Y,同样的道理,结果反之
如果是同时增大X和Y,再讨论其体积分数和浓度就完全没有意义了,加入X、Y,平衡固然是正向移动,但是如果加入的X、Y物质的量之比远远超过或低于1:3,那谁的体积分数增大还是减小就说不定了.
举个极端离子:加入1mol X 10000mol Y,平衡正向移动,X转化率提高了,但是体积分数却极大地降低了.或者10000mol X 和1mol Y,这个体积分数的结论又相反了.
在这里体积分数和转化率都无法断定是增大还是减小.1年前查看全部
- XYZ三种元素的原子具有相同的电子层数,而Y的核电荷数比X大2,Z的质子数比Y多4,1mol X的单质与足量酸起反
XYZ三种元素的原子具有相同的电子层数,而Y的核电荷数比X大2,Z的质子数比Y多4,1mol X的单质与足量酸起反
置换出1g氢气,这是X转化为和氖原子有相同的电子层结构的例子,根据上述条件推测:X是___.Y是___.Z是__. 杨的1年前3
杨的1年前3 -
 阿狄丽娜87 共回答了23个问题
阿狄丽娜87 共回答了23个问题 |采纳率82.6%1mol X的单质与足量酸起反置换出1g氢气,该金属为+1价,X转化为和氖原子有相同的电子层结构的离子,所以是Na;Y为Al,z为Cl1年前查看全部
- 在一定温度下,向a L体积固定的密闭容器中加入1mol X气体和2mol Y气体,发生如下
在一定温度下,向a L体积固定的密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌3Z(g).下列说法不正确的是( )
A.容器内压强不随时间变化而变化
B.任一时刻,容器内各物质的浓度不可能相等
C.达到平衡时,单位时间内生成3n mol Z,同时生成 2n mol Y
D.X,Y的转化率不相等 ddwwdd1年前1
ddwwdd1年前1 -
 zbwddd 共回答了15个问题
zbwddd 共回答了15个问题 |采纳率100%解题思路:A、反应前后气体体积不变,一定温度,一定体积容器中的化学反应,压强始终不变;
B、反应起始量不同,反应到某时刻浓度不可能相同;
C、依据平衡标志是正逆反应速率相同分析判断;
D、起始量1:2和反应比相同,反应转化率相同.A、反应前后气体体积不变,一定温度,一定体积容器中的化学反应,压强不变;容器内压强不随时间变化而变化,故A正确;B、反应起始量不同,反应比是1:2,所以反应到某时刻浓度不可能相同,故C正确C、达到平衡时,单...
点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查了化学平衡的分析判断,转化率计算,平衡标志的分析,反应特征和影响因素是解题关键,题目难度中等.1年前查看全部
- 在一定温度下,向2L某恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g
在一定温度下,向2L某恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g)
在一定温度下,向2L某恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),5min时测得Z的物质的量为1.2mol,下列说法正确的是( )
A.此时Y的浓度为0.6mol/L
B.5min 内v(X)=0.06mol/(L?min)
C.容器内X、Y、Z的浓度之比为1:2:2,则该反应达到平衡状态
D.单位时间消耗0.1 molX同时生成0.2molZ,则该反应达到平衡状态
 浅海淡水鱼1年前1
浅海淡水鱼1年前1 -
 jcy0830 共回答了19个问题
jcy0830 共回答了19个问题 |采纳率94.7%在一定温度下,向2L某恒容密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),5min时测得Z的物质的量为1.2mol,依据化学平衡三段式列式;
X(g)+2Y(g)?2Z(g)
起始量(mol) 12 0
变化量(mol) 0.6 1.2 1.2
5min时(mol)0.4 0.8 1.2
A、Y的浓度=[0.8mol/2L]=0.4mol/L,故A错误;
B、5min 内v(X)=
0.6mol
2L
5min=0.06mol/(L?min),故B正确;
C、起始量和反应比相同,反应过程中和平衡状态下容器内X、Y、Z的浓度之比为1:2:2,不能判断反应达到平衡状态,故C错误;
D、单位时间消耗0.1 molX同时生成0.2molZ,说明反应正向进行,不能说明该反应达到平衡状态,故D错误;
故选B.1年前查看全部
- 一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g⇌Z(
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g⇌Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.若升高温度,X的体积分数增大,则正反应为吸热反应
B.将容器体积变为20 L,Z的平衡浓度变为原来的[1/2]
C.若增大压强,则物质Y的转化率减小
D.以X浓度变化表示的反应速率为0.001 mol/(L•s) kennethelectric1年前1
kennethelectric1年前1 -
 角落控 共回答了15个问题
角落控 共回答了15个问题 |采纳率93.3%解题思路:A、升高温度化学平衡向吸热的方向移动;
B、由于前后气体计量数之和不相等,容积增大,压强减小,化学平衡向逆反应方向移动;
C、增大压强平衡向气体体积减小的方向移动;
D、根据达到平衡时生成的0.3mol的Z,可以计算出Z的浓度,得出60s内Z的反应速率,再根据不同物质反应速率之比等于计量数之比,得出答案.A、X的体积分数增大,说明向逆反应方向移动,故逆反应吸热,则正反应方向为放热,故△H<0,故A错误;
B、容积增大为20L,压强减小为原来的一半,如果平衡不移动则Z浓度变为原来的[1/2],但是平衡向左移动,Z浓度小于原来的[1/2],故B错误;
C、增大压强,平衡向气体体积减小的正反应方向移动,Y的转化率增大,故C错误;
D、c(Z)=[0.3mol/10L]=0.03mol/L,所以v(Z)=[0.03mol/l/60s]=0.0005mol/(L•s),故v(X)=2v(Z)=0.001 mol•L-1•s-1,故D正确.
故选D.点评:
本题考点: 化学平衡的影响因素.
考点点评: 考查外界条件温度、浓度、压强对化学平衡的影响,要求学生能根据题目所给的各种条件改变,来判断化学平衡移动的方向,题目难度中等.1年前查看全部
- (2012•梧州模拟)1mol X气体和amol Y气体在体积可变的密闭容器中发生如下反应:X(g)
(2012•梧州模拟)1mol X气体和amol Y气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)⇌bZ(g) 反应达到平衡后,测得X的转化率为50%.且在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的[3/4],则a和b的数值可能是( )
①a=1,b=1②a=2,b=5③a=2,b=1④a=3,b=2.
A.①③
B.①④
C.②③
D.②④ ypjian1年前1
ypjian1年前1 -
 Erich 共回答了6个问题
Erich 共回答了6个问题 |采纳率83.3%解题思路:依据化学平衡三段式列式计算分析判断,密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到ab的取值;1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)⇌b Z(g).反应达到平衡后,测得X的转化率为50%.而且,在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到ab的取值;
X(g)+a Y(g)⇌b Z(g).
起始量(mol) 1 a 0
变化量(mol) 0,5 0.5a 0.5b
平衡量(mol) 0.5 0.5a 0.5b
依据在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比得到,在同温同压下测得反应前混合气体的密度是反应后混合气体密度的[3/4],即反应后气体物质的量是反应前气体物质的量[3/4],则得到;(0.5+0.5a+0.5b):(1+a)=3:4;
计算得到:2b=a+1;
依据选项中的取值分析判断,a=1,b=1,a=3,b=2符合计算关系,所以①④符合;
故选B.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算应用,混合气体密度之比在相同条件下和气体物质的量成反比是应用的主要计算依据,题目难度中等.1年前查看全部
- 一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)⇌2Z(g),经12s达到平
一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)⇌2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A. 以X浓度变化表示的反应速率为[1/8]mol(L•s)
B. 12s后将容器体积扩大为10L,Z的平衡浓度变为原来的[1/5]
C. 若增大X的浓度,则物质Y的转化率减小
D. 若该反应的△H<0,升高温度,平衡常数K减小 棋云郡主1年前1
棋云郡主1年前1 -
 风物长 共回答了25个问题
风物长 共回答了25个问题 |采纳率84%解题思路:依据化学平衡的三段式列式计算,依据化学平衡影响因素分析判断平衡移动的方向,平衡常数随温度变化分析回答.一定条件下,体积为2L的密闭容器中,1molX和3molY进行反应:X(g)+3Y(g)⇌2Z(g),经12s达到平衡,生成0.6molZ.依据化学平衡三段式列式计算为:
X(g)+3Y(g)⇌2Z(g)
起始量(mol) 1 3 0
变化量(mol) 0.30.9 0.6
平衡量(mol) 0.7 2.10.6
A、以X浓度变化表示的反应速率为
0.3mol
2L
12s=[1/80]mol(L•s),故A错误;
B、12s后将容器体积扩大为10L,体积变化Z的浓度变为原来的[1/5],为0.06mol/L,但减小压强平衡逆向进行,Z的平衡浓度小于0.06mol/L,故B错误;
C、若增大X的浓度,则物质Y的转化率增大,故C错误;
D、若该反应的△H<0,升高温度,平衡向吸热反应方向进行,平衡逆向进行,平衡常数K减小,故D正确;
故选D.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查了化学平衡影响因素的分析判断,平衡移动原理的应用,化学平衡的计算应用,题目难度中等.1年前查看全部
- 如图所示,当关闭K时,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,起始时,V(A)=V(
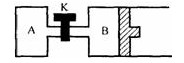
如图所示,当关闭K时,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,起始时,V(A)=V(B)=aL.在相同温度和催化剂存在的条件下,两容器中各自发生下列反应:2X(g)+2Y(g) ==3Z(g)+2W(g) (正反应是放热反应) ,达到平衡(Ⅰ)时,V(B)=1.2aL.请回答:
(1)B中X的转化率α(X)B为 ;
(2)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为 (用α的代数式表
示,连通管中气体体积不计).
...
 懒算输赢信手棋1年前2
懒算输赢信手棋1年前2 -
 缺一根筋的双刃剑 共回答了24个问题
缺一根筋的双刃剑 共回答了24个问题 |采纳率91.7%(1) 40% B中由aL到1.2aL多了0.2aL,反应2X(g)+2Y(g) ==3Z(g)+2W(g)可得反应掉4MOL气体便生成5MOL气体,增加1MOL,现增加0.1aL则反应了0.4aLX与Y有因为反应中X=Y所以X反应了0.2aL,原气体中X=Y=2MOL则 X占一半0.5aL 得 X的转换率=0.2/0.5=40%
(2)0.6aL 打开K则A会受到外界压强,B中4MOLX,Y为aL,A中2MOLX,Y就变为0.5aL因为(连通管中气体体积不计)所以B中有0.5aL进入A中,但是A中也有反应又因为相同温度和催化剂存在的条件下和同样压强下A中40%转化率变为0.6aL最终B体积为0.6aL1年前查看全部
- 在一定温度下,向体积恒定的密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g
在一定温度下,向体积恒定的密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内X、Y、Z的浓度之比为1:2:2
C.容器内气体的密度不变
D.单位时间消耗0.1mol X同时生成0.2mol Z 春日游1年前1
春日游1年前1 -
 tanggongjun 共回答了23个问题
tanggongjun 共回答了23个问题 |采纳率87%解题思路:可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.A、反应是前后压强变化的反应,容器内压强不随时间变化可以说明反应达到平衡,故A正确;
B、浓度之比等于化学方程式系数之比,起始量符合化学方程式的反应比,反应过程中始终为1:2;2,所以不能说明达平衡,故B错误;
C、容器内气体密度=[m/V],反应混合物都为气体,根据质量守恒,混合气体的总质量不变,体积为定值,密度自始至终不变,不能说明到达平衡状态,故C错误;
D、单位时间消耗0.1molX同时生成0.2molZ,说明反应v正(X)=2v正(Y),不能说明达平衡,故D错误;
故选A.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡的标志判断,正逆反应速率相同是理解的关键,题目难度中等.1年前查看全部
- 一定温度下,向 a L密闭容器中加入1mol X 气体和2mol Y&
一定温度下,向 a L密闭容器中加入1mol X 气体和2mol Y 气体,发生如下反应:X(g)+2Y(g)⇌3Z(g),此反应达到平衡的标志是( )
A.容器内压强不再随时间变化
B.容器内各物质浓度不再随时间变化
C.容器内气体密度不再随时间变化
D.单位时间内消耗0.1 mol X 的同时生成0.3 molZ 街头_浪子1年前1
街头_浪子1年前1 -
 傻瓜二独奏 共回答了24个问题
傻瓜二独奏 共回答了24个问题 |采纳率83.3%解题思路:由X(g)+2Y(g)⇌3Z(g)可知,该反应前后的化学计量数之和相等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.A、该反应前后的化学计量数之和相等,容器内的压强始终不随时间改变,所以压强不再变化,不能确定是否达到平衡,故A错误;B、反应达平衡时,各物质的浓度不再随时间改变,故B正确;C、反应混合物都为气体,根据质量...
点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查化学平衡状态的判断,题目难度不大,做题时注意分析化学方程式的前后计量数大小的关系.1年前查看全部
- 某温度下在容积为2L的密闭容器中,发生2X(g)+Y(g)⇌2W(g)的反应,当充入1mol X和1mol
某温度下在容积为2L的密闭容器中,发生2X(g)+Y(g)⇌2W(g)的反应,当充入1mol X和1mol Y,经20s达到平衡时生成了0.4mol W.下列说法正确的是( )
A.若升高温度,W的体积分数减小,则该反应△H<0
B.以Y的浓度变化表示的反应速率为0.01 mol/(L•s)
C.在其他条件不变的情况下,增加1 mol X,则X和Y的转化率均提高
D.增大压强正反应速率增大,逆反应速率减小,平衡向正反应方向移动 aswj_431年前1
aswj_431年前1 -
 jalen_cheung 共回答了19个问题
jalen_cheung 共回答了19个问题 |采纳率89.5%解题思路:A、升高温度化学平衡向着吸热方向进行;
B、根据公式v=[△c/△t]计算化学反应速率;
C、增加X的量,则X的转化率会减小;
D、增大压强,正逆反应速率都加快.A、升高温度化学平衡向着吸热方向进行,W的体积分数减小,反应逆向进行,所以逆反应方向是吸热的,该反应是放热反应,故A正确;
B、W的浓度变化表示的反应速率v=[△c/△t]=
0.4mol
2L
20s=0.01mol/(L•s),所以用Y表示的反应速率0.005 mol/(L•s),故B错误;
C、增加X的量,则X的转化率会减小,Y的转化率增大,故C错误;
D、增大压强,正逆反应速率都加快,平衡向气体系数和减小的方向进行,即向着正反应方向移动,故D错误.
故选:A.点评:
本题考点: 化学平衡的影响因素;反应速率的定量表示方法.
考点点评: 本题考查学生影响化学平衡移动、化学反应速率以及化学反应速率的计算等知识,根据所学知识来回答即可,难度不大.1年前查看全部
- 两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g
两体积相同的密闭容器中均充入1mol X和1mol Y,分别于300℃和500℃开始发生反应:X(g)+Y(g) 3Z(g).Z的含量(Z%)随时间t的变化如下图所示.已知在t 3 时刻改变了某一实验条件.相关判断正确的是( ) A.曲线a是500℃时的图象 B.正反应是吸热反应 C.t 3 时刻可能是升高了温度 D.t 3 时刻可能是减小了压强 
 开心就好灭1年前1
开心就好灭1年前1 -
 曾经拥有的 共回答了14个问题
曾经拥有的 共回答了14个问题 |采纳率100%A、图象判断,b曲线先到达平衡,反应速率大,说明b曲线的反应温度高,应是500℃时的图象,故A错误;
B、温度升高,Z%的数值减小,说明升高温度平衡向逆向移动,正反应是放热反应,故B错误;
C、t 3 时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是放热反应,可能为降低温度,不可能是升高温度,故C错误;
D、t 3 时刻时,改变条件,到达平衡时Z%的数值增大,说明平衡向正反应移动,该反应正反应是气体体积增大的反应,减小压强,平衡向正反应移动,故可能是减小了压强,故D正确;
故选D.1年前查看全部
- 一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g)△H
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g)△H<0,反应经60s达到平衡并生成0.3mol Z,则下列说法中正确的是( )
A.以Y浓度变化表示的反应速率为0.0005mol/(L•s)
B.其他条件不变,将容器体积扩大至20L,则Z的平衡浓度变为原来的[1/2]
C.其他条件不变,将容器体积缩小至5L,平衡正向移动,平衡常数增大
D.其他条件不变,升高温度逆反应速率加快,正反应速率减慢 qwertom09121年前1
qwertom09121年前1 -
 深蓝40 共回答了16个问题
深蓝40 共回答了16个问题 |采纳率87.5%解题思路:A.根据方程式计算参加反应Y的物质的量,再根据v=△nV△t计算v(Y);B.其他条件不变,将容器体积扩大至20L,压强降低,平衡向逆反应方向移动,平衡时Z的物质的量小于0.3mol,结合c=nV判断;C.化学平衡常数只受温度影响;D.升高温度,正、逆反应速率都增大.A.反应经60s达到平衡时生成0.3mol Z,根据方程式可知,参加反应的Y为0.3mol,故v(Y)=
0.3mol
10L
60s=0.0005mol/(L•s),故A正确;
B.其他条件不变,将容器体积扩大至20L,压强降低,平衡向逆反应方向移动,平衡时Z的物质的量小于0.3mol,体积变为原来的2倍,故平衡时浓度小于原平衡的[1/2],故B错误;
C.化学平衡常数只受温度影响,减小体积,压强增大,平衡向正反应方向移动,平衡常数不变,故C错误;
D.升高温度,正、逆反应速率都增大,但逆反应速率增大更多,平衡向逆反应方向移动,故D错误,
故选A.点评:
本题考点: 化学平衡的影响因素;化学平衡的计算.
考点点评: 本题考查反应速率计算、化学平衡影响因素、平衡常数等,难度中等,注意理解平衡移动原理.1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g) 2Z(g), 不能标志该反应达平衡状态的是( )
2Z(g), 不能标志该反应达平衡状态的是( )A.容器内压强不随时间变化 B.容器内各物质的浓度不随时间变化 C.容器内X、Y、Z的浓度之比为1︰2︰2 D.X的生成速率和Z的生成速率之比为1︰2  作者已逝1年前1
作者已逝1年前1 -
 gedty 共回答了30个问题
gedty 共回答了30个问题 |采纳率96.7%C
1年前查看全部
- 如图所示,B中活塞可以自由滑动。A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L。关闭K,相同
如图所示,B中活塞可以自由滑动。A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L。关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)
 Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。
Z(g)+2W(g) ΔH<0,达到平衡(Ⅰ)时,V(B)=0.8a L。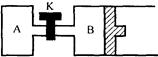
(1)达到平衡所需的时间:A B。(填“>”、“<”、或“=”,下同)
(2)W的百分含量:A B。
(3)B中X的转化率为 。
(4)打开K,重新达平衡(Ⅱ)时,B的体积为 L(用含a的式子表示,连通管体积忽略不计)。 glpm36121年前1
glpm36121年前1 -
 风之子gh 共回答了17个问题
风之子gh 共回答了17个问题 |采纳率82.4%(1)> ;
(2)< ;
(3)80%
(4)0.6a L
1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g)此反应达到平衡的标志是( )
A.X、Y、Z的速率之比为1:2:2
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1mol X同时消耗0.2mol Z 土豆外婆1年前1
土豆外婆1年前1 -
 lsbc 共回答了19个问题
lsbc 共回答了19个问题 |采纳率89.5%解题思路:根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.A、X、Y、Z的速率之比为1:2:2,未平衡时就是这个比值,故A错误;
B、容器内各物质的浓度不随时间变化,说明达平衡状态,故B正确;
C、当体系达平衡状态时,容器内X、Y、Z的浓度之比为1:2:2,与各物质的初始浓度及转化率有关,故C错误;
D、单位时间消耗0.1mol X等效于单位时间生成0.2mol Z,同时消耗0.2mol Z,正逆速率相等,故D正确;
故选BD.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌3Z(g)此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.容器内各物质的浓度不随时间变化
C.容器内X、Y、Z的浓度之比为1:2:3
D.单位时间消耗0.1 mol X同时生成0.3 mol Z bbbfish1年前1
bbbfish1年前1 -
 人生有爱就有痛 共回答了16个问题
人生有爱就有痛 共回答了16个问题 |采纳率81.3%解题思路:由X(g)+2Y(g)⇌3Z(g)可知,该反应前后的化学计量数之和相等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.A、该反应前后的化学计量数之和相等,容器内的压强始终不随时间改变,所以压强不再变化,不能确定是否达到平衡,故A错误;
B、反应达平衡时,各物质的浓度不再随时间改变,故B正确;
C、平衡时各物质的浓度之比决定于反应前加入的量和转化程度,与是否达到平衡状态无关,故C错误;
D、单位时间内消耗0.1 mol X 为正速率,同时生成0.3 molZ为正速率,都是正速率不能说明达到平衡状态,故D错误;
故选B.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查化学平衡状态的判断,题目难度不大,做题时注意分析化学方程式的前后计量数大小的关系.1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g).此反应达到平衡的标志是( )
A. 容器内压强不随时间变化
B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1:2:2
D. 单位时间消耗0.1 mol X的同时生成0.2 mol Z 33233101年前2
33233101年前2 -
 rkun 共回答了20个问题
rkun 共回答了20个问题 |采纳率70%解题思路:由X(g)+2Y(g)⇌2Z(g)可知,该反应前后的化学计量数之和不等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.A、反应达平衡时,各物质的浓度不再随时间改变,所以压强不再变化,故A正确;B.当容器内各物质的浓度不随时间变化时,该反应达到平衡状态,故B正确;C.当容器内X、Y、Z的浓度之比为1:2:2时,该反应可能达到平衡...
点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查化学平衡状态的判断,明确只有“反应前后能改变的物理量”才能作为判断依据,难度中等.1年前查看全部
- (2008•枣庄一模)一定条件下,在容积为10L的密闭容器中,1mol X和1mol Y进行如下反应:2X(g)+Y(g
(2008•枣庄一模)一定条件下,在容积为10L的密闭容器中,1mol X和1mol Y进行如下反应:2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3mol Z,下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L•s)
B.将容器容积变为20L,Z的平衡浓度为原来的[1/2]
C.若增大夺强,则正反应速率增大,逆反应速率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0 另类一族1年前1
另类一族1年前1 -
 haz981626 共回答了18个问题
haz981626 共回答了18个问题 |采纳率83.3%解题思路:A、依据化学反应速率的概念是单位时间内物质浓度的变化计算得到;
B、反应前后气体体积发生改变,增大体积是减小压强,平衡浓度由体积变化和平衡移动共同影响;
C、压强对反应速率的影响是正逆反应都增大,但增大程度不同;
D、依据化学平衡移动原理分析判断.A、1mol X和1mol Y进行如下反应:2X(g)+Y(g)⇌Z(g),经60s达到平衡,生成0.3mol Z,消耗X物质的量为0.6mol,X表示的反应速率=
0.6mol
10L
60s=0.001mol/(L•s),故A正确;
B、反应前后气体体积发生改变,将容器容积变为20L,压强减小,平衡逆向进行,Z的平衡浓度小于原来的[1/2],故B错误;
C、压强对反应速率的影响是正逆反应都增大,但增大程度不同,故C错误;
D、若升高温度,X的体积分数增大,反应逆向进行,逆向是吸热反应,所以正向反应是放热反应,则该反应的△H<0,故D错误;
故选A.点评:
本题考点: 化学平衡建立的过程.
考点点评: 本题考查化学反应速率计算、化学平衡的影响因素分析判断,掌握基础是关键,题目难度中等.1年前查看全部
- 1mol X跟a mol Y在体积可变的密闭容器中发生如下反应:X(g)+a Y
1mol X跟a mol Y在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)⇌b Z(g),反应达到平衡后,测得X的转化率为50%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的[3/4],则a和b的数值可能是( )
A. a=l,b=l
B. a=2,b=1
C. a=2,b=2
D. a=1,b=2 含羞草搞活的1年前2
含羞草搞活的1年前2 -
 xmanzb 共回答了21个问题
xmanzb 共回答了21个问题 |采纳率85.7%解题思路:依据化学平衡三段式列式计算分析判断,密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到ab的取值;1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g)+a Y(g)⇌b Z(g).反应达到平衡后,测得X的转化率为50%.而且,在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比,讨论分析判断得到ab的取值;
X(g)+a Y(g)⇌b Z(g).
起始量(mol) 1 a 0
变化量(mol) 0.5 0.5a 0.5b
平衡量(mol)0.5 0.5a 0.5b
依据在同温同压下反应前后混合气体的密度之比和气体体积成反比即和气体物质的量成反比得到,在同温同压下测得反应前混合气体的密度是反应后混合气体密度的[3/4],即反应后气体物质的量是反应前气体物质的量[3/4],则得到
(0.5+0.5a+0.5b)
(1+a)=[3/4];
计算得到:2b=a+1;
依据选项中的取值分析判断:a=1,b=1,符合计算关系,故选A.点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查了化学平衡的计算应用,混合气体密度之比在相同条件下和气体物质的量成反比是应用的主要计算依据.1年前查看全部
- 在n L密闭容器中,使1mol X和2mol Y在一定条件下反应:
在n L密闭容器中,使1mol X和2mol Y在一定条件下反应:
aX(g)+bY(g) cZ(g),达到平衡时,Y的转化率为20%,混合气体压强比原来下降20%,Z的浓度为Y的浓度的0.25倍,则a,c的值依次为
A.1,2 B.3,2 C.2,1 D.2,3
答案是b,求解析,谢谢了。
 gmmxd1年前1
gmmxd1年前1 -
 蓝调SANGBA 共回答了17个问题
蓝调SANGBA 共回答了17个问题 |采纳率100%试试用三段式解
x y = z
1 2 0 起始
(0.4/b)*a 0.4 0.4 转化了
1- (0.4/b)*a 1.6 0.4 平衡时
2*80%=1.6 1.6*1/4=0.4
显然b=c
混合气体压强比原来下降20%=体积减少为原来的4/5=mol数减少为原来的4/5,所以:(1-(0.4/b)*a+1.6+0.4)/(1+2)=4/5
解得a/b=3/2 所以a/b/c=3/2/2 所以原题中系数比为3/2/2 所以选b
实在不明白qq:5322760161年前查看全部
- 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g)(正反应为放热反
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)⇌Z(g)(正反应为放热反应),经60s达到平衡,生成0.3mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol(L•S)
B.若减少X的浓度,平衡将逆向移动
C.物质Y的转化率为70%
D.若升高温度,平衡将正向移动 trampbaby1年前1
trampbaby1年前1 -
 的乱码 共回答了14个问题
的乱码 共回答了14个问题 |采纳率100%解题思路:A、根据v=[△c/△t]计算v(Z),再根据速率之比等于化学计量数之比计算v(X);
B、根据勒夏特列原理分析;
C、先计算出参加反应的Y的物质的量,再利用转化率的定义计算Y的转化率;
D、升高温度平衡向吸热方向移动.A、v(Z)=
0.3mol
10L
60s=0.0005mol(L•S),率之比等于化学计量数之比,所以v(X)=2v(Z)=2×0.0005mol(L•S)=0.001mol(L•S),故A正确;
B、减少X的浓度,平衡向着减弱这种改变的方向移动,即向逆反应方向移动,故B正确;
C、参加反应的Y的物质的量n(Y)=n(Z)=0.3mol,所以Y的转化率为[0.3mol/1mol]×100%=30%,故C错误;
D、该反应正反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应移动,故D错误;
故选AB.点评:
本题考点: 化学平衡的计算;化学平衡的影响因素.
考点点评: 本题考查化学平衡问题,题目难度不大,本题注意外界条件对化学平衡的影响,根据定义法及化学计量法计算反应速率.1年前查看全部
- 一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(
一定条件下,体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g)=Z(g),经60s达到平衡,生成0.3mol Z.下列说法正确的是( ) A.以X浓度变化表示的反应速率为0.001mol/(L•s) B.将容器体积变为20L,Z的平衡浓度变为原来的 1 2 C.若增大压强,则物质Y的转化率减小 D.若升高温度,X的体积分数增大,则正反应的△H>0  _聖_1年前1
_聖_1年前1 -
 苗苗8307 共回答了18个问题
苗苗8307 共回答了18个问题 |采纳率94.4%A、经60s达到平衡,生成0.3molZ,则Z的反应速率等于v(Z)=
0.3mol
10L
60s =0.0005mol/(L•s),根据化学反应速率之比等于化学质量数之比,由方程式可知,v(X)=2v(Z)=2×0.0005mol/(L•s)=0.00lmol/(L•s),故A正确;
B、反应前后气体的化学计量数之和不相等,体积变为20L,体系的压强减小,平衡向逆反应方向移动,Z的平衡浓度小于原来的
1
2 ,故B错误;
C、增大压强平衡向正反应方向移动,反应物Y的转化率增大,故C错误;
D、升高温度,X的体积分数增大,说明升高温度平衡向逆反应方向移动,则正反应的△H<0,故D错误.
故选A.1年前查看全部
- 化学反应平衡~~ 转化率问题2X+Y=Z (都是气体) 已知 10L密闭容器 有 1mol X 1mol Y 达平衡后生
化学反应平衡~~ 转化率问题
2X+Y=Z (都是气体) 已知 10L密闭容器 有 1mol X 1mol Y 达平衡后生成0.3mol Z 60秒 达平衡 求 以A表示的 平衡反应速率?
解
2X + Y =Z
始 1 1 0
变 2 1 1
平 0.4 0.7 0.3
则 V=0.4/(10*60)
问一下 这样做对么 如果不对 请多多 指教~~~ koni901年前3
koni901年前3 -
 hail11w 共回答了13个问题
hail11w 共回答了13个问题 |采纳率84.6%不对,变 0.6 0.3 0.3 v=0.6/1(10*60)1年前查看全部
- 在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(
在一定温度下,向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)⇌2Z(g),此反应达到平衡的标志是( )
A.容器内压强不随时间变化
B.v正(X)=v逆(Z)
C.容器内X、Y、Z的浓度之比为1:2:2
D.单位时间消耗0.1molX同时生成0.2molZ Oo淼焱oO1年前1
Oo淼焱oO1年前1 -
 bl100870 共回答了18个问题
bl100870 共回答了18个问题 |采纳率94.4%解题思路:由X(g)+2Y(g)⇌2Z(g)可知,该反应前后的化学计量数之和不等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.A、反应达平衡时,各物质的浓度不再随时间改变,所以压强不再变化,故A正确;
B、正逆反应速率相等指同一种物质的正逆反应速率相等,故B错误.
C、反应达到平衡时的浓度与反应的初始物质的量以及反应的转化程度有关,所以不能确定是否达到平衡,故C错误;
D、无论反应是否达到化学平衡,消耗的反应物的物质的量之比等于计量数之比,所以不能用来作为判断是否达到平衡状态的依据,故D错误;
故选A.点评:
本题考点: 化学平衡状态的判断.
考点点评: 本题考查了化学平衡状态的判断,难度不大,平衡状态的本质是正逆反应速率相等,化学平衡状态的判断常以选择题方式考查.1年前查看全部
大家在问
- 1高考前总结了一堆方程式的规范性问题,学渣感激不尽.
- 2怎样才能判断法线,反射光线,入射光线,折射光线呢?
- 3把一个长8分米,宽6分米,高5分米的长方形铁块熔铸成一个高5分米的圆锥,圆锥的底面积是多少?
- 4以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物 其中氯化钠和氯化钾的质量和小于总质量的3%
- 5通过质壁分离实验可以鉴定①细胞的死活 ②原生质层与细胞壁伸缩性大小的差异 ③原生质层相当于半透膜 ④水分子进出细胞的方式
- 6一根长方体木料长3M[横截面是正方形】据下一米一段后,表面积比原来减少了120平方分米,剩下的体积是多少
- 7work-worker,这样的变化有什么规律?
- 8谁有三国演义的好词好句好段 111
- 9“大漠孤烟直.”这首诗是谁作的?诗的全文?具体解释一下诗的意思!
- 1030分!英语,过去式和过去分词hear,hide,hit,hold,hurt,keep,know,lead,learn,
- 11一物体在线圈中移动,如何根据物体的移动位移、线圈的匝数以及线圈的电阻求出物体移动时的电磁力
- 12你的好朋友露西生病了,今天没来上学,于是你打电话问候她.请用英语设计电话内容,要求不少于5句话
- 13Rather changes in that biomass over time.一点也不明白为什么是 这些生物量...
- 14西方经济学计算题1.已知某一时期内某种商品的需求函数为 Q d =300 - 30P ,供给函数为 Q s = - 10
- 15请详细什么是定语从句?最好有句子分析,答按和为什么会选这个
