某试样含35%的al2(so4)3和60%的kal(so4)2·12h2o,
 zdmxx2022-10-04 11:39:540条回答
zdmxx2022-10-04 11:39:540条回答某试样含35%的al2(so4)3和60%的kal(so4)2·12h2o,若用沉淀重量法使之生成al2o3·xh2o,灼烧后欲得0.15gal2o3,应取试样多少克?

已提交,审核后显示!提交回复
共0条回复
相关推荐
- 为鉴定产品硅中是否含有微量铁单质,将试样用稀盐酸溶解,取上层清液后需在加入的试剂是 a 碘水 b 氯水 c
 blackwilli1年前2
blackwilli1年前2 -
 ljczgc 共回答了18个问题
ljczgc 共回答了18个问题 |采纳率72.2%B1年前查看全部
- 由硅铝两种物质组成的试样11g,均匀的分成等质量的两份,
由硅铝两种物质组成的试样11g,均匀的分成等质量的两份,
一份与足量的盐酸接触可产生气体aL,一份与足量的氢氧化钠溶液接触产生同样的气体bL,合并两次收集的气体共有11.2L(标准状况)试分析试样的百分组成. ananqq1年前1
ananqq1年前1 -
 我就是小强 共回答了24个问题
我就是小强 共回答了24个问题 |采纳率87.5%设每份Si是xmol,Al是ymol
和盐酸反应的只有Al
Al转移电子是3ymol
和氢氧化钠反应两者皆可
Si和Al共转移电子是4x+3ymol
所以合并转移电子是4x+6ymol
那么生成的氢气是(4x+6y)/2=2x+3ymol
即2x+3y=11.2/22.4=0.5①
从质量知道了(28x+27y)×2=11②
解得x=0.1mol
y=0.1mol
所以每份中含有Si是2.8g,Al是2.7g,共5.5g
所以Si的质量分数是2.8/5.5=50.9%
Al是49.1%1年前查看全部
- 对某个试样的平行分析结果越接近,其分析结果越准确.这句话对吗?
 月色甜心1年前1
月色甜心1年前1 -
 565199098 共回答了17个问题
565199098 共回答了17个问题 |采纳率94.1%不对,因为某个试样的平行分析结果越接近,只能说明分析结果的精密度好,而不能说明准确度好.1年前查看全部
- 用硫酸钡沉淀法测定黄铁矿中硫酸的含量时,称取试样0.2436g最后得到硫酸钡沉淀0.
用硫酸钡沉淀法测定黄铁矿中硫酸的含量时,称取试样0.2436g最后得到硫酸钡沉淀0.
128g计算试样中硫的质量分数. happyhxf1年前1
happyhxf1年前1 -
 kevinzhangfengls 共回答了20个问题
kevinzhangfengls 共回答了20个问题 |采纳率90%你确定题目没有表达错误?黄铁矿中硫酸的含量?!1年前查看全部
- 现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元
现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元素质量比为7:8.为进一步确定该固体成分,现将4.68g该固体试样溶于水,滴加适量稀硫酸后,再加入2.24g铁粉,铁粉与酸根恰好完全反应生成Fe2+.向反应后的溶液中加入一定量的KOH溶液至刚好将Fe2+沉淀完全,过滤;将沉淀充分加热后得到Fe2O3 4.8g.将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸正盐(不是复盐)A,测得其质量为13.92g.
(1)A的化学式为______.
(2)该盐含有的金属元素是______.
(3)通过计算推断该盐的化学式. 爱吃萝卜爱吃菜1年前1
爱吃萝卜爱吃菜1年前1 -
 Mshine520 共回答了27个问题
Mshine520 共回答了27个问题 |采纳率92.6%解题思路:(1)根据加入的试剂和元素守恒确定A的化学式;
(2)根据加入的铁粉和生成的氧化铁中铁是否相等判断是否含铁;根据加入的钾和硫酸钾中的钾是否相等,判断是否含钾元素;
(3)根据钾和酸根的量的关系初步写出化学式,根据相对分子质量计算出结晶水的含量,进一步写出化学式.(1)因在反应过程中加入了硫酸溶解该盐,后又加入了氢氧化钾来沉淀亚铁离子,根据原子守恒,滤液中溶质只能是硫酸钾,故答案为:K2SO4;
(2)2.24g铁粉的物质的量为:[2.24g/56g/mol]=0.04mol,4.8g氧化铁的物质的量为:[4.8g/160g/mol]=0.03mol,该氧化铁中含铁0.06mol,比加入的铁粉多0.02,根据铁粉与酸根恰好完全反应生成Fe2+,可知酸根由铁元素和氧元素组成,因二者质量比为7:8,故二者物质的量比为:[7/56]:[8/16]=1:4,0.04mol铁粉和0.02mol该酸根反应,设酸根中铁的化合价为x,根据得失电子守恒得:0.04×2=0.02×(x-2),解得x=6,故该酸根为:FeO42-.将Fe2+完全沉淀需氢氧化钾的物质的量为:0.06mol×2=0.12mol,硫酸钾的物质的量为:[13.92g/174g/mol]=0.08mol,含K+的物质的量为0.16mol,大于加入的氢氧化钾0.12mol,故该盐中含钾元素0.04mol,故该盐中含铁、钾两种金属元素;
故答案为:钾和铁;
(3)该盐中钾和酸根的物质的量之比为:0.04:0.02=2:1,该盐还有一种元素,只能以结晶水存在,故该盐可写成K2FeO4•nH2O的形式,
该盐的摩尔质量为:[4.68g/0.02mol]=234g/mol,即39×2+56+16×4+n×18=234,解得 n=2,故该盐的化学式为:K2FeO4•2H2O
答:该盐的化学式为K2FeO4•2H2O.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查了复杂化学式的确定,题目较难,关键是利用已加物质和通过反应生成物质之间的某种元素的量的关系确定某元素是否存在,题目多次用到守恒法,要灵活运用.1年前查看全部
- 现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元
现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素.其中酸根由一种金属元素和氧元素组成,且两种元素质量比为7:8.为进一步确定该固体成分,现将4.68g该固体试样溶于水,滴加适量稀硫酸后,再加入2.24g铁粉,铁粉与酸根恰好完全反应生成Fe2+.向反应后的溶液中加入一定量的KOH溶液至刚好将Fe2+沉淀完全,过滤;将沉淀充分加热后得到Fe2O3 4.8g.将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸正盐(不是复盐)A,测得其质量为13.92g.
(1)A的化学式为______.
(2)该盐含有的金属元素是______.
(3)通过计算推断该盐的化学式. 希望简单爱1年前1
希望简单爱1年前1 -
 689jsp 共回答了19个问题
689jsp 共回答了19个问题 |采纳率89.5%解题思路:(1)根据加入的试剂和元素守恒确定A的化学式;
(2)根据加入的铁粉和生成的氧化铁中铁是否相等判断是否含铁;根据加入的钾和硫酸钾中的钾是否相等,判断是否含钾元素;
(3)根据钾和酸根的量的关系初步写出化学式,根据相对分子质量计算出结晶水的含量,进一步写出化学式.(1)因在反应过程中加入了硫酸溶解该盐,后又加入了氢氧化钾来沉淀亚铁离子,根据原子守恒,滤液中溶质只能是硫酸钾,故答案为:K2SO4;
(2)2.24g铁粉的物质的量为:[2.24g/56g/mol]=0.04mol,4.8g氧化铁的物质的量为:[4.8g/160g/mol]=0.03mol,该氧化铁中含铁0.06mol,比加入的铁粉多0.02,根据铁粉与酸根恰好完全反应生成Fe2+,可知酸根由铁元素和氧元素组成,因二者质量比为7:8,故二者物质的量比为:[7/56]:[8/16]=1:4,0.04mol铁粉和0.02mol该酸根反应,设酸根中铁的化合价为x,根据得失电子守恒得:0.04×2=0.02×(x-2),解得x=6,故该酸根为:FeO42-.将Fe2+完全沉淀需氢氧化钾的物质的量为:0.06mol×2=0.12mol,硫酸钾的物质的量为:[13.92g/174g/mol]=0.08mol,含K+的物质的量为0.16mol,大于加入的氢氧化钾0.12mol,故该盐中含钾元素0.04mol,故该盐中含铁、钾两种金属元素;
故答案为:钾和铁;
(3)该盐中钾和酸根的物质的量之比为:0.04:0.02=2:1,该盐还有一种元素,只能以结晶水存在,故该盐可写成K2FeO4•nH2O的形式,
该盐的摩尔质量为:[4.68g/0.02mol]=234g/mol,即39×2+56+16×4+n×18=234,解得 n=2,故该盐的化学式为:K2FeO4•2H2O
答:该盐的化学式为K2FeO4•2H2O.点评:
本题考点: 复杂化学式的确定.
考点点评: 本题考查了复杂化学式的确定,题目较难,关键是利用已加物质和通过反应生成物质之间的某种元素的量的关系确定某元素是否存在,题目多次用到守恒法,要灵活运用.1年前查看全部
- 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.3)如果将分液漏斗中的硫酸换成浓
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验.3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果__________(填偏高、偏低或不变). 为什么是偏高啊?
 wanglei58852551年前1
wanglei58852551年前1 -
 大袋鼠的最爱 共回答了20个问题
大袋鼠的最爱 共回答了20个问题 |采纳率90%因为盐酸中的HCl会挥发.和纯碱反应的HCl 再加上挥发的HCl,所以实际所需的盐酸要更多,所以计算的纯碱值偏大.1年前查看全部
- 问一科学(化学)题物质MgSO4.xH2O经实验测得:瓷坩锅-----8.66克瓷坩锅和试样总质量------10.94
问一科学(化学)题
物质MgSO4.xH2O
经实验测得:
瓷坩锅-----8.66克
瓷坩锅和试样总质量------10.94克
瓷坩锅和已经无水的试样总质量--------9.86克
求x的值
物质中的4和2是下标,点也要再上去一些,只是我打不出来,这个物质是硫酸镁晶体 lvgangff66661年前2
lvgangff66661年前2 -
 yang37 共回答了18个问题
yang37 共回答了18个问题 |采纳率94.4%MgSO4·xH2O的质量:10.94-8.66=2.28g 相对分子质量120+18x
MgSO4的质量:9.86-8.66=1.2g 相对分子质量120
120/1.2=(120+18x)/2.28
解得 x=61年前查看全部
- C30 的混凝土试样10组,养护28天抗压强度为33.8 、40.3、39.7、29.5、31.6、32.4、32.1
C30 的混凝土试样10组,养护28天抗压强度为33.8 、40.3、39.7、29.5、31.6、32.4、32.1 、31.8、30.1、37.
我个人评定Sfcu=4.17,我怎么算都是根号17,好郁闷呀,请问Sfcu等于多少?
最后那个抗压值是37.9 andy12345678901年前1
andy12345678901年前1 -
 风轻云淡月 共回答了17个问题
风轻云淡月 共回答了17个问题 |采纳率88.2%Sfcu=3.94 mfcu=33.92
评定界限0.90fcu,k mfcu-λ1×Sfcu λ2×fcu.k
27.00 27.22 27.00
判定式
mfcu-λ1×Sfcu≥0.90 fcu.k fcu.min≥λ2×fcu.k
合格 合格1年前查看全部
- (2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验
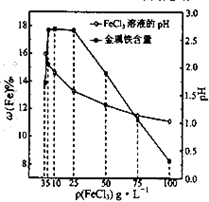 (2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
(2013•江苏三模)用氯化铁浸出重铬酸钾(K2Cr2O7)滴定法测定钛精粉试样中单质铁的质量分数[ω(Fe)%],实验步骤如下:
步骤1:称取试样0.100g于250mL洗净的锥形瓶中.
步骤2:加入FeCl3溶液100mL,迅速塞上胶塞,用电磁搅拌器30min.
步骤3:过滤,用水洗涤锥形瓶和滤渣各3~4次,洗液全部并入滤液中.
步骤4:将滤液稀释至500mL,再移去100mL稀释液于锥形瓶中,加入20mL硫酸和磷酸的混合酸,加0.5%二苯胺磺酸钠指示剂4滴.
步骤5:以K2Cr2O7标准溶液滴定至出现明显紫色为终点.发生的反应为:Cr2O72-+6Fe2++14H+=2Cr3++Fe3++7H2O.
步骤6:重复测定两次.
步骤7:数据处理.
(1)步骤2中加入FeCl3溶液后锥形瓶中发生反应的离子方程式为______,迅速塞上胶塞的原因是______.
(2)步骤3中判断滤纸上残渣已洗净的方法是______.
(3)实验中需用到100mL浓度为0.01mol•L-1K2Cr2O7标准溶液,配置时用到的玻璃仪器有______.称量K2Cr2O7固体前应先将其烘干至恒重,若未烘干,对测定结果的影响是______(填“偏高”、“偏低”、或“无影响”):滴定时,K2Cr2O7溶液应置于______(填仪器名称)中.
(4)科研人员确定FeCl3溶液的最佳浓度,选用100mL不同浓度的FeCl3溶液(FeCl3溶液均过量)溶解同一钛精粉试样,其余条件控制相同,得到测定结果如图所示.则FeCl3溶液的浓度[用ρ(FeCl3)表示]范围应为______g•L-1,浓度过低或过高时测定结果偏低的原因分别是______. yxy_qzkz1年前1
yxy_qzkz1年前1 -
 sonic0320 共回答了20个问题
sonic0320 共回答了20个问题 |采纳率90%解题思路:(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净;
(3)依据溶液配制的实验过程中的操作步骤分析选择所需仪器;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5-25g/L时铁的质量分数最大,浓度低溶解速率慢,浓度高溶液酸性强和铁发生反应;(1)钛精粉试样中含单质铁,加入氯化铁溶液反应生成氯化亚铁,反应的离子方程式为:2Fe3++Fe=3Fe2+,迅速塞上胶塞防止生成的亚铁离子被氧气氧化;
故答案为:2Fe3++Fe=3Fe2+,防止Fe2+被空气中的氧气氧化;
(2)依据检验氯化铁溶液中的氯离子的存在分析判断是否洗涤干净,实验设计方案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
故答案为:取最后一次洗涤滤出液,滴加硝酸银溶液,若无白色沉淀证明已洗净;
(3)溶液配制的实验过程中的操作步骤为计算,称量、溶解、转移、洗涤定容,选择所需玻璃仪器为烧杯、玻璃棒、100ml容量瓶、胶头滴管;若未烘干会增大标准液的体积,造成测定结果偏高,K2Cr2O7溶液是强氧化剂,能腐蚀橡胶管,应盛在酸式滴定管中;
故答案为:100ml容量瓶,烧杯,玻璃棒,胶头滴管,偏高,酸式滴定管;
(4)依据图象变化曲线分析,FeCl3溶液的浓度在5g/L-25g/L时铁的质量分数最大,测定误差小,浓度低时溶解速率慢,单质铁未全部反应,浓度高溶液酸性强和铁发生反应;
故答案为:5-25,浓度过低时溶解速率过慢,单质铁未完全反应;浓度过高时溶液酸性强,溶液中H+与单质铁反应;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了物质含量的实验分析验证,物质性质和实验基本操作是解题关键,题目难度中等.1年前查看全部
- 气相色谱分析某试样组分,得如下数据:死时间为1.5min,保留时间为6.5min,固定液体积为2.5ml,
气相色谱分析某试样组分,得如下数据:死时间为1.5min,保留时间为6.5min,固定液体积为2.5ml,
载气平均流速为0.8ml/min.计算1、该组分的容量因子和分配系数 2、死体积,保留体积和调整保留体积. 花开靡乡1年前0
花开靡乡1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是( )
下列除去杂质(试样中括号内的物质是杂质)时,选用的试剂正确的是()
A B C D 试样 Na 2 CO 3 (NaHCO 3 ) FeCl 2 (FeCl 3 ) Fe(A1) CO 2 (SO 2 ) 除杂试剂 澄清石灰水 NaOH溶液 NaOH溶液 饱和NaHSO 3 溶液  茶王1年前1
茶王1年前1 -
 zl4475455 共回答了18个问题
zl4475455 共回答了18个问题 |采纳率72.2%C
1年前查看全部
- 称取碳酸钠试样0.1608克溶于水,用0.1200摩尔每升的盐酸标准滴定溶液滴定至终点,消耗24.56毫升,求试样中..
称取碳酸钠试样0.1608克溶于水,用0.1200摩尔每升的盐酸标准滴定溶液滴定至终点,消耗24.56毫升,求试样中...
称取碳酸钠试样0.1608克溶于水,用0.1200摩尔每升的盐酸标准滴定溶液滴定至终点,消耗24.56毫升,求试样中碳酸钠的质量分数.
那个 0.1562是怎 么得来的 guopingru1年前1
guopingru1年前1 -
 秋夜风凉 共回答了21个问题
秋夜风凉 共回答了21个问题 |采纳率90.5%Na2CO3+2HCl=====2NaCl+H2O+CO2
106 2
x 0.12*24.56/1000
故碳酸钠质量x=0.12*24.56/1000*106/2=0.1562g,
试样中碳酸钠的质量分数=0.1562/0.1608=97.1%1年前查看全部
- 用重铬酸钾标准溶液滴定0.4000g褐铁矿,若所用的重铬酸钾溶液的体积与试样中的氧化铁质量分数相同,求重铬酸钾对铁的滴定
用重铬酸钾标准溶液滴定0.4000g褐铁矿,若所用的重铬酸钾溶液的体积与试样中的氧化铁质量分数相同,求重铬酸钾对铁的滴定度
 l灵灵1年前1
l灵灵1年前1 -
 高温低温常温 共回答了13个问题
高温低温常温 共回答了13个问题 |采纳率84.6%X=[(T*V)/(0.4000*1000)]*100
当X=V时,T=4.000mg/ml1年前查看全部
- 某同学欲测定草木灰中碳酸钾的含量,称取69g试样于烧杯中,加入29.2g稀盐酸恰好反应,充分反应后,
某同学欲测定草木灰中碳酸钾的含量,称取69g试样于烧杯中,加入29.2g稀盐酸恰好反应,充分反应后,
称得混合物的总质量为93.8g(忽略二氧化碳的溶解度对质量的影响,碳酸钾与碳酸钠的化学性质相似)该草木试样中碳酸钾的质量分数是? oolong111年前1
oolong111年前1 -
 衤刀七 共回答了12个问题
衤刀七 共回答了12个问题 |采纳率83.3%设试样中K2CO3的质量为x.
K2CO3+2HCl=2KCl+H2O+CO2↑
138 44
x 4.4g
x=13.8
13.8/69g=20%
解得:x=13.8 g
答:该试样中碳酸钾的质量分数为20%.1年前查看全部
- 已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体中Ca(OH)2的质量分数为
已部分变质的Ca(OH)2固体试样10g,与足量稀盐酸反应,产生2.2gCO2,则该固体中Ca(OH)2的质量分数为
答案是50%,但我不懂为什么算出CACO3的质量后可以直接用10g减啊?不是还要把CACO3的m带回第一个方程求得变质的CA(OH)2的m吗? 2007之最冷的冬季1年前1
2007之最冷的冬季1年前1 -
 zcx798 共回答了18个问题
zcx798 共回答了18个问题 |采纳率72.2%用2.2克CO2可以算出CaCO3是5克.所以那个变质后的混合物里面,有5克的碳酸钙和5克的氢氧化钙.所以直接算就可以了.
你的想法是,想算出那5克碳酸钙在变质之前的氢氧化钙的质量,你想的其实很好,只是题目问的是变质后的混合物里的含量,所以不必再考虑原始的成分了.
如果提问说原有的氢氧化钙有多少变质了,那么就要按你想的再算一步了.1年前查看全部
- 在以hcl溶液滴定时,怎样使甲基橙及酚酞两种指示剂来判别试样是由naoh-na2co3或na2
 姬生1年前1
姬生1年前1 -
 卖红薯8 共回答了18个问题
卖红薯8 共回答了18个问题 |采纳率88.9%甲基橙变色范围是3.3—4(具体的记不太清了),苯酚是8.3—10(也记不清了),盐酸过量了甲基橙变色,至变量就那么一滴,所以应该用甲基橙做指示剂1年前查看全部
- 现有含Cl离子的固体试样,其Cl离子的质量分数为A%,为了确定试样是否合格,实验者用0.2mol/L 的AgNO3标准液
现有含Cl离子的固体试样,其Cl离子的质量分数为A%,为了确定试样是否合格,实验者用0.2mol/L 的AgNO3标准液滴定已称量的试样配制的溶液,让滴入的AgNO3溶液的mL数正好等于样品中cl离子的质量分数的A值,求称取试样质量为多少?
答案我知道是0.71g, 139747578351年前1
139747578351年前1 -
 xinxue205 共回答了21个问题
xinxue205 共回答了21个问题 |采纳率90.5%Ag+ + Cl- ===AgCl(s)
1.35.5g
0.2*(0.1A)...XA
1*X*A=35.5*0.2*0.1*A
X=0.71
关键点是ML数A,而AgNO3溶液是0.2mol/L,单位要换算统一1年前查看全部
- 将55克含杂质的干燥氧化铜试样放入试管中,先通氢气后加热,待完全反应后冷却称得残留物45克(杂质不气化、不反应)求:
将55克含杂质的干燥氧化铜试样放入试管中,先通氢气后加热,待完全反应后冷却称得残留物45克(杂质不气化、不反应)求:
(1)生成铜多少克?
(2)该氧化铜试样中氧化铜的质量分数? ioi01年前1
ioi01年前1 -
 zhang9hong 共回答了20个问题
zhang9hong 共回答了20个问题 |采纳率85%设生成的铜的质量是x,试样中氧化铜的质量为y
CuO+H 2
△
.
Cu+H 2 O 固体减少的质量
8064 80-64=16
y x 55g-45g=10g
64
16 =
x
10g x=40g
80
16 =
y
10g y=50g
所以氧化铜试样中氧化铜的质量分数是:
50g
55g ×100%≈90.9%
答:(1)生成铜40g;
(2)该氧化铜试样中氧化铜的质量分数是90.9%.1年前查看全部
- A是只含碳、氢元素的有机物,相对分子质量为72;某学生设计了如图实验装置,使该Q试样在纯氧中燃烧,观察实验现象,分析有关
A是只含碳、氢元素的有机物,相对分子质量为72;某学生设计了如图实验装置,使该Q试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量.

(1)仪器B的作用是______.
(2)A中产生32g氧气的体积相当于______升空气的含氧量(氧气密度按1.43g/L计算).
(3)若仪器C的玻璃管中放入的试样质量为43.2g,试样充分燃烧后,若仪器D增重64.8g,仪器E增重132.0g,则试样中含氢元素的质量为______g,试样中含碳元素的质量为______g,则Q的化学式为______.装置D与装置E如果颠倒的后果是使Q中______的质量分数变小.
(4)若装置中没有连接仪器B,将使该试样中氢元素的质量测算结果______(填“偏小”、“偏大”、“无影响”中之一).若装置中没有连接仪器F,将使该试样中______. lyg_wjs1年前1
lyg_wjs1年前1 -
 微笑的老狼 共回答了21个问题
微笑的老狼 共回答了21个问题 |采纳率95.2%解题思路:(1)根据浓硫酸的吸水性考虑;(2)用氧气的质量除以氧气的密度,算出氧气的体积,再根据氧气在空气中的体积分数算出空气的体积;(3)仪器D增重64.8g是有机物燃烧生成的水的质量,根据水的质量算出氢元素的质量;仪器E增重132.0g是有机物燃烧生成的二氧化碳的质量,根据二氧化碳的质量算出碳元素的质量,再根据碳元素与氢元素的原子个数比,结合相对分子质量,求出有机物的化学式,根据装置D与装置E如果颠倒的后果考虑谁的质量分数偏小;(4)根据装置B的作用考虑该试样中氢元素的质量偏大还是偏小;根据仪器F的作用考虑实验结果.(1)因为浓硫酸具有吸水性,所以仪器B的作用是除去氧气中的水蒸气,防止影响对有机物中氢元素的测定;(2)氧气的体积为:32g1.43g/L=22.38L,由于氧气约占空气体积的15,所以空气体积为:22.38L×5=111.9L;(3)...
点评:
本题考点: 物质的鉴别、推断.
考点点评: 解答本题关键是要知道氧气在空气中约占体积的[1/5];知道浓硫酸具有吸水性,根据浓硫酸质量的增加量,是水的质量,进而算出氢元素的质量;澄清石灰水能吸收二氧化碳,根据石灰水的质量的增加量就是二氧化碳的质量,进而计算出碳元素的质量,再计算出原子个数比,写出化学式.1年前查看全部
- 对上述试样进行EDS成分分析,结 果如图5所示.观察图 5(a)中 Spectrum1 处的基体可见灰色基体中有黑色相.
对上述试样进行EDS成分分析,结 果如图5所示.观察图 5(a)中 Spectrum1 处的基体可见灰色基体中有黑色相.结合 XRD 分析、显微硬度测试、EDS 分析结果,可以判断:图5(a)和(b)中所示灰色基体由NiAl金属间化合物和 Al2O3 陶瓷两相组成,深灰色相为NiAl 金属间化合物,无晶界显示,而黑色相为Al2O3,呈无规则形状;图 5(c)中白色规则颗粒皆为TiB2.T iB2的形态种类较多,有类正六方体、类六棱柱体和棒条状,最小的比较完整的颗粒尺寸为2~5 μm,主要镶嵌在无规则的 Al2O3 相中,还有一些 TiB2 颗粒分布在NiAl 基体上,尺寸为5~10 μm.
在反应混合物中Al 的颗粒较大,为70~230 mm,但生成的 TiB2 颗粒却很小,大部分尺寸小于 5 μm,主要呈簇状镶嵌在 Al2O3 基体上,由此推断 Al2O3 和TiB2 是相伴生长的.TiB2 团簇的尺寸为10~20 mm,远远小于Al 颗粒的尺寸.对于 NiAl摩尔比为 1:1 的体系,室温下引发反应,体系的绝热温度 Tad=Tm,NiAl=1 911 K [19] ;而对于AlTiO2B2O3
摩尔比为 10:3:3 的体系,室温下引发反应,反应的绝热温度Tad=2 448 K [20] .对试样300 ℃预热,根据文献[21]热力学数据计算混合体系 NiAl+AlTiO2B2O3的绝热温度,随着 AlTiO2B2O3含量的增加,体系绝热温度升高,当 AlTiO2B2O3的质量分数由10%增加至30%时,其 Tad 由2 684 K升高至2 723K,介于Al2O3 和TiB2 的熔点之间. microtruth1年前1
microtruth1年前1 -
 牛城 共回答了18个问题
牛城 共回答了18个问题 |采纳率94.4%analyzing the EDS composition of above samples,the result as shown in Figure 5.Observe the basical body at Spectrum 1 in Figure 5(a),black phases can be seen in the gray basical body.Combining the result of XRD analysis,hardness test and EDS composition anlysis,we can judge that :the gray basical body shown in Fig.5 (a)and (b) is composed of NiAl intermetallic compounds and Al2O3 ceramic phases,in which the dark gray phases are NiAl intermetallic compounds with no display of grainboundary,while the black phases are Al2O3 in irregular shape; the white particles in regular shape shown in Fig.5(C)are all TiB2.TiB2 is of great morphological diversity,including cube hexahedron,six - sided prism,or bar shape.the minimum size of a comprehensive particle is 5 μm,mainly inserted in the irregular AI203 phases,while some were distributed onto the basical body sized 10 μm.
The AI particles are with comparetively bigger size of 70~230 mm among the reaction mixture,however,the TiB2 particles generated by reaction were very small,mostly are smaller than 5 μm and clustered on the basical body of Al2O3.Thus,we deducted that Al2O3 and TiB2 have grown together.The size of the clustered TiB2 is 10~20 mm,which is far less smaller than the size of AI particles.For the molar ratio of 1:1 NiAl system to initiate reaction under room temperature,the adiabatic temperature is Tad=Tm,NiAl=1 911 K [19]; while the molar ratio of 10:3:3 AlTiO2B2O3 system to initiate reaction under room temperature,the adiabatic temperature is Tad=2 448 K [20].Preheating the samples under 300 ℃,and calculate the adiabatic temperature of hybrid system NiAl+AlTiO2B2O3 according to the thermodynamic data provided in Ref.[21],with the amount content of AlTiO2B2O3 increasing,the adiabatic temperature rises.When the mass fraction of AlTiO2B2O3 increases from 10% to 30%,the Tad rises from 2648K to 2723K,which is between the Melting point of Al2O3 and TiB2.1年前查看全部
- 谁能知道“夏比”试验、“夏比标准试样”中的“夏比”到底是什么含义?
 叫我薇小安1年前1
叫我薇小安1年前1 -
 法纪 共回答了24个问题
法纪 共回答了24个问题 |采纳率75%Charpy impact test 是用以测定金属材料抗缺口敏感性(韧性)的试验.
夏比Charpy 为 Georges Charpy (1865-1945) 法国工程师,是这项试验的主要理论家和推动者.1年前查看全部
- 以重铬酸钾发测定铁矿石中铁含量,用0.02mol/L重铬酸钾滴定,设试样含铁以Fe2O3计,约为50%,
以重铬酸钾发测定铁矿石中铁含量,用0.02mol/L重铬酸钾滴定,设试样含铁以Fe2O3计,约为50%,
则试样称取量为多少克 一土静子1年前2
一土静子1年前2 -
 zhcqn 共回答了18个问题
zhcqn 共回答了18个问题 |采纳率88.9%滴定体积一般要求在20—40毫升范围内
K2Cr2O7——6Fe——3Fe2O3
1 3
0.02*20/1000 m*50%/159.69
m=(3*0.02*20/1000)/(1*50%/159.69)=3.83g
同样当V=40ml时,m=7.66g1年前查看全部
- 请问阿克隆橡胶磨耗试验的试样尺寸是多大?
请问阿克隆橡胶磨耗试验的试样尺寸是多大?
有人说是方的,有人说是园的 画虎类犬1年前1
画虎类犬1年前1 -
 xuanli 共回答了20个问题
xuanli 共回答了20个问题 |采纳率75%GB/T1689-1998:
试样为条状:长为(68+3.2)л+0~5mm,宽为12.7±0.2mm,厚为3.2±0.2mm的长条
68是胶轮的直径
胶轮直径为68-1mm,厚度为12.7±0.2mm,硬度为75~80度(邵尔A),中心孔直径应符合胶轮回转轴的直径.
试样两面打磨后粘于胶轮上,粘接时试样不受张力,接头粘接应光滑过渡.1年前查看全部
- 原子吸收光谱法中如果试样成分复杂应该怎样进行测定
 ff翁1年前1
ff翁1年前1 -
 yuzhui2005 共回答了20个问题
yuzhui2005 共回答了20个问题 |采纳率85%如果含量太高,影响测定,可考虑分离干扰物质;如干扰不严重,可以考虑换用小狭缝.1年前查看全部
- 分析化学计算题: 药用NaOH的测定,称取试样0.2875g,溶解后用0.2450mol/L HC
分析化学计算题: 药用NaOH的测定,称取试样0.2875g,溶解后用0.2450mol/L HC
分析化学计算题:
药用NaOH的测定,称取试样0.2875g,溶解后用0.2450mol/L HCL溶液滴定到酚酞变色,用去29.30ml,继续用甲基橙做指示剂,用HCL溶液滴至甲基橙变色,消耗HCL0.30ml。计算药用NaOH的含量(M=40.01g/mol)
快来帮帮忙吧!
 235236841年前2
235236841年前2 -
 652658 共回答了18个问题
652658 共回答了18个问题 |采纳率83.3%氢氧化钠易吸收空气中的CO2,变为碳酸钠,所以氢氧化钠中含少量的碳酸钠
用酚酞为指示剂,氢氧化钠生成氯化钠,碳酸钠生成碳酸氢钠
继续加甲基橙做指示剂,碳酸氢钠生成CO2,消耗的体积为0.30mL,则
用酚酞为指示剂,氢氧化钠消耗盐酸的体积=29.30-0.30=29.00mL,
药用NaOH的含量=0.2450*0.02900*40.01/0.2875=98.88%...1年前查看全部
- 测定磁铁矿(不纯的Fe3o4)中的铁含量时,称取试样0.1668经溶解氧化使Fe3+离子沉淀为Fe(oh)3灼烧后得Fe
测定磁铁矿(不纯的Fe3o4)中的铁含量时,称取试样0.1668经溶解氧化使Fe3+离子沉淀为Fe(oh)3灼烧后得Fe2o3质量为0.1370克计算试样中1.Fe质量分数2.Fe3o4的质量分数
可不可以用等物质量的原理计算一下,这样有点繁琐,还有没有通俗易懂的,因为比较急, 杨柳岸53611年前1
杨柳岸53611年前1 -
 云心yunxin 共回答了25个问题
云心yunxin 共回答了25个问题 |采纳率88%∵Fe2o3质量为0.1370克
∴Fe2o3物质的量为0.1370/160=8.5625×10-4mol
∴n(Fe)=8.5625×10-4mol×2=1.7125×10-3mol
n(Fe3O4)=8.5625×10-4mol×2÷3=5.7083×10-4mol
∴Fe质量分数=1.7125×10-3×56÷0.1668×100%=57.49%
Fe3o4的质量分数=5.7083×10-4×232÷0.1668×100%=79.40%1年前查看全部
- 吸取醋酸试样3.00ml,在容量瓶中稀释成250ml.摇匀后取出25.00ml.用NaOH标准溶液进行滴定,看补充说明
吸取醋酸试样3.00ml,在容量瓶中稀释成250ml.摇匀后取出25.00ml.用NaOH标准溶液进行滴定,看补充说明
准确吸取醋酸试样3.00ml,在容量瓶中稀释成250ml.摇匀后取出25.00ml.用NaOH标准溶液进行滴定,需要0.1000mol/L的NaOH标准溶液20.00ml滴定至终点,求试样中醋酸的含量(以g/L表示).(已知M3COOH=60.00g/mol) zhuxh251年前1
zhuxh251年前1 -
 北三环马甸 共回答了15个问题
北三环马甸 共回答了15个问题 |采纳率100%很简单
设原试样醋酸的浓度是Xg/L,则进行滴定反应的醋酸的物质的量应该是X*3/1000*25/250=0.0003X (g)
滴定消耗NaOH:0.1000*20/1000=0.002mol,
NaOH和醋酸反应物质的量的比是1:1,
即反应的醋酸的物质的量是0.002mol,即0.002*60=0.12g
所以有0.0003X=0.12
X=400g/L1年前查看全部
- 称取1.4210g明矾试样,经化学反应后生成Al(OH)3,经灼烧生成 Al2O3,质量为0.1410g,计算明矾中S得
称取1.4210g明矾试样,经化学反应后生成Al(OH)3,经灼烧生成 Al2O3,质量为0.1410g,计算明矾中S得百分含
明矾的化学式为K2SO4·Al2(SO4)3·24H2O wuwuyuan1年前2
wuwuyuan1年前2 -
 70bacwui 共回答了18个问题
70bacwui 共回答了18个问题 |采纳率88.9%Al2O3~2Al~4S
102 128
0.1410 X
解得X=0.1769g
S%=12.45%1年前查看全部
- 土质与土力学 请知道以下题目答案的高手给予回答:1、 某粘土试样,在室内测得其湿土和烘干后的质量分别为210g 和162
土质与土力学
请知道以下题目答案的高手给予回答:
1、 某粘土试样,在室内测得其湿土和烘干后的质量分别为210g 和162g,并已知其土粒比重为2.7,若该试样是完全饱和的,其含水量,饱和密度,干密度和孔隙比各为多少?
2、一干砂试样的密度为1.66g/cm3,土粒相对密度为2.70,将此干砂试样置于雨中,若砂样体积不变,饱和度增加到0.60,试计算此湿砂的密度和含水量.3、挡土墙高5m,墙背直立、光滑,墙后土体表面水平,共分二层,各层土的物理力学指标如图所示,求主动土压力并绘出土压力分布图.
4、环刀体积为60cm3,重45.4g,环刀取湿土后称重为159.4g(包括环刀重),土样孔隙比e为1.12,土粒比重Gs为2.68.从土样中取湿土12.7g,烘干后称重为10.6g.求土的湿密度,含水量和有效密度.
5、某一取自地下的试样,用环刀法测定其密度.环刀的体积为60cm3,环刀质量为50g,环刀加湿土质量为172.5g,环刀加干土质量为152.0g,试计算该土样的含水率、天然密度、干密度.
6、某路段路基施工填土时,土较干不利于压实,取土2860g,测得其含水量w=10%,拟将含水量增加到17%,试计算该土样应加多少水? s54844441年前1
s54844441年前1 -
 dieleng1992610 共回答了12个问题
dieleng1992610 共回答了12个问题 |采纳率83.3%6、土壤含水量(重量%)=(原土重-烘干土重)/烘干土重×100%=水重/烘干土重×100%
根据上述公式计算出
烘干土重Ms=2600g
原状土中含水Mw=2860-2600=260g
Wo=17%时土中含水量=2600*17%=442g
应加水=442-260=182g1年前查看全部
- 红外光谱的灵敏度较低,尚不适于___的测定(常量分析,微量分析,气体试样,固体和液体试样,)
 jinshugupiao121年前1
jinshugupiao121年前1 -
 swzmf 共回答了17个问题
swzmf 共回答了17个问题 |采纳率88.2%灵敏度较低=微量分析1年前查看全部
- 试样在拉伸过程中为什么随着塑性变形增加强度增大
 陈年梦1年前2
陈年梦1年前2 -
 wanyong620 共回答了15个问题
wanyong620 共回答了15个问题 |采纳率93.3%金属的强化机制有四种,分别是 固溶强化 第二相强化 形变强化 和 细晶强化
楼上这种情况就属于形变强化
其机制是 形变导致位错密度增加,然后位错线交织在一起,限制其进一步运动,导致形变难以继续进行,宏观表现为金属的强化!1年前查看全部
- 有一瓶储存时间较长的Na2SO3试剂,部分被氧化为Na2SO4,试样中还含有质量分数为5.3%的Na2CO3.取此试样2
有一瓶储存时间较长的Na2SO3试剂,部分被氧化为Na2SO4,试样中还含有质量分数为5.3%的Na2CO3.取此试样20g,加入4mol·L-1的盐酸溶液300mL,产生的气体经干燥后,测得其体积为2464mL(标准状况).求此试样中Na2SO3所占的质量分数.
 lanmao5581年前1
lanmao5581年前1 -
 雨中哭泣的女子 共回答了24个问题
雨中哭泣的女子 共回答了24个问题 |采纳率87.5%20g样品中有Na2CO3:(20*5.3%)/106=0.01mol
0.1molNa2CO3与盐酸完全反应后,生成CO2体积(标准状况)为0.224L,
这样样品中Na2SO3与酸反应生成SO2的物质的量为:
(2.464-0.224)/22.4=0.1mol
由于1molNa2SO3与酸反应产生1molSO2,
所以样品中有Na2SO30.01mol,质量为0.1*126=12.6g
样品中Na2SO3的质量分数为:12.6/20=63%1年前查看全部
- 计算!有一瓶储存时间较长的Na2SO3试剂,部分被氧化为Na2SO4.取此试样2
计算!有一瓶储存时间较长的Na2SO3试剂,部分被氧化为Na2SO4.取此试样2
计算!有一瓶储存时间较长的Na2SO3试剂,部分被氧化为Na2SO4.取此试样20g,加入足量稀盐酸,产生的气体经干燥后,测得其体积为2.24L(标准状况).求此试样中Na2SO3所占的质量分数. jnkfq1年前1
jnkfq1年前1 -
 necc 共回答了19个问题
necc 共回答了19个问题 |采纳率94.7%Na2SO3 + 2HCl = 2NaCl + SO2 + H2O
1 22.4
X 2.24
X=0.1mol
Na2SO3的质量=12.6克
试样中Na2SO3所占的质量分数=12.6/20=63%1年前查看全部
- 粉末状试样A是由等物质的量的MgO和Fe 2 O 3 组成的混合物,现进行如下实验:
粉末状试样A是由等物质的量的MgO和Fe 2 O 3 组成的混合物,现进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.2 L 6.0 mol / L的盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出标准状况下4.48L的气体,生成溶液D,同时还有残留的单质B。请你填写下列空白:
(1)①中铝热反应的化学方程式是_____________,产物中单质B的化学式是___________。
(2)③中反应的离子方程式是____________、____________。
(3)20g A中n(Fe 2 O 3 )=_________;若溶液D的体积仍视为0.2L ,则该溶液中c(Mg 2+ )=_______,c(Fe 2+ )=_______。 lgvc1年前1
lgvc1年前1 -
 愧疚伊人 共回答了16个问题
愧疚伊人 共回答了16个问题 |采纳率87.5%1年前查看全部
- 问几道高一化学题.急!1、有一块表面部分被氧化为氧化钠的金属钠试样,设其钠在反应中生成氢气的质量为m3g,中和反应所得的
问几道高一化学题.急!
1、有一块表面部分被氧化为氧化钠的金属钠试样,设其钠在反应中生成氢气的质量为m3g,中和反应所得的氢氧化钠消耗H2SO4的质量为m4g,写出计算钠纯度的数学表达式.
2、将ag的钠投入bg水中{水过量},在反应后所得溶液中溶质的质量分数是多少?
3、将一块29.2g表面被氧化{氧化产物是氧化钠}的金属钠,分多次小心投入71.8水里,最终得到100g溶液.
(1)金属钠的纯度
(2)所得溶液中溶质的质量分数.
P.S以上问题请写过程,今晚之内要,会悬赏.
 心呢1年前1
心呢1年前1 -
 jdgdwl 共回答了19个问题
jdgdwl 共回答了19个问题 |采纳率94.7%1.
2Na--H2--2NaOH
46 2 80
23M3 M3 40M3
2NaOH--H2SO4
80 98
M4 40M4/49
所以 钠纯度的数学表达=40M3/(40M4/49)
2.
Na--NaOH--- 差量
23 40 1
a 40a/23 a/23
溶液的质量 a+b-a/23=22a/23+b
溶质的质量分数是多少 40a/23 /(22a/23+b)
3.
H2的质量为 29.2+71.8-100=1 g
2Na--H2--2NaOH
46 2 80
X 1 Y=8
X=23g 金属钠的纯度=23/29.2=78.8%
那么Na20的质量 29.2-23=6.2
Na2O-2NaOH
62 80
6.2 Z=8
那么NaOH的质量为8+8=16
溶质的质量分数16/100=16%
不懂+我Q 4598129871年前查看全部
- 有一标准Fe2+溶液,浓度为6μg.cm-3,有一Fe2+的待测液体试样,在同一条件下测得吸光度为0.510,求试样中铁
有一标准Fe2+溶液,浓度为6μg.cm-3,有一Fe2+的待测液体试样,在同一条件下测得吸光度为0.510,求试样中铁的含量.
 kwan1631年前1
kwan1631年前1 -
 伤说不出 共回答了20个问题
伤说不出 共回答了20个问题 |采纳率100%缺少条件,没有给出标准溶液的吸光度值,给出以后,本题非常简单,根据朗伯比耳定律(吸光度与浓度成正比)计算即可.1年前查看全部
- 三、取井水试样100.0ml,调节溶液的PH=10.0,以0.0100mol/LEDTA溶液至计量点,消耗25.00ml
三、取井水试样100.0ml,调节溶液的PH=10.0,以0.0100mol/LEDTA溶液至计量点,消耗25.00ml.
计算水样以ppm和度表示的CaC03的硬度. 小刚2601年前1
小刚2601年前1 -
 泊静 共回答了16个问题
泊静 共回答了16个问题 |采纳率93.8%小朋友,你连这么简单的作业都要来这里问答案啊?你是不是连最基本的化学当量概念都没有哦?这道题根本就不用计算,口算都解决了:
0.0100mol/L*25.00ml=0.00025mol
这一步计算出滴定所消耗的EDTA摩尔数
0.00025mol*100*1000=25ppm
这一步换算出相当于碳酸钙的克数、再进一步变为毫克数.而毫克/升,就是表示硬度的单位ppm1年前查看全部
- 某试样的焰色反应呈黄色,下列对该试样成分的说法正确的是( )
某试样的焰色反应呈黄色,下列对该试样成分的说法正确的是( )
A. 肯定是钠单质
B. 肯定是钠的化合物
C. 肯定含有钠元素
D. 不可能含有钾元素 zuibiandechun1年前1
zuibiandechun1年前1 -
 欣仁 共回答了12个问题
欣仁 共回答了12个问题 |采纳率100%解题思路:物质灼烧时,焰色反应为黄色,注意焰色反应的性质是元素的性质,和元素的存在形态无关,可能是含钠化合物,也可能是单质,钾元素的焰色反应为紫色,易被黄光遮住,应透过蓝色钴玻璃观察.A、只要含有钠元素,焰色反应就呈黄色,不一定是钠单质,故A错误;
B、焰色反应的性质是元素的性质,和元素的存在形态无关,可能是含钠化合物,也可能是单质,故B错误;
C、焰色反应的性质是元素的性质,物质灼烧时,焰色反应为黄色,则一定含有钠元素,故C正确;
D、钾元素的焰色反应为紫色,易被黄光遮住,应透过蓝色钴玻璃观察,故D错误.
故选C.点评:
本题考点: 焰色反应.
考点点评: 本题考查焰色反应,题目难度不大,注意掌握焰色反应的性质是元素的性质,和元素的存在形态无关;钾元素焰色的特点.1年前查看全部
- 完全燃烧1L CH4、CO、CO2组成的天然气试样,耗用1.65L O2;若把1L这种天然气导入NaOH溶液中,气体体积
完全燃烧1L CH4、CO、CO2组成的天然气试样,耗用1.65L O2;若把1L这种天然气导入NaOH溶液中,气体体积缩小0.1L.计算该天然气中各组分的体积含量?(气体体积均在标准状况下测定)
 奋斗三百六十五1年前2
奋斗三百六十五1年前2 -
 卖男孩的小tt 共回答了15个问题
卖男孩的小tt 共回答了15个问题 |采纳率73.3%1、通入 NaOH 溶液中,气体体积减小的就是 CO2 的体积,所以 CO2 — 0.1L
剩余的就是 0.9L 的 CH4 和 CO 混合气体
2、CO2 不需要 O2 ,所以 0.9L 的 CH4 和 CO 混合气体,完全燃烧耗用 O2 — 1.65L
设 CH4 xL ,CO yL ,则
2 x + y / 2 = 1.65
x + y = 0.9 所以
x = 0.8 ,y = 0.1
综上 CH4——0.8L ,CO——0.1L ,CO2——0.1L
这类题最简单明了的方法就是:把所有未知的设出来,逐个去解答
当然很多时候会有些简便方法的,主要是从元素守恒或者电子守恒等方面来寻找1年前查看全部
- 一包固体物质可能由Na2CO3、K2SO4、NaCl中的一种或几种组成.取试样少许溶于水,加入过量BaCl2溶液,产生白
一包固体物质可能由Na2CO3、K2SO4、NaCl中的一种或几种组成.取试样少许溶于水,加入过量BaCl2溶液,产生白色沉淀,该沉淀不溶于稀硝酸,过滤,在滤液中加入用硝酸酸化的AgNO3溶液,产生白色沉淀.则原固体物质组成中( )
A. 一定有K2SO4
B. 一定有NaCl
C. 一定有Na2CO3
D. 可能有NaCl petehu1年前5
petehu1年前5 -
 重换ID进TY 共回答了24个问题
重换ID进TY 共回答了24个问题 |采纳率87.5%解题思路:因混合物中没有不溶物,当把混合物放入水中配制成溶液后,滴加氯化钡产生白色沉淀,且沉淀不溶于稀硝酸,所以我们可以判断在混合物中一定含有硫酸钾.因滴加过量BaCl2溶液,产生白色沉淀,该沉淀不溶于稀硝酸,所以我们可以断定在混合物中一定含有K2SO4;且一定不含碳酸钠.因碳酸钠和氯化钡生成的碳酸钡沉淀能溶于硝酸.而在滤液中加入用硝酸酸化的硝酸银时,产生白色沉淀,说明在滤液中含有氯离子,但不能说明原混合物中一定含有氯化钠,因为在第一次反应时,加入的氯化钡与硫酸钾反应生成了硫酸钡和氯化钾,并且还有过量的氯化钡溶液.
故选AD点评:
本题考点: 实验探究物质的组成成分以及含量.
考点点评: 在初中阶段我们所学过的即不溶于水,也不溶于酸的沉淀有两种.一种是氯化银,一种是硫酸钡.所以在题目中若出现了即不溶于水也不溶于酸的沉淀,我们就考虑这两种物质.1年前查看全部
- 纯净的CA(HCO3)2试样在高温下分解,当剩余的固体物质质量是原试剂质量的一半是,CAHCO32的分解率是?
纯净的CA(HCO3)2试样在高温下分解,当剩余的固体物质质量是原试剂质量的一半是,CAHCO32的分解率是?
Ca(HCO3)2分子量162
CaCO3分子量100
剩余的固体物质质量为原试样质量的一半
说明碳酸钙也开始分解了
所以碳酸氢钙分解率100%,【难道这不会说先分解了一些碳酸氢钙的时候,得到的碳酸钙分解同时也分解,那么不是没解了? calvinlong1年前1
calvinlong1年前1 -
 edithyim 共回答了19个问题
edithyim 共回答了19个问题 |采纳率89.5%碳酸氢钙容易分解,所以先分解,其分解完全后,碳酸钙在分解.二者分解温度差别很大.
其实你的想法是有道理的,一般都说的是理想状态.1年前查看全部
- 粉末状态试样A是由等物质的量的MgO和Fe2O3组成混合物.进行如下实验:(1)取适量A进行铝热反应,产物中有单质B生成
粉末状态试样A是由等物质的量的MgO和Fe2O3组成混合物.进行如下实验:(1)取适量A进行铝热反应,产物中有单质B生成;(2)另取20 g A全部溶于0,15,L 6.0 m0l
 dillon41151年前1
dillon41151年前1 -
 舞蝶小精灵 共回答了21个问题
舞蝶小精灵 共回答了21个问题 |采纳率100%步骤一:MgO、Fe2O3铝热反应后产物为:MgO、Fe、Al2O3,故单质B为Fe.
步骤二:20g的A中两种物质的物质的量相等,可推断出两者皆为0.1mol;
0.15L 6mol/L 的盐酸中,HCl物质的量:0.90mol
反应后有0.1molMgCl2,0.2molFeCl3,0.1molHCl.
步骤三、四:根据步骤四,得到步骤三反应后产物中不含Fe3+,只有Fe,Fe2+,可推断出:
单质B(Fe)先与溶液C余下的0.1mol盐酸反应,
2Fe+6HCl=2FeCl3+3H2(上升符号)
0.1 a 0.05 (为了方便计算,先用a代替)
得到0.05mol氢气,氯化铁,然后
所有氯化铁与铁反应:
2FeCl3+Fe=3FeCl2a+0.2 0.35因此反应完毕,n(Mg2+)=0.1mol n(Fe2+)=0.35mol1年前查看全部
- 邻菲啰啉比色测铁的作用原理如何?用该法测得的铁含量是否为试样中的亚铁含量?为什
 sdfslfdskfj091年前1
sdfslfdskfj091年前1 -
 用户名on1_的组合 共回答了14个问题
用户名on1_的组合 共回答了14个问题 |采纳率78.6%原理:盐酸羟胺能将三价铁也还原成二价铁.在pH2-9范围内,二价铁与邻菲罗琳反应生成橙红色配合物,530nm下比色.反应如下:
4FeCl3+2NH2OH∙HCl→4FeCl2+6HCl+H2O
Fe2+ +3C12H8N2=【Fe6(C12H8N2)3】2+ 橙红色
测量范围:Fe浓度0.1-0.6微克每毫升
不加盐酸羟胺的话测得就是亚铁,加了测得就是总铁.1年前查看全部
- 已知某试样可能含有Na3Po4,Na2HPo4,NaH2Po4和杂质。称取试样1·1000g.用蒸馏水溶解,并稀释至10
已知某试样可能含有Na3Po4,Na2HPo4,NaH2Po4和杂质。称取试样1·1000g.用蒸馏水溶解,并稀释至100ML.取试样溶液25ml以甲基橙作指示剂,用0.2500摩尔每升Hcl溶液滴定至终点,消耗Hcl溶液8.00ml。另取试样溶液25ml以百里酚酞作指示剂,用0.250摩尔每升Hcl溶液滴定至终点,消耗Hcl溶液3.00ml。试求试样的组成和含量。
 64m155ab1年前1
64m155ab1年前1 -
 不要来中铁 共回答了14个问题
不要来中铁 共回答了14个问题 |采纳率78.6%取少量原溶液,分别置于三支试管。一支加入硝酸银溶液,有沉淀(黄色、白色混杂的沉淀,即黄色沉淀)则证明存在磷酸根。一支加入醋酸后加入硫酸亚铁,有棕色沉淀为有亚硝酸根(原理:NO2-的鉴定
酸性条件下分解
2H+ +2NO2-=H2O+NO+NO2
3Fe2++NO+ 2 SO42-=[Fe (NO)]SO4生成棕色的硫酸亚硝酰铁)。一支和铜粉混合加热,有气泡,气体遇到空气变成...1年前查看全部
- 大二《分析化学》的一条题目.15.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50
大二《分析化学》的一条题目.
15.测定试样中CaO的质量分数,称取试样0.9080g,滴定耗去EDTA标准溶液20.50mL,以下结果表示正确的是( )
(A)10% (B)10.1% (C)10.08% (D)10.077%
我知道答案选C,我怎么总觉得题目不全呢.EDTA的浓度不是没有么 候鸟061年前1
候鸟061年前1 -
 好像没有不对 共回答了24个问题
好像没有不对 共回答了24个问题 |采纳率91.7%这道题考的是有效数字
题目中出现的两个数字有效数字都是4位,所以选C1年前查看全部
- X射线衍射法分析蛋白质是否会破坏接受分析的蛋白子试样
 zu00261年前1
zu00261年前1 -
 cocoyoko 共回答了18个问题
cocoyoko 共回答了18个问题 |采纳率94.4%X射线衍射法分析蛋白质不会破坏接受分析的蛋白分子.1年前查看全部
- 称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00m
称取软锰矿试样0.5000g,加入0.7500gH2C2O4·2H2O及稀硫酸,加热至反应完全.过量的草酸用30.00mL0.02000mol/L的KMnO4溶液滴定至终点,求软锰矿的氧化能力(以已知)(8分)
 c1dt1ybg1年前1
c1dt1ybg1年前1 -
 youbear 共回答了24个问题
youbear 共回答了24个问题 |采纳率91.7%哦,擅长领域还是化学的呢?!
5H2C2O4.2H2O :2KMnO4
5*126.07 2
X 30/1000*0.02 X = 5*126.07*0.02/2/1000 = 0.1891g
MnO2 :H2C2O4.2H2O
86.94 126.07
Y 0.1891 Y = 86.94*0.1891/126.07 = 0.1304g
……1年前查看全部
- 混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为(
混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为(
混合物K2SO4,(NH4)2SO4总质量为m克,把混合物溶于水得沉淀 n mol ,则试样中K2SO4的物质的量为( )mol (用含m,n的代数式表示). 废物点心161年前1
废物点心161年前1 -
 ihivw 共回答了22个问题
ihivw 共回答了22个问题 |采纳率81.8%K2SO4的分子量为174,(NH4)2SO4的分子量为132.
设有K2SO4 a mol,(NH4)2SO4 b mol
混合物质量即为158a+114b=m g
又沉淀的物质的量为nmol,即SO4为 nmol,也就是a+b=n
联立两个方程得a=(m-132n)/421年前查看全部
大家在问
- 1正方形的面积是2平方分米,周长是多少?今天就要
- 2今年教师节,刘老师光荣地评为"优秀教师"的光荣称号.修改病句
- 3我的观察 作文
- 4梯形的中位线长为12 cm,一条对角线把它分为1:2两部分,梯形上、下底的长为 .
- 5A,B两站相距300千米,一列快车从A站出发,速度60km/h一列慢车从B站出发,速度40km/h
- 6已知(2-根号5)的平方=9-4倍根号5,求9-4倍根号5的平方根和算术平方根.
- 7英语阅读排序 Today is May tenth.It is Cindy`s birthday
- 8用When连接两个从句,动词用一般过去时
- 9英语翻译He felt he was mature enough to think for himself and bi
- 10已知函数f(x)在x=a处可导,则limf(h)-f(a)/h-a?
- 11下列关于水的认识正确的是( ) A.活性炭能将硬水变成软水 B.电解水的实验说明了水是由氢气和氧气组成的 C.水是一种化
- 12已知:关于x的一元二次方程x2-2(2m-3)x+4m2-14m+9=0
- 13一种用方程,要写解设,与等量关系式,另一种是算数解法
- 148A Unit 3 A day out 的Reading翻译
- 15西北地区植被由东向西的分布规律是?

