CuFeS2的各元素化合价分别是?
 思念猫猫的鱼2022-10-04 11:39:541条回答
思念猫猫的鱼2022-10-04 11:39:541条回答CuFeS2被O2氧化生成SO2,FeO和Cu时,各元素化合价是如何变化的.为什么?请高手赐教,

已提交,审核后显示!提交回复
共1条回复
 5hql 共回答了24个问题
5hql 共回答了24个问题 |采纳率87.5%- CuFeS2中Cu为+2价,Fe为+2价,S为-2价
SO2中S为+4价,化合价升高了;FeO中Fe为+2价,没有变;Cu由+2价降为0价 - 1年前
相关推荐
- 以黄铜矿(CuFeS2)为原料冶炼铜的反应为:8CuFeS2+2102 高温 . 8Cu+
以黄铜矿(CuFeS2)为原料冶炼铜的反应为:8CuFeS2+2102
8Cu+4FeO+2Fe2O3+16SO2高温 .
(1)已知CuFeS2中Cu为+2价,则反应中每生成lmolCu需要转移______mol电子.
(2)为综合利用炉气中的大量S02,下列方案合理的是______.
a.用浓硫酸吸收b.用于制备硫酸
c.高空排放 d.用纯碱液吸收制亚硫酸钠
(3)为检验所得矿渣中是否含有FeO、Fe2O3、CuO、A12O3、SiO2等氧化物,进行了以下实验;
①取一定量矿渣粉末,加入适量浓硫酸后加热,固体全部溶解,得溶液A;将产生的气体通入品红溶液中,溶液褪色.由此判断矿渣中一定含有______,一定没有______.
②将溶液A稀释后分成两份,取其中一份,加入过量NaOH溶液,有沉淀产生,静置后取上层清液,通入过量的CO2溶液变浑浊.写出通入过量的CO2所发生反应的离子方程式______.取另一份溶液加入过量的铁粉充分反应后过滤,得到的固体中有红色物质,写出反应的离子方程式______. cheng881231年前1
cheng881231年前1 -
 ning1155 共回答了19个问题
ning1155 共回答了19个问题 |采纳率94.7%解题思路:8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0,O元素的化合价由0降低为-2价,而Fe元素的化合价由+2价升高为+3价,S元素的化合价由-2价升高为+4价,该反应中参加反应8molCuFeS2转移100mol电子,以此来解答;高温 .
(1)反应中元素化合价升降,来求转移电子的总数;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;
(3)①根据①中加入适量浓硫酸后加热,固体全部溶解,知样品中一定没有SiO2;又知产生的气体能使品红溶液褪色,则该气体为SO2,原样品中应有还原性物质即FeO.
②根据②中加NaOH溶液有沉淀生成且上层清液通入过量的CO2时变浑浊,可知该沉淀为Al(OH)3,与CO2反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,原样品中含有Al2O3.根据③中有红色物质生成可判断原样品中含有CuO.8CuFeS2+21O2
高温
.
8Cu+4FeO+2Fe2O3+16SO2中,Cu元素的化合价由+2价降低为0,O元素的化合价由0降低为-2价,而Fe元素的化合价由+2价升高为+3价,S元素的化合价由-2价升高为+4价,该反应中参加反应8molCuFeS2转移100mol电子.
(1)该反应中参加反应8molCuFeS2转移100mol电子生成8molCu,则每生成lmolCu需要转移电子为[100/8]=12.5mol电子,故答案为:12.5;
(2)冶炼过程产生大量SO2.分析下列处理方案:
a.用浓硫酸不能吸收二氧化硫,故a不合理;
b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;
c.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故c错误;
d.用纯碱溶液吸收二氧化硫可以制Na2SO3,故d合理;
故答案为:b、d.
(3)①根据①中加入适量浓硫酸后加热,固体全部溶解,知样品中一定没有SiO2;又知产生的气体能使品红溶液褪色,则该气体为SO2,原样品中应有还原性物质即FeO,
故答案为:FeO;SiO2;
②根据②中加NaOH溶液有沉淀生成且上层清液通入过量的CO2时变浑浊,可知该沉淀为Al(OH)3,与CO2反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,原样品中含有Al2O3.根据③中有红色物质生成可判断原样品中含有CuO,另一份溶液加入过量的铁粉充分反应后过滤,得到的固体中有红色物质,反应的离子方程式为Fe+Cu2+═Fe2++Cu,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;Fe+Cu2+═Fe2++Cu.点评:
本题考点: 氧化还原反应的电子转移数目计算;常见的生活环境的污染及治理;几组未知物的检验.
考点点评: 本题考查氧化还原反应,为高考常见题型,侧重多元素化合价变化的氧化还原反应中电子转移数目的求解,把握元素的化合价变化即可解答,实验现象的判断,题目难度中等.1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是______(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是______(填代号).
a.高空排放b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:______、______(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是______.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸稀硫酸KSCN溶液KMnO4溶液NaOH溶液碘水
所选试剂为______.证明炉渣中含有FeO的实验现象为______. 天外星星1年前1
天外星星1年前1 -
 grey658 共回答了27个问题
grey658 共回答了27个问题 |采纳率92.6%解题思路:(1)反应中化合价降低的元素被还原;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;
(3)三价铁具有氧化性,能将碘离子氧化;
(4)a、氧化铝是两性氧化物,能和强酸以及强碱反应;
b、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;
(2)冶炼过程产生大量SO2.分析下列处理方案:
a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故a错误;
b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;
c.用纯碱溶液吸收二氧化硫可以制Na2SO4,故c合理;
d.用浓硫酸不能吸收二氧化硫,故d不合理;
故答案为:b、c.
(3)三价铁具有氧化性,能将碘离子氧化,S2O82-能将亚铁离子氧化,原理为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
(4)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++AI2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成四羟基合铝,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.点评:
本题考点: 铁的化学性质;含硫物质的性质及综合应用;制备实验方案的设计.
考点点评: 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.1年前查看全部
- (2013•德州模拟)黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石.为测定该黄铜矿的纯度,某同学设计了
(2013•德州模拟)黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石.为测定该黄铜矿的纯度,某同学设计了如图所示实验:

现用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的[1/10]置于锥形瓶中,用0.05mol•L-1标准碘溶液进行滴定,消耗标准碘溶液20.00mL.请回答下列问题:
(1)将样品研细后再进行反应,其目的是______;标准碘溶液应盛放在(填“碱式”或“酸式”)______滴定管中.
(2)装置a的作用是______.
A.除去空气中的二氧化碳
B.除去空气中的水蒸气
C.有利于气体混合
D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”)______,写出影响测定结果的化学方程式______.
(4)上述反应结束后,仍需通一段时间的空气,其目的是______.
(5)通过计算可知,该黄铜矿的纯度为______.
(6)假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有______. 多情冷风1年前1
多情冷风1年前1 -
 净化的空气 共回答了18个问题
净化的空气 共回答了18个问题 |采纳率94.4%解题思路:(1)增大固体的表面积可以加快化学反应速率;
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;
(3)去掉c装置气体中二氧化硫在水溶液中会和氧气反应;测定结果偏小;
(4)二氧化硫全部被吸收是实验成败的关键;
(5)二氧化硫和单质碘之间发生氧化还原反应,根据消耗碘单质的量可以确定二氧化硫的量,进而确定黄铜矿的纯度;
(6)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡.该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)将样品研细后再反应,即增大固体的表面积,目的是使原料充分反应、加快反应速率,故答案为:使原料充分反应、加快反应速率;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量,故答案为:BD;
(3)去掉c装置气体中二氧化硫在水溶液中会和氧气反应,反应的化学方程式为:2SO2+O2+H2O=2H2SO4,测定结果偏小,
故答案为:偏低;2SO2+O2+H2O=2H2SO4;
(4)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(5)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:[0.92g/1.15g]×100%=80%,故答案为:80%;
(6)用水吸收二氧化硫不充分,空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,用水吸收二氧化硫不充分,BaSO3被氧化成BaSO4.点评:
本题考点: 探究物质的组成或测量物质的含量;物质分离和提纯的方法和基本操作综合应用.
考点点评: 本题是一道关于物质的百分含量的综合考查题目,考查学生分析和解决问题的能力,难度较大.1年前查看全部
- 海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜
海底黑烟囱可在海底堆积硫化物的颗粒,形成多种金属矿产.若从海底黑烟囱附近的矿产物中分离出富铜矿CuFeS2,可用于冶炼铜,熔炼过程主要反应为:
2CuFeS2=Cu2S+2FeS+S…①2Cu2S+3O2=2Cu2O+2SO2…②
Cu2O+FeS=Cu2S+FeO③2FeS+3O2+SiO2=2FeO•SiO2+2SO2…④
2FeO+SiO2=2FeO•SiO2⑤Cu2S+2Cu2O=6Cu+SO2 ⑥
下列有关说法不正确的是( )
A. 上述反应均属于氧化还原反应
B. 该厂可同时建硫酸厂和炼铁厂
C. 该厂的原料除富铜矿外,还需空气和硅石
D. 反应④转移12e- chyping1年前1
chyping1年前1 -
 zhongwenli 共回答了16个问题
zhongwenli 共回答了16个问题 |采纳率87.5%解题思路:A.化学反应前后有元素化合价变化的一定是氧化还原反应;依据元素化合价变化分析反应判断;
B.根据工业上制备硫酸和炼铁原理进行解答;
C.根据冶炼铜,熔炼过程主要反应进行解答;
D.2FeS+3O2+SiO2=2FeO•SiO2+2SO2中S元素的化合价升高,氧气中O元素的化合价降低,据此分析进行解答.A.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价;②中S元素的化合价升高,氧气中O元素的化合价降低;③中,铜氧、硫、铁四种元素化合价未变,不是氧化还原反应;④中S元素的化合价升高,氧气中O元素的化合价降低;⑤中,氧、硅、铁三种元素化合价未变,不是氧化还原反应;⑥中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;则③⑤不是氧化还原反应,故A错误;
B.工业制硫酸常用接触法,先制气制取SO2,然后在接触室中进行的反应为2SO2+O2
催化剂
.
加热2SO3,最后用98.3%的硫酸吸收,①中的硫可制取二氧化硫,②④⑥产生二氧化硫,所以该厂可同时建硫酸厂;炼铁厂常以焦炭、赤铁矿(主要成分是氧化铁)、空气等为主要原料炼铁,反应①③④⑤均有氧化亚铁,能提供含铁的原料,所以该厂可同时建炼铁厂,故B正确;
C.硅石的主要成分为二氧化硅,从反应④⑥看出需硅石,从反应②④需氧气可知需空气,故C正确;
D.2FeS+3O2+SiO2=2FeO•SiO2+2SO2中FeS中S元素从-2价升高为二氧化硫中的+4价,2FeS转移12e-,氧气中O元素的化合价降低为-2价转移12e-,故D正确;
故选A.点评:
本题考点: 金属冶炼的一般原理;氧化还原反应;铜金属及其重要化合物的主要性质.
考点点评: 本题考查冶炼铜,熔炼过程,明确反应中的元素的化合价变化是解答本题的关键,注意选项D转移的电子数目为易错点,题目难度中等.1年前查看全部
- 复盐是怎样形成的 如CuFeS2
 长虹照影1年前1
长虹照影1年前1 -
 农妇山泉没有田 共回答了13个问题
农妇山泉没有田 共回答了13个问题 |采纳率100%使两种简单盐的混合饱和溶液结晶,可以制得复盐
复盐:由两种或两种以上的简单盐类组成的同晶型化合物,叫做复盐.复盐又叫重盐.复盐中含有大小相近、适合相同晶格的一些离子.例如,明矾(硫酸铝钾)是KAl(SO4)2·12H2O,莫尔盐(硫酸亚铁铵)是(NH4)2Fe(SO4)2·6H2O,铁钾矾(硫酸铁钾)是KFe(SO4)2·12H2O.复盐溶于水时,电离出的离子,跟组成它的简单盐电离出的离子相同.使两种简单盐的混合饱和溶液结晶,可以制得复盐.例如,使CuSO4和(NH4)2SO4的溶液混合结晶,能制得硫酸铜铵[(NH4)2SO4·CUSO4·6H2O].1年前查看全部
- 黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为:2CuFe
黄铜矿(CuFeS2)常用于提炼金属铜.黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为:2CuFeS2+O2
□+2FeS+SO2 (已配平),则下列关于该反应的说法错误的是( )高温 .
A.方框中的物质应为Cu2S
B.该反应的部分产物可用于硫酸工业
C.反应中O2只做氧化剂,CuFeS2只做还原剂
D.反应中若有1 mol SO2 生成,则一定有6 mol电子发生转移 sz_zwm1年前1
sz_zwm1年前1 -
 nancylem 共回答了16个问题
nancylem 共回答了16个问题 |采纳率93.8%解题思路:2CuFeS2+O2=□+2FeS+SO2中,O元素化合价由0降低为-2价,S元素的化合价升高,由-2价升高为+4价,根据质量守恒定律可知,方框中的物质应是Cu2S,以此解答该题.A.根据质量守恒定律可知,方框中的物质应是Cu2S,故A正确;
B.氧化硫与氧气反应生成三氧化硫,三氧化硫与水反应生成硫酸,则可用于硫酸工业,故B正确;
C.反应中Cu元素化合价由+2价降低到+1价,S元素化合价由-2价升高到+4价,则CuFeS2既是氧化剂也是还原剂,故C错误;
D.若有1 mol SO2生成,由S元素的化合价升高可知,由-2价升高为+4价,则反应中有1mol×(4+2)=6mol电子转移,故D正确.
故选C.点评:
本题考点: 氧化还原反应;含硫物质的性质及综合应用.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念及转移电子的考查,注意从元素化合价角度分析,题目难度不大.1年前查看全部
- CuFeS2、FeS2的 化学名称怎么读
 lujun861年前1
lujun861年前1 -
 hsq7273 共回答了22个问题
hsq7273 共回答了22个问题 |采纳率90.9%我只知道黄铜矿、黄铁矿.
硫酸亚铁,那是FeSO4
FeS的话,叫硫化亚铁
FeS2,可能得叫 亚硫化亚铁 吧.1年前查看全部
- (2008•山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(2008•山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是______(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是______(填代号).
a.高空排放b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:______、______(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是______.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸稀硫酸KSCN溶液KMnO4溶液NaOH溶液碘水
所选试剂为______.证明炉渣中含有FeO的实验现象为______. xksz6661年前1
xksz6661年前1 -
 丑得ll医大 共回答了21个问题
丑得ll医大 共回答了21个问题 |采纳率90.5%解题思路:(1)反应中化合价降低的元素被还原;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;
(3)三价铁具有氧化性,能将碘离子氧化;
(4)a、氧化铝是两性氧化物,能和强酸以及强碱反应;
b、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;
(2)冶炼过程产生大量SO2.分析下列处理方案:
a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故a错误;
b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;
c.用纯碱溶液吸收二氧化硫可以制Na2SO4,故c合理;
d.用浓硫酸不能吸收二氧化硫,故d不合理;
故答案为:b、c.
(3)三价铁具有氧化性,能将碘离子氧化,S2O82-能将亚铁离子氧化,原理为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
(4)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++AI2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成四羟基合铝,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.点评:
本题考点: 铁的化学性质;含硫物质的性质及综合应用;制备实验方案的设计.
考点点评: 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.1年前查看全部
- 黄铜(cufes2)在空气中加热.的化学方程式.
 哪里的木头船1年前2
哪里的木头船1年前2 -
 侠士跟 共回答了23个问题
侠士跟 共回答了23个问题 |采纳率91.3%2Zn+O2=加热=2ZnO;
2Cu+O2=加热=2CuO1年前查看全部
- thanks17.用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe
thanks
17.用硫酸铁电化浸出黄铜矿精矿工艺中,精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+===Cu2++5Fe2++2S.下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.还原剂是S2-氧化剂是Fe3+
C.氧化产物是S,还原产物是Cu2+和Fe2+
D.当转移1 mol电子时,46 g CuFeS2参加反应 txyypp1年前1
txyypp1年前1 -
 edison_wly 共回答了18个问题
edison_wly 共回答了18个问题 |采纳率94.4%CuFeS2中,Cu和Fe都是+2价,
A,错误.只有Fe3+被还原,不是所有铁
B,正确.还原剂是S2-
C,错误.还原产物只有Fe2+
D,正确.转移4 mol电子时,有184gCuFeS2参加反应,1mol就是46 g
选择BD
本题有争议.主要出在CuFeS2的化合价上.1年前查看全部
- 工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质.
工业上可用黄铜矿(CuFeS2)冶炼铜,同时还可得到多种物质.
工业冶炼铜的化学方程式是:8CuFeS2+2lO2
8Cu+4FeO+2Fe2O3+16SO2高温 .
(1)CuFeS2中Fe的化合价为+2,反应中被还原的元素是氧元素和______.
(2)用少量黄铜矿冶炼铜产生的炉渣(主要含Fe2O3、FeO、SiO2、Al2O3)模拟制铁红(Fe2O3),进行如下实验.
①滤液中的阳离子有Fe3+、Fe2+、H+、______.
②为确认滤液中含Fe2+,下列实验方案和预期现象正确的是______(填序号).
③滤液在酸性条件下,与H2O2反应的离子方程式是______.实验方案 预期现象 a 加NaOH溶液 产生白色沉淀,变灰绿再变红褐 b 先加KSCN溶液,再加氯水 先无明显现象,后变红 c 加酸性KMnO4溶液 紫色褪去 d 先加氯水,再加KSCN溶液 溶液先变黄,再变红
(3)冶炼铜过程中产生大量的SO2可用于制硫酸,尾气可用纯碱溶液吸收.已知用1L1mol/L的纯碱溶液吸收SO2,生成n(Na2SO3):n(NaHSO3)=1:2,则吸收的SO2物质的量是______mol. csclxl1年前1
csclxl1年前1 -
 定点清除 共回答了16个问题
定点清除 共回答了16个问题 |采纳率93.8%解题思路:(1)CuFeS2中Fe的化合价为+2,根据反应8CuFeS2+2lO2
8Cu+4FeO+2Fe2O3+16SO2中元素化合价变化判断反应中被还原的元素;高温 .
(2)①炉渣主要含Fe2O3、FeO、SiO2、Al2O3,然后根据与过量稀硫酸的反应判断滤液中的阳离子;
②根据亚铁离子检验还原性判断,注意滤液中含有铁离子,需要排除铁离子的干扰;
③亚铁离子能够与双氧水发生氧化还原反应生成铁离子、水,据此写出反应的离子方程式;
(3)碳酸钠与二氧化硫反应生成亚硫酸钠、亚硫酸氢钠,根据钠原子守恒及n(Na2SO3):n(NaHSO3)=1:2列式计算出二氧化碳的物质的量.(1)黄铜矿冶炼得到粗铜的一步反应为:8CuFeS2+21O2
高温
.
8Cu+4FeO+2Fe2O3+16SO2,若CuFeS2中的Fe的化合价为+2价,则铜的化合价为+2价,硫的化合价为-1价,氧气中氧元素的化合价为0价,产物中铜的化合价为0价,氧化亚铁中铁的化合价为+2价,氧元素为-2价,三氧化二铁中铁的元素化合价为+3价,氧元素为-2价,二氧化硫中硫元素的化合价为+4价,氧元素为-2价,根据氧化还原反应规律,化合价降低的发生还原反应,所以反应中被还原的元素是:Cu、O,
故答案为:铜元素;
(2)①炉渣中要含Fe2O3、FeO、SiO2、Al2O3和稀硫酸反应生成硫酸铁、硫酸亚铁和硫酸铝,所以滤液中含有的阳离子有:Fe3+、Fe2+、H+、Al3+,
故答案为:Al3+;
②a.由于溶液中含有Fe3+、Fe2+、H+、Al3+,所以a中加入氢氧化钠溶液后生成氢氧化铁红褐色沉淀会掩盖氢氧化亚铁沉淀,故a产物;
b.溶液中含有铁离子,因此加KSCN溶液显红色,无法据此检验铁离子,故b产物;
C.亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,故C正确;
d.溶液中含有铁离子,原溶液显黄色,无法据此检验亚铁离子,故d产物,
故答案为:c;
③双氧水具有氧化性,亚铁离子具有还原性,能氧化亚铁离子生成铁离子,反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)设SO2的物质的量是x,n(Na2SO3):n(NaHSO3)=1:2,根据S原子守恒可知:亚硫酸钠为[x/3]mol,亚硫酸氢钠为[2x/3]mol,
碳酸钠的物质的量为:1L×1mol/L=1mol,
根据钠原子守恒可知:[x/3]mol×2+[2x/3]mol=2mol,
解得:x=1.5mol,
故答案为:1.5.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;二价Fe离子和三价Fe离子的检验;铁及其化合物的性质实验.
考点点评: 本题考查了物质的分离提纯方法及基本操作方法的综合应用,为中等难度的试题,试题贴近高考,综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和训练,意在培养学生分析、归纳、总结问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力.1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2C
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.工业上以黄铜矿为原料,采用火法熔炼工艺生产铜时发生如下反应:2Cu2O+Cu2S
6Cu+SO2↑.高温 .
Ⅰ.反应产生的SO2是大气污染物,可用NaOH溶液吸收得到NaHSO3.常温下,0.1mol•L-1NaHSO3溶液的pH小于7,则溶液中c(H2SO3)______c(SO32-)(填“>”、“=”或“<”),原因是______.
Ⅱ.黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制.
(1)请完成下列粗铜电解得到精铜的原理:电解池中______作阴极.
(2)精炼铜产生的废液中含有Fe2+、Fe3+、Cu2+等金属阳离子.已知25℃时如下数据,请完成下列问题:
在25℃下,向浓度均为0.1mol•L-1的FeCl2和CuCl2混合溶液中逐滴加入氨水,先生成______沉淀(填化学式),生成该沉淀的离子方程式为______.物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp 8.0×10-16 2.2×-20 4.0×10-38  幸福是种感觉1年前1
幸福是种感觉1年前1 -
 caodifeiqian 共回答了22个问题
caodifeiqian 共回答了22个问题 |采纳率100%解题思路:Ⅰ.常温下,0.1mol•L-1NaHSO3溶液的pH小于7,说明HSO3-电离程度大于水解程度;
Ⅱ.(1)精炼粗同时,粗铜为阳极,纯铜为阴极;
(2)溶度积越小,越先生成沉淀.Ⅰ.已知NaHSO3中的HSO3-既能电离又能水HSO3-⇌H++SO32-电离显酸性,HSO3-+H2O⇌H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),
故答案为:<;NaHSO3溶液中HSO3-电离程度大于水解程度;
Ⅱ.(1)精炼粗同时,粗铜为阳极,纯铜为阴极,故答案为:纯铜;
(2)Cu(OH)2因溶度积较小,则滴加氨水时首先生成Cu(OH)2沉淀,反应的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+,
故答案为:Cu(OH)2;Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.点评:
本题考点: 二氧化硫的污染及治理;难溶电解质的溶解平衡及沉淀转化的本质;铜金属及其重要化合物的主要性质.
考点点评: 本题考查较为综合,涉及二氧化硫的污染及治理、铜的精炼以及难溶电解质的溶解平衡问题,为高考常见题型,侧重于学生的分析能力的考查,注意相关基础知识的学习,难度不大.1年前查看全部
- CuFeS2 这个化学式叫什么?
 qazqaz0031年前1
qazqaz0031年前1 -
 lyc778 共回答了21个问题
lyc778 共回答了21个问题 |采纳率90.5%就是黄铜矿的化学分子式
黄铜矿的化学成分是CuFeS2,晶体属四方晶系的硫化物矿物.单个晶体很少见,集合体常为不规则的粒状或致密块状.黄铜色,表面常有斑驳的蓝、紫、褐色的锖色膜,条痕绿黑色,金属光泽.1年前查看全部
- (2014•湖南一模)高温下焙烧CuFeS2的反应之一为:2CuFeS2+7O2═CuSO4+CuO+Fe2O3+3SO
(2014•湖南一模)高温下焙烧CuFeS2的反应之一为:2CuFeS2+7O2═CuSO4+CuO+Fe2O3+3SO2,下列关于该反应的叙述正确的是( )
A.CuFeS2中硫的化合价为-1
B.CuFeS2发生还原反应
C.1mol CuFeS2完全反应转移13mol电子
D.CuSO4和SO2既是氧化产物,又是还原产物 其农1年前1
其农1年前1 -
 小部 共回答了17个问题
小部 共回答了17个问题 |采纳率100%解题思路:由2CuFeS2+7O2═CuSO4+CuO+Fe2O3+3SO2,可知Fe元素的化合价由+2价升高为+3价,S元素的化合价由-2价升高为+4价、+6价,O元素的化合价由0降低为-2价,以此来解答.A.CuFeS2中CuFe均为+2价,由化合物中正负化合价的倒数和为0可知,硫的化合价为-2,故A错误;B.Fe元素的化合价升高,S元素的化合价升高,则CuFeS2发生氧化反应,故B错误;C.由反应可知,1mol CuFeS2完全反应...
点评:
本题考点: 氧化还原反应.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子的考查,选项C为易错点,题目难度不大.1年前查看全部
- 冶炼黄铜矿中黄铜矿(CuFeS2)与氧气反应的方程式用氧化还原法怎么配平
 披着狼皮的熊1年前1
披着狼皮的熊1年前1 -
 嘿嘿米奇老鼠 共回答了18个问题
嘿嘿米奇老鼠 共回答了18个问题 |采纳率88.9%2CuFeS2+ 4O2==Cu2S+3SO2+2FeO
这个方程式太过复杂,化合价很难确定,升降价变化多,因此不建议氧化还原法配平!
我们可以考虑最简单的方法:归一法!
先设最复杂的化合物CuFeS2的的系数是1,铜元素守恒得到Cu2S是1/2,硫元素守恒得到SO2的系数是3/2,铁元素守恒得到FeO的系数是1,氧元素守恒得到O2的系数是2,全部系数乘以2得到
2CuFeS2+ 4O2==Cu2S+3SO2+2FeO,完成!
当然了,在不同条件下生成物也不同,
5O2+2CuFeS2==4SO2+2FeO+2Cu
4CuFeS2 + 13O2 == 4CuO + 2Fe2O3+ 8SO2
也可以这样配平~LZ试试吧~不会可以Hi我!1年前查看全部
- CuFeS2是什么?
 shenxialiang1年前1
shenxialiang1年前1 -
 胡歌婚介人 共回答了17个问题
胡歌婚介人 共回答了17个问题 |采纳率88.2%就是黄铜矿的化学分子式
黄铜矿的化学成分是CuFeS2,晶体属四方晶系的硫化物矿物.单个晶体很少见,集合体常为不规则的粒状或致密块状.黄铜色,表面常有斑驳的蓝、紫、褐色的锖色膜,条痕绿黑色,金属光泽.1年前查看全部
- CuFeS2与O2高温下反应的化学方程式
 灵魂在你中1年前1
灵魂在你中1年前1 -
 mm真的能唱歌吗 共回答了18个问题
mm真的能唱歌吗 共回答了18个问题 |采纳率88.9%2 CuFeS2+4O2===Cu 2S+3S O2+2Fe O1年前查看全部
- 黄铜矿的化学式为何要写成CuFeS2,能否写成FeCuS2
 燕xiaoxiao1年前3
燕xiaoxiao1年前3 -
 特丽珑 共回答了19个问题
特丽珑 共回答了19个问题 |采纳率94.7%KAl(SO4)2.十二水合硫酸铝钾,K的化合价低...
Cu和Fe...一样的.我觉得是不可以...1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物.
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫和铁的化合物.
(1)冶炼铜的反应为:8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是______(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是______(填代号).
a.高空排放b.用于制备硫酸c.用纯碱溶液吸收制Na2SO3d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣、过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
根据以上信息回答下列问题:
a.除去Al3+的离子方程式是Al3++4OH-═AlO
+2H2O−2Al3++4OH-═AlO.
+2H2O−2
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为______.证明炉渣中含有FeO的实验现象为______. 日不落hh1年前1
日不落hh1年前1 -
 南路 共回答了22个问题
南路 共回答了22个问题 |采纳率100%解题思路:(1)反应中化合价降低的元素被还原;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;
(3)a、氧化铝是两性氧化物,能和强酸以及强碱反应,利用氢氧化钠使其变为偏铝酸根即可;
b、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;
(2)冶炼过程产生大量SO2.分析下列处理方案:
a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故a错误;
b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;
c.用纯碱溶液吸收二氧化硫可以制Na2SO4,故c合理;
d.用浓硫酸不能吸收二氧化硫,故d不合理;
故答案为:b、c.
(3)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++Al2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成偏铝酸根,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.点评:
本题考点: 铜金属及其重要化合物的主要性质;制备实验方案的设计.
考点点评: 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.1年前查看全部
- (2014•山东一模)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.其中炉渣的主要成分是Fe0、Fe203、S
(2014•山东一模)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一.其中炉渣的主要成分是Fe0、Fe203、Si02、Al203.各物质有如下转化关系,

请回答:
(1)写出能证明SO2具有氧化性且现象明显的化学方程式______.
(2)用NaOH溶液吸收SO2,所得NaHSO3溶液pH<7,则该溶液中存在离子的物质的量 浓度由大到小的顺序是______.
(3)写出Cu2S熔炼制取粗铜的化学方程式Cu2S+O2
2Cu+SO2高温 .Cu2S+O2
2Cu+SO2高温 .
(4)废电解液中常含有Pb2+、Zn2+,向废电解液中加入Na2S溶液,当有PbS和ZnS沉淀时,C(Zn2+):C(Pb2+)=______.已知:Ksp(PbS)=3.4×10-28mol•L-2,Ksp(Zns)=1.6×10-24mol•L-2.
(5)写出证明溶液I中含有Fe2+的实验过程______o
(6)Na2FeO4能杀菌净水的原因是______
(7)Na2FeO4和Zn可以组成碱性电池,其反应式为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-.请写出放电时正极电极反应式______. shallphone1年前1
shallphone1年前1 -
 包包195 共回答了16个问题
包包195 共回答了16个问题 |采纳率93.8%解题思路:(1)根据二氧化硫与硫化氢的水溶液发生反应生成单质硫沉淀;
(2)NaHSO3溶液呈酸性,说明亚硫酸氢根离子水解程度小于电离程度,然后根据电离平衡和水解平衡分析解答.
(3)工业上可用Cu2S和O2反应制取粗铜,说明亚铜被还原,硫元素被氧化,依据氧化还原反应的化合价升降守恒分析书写判断;
(4)根据C(Zn2+):C(Pb2+)=
;Ksp(Zns) Ksp(Pbs)
(5)根据酸性KMnO4溶液能氧化Fe2+,溶液颜色褪去;
(6)根据Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用.,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;
(7)依据原电池反应,3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-,正极上FeO42-发生还原反应;(1)二氧化硫与硫化氢的水溶液发生反应生成单质硫沉淀:SO2+2H2S=3S↓+2H2O,SO2体现了氧化性且现象明显,故答案为:SO2+2H2S=3S↓+2H2O;
(3)NaHSO3溶液中亚硫酸氢根离子无论电离还是水解都是较微弱的,NaHSO3溶液呈酸性,说明亚硫酸氢根离子水解程度小于电离程度,所以c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(2)工业上可用Cu2S和O2反应制取粗铜,元素化合价铜元素化合价降低,硫XYZ元素化合价升高,氧气中氧元素化合价降低,说明亚铜被还原,硫元素被氧化,发生的氧化还原反应为Cu2S+O2
高温
.
2Cu+SO2,故答案为:Cu2S+O2
高温
.
2Cu+SO2;
(4)C(Zn2+):C(Pb2+)=
Ksp(Zns)
Ksp(Pbs)=
1.6×10 −24
3.4×10 −28=4.7×10-3;
(5)酸性KMnO4溶液能氧化Fe2+,溶液颜色褪去,故答案为:取少量溶液于试管中,然后滴加少量酸性KMnO4溶液,紫色褪去,证明有Fe2+;
(6)Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;故答案为:Na2FeO4是可溶于水的强氧化剂,在水中有杀菌消毒的作用,其还原产物主要是Fe3+,会水解形成Fe(OH)3胶体,Fe(OH)3胶体,能吸附水中的悬浮的固体颗粒;
(7)反应原理为:3Zn+2FeO42-+8H20═3Zn(OH)2+2Fe(0H)3+40H-,正极电极反应式为:FeO42-+3e-+4H2O═Fe(OH)3+5OHˉ,故答案为:FeO42-+3e-+4H2O═Fe(OH)3+5OH-.点评:
本题考点: 二氧化硫的化学性质;难溶电解质的溶解平衡及沉淀转化的本质;二价Fe离子和三价Fe离子的检验.
考点点评: 本题考查学生阅读题目获取信息的能力、氧化还原反应、原电池的工作原理的应用,电极反应,电极产物的判断等,难度中等,要求学生要有扎实的基础知识和灵活运用知识解决问题的能力.注意基础知识的全面掌握.1年前查看全部
- 黄铜矿(CuFeS2)是制取铜的主要原料,还可制备硫及铁的化合物.
黄铜矿(CuFeS2)是制取铜的主要原料,还可制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Cu、Fe的化合价均为+2,反应中被氧化的元素有______(填元素符号).
(2)上述冶炼过程中产生大量的SO2,下列关于SO2的说法中正确的是______(填字母).
a.可处理后用于消毒杀菌
b.可排放到空气中消灭害虫
c.可处理后用于漂白织物
d.可用KMnO4溶液吸收制浓硫酸
(3)过二硫酸钾(K2S2O8)具有强氧化性,经少量K2S2O8处理过的KI溶液遇淀粉变蓝色,写出K2S2O与KI溶液反应的离子方程式:______.
(4)用冶炼铜反应的固体产物配制FeCl2溶液,首先用______处理,然后过滤,再向溶液中加入过量的______.FeCl2溶液长期放置会变质,溶液变成棕黄色.检验FeCl2溶液已变质加入______,溶液中立即出现______现象.
(5)将足量的SO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随SO2体积(已换算成标准状况,不考虑溶液体积变化)的变化曲线如图所示:
①NaOH溶液的物质的量浓度为______mol•L-1;
②n(SO2):n(NaOH)=1:2,反应对应M点的纵坐标______7(填“<”、“=”或“>”);
③N点溶液中含有的阴离子除OH-外,还有______(填化学式). 心情使者1年前1
心情使者1年前1 -
 陈可心 共回答了10个问题
陈可心 共回答了10个问题 |采纳率80%解题思路:(1)在氧化还原反应中,化合价升高的元素被氧化;
(2)根据二氧化硫的性质和作用来回答;
(3)过二硫酸钾(K2S2O8)具有强氧化性,碘离子具有还原性,根据氧化还原反应知识来回答;
(4)FeO和Fe2O3都能和盐酸反应生成对应的盐,三价铁可以和金属铁反应生成亚铁离子,三价铁离子遇到硫氰酸钾显示红色;
(5)①根据氢氧化钠溶液的pH计算溶液的浓度;
②当n(SO2):n(NaOH)=1:2时,二者发生反应生成亚硫酸钠和水,亚硫酸钠会发生水解反应;
③根据二氧化硫的量以及氢氧化钠的量之间的关系来判断化学反应后的产物.(1)在氧化还原反应中,化合价升高的元素Fe、S,被氧化,故答案为:Fe、S;(2)a.二氧化硫处理后用于消毒杀菌,故a正确;b.二氧化硫有毒,不可排放到空气中,故b错误;c.二氧化硫具有漂白性,可处理后用于漂白...
点评:
本题考点: 含硫物质的性质及综合应用;氧化还原反应;二氧化硫的化学性质.
考点点评: 本题综合考查学生氧化还原反应知识以及元素及化合物知识,属于综合知识的考查,难度大.1年前查看全部
- CuFeS2在空气中燃烧方程式当C、H、S、Fe、Cu等元素氧化后,生成稳定的氧化物分别是CO2、H2O、SO2、Fe2
CuFeS2在空气中燃烧方程式
当C、H、S、Fe、Cu等元素氧化后,生成稳定的氧化物分别是CO2、H2O、SO2、Fe2O3、CuO等.黄铁矿(主要成分为CuFeS2)在空气中燃烧,反应的生成物都是每种元素的稳定氧化物.写出反应的化学方程式 龙恨情怀1年前1
龙恨情怀1年前1 -
 yinyang 共回答了21个问题
yinyang 共回答了21个问题 |采纳率95.2%4CuFeS2+13O2=4CuO+2Fe2O3+8SO2
用氧化还原法配平就可以1年前查看全部
- 12.5g黄铜矿经测含3.6g硫(杂质吧含硫),矿样中CuFeS2的质量分数为多少.请详解
 念念忘返1年前1
念念忘返1年前1 -
 飘零的天空幻 共回答了13个问题
飘零的天空幻 共回答了13个问题 |采纳率100%设,矿样中CuFeS2的质量是Xg
X*64/(64+56+32*2)*100%=3.6
X=10.35g
矿样中CuFeS2的质量分数为10.35/12.5*100%=82.8%1年前查看全部
- 化学反应式的配平细菌在氧气存在的条件下将黄铁矿CuFeS2氧化为硫酸盐,铜离子为二价,铁离子为三价,反应在酸性条件下进行
化学反应式的配平
细菌在氧气存在的条件下将黄铁矿CuFeS2氧化为硫酸盐,铜离子为二价,铁离子为三价,反应在酸性条件下进行,求离子反应式. akxwz1年前1
akxwz1年前1 -
 独语斜栏 共回答了26个问题
独语斜栏 共回答了26个问题 |采纳率84.6%17O2+4CuFeS2+4H(+)=4Cu(2+)+4Fe(3+)+8SO4(2-)+2H2O
Cu(2+)表示铜离子1年前查看全部
- 火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
火法炼铜可以从黄铜矿(CuFeS2)或辉铜矿(Cu2S)中提取铜,发生如下反应:
①2CuFeS2+4O2
Cu2S+3SO2+2FeO800℃ .
②2Cu2S+3O2
2Cu2O+2SO21200℃ .
③2Cu2O+Cu2S
6Cu+SO2↑1200℃ .
下列说法正确的是( )
A. 反应②、③中,Cu2S都只做还原剂
B. 1mol CuFeS2生成1molCu,理论上消耗2.5mol O2
C. 1mol Cu2S和O2反应生成2molCu转移的电子数为4mol
D. 反应①中,共转移的电子数为16mol,CuFeS2中铜元素的化合价为+2 moon_男孩1年前1
moon_男孩1年前1 -
 bgszcj 共回答了14个问题
bgszcj 共回答了14个问题 |采纳率100%解题思路:A.②中S元素的化合价升高,O元素的化合价降低;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,以此分析;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价;
D.反应①中,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价升高.A.②中S元素的化合价升高,O元素的化合价降低,Cu2S只做还原剂;③中,Cu2S中Cu元素的化合价降低,S元素的化合价升高,Cu2S既是还原剂又是氧化剂,故A错误;
B.由反应可知,存在6Cu~3Cu2S~6CuFeS2~15O2,则1mol CuFeS2生成1molCu,理论上消耗2.5molO2,故B正确;
C.Cu元素由+1价降低为0,O元素的化合价降低,而S元素的化合价由-2价升高为+4价,则转移的电子数为1mol×[4-(-2)]=6mol,故C错误;
D.反应①中,CuFeS2中铜元素的化合价为+2,Cu元素的化合价降低,O元素的化合价降低,S元素的化合价由-2价升高为+4价,2molCuFeS2反应转移电子为24mol,故D错误;
故选B.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应及计算,明确反应中的元素的化合价变化是解答本题的关键,注意电子守恒、原子守恒的应用,选项D为易错点,题目难度较大.1年前查看全部
- 黄铜矿(主要成分CuFeS2)是提取铜的主要原料
黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为______;
(2)已知2CuFeS2+4O2
Cu2S+3SO2+2FeO(炉渣)产物Cu2S在1200℃高温下继续反应:2Cu2S+3O2→2Cu2O+2SO2;2Cu2O+Cu2S→6Cu+SO2;800℃
假定各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,求消耗O2的物质的量______;
②6mol CuFeS2和14.25mol O2反应,理论上可得到______摩尔铜;
③6mol CuFeS2和15.75mol O2反应,理论上可得到______摩尔铜. 772327681年前1
772327681年前1 -
 bw**83a_dv_25f2 共回答了12个问题
bw**83a_dv_25f2 共回答了12个问题 |采纳率100%解题思路:(1)m(样品)×ω(CuFeS2)×CuFeS2中S元素的质量分数=m(S);
(2)①由反应可知,最终CuFeS2与O2反应的最终成为FeO、Cu、SO2,根据原子守恒计算n(FeO)、n(SO2),根据O原子守恒可知2n(O2)=n(FeO)+n(SO2);
②③根据方程式计算6mol CuFeS2消耗O2的物质的量、生成Cu2S的物质的量,进而计算剩余O2的物质的量.根据2Cu2S+3O2=2Cu2O+2SO2计算反应的Cu2S的物质的量、生成Cu2O的物质的量,进而计算剩余Cu2S的物质的量,再根据2Cu2O+Cu2S→6Cu+SO2进行过量计算.(1)12.5g×ω(CuFeS2)×[64/64+56+64]=3.6g,解得ω(CuFeS2)=82.8%,
故答案为:82.8%;
(2)①由反应可知,最终CuFeS2与O2反应的最终成为FeO、Cu、SO2,根据原子守恒n(FeO)=n(CuFeS2)=6mol,n(SO2)=2n(CuFeS2)=mol,根据O原子守恒可知2n(O2)=n(FeO)+2n(SO2)=6mol+12mol×2,故n(O2)=15mol,
故答案为:15;
②2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol12mol 3mol
故剩余氧气为14.25mol-12mol=2.25mol,生成Cu2S为3mol,
2Cu2S+3O2=2Cu2O+2SO2;
3mol 4.5mol
故氧气不足,故氧气完全反应,生成Cu2O为2.25mol×[2/3]=1.5mol,剩余Cu2S为3mol-1.5mol=1.5mol,
2Cu2O+Cu2S=6Cu+SO2;
1.5mol 0.75mol
故氧化亚铜完全反应,生成铜1.5mol×[6/2]=4.5mol,
故答案为:4.5;
③2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol12mol 3mol
故剩余氧气为15.75mol-12mol=3.75mol,生成Cu2S为3mol,
2Cu2S+3O2=2Cu2O+2SO2;
3mol 4.5mol
故氧气不足,故氧气完全反应,生成Cu2O为3.75mol×[2/3]=2.5mol,剩余Cu2S为3mol-2.5mol=0.5mol,
2Cu2O+Cu2S=6Cu+SO2;
1mol 0.5mol
故氧化亚铜有剩余,生成铜0.5mol×6=3mol,
故答案为:3.点评:
本题考点: 有关混合物反应的计算;化学方程式的有关计算.
考点点评: 本题考查混合物的有关计算,题目过程复杂,计算量很大,为易错题目,对学生的心理素质有较高的要求,注意原子守恒计算与过量计算.1年前查看全部
- 某矿石(CuFeS2)中含硫元素29.75%,求该矿石中铜元素的质量分数
某矿石(CuFeS2)中含硫元素29.75%,求该矿石中铜元素的质量分数
某硝酸铵样品中NH4NO3的纯度为90%,求此样品中氮元素的质量分数 DawsonJack1年前1
DawsonJack1年前1 -
 leiqianyu 共回答了14个问题
leiqianyu 共回答了14个问题 |采纳率92.9%1、方法一:设硫的质量为a,则
矿石的质量=10000a/2975
铜元素的质量=(a/0.3478)×0.3478=a(在CuFeS2中硫和铜的质量分数都为34.78%)
铜元素的质量分数=[a/(10000a/2975)]×100%=29.75%
方法二:在CuFeS2中硫和铜的质量分数都为34.78%
故m(铜)=m(硫),所以铜元素的质量分数=硫元素的质量分数=29.75%
2、方法一:设硝酸铵样品的质量为a,则
氮元素的质量=a×90%×35%=0.315a (在NH4NO3中氮元素的质量分数为35%)
氮元素的质量分数=(0.315a/a)×100%=31.5%
方法二:在NH4NO3中氮元素的质量分数为35%,同时硝酸铵样品中NH4NO3的纯度为90%,
所以,氮元素的质量分数=35%×90%=31.5%1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为:
8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是______(填元素符号).
(2)上述冶炼过程产生大量SO2.下列处理方案中合理的是______(填代号).
a.高空排放b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:S2O82-+2I-=2SO42-+I2.
通过改变反应途径,Fe3+、Fe2+均可催化上述反应.试用离子方程式表示Fe3+对上述反应催化的过程:______、______(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3.
a.除去Al3+的离子方程式是______.
b.选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸稀硫酸KSCN溶液KMnO4溶液NaOH溶液碘水
所选试剂为______.证明炉渣中含有FeO的实验现象为______. sdu_xuhui1年前1
sdu_xuhui1年前1 -
 东巴龙 共回答了20个问题
东巴龙 共回答了20个问题 |采纳率100%解题思路:(1)反应中化合价降低的元素被还原;
(2)冶炼过程产生大量SO2,处理方案中合理的分析是二氧化硫是污染性气体,不能排放到空气中,可以吸收利用;
(3)三价铁具有氧化性,能将碘离子氧化;
(4)a、氧化铝是两性氧化物,能和强酸以及强碱反应;
b、亚铁离子能被高锰酸钾溶液氧化,使的高锰酸钾溶液褪色.(1)化合价降低的元素Cu、O,在反应中被还原,故答案为:Cu、O;
(2)冶炼过程产生大量SO2.分析下列处理方案:
a.二氧化硫是污染性气体,高空排放会污染空气,处理不合理,故a错误;
b.可以利用吸收二氧化硫生成硫酸,用于制备硫酸,故b合理;
c.用纯碱溶液吸收二氧化硫可以制Na2SO4,故c合理;
d.用浓硫酸不能吸收二氧化硫,故d不合理;
故答案为:b、c.
(3)三价铁具有氧化性,能将碘离子氧化,S2O82-能将亚铁离子氧化,原理为:2Fe3++2I-=2Fe2++I2,S2O82-+2Fe2+=2SO42-+2Fe3+,
故答案为:2Fe3++2I-=2Fe2++I2;S2O82-+2Fe2+=2SO42-+2Fe3+;
(4)a.氧化铝是两性氧化物,能和强酸以及强碱反应,6H++AI2O3=3H2O+2Al3+,除去铝离子的反应是利用过量氢氧化钠溶液和铝离子反应生成四羟基合铝,
故答案为:Al3++4OH-=2H2O+AlO2-;
b.高锰酸钾溶液能氧化亚铁离子,使得高锰酸钾溶液褪色,故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色.点评:
本题考点: 铁的化学性质;含硫物质的性质及综合应用;制备实验方案的设计.
考点点评: 本题是对金属的化学性质的考查,要求学生熟记教材知识,学以致用,综合性较强,难度中等.1年前查看全部
- 黄铜矿(主要成分CuFeS2)是提取铜的主要原料. 问:已知2 CuFeS2+4O2===Cu 2S+3S O2+2Fe
黄铜矿(主要成分CuFeS2)是提取铜的主要原料. 问:已知2 CuFeS2+4O2===Cu 2S+3S O2+2Fe O 产物Cu S2在1
200度高温下继续反应:
2Cu S2+3 O2==== 2Cu2 O+2 S O2
2Cu2 O+ Cu2 S====6 Cu+ S O2
假设各步反应都完全,完成下列计算:
①由6mol CuFeS2生成6mol Cu,需消耗O2的物质的量是多少?
② 6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜?
③ 6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜? 134724106101年前1
134724106101年前1 -
 舞之魂200 共回答了21个问题
舞之魂200 共回答了21个问题 |采纳率85.7%①由第一个得 6mol和12mol O2生成3mol Cu2S6CuFeS2+12O2===3Cu2S+9SO2+6FeO2mol Cu2S和3mol O2生成2mol Cu2O2Cu2S+3O2===2Cu2O+2SO22mol Cu2O和1mol Cu2S最终生成6mol Cu2Cu2O+Cu2S===6Cu+SO2所以整个过程中共消耗O2...1年前查看全部
- (2011•福建模拟)某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S.下列说法正确的是(
(2011•福建模拟)某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S.下列说法正确的是( )
A.氧化剂为Fe3+,还原剂为Cu2+和S2+
B.氧化产物是S,还原产物是Fe2+和Cu2+
C.当转移1mol电子时,有46gCuFeS2参加反应
D.氧化剂的氧化性Fe3+>Fe2+>Cu2+ 肥肥妹1年前1
肥肥妹1年前1 -
 工453 共回答了25个问题
工453 共回答了25个问题 |采纳率96%解题思路:CuFeS2中Cu、Fe的化合价都为+2价,S元素的化合价为-2价,反应CuFeS2+4Fe3+=5Fe2++Cu2++2S中,S元素化合价升高,Fe元素化合价降低,从化合价变化的角度分析氧化还原反应.A.反应CuFeS2+4Fe3+=5Fe2++Cu2++2S中,S元素化合价升高,Fe元素化合价降低,氧化剂为Fe3+,还原剂为CuFeS2,故A错误;B.氧化产物是S,还原产物是Fe2+,Cu元素化合价没有变化,故B错误;C.n(CuFeS2)=46g184g/mol...
点评:
本题考点: 氧化还原反应;氧化性、还原性强弱的比较.
考点点评: 本题考查氧化还原反应知识,题目难度不大,本题注意把握氧化还原反应的判断角度,注意化合价的判断.1年前查看全部
- 黄铜矿CuFeS2可用于冶炼铜,冶炼原理为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2.
黄铜矿CuFeS2可用于冶炼铜,冶炼原理为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2.
(1)黄铜矿冶炼铜产生的炉渣中主要含Fe2O3、FeSiO3、SiO2、Al2O3等,请完成以下验证炉渣中含有+2价的铁的探究过程中的有关问题:
仅限选择的试剂有:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水
①应选用试剂为______.
②有关的实验现象为______.
(2)据报道,有一种叫ThibacillusFerroxidans的细菌在氧气存在下,酸性溶液中,将黄铜矿CuFeS2氧化成硫酸盐:4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.利用反应后的溶液,按如图所示流程可制备胆矾(CuSO4•5H2O):
①操作a的名称是______,操作b的操作方法是______.
②检验溶液B中Fe3+是否被除尽的试剂是______,证明Fe3+已被除尽的现象是______.
③在实验室中,设计两个原理不同的方案,从溶液B中提炼金属铜(要求:一种方案只用一个反应来完成).写出两种方案的化学方程式:
方案一:______;
方案二:2CuSO4+2H2O
2Cu+O2↑+2H2SO4通电 .2CuSO4+2H2O.
2Cu+O2↑+2H2SO4通电 . 带着我飞1年前1
带着我飞1年前1 -
 cmwlg 共回答了22个问题
cmwlg 共回答了22个问题 |采纳率86.4%解题思路:(1)①亚铁离子能被高锰酸钾溶液氧化,高锰酸钾溶液被亚铁离子还原溶液褪色;
②选择硫酸和高锰酸钾溶液,可以和亚铁离子反应溶液褪色;
(2)①依据流程分析,操作a是得到氢氧化铁沉淀和溶液B,说明是过滤操作;操作b是溶液中得到晶体的方法,利用浓缩溶液结晶析出;
②依据铁离子的性质进行验证,铁离子遇到硫氰酸钾溶液变红色,若无红色出现这么铁离子除净;
③溶液B为硫酸铜溶液,可以加入铁粉置换铜得到,也可以通过电解硫酸铜溶液得到;(1)①高锰酸钾溶液酸性溶液中能氧化亚铁离子,使得高锰酸钾溶液褪色,
故答案为:①稀硫酸、KMnO4溶液;②稀硫酸浸取炉渣所得溶液使KMnO4 溶液褪色;
(2)①流程中操作a是通过过滤的方法得到氢氧化铁沉淀和滤液B,滤液B是硫酸铜溶液,操作b是溶液中得到CuSO4•5H2O晶体的实验方法,溶液中得到溶质晶体可以加热蒸发浓缩,冷却结晶得到;
故答案为:过滤;蒸发浓缩,冷却结晶;
②检验溶液B中Fe3+是否被除尽的试剂是KSCN溶液,加入KSCN溶液若变红证明含有铁离子,若加入后溶液不变红证明不含铁离子;
故答案为:KSCN溶液;溶液不变红;
③硫酸铜溶液得到金属铜的方法,可以加入铁粉置换铜反应的化学方程式为:CuSO4+Fe=FeSO4+Cu;也可以惰性电极通电电解硫酸铜溶液,反应的化学方程式为:2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4;
故答案为:CuSO4+Fe=FeSO4+Cu;2CuSO4+2H2O
通电
.
2Cu+O2↑+2H2SO4;点评:
本题考点: 性质实验方案的设计;制备实验方案的设计.
考点点评: 本题考查物质性质的实验设计和反应现象判断,实验流程的正确判断是解题关键,题目难度中等.1年前查看全部
- (2014•陕西一模)黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氧化二铁和氧化亚铜.三氧化二铁和氧
(2014•陕西一模)黄铜矿(CuFeS2)是炼钢和炼铜的主要原料.在高温下灼烧生成二氧化二铁和氧化亚铜.三氧化二铁和氧化亚铜都是红色粉末.常用作颜料.某学校化学兴趣小组通过实验探究一红色粉末是Fe2O3、Cu2O或两者的混合物.探究过程如下:
查阅资料:Cu2O是一种碱性氧化物.溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3.
假设2:红色粉末是Cu2O.
假设3:红色粉末是Fe2O3和Cu2O的混合物.
设计探究实验:
取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂.
(1)若假设1成立,则实验现象是______.
(2)滴加KSCN试剂后溶液不变红色.某同学认为原同体粉末中一定不含三氧化二铁.你认为这种说法合
理吗?______.简述你的理由(不需写出反应的化学方程式):______.
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色.则证明原同体粉末是______,写出发生的氧化还原反应的离子方程式:______.
探究延伸:
(4)经实验分析.确定红色粉末为Fe2O3和Cu2O的混合物.实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4•5H2O).经阅资料得知.在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如表:
实验小组设汁如图实验方案:物质 Cu(OH)2 Fe(OH)2 Fe(OH)3 开始沉淀时的pH 6.0 7.5 1.4 完全沉淀时的pH 13 14 3.7 
①试剂Ⅰ为______.试剂2为______.(填字母)
A.氯水B.H2O2C.NaOH D.Cu2(OH)2CO3
②同体X的化学式为______.
③操作Ⅱ为______. 雪兰狐1年前1
雪兰狐1年前1 -
 seth1023 共回答了26个问题
seth1023 共回答了26个问题 |采纳率84.6%解题思路:(1)依据假设1为氧化铁,和实验工厂分析,固体溶解后生成硫酸铁,遇到硫氰酸钾会发生反应生成血红色溶液;
(2)滴加KSCN试剂后溶液不变红色,说明溶液中无铁离子,可能是氧化亚铜在酸中发生氧化还原反应生成氧化铜和铜,生成的铜能把铁离子还原为亚铁离子,使溶液遇到硫氰酸钾不变红色;
(3)固体完全溶解,无固体存在,说明固体含有氧化铁和氧化亚铜;反应生成的铜会和铁离子全部反应;
(4)①红色粉末为Fe2O3和Cu2O的混合物溶于硫酸后氧化亚铜反应生成的铜会还原铁离子为亚铁离子,加入氧化剂过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀;
②X推断为氢氧化铁沉淀;
③操作Ⅰ是溶液中得到溶质结晶水合物;是通过蒸发浓缩冷却结晶,过滤洗涤干燥得到晶体;(1)取少量粉末放入足量稀硫酸中.在所得溶液中再滴加KSCN试剂,若假设1成立,红色粉末是Fe2O3,则实验现象是固体完全溶解,溶液呈血红色;
故答案为:固体完全溶解,溶液呈血红色;
(2)滴加KSCN试剂后溶液不变红色,说明溶液中无铁离子,可能是氧化亚铜在酸中发生氧化还原反应生成氧化铜和铜,生成的铜能把铁离子还原为亚铁离子,使溶液遇到硫氰酸钾不变红色,所以滴加KSCN试剂后溶液不变红色,不能说明原混合物不含氧化铁;
故答案为:不合理;当原固体粉末为Fe2O3和Cu2O的混合物时,加入稀H2SO4后产生的Fe3+与Cu反应生成Fe2+,滴加KSCN溶液后也可能不变红色;
(3)固体完全溶解,无固体存在,说明固体含有氧化铁和氧化亚铜;反应生成的铜会和铁离子全部反应,反应的离子方程式为:Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+;
故答案为:Fe2O3和Cu2O;Cu2O+2H+═Cu+Cu2++H2O、2Fe3++Cu═2Fe2++Cu2+;
(4)①红色粉末为Fe2O3和Cu2O的混合物溶于硫酸后氧化亚铜反应生成的铜会还原铁离子为亚铁离子,加入氧化剂过氧化氢氧化亚铁离子为铁离子,调节溶液PH使铁离子全部沉淀,为不引入杂质需要加入氧化铜或碱式碳酸铜调节溶液PH,AC会引入新的杂质;
故答案为:B;D;
②流程分析判断固体X为氢氧化铁沉淀;
故答案为:Fe(OH)3;
③操作Ⅰ是溶液中得到溶质结晶水合物;是通过蒸发浓缩冷却结晶,过滤洗涤干燥得到晶体;
故答案为:蒸发浓缩、冷却结晶;点评:
本题考点: 探究物质的组成或测量物质的含量.
考点点评: 本题考查了实验探究物质组成和性质的实验分析,物质的性质和转化关系,掌握基础,细心审题是解题关键,题目难度中等.1年前查看全部
- CuFeS2怎么读?Cu和 fe的化合价分别是多少?
 g29f1年前1
g29f1年前1 -
 pbo89 共回答了17个问题
pbo89 共回答了17个问题 |采纳率94.1%CuFeS2:二硫化亚铁铜 (黄铜矿主要成分)
Cu:+2 Fe:+21年前查看全部
- (2012•润州区二模)以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种
(2012•润州区二模)以黄铜矿(主要成分是CuFeS2,含少量杂质SiO2)为原料炼铜的方法分为高温炼铜和湿法炼铜两种.近年来,湿法炼铜有了新进展,科学家发现有一种细菌在酸性水溶液、氧气存在下,可以将黄铜矿氧化成硫酸盐,某工厂运用该原理生产铜和绿矾(FeSO4的晶体,含结晶水).
回答下列问题:
(1)写出反应Ⅰ的化学反应方程式:______;
(2)欲从溶液中获得绿矾晶体,分离“操作2”应为蒸发浓缩、______、过滤. jackingyu1年前1
jackingyu1年前1 -
 没有dd 共回答了26个问题
没有dd 共回答了26个问题 |采纳率88.5%解题思路:(1)根据化学方程式的书写方法考虑;(2)根据固体溶质从溶液中结晶析出的方法是:蒸发溶剂,降温结晶,再过滤.(1)反应Ⅰ中的反应物是CuFeS2、O2、H2SO4三种物质,生成物是硫酸铁、硫酸铜和水,根据奇偶法配平,所以方程式是:4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;
(2)获得绿矾晶体时先蒸发浓缩,因为硫酸铁的溶解度随温度的升高而增大,所以降温溶解度减小,会析出晶体,最后过滤即可.
故答案为:(1)4CuFeS2+17O2+2H2SO4═2Fe2(SO4)3+4CuSO4+2H2O;(2)降温结晶.点评:
本题考点: 物质的相互转化和制备;结晶的原理、方法及其应用;金属的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 解答本题关键是要知道方程式的书写方法,熟悉溶液中溶质结晶析出的方法.1年前查看全部
- 由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物.该过程中两个主要反应的化学方程式分别是__________、__________,反射炉内生成炉渣的主要成分是__________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%.转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼.冰铜中的Cu2S被氧化为Cu2O.生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是__________、__________. 品牌小戴1年前0
品牌小戴1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:(1)气
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:(1)气
手机看不了答案,求帮搜标题,一共五小题的,
顺便再搜下 下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示 庥琦1年前1
庥琦1年前1 -
 wending 共回答了23个问题
wending 共回答了23个问题 |采纳率100%第一题 C
第二题 Fe3+;加NaOH,有白色沉淀,沉淀颜色逐渐变深,最终变为红褐色.
第三题 啊氧化亚铜同铝反应的化学方程式,自己写吧,应该会吧.
第四题 D
第五提 氧气在酸的作用下变为水,自己写吧.
为了取得好成绩建议换部好手机1年前查看全部
- (2011•南京一模)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之,还可以制备硫以及铁的化合物.
(2011•南京一模)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之,还可以制备硫以及铁的化合物.
(1)近年来,湿法炼钢有了新进展.某工厂以一种叫Thibacillus ferroxidans的细菌为基体生产 铜和绿矾的工艺流程如下:
(1)试剂a为______,试剂b为______.(写名称)
(2)反应l的化学方程式为4CuFeS2+2H2SO4+17O2
4CuSO4+2Fe2(SO4)3+2H2O细菌 .4CuFeS2+2H2SO4+17O2
4CuSO4+2Fe2(SO4)3+2H2O细菌 .
(Ⅱ)以CuFeS2精矿为原料在沸腾炉中和02(空气)反应,生成物冷却后经溶解、除铁、结晶.得到 CuS04•5H2O.沸腾炉的温度与生成物主要成分的水溶性和酸溶性实验结果如图.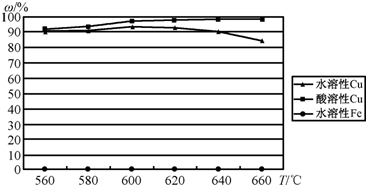
(1)沸腾炉生成物中的含铁物质主要成分为______.
(2)为获得最高的水溶性Cu(%),沸腾炉的温度应控制在______℃左右,高于该温度生成物中的水溶性 Cu(%)下降,可能原因是______. 予禾1年前1
予禾1年前1 -
 谁与争锋669 共回答了19个问题
谁与争锋669 共回答了19个问题 |采纳率94.7%解题思路:(Ⅰ)(1)得到的滤渣2是将三价铁沉淀下来的难溶物,可用硫酸来溶解,金属铁可以和三价铁化合为亚铁离子;加入稀硫酸溶解氢氧化铁生成硫酸铁,加入铁粉和硫酸铁反应生成硫酸亚铁;
(2)依据流程分析可知反应物为黄铜矿中加入硫酸和氧气反应硫酸铜、硫酸铁和水;
(Ⅱ)(1)从整个过程来看,CuFeS2最终变为Cu、FeO和SO2,即2CuFeS2+5O2=2Cu+4SO2+2FeO;
(2)据图象分析可知,600°C时水溶性铜最高;水溶性铜化合物为CuSO4•5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4•5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少.(Ⅰ) (1)得到的滤渣2是将三价铁沉淀下来的难溶物,可用硫酸来溶解,再加入金属铁可以和三价铁化合为亚铁离子,而又不会引进杂质离子,故答案为:硫酸、过量的铁粉,故答案为:稀硫酸;铁粉;
(2)反应1的反应可以依据流程分析可知反应物为黄铜矿中加入硫酸和氧气反应硫酸铜、硫酸铁和水,反应的化学方程式为:4CuFeS2+2H2SO4+17O2
细菌
.
4CuSO4+2Fe2(SO4)3+2H2O,故答案为:4CuFeS2+2H2SO4+17O2
细菌
.
4CuSO4+2Fe2(SO4)3+2H2O;
(Ⅱ) (1)依据流程图,从整个过程来看,CuFeS2最终变为Cu、FeO和SO2,即2CuFeS2+5O2=2Cu+4SO2+2FeO;沸腾炉生成物中的含铁物质主要成分为铁的氧化物,
故答案为:铁的氧化物;
(2)CuFeS2与O2反应放热,依据图象分析可知,600°C时水溶性铜最高;水溶性铜化合物为CuSO4•5H2O,酸溶性铜化合物为CuO,温度较高时,CuSO4•5H2O可分解生成CuO,则在600℃以上时水溶性铜化合物含量减少,
故答案为:600;生成的CuSO4发生了分解生成酸溶性铜化合物.点评:
本题考点: 制备实验方案的设计;探究物质的组成或测量物质的含量.
考点点评: 本题考查考查较为综合,涉及物质的制备、检验和性质实验设计等问题,侧重于考查学生综合运用化学知识的能力,为高考常见题型,难度中等.1年前查看全部
- 取12.5克黄铜矿样品,经测定含3.6gliu(杂质中不含liu),矿样中CuFeS2含量为多少?
 蒲公英种子1年前1
蒲公英种子1年前1 -
 八面妖精 共回答了18个问题
八面妖精 共回答了18个问题 |采纳率94.4%因为杂质中不含中不含S; CuFeS2~2S 184 64 x g 3.6g x=10.35g CuFeS2%=10.35g/12.5g=82.8%1年前查看全部
- (2013•德州模拟)黄铜矿的主要成分是CuFeS2(硫元素一2价,铁元素+2价).是工业炼铜的主要原料.已知黄铜矿在空
(2013•德州模拟)黄铜矿的主要成分是CuFeS2(硫元素一2价,铁元素+2价).是工业炼铜的主要原料.已知黄铜矿在空气中焙烧生成cu、FeS和S02,FeS+2Hcl=FeCl+H2S.H2S是一种剧毒气体.某科研小组设计以黄铜矿为原料涮取单质铜和氯化铁晶体(FeCl3•6H2O)的流程如下:

(1)92gCuFeS2在空气中焙烧生成Cu、FeS和S02转移电子的物质的量为______.
(2)请简述检验气体Ⅰ的操作步骤.
(3)在实验室中,欲用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,需要的玻璃仪器主要有______.
(4)气体Ⅲ最好选用______(填写序号),其主要作用是______;
A.02B.H2C.Cl2D.N2
欲选用下列仪器在实验室中制取纯净干燥的该气体.
装置A中发生反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O△ .MnO2+4H++2Cl-.
Mn2++Cl2↑+2H2O△ .
选用合适装置导管口的连接顺序为a接______.图中仪器G的名称是______;在使用该仪器时,应首先______. 景萱1年前1
景萱1年前1 -
 妮妮1111 共回答了16个问题
妮妮1111 共回答了16个问题 |采纳率93.8%解题思路:(1)根据n=[m/M]计算92gCuFeS2的物质的量,根据原子守恒计算Cu、FeS和SO2的物质的量,反应中只有生成SO2的硫元素化合价升高,由-2价升高为+4价,据此计算转移电子物质的量;
(2)由工艺流程可知,焙烧产生的气体Ⅰ为SO2,利用品红溶液进行检验;
(3)用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,用量筒量取需要浓盐酸与水的体积,在烧杯中稀释,丙用玻璃棒搅拌;
(4)由工艺流程可知,过滤得到的滤液中主要为FeCl2,产品为FeCl3•6H2O,故通入的气体将Fe2+氧化为Fe3+,且不引入杂质,应为氯气最好;
制备干燥纯净的氯气:由发生装置可知,应是二氧化锰与浓盐酸加热制备,生成的氯气中含有HCl、水蒸气,利用饱和氯化钠溶液吸收氯气中的氯化氢气体;再利用浓硫酸除去氯气中的水蒸气,最后用氢氧化钠溶液吸收尾气中的氯气,连接时注意洗气与干燥装置导气管需要长进短出、收集装置应长进短出;
G是分液漏斗,使用之前应检查是否漏水.(1)92gCuFeS2的物质的量=[92g/184g/mol]=0.5mol,根据原子守恒可知生成Cu、FeS的物质的量分别为0.5mol、0.5mol,由硫原子守恒可知SO2的物质的量=0.5mol×2-0.5mol=0.5mol,反应中只有生成SO2的硫元素化合价升高,由-2价升高为+4价,故转移电子物质的量=0.5mol×[4-(-2)]=3mol,
故答案为:3mol;
(2)由工艺流程可知,焙烧产生的气体Ⅰ为SO2,利用品红溶液进行检验,具体操作为:收集适量气体Ⅰ通入品红溶液中,品红溶液褪色,加热溶液恢复红色,
故答案为:收集适量气体Ⅰ通入品红溶液中,品红溶液褪色,加热溶液恢复红色;
(3)用38%(密度为1.18g.mL-1)的盐酸配制30%的盐酸,用量筒量取需要浓盐酸与水的体积,在烧杯中稀释,丙用玻璃棒搅拌,故需要的仪器有:量筒、玻璃棒、烧杯,
故答案为:量筒、玻璃棒、烧杯;
(4)由工艺流程可知,过滤得到的滤液中主要为FeCl2,产品为FeCl3•6H2O,故通入的气体将Fe2+氧化为Fe3+,且不引入杂质,应为氯气最好;
制备干燥纯净的氯气:由发生装置可知,应是二氧化锰与浓盐酸加热制备,反应离子方程式为:MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;
生成的氯气中含有HCl、水蒸气,利用饱和氯化钠溶液吸收氯气中的氯化氢气体;再利用浓硫酸除去氯气中的水蒸气,最后用氢氧化钠溶液吸收尾气中的氯气,连接时注意洗气与干燥装置导气管需要长进短出、收集装置应长进短出,故连接顺序为aghefb;
G是分液漏斗,使用之前应检查是否漏水,
故答案为:C;将Fe2+氧化为Fe3+;MnO2+4H++2Cl-
△
.
Mn2++Cl2↑+2H2O;ghefb;分液漏斗;检查是否漏水.点评:
本题考点: 制备实验方案的设计;气体发生装置.
考点点评: 本题考查氧化还原反应、元素化合物性质、实验方案设计、氯气实验室制备等,侧重对化学基本操作与技能的考查,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.1年前查看全部
- FeS2 CuFeS2 怎么读?
 whbriar1年前1
whbriar1年前1 -
 浪子天城 共回答了18个问题
浪子天城 共回答了18个问题 |采纳率88.9%化学东西直接读 Fe S2 Cu FeS2 就是中间注意停顿,用英文字母去读就可以,数字直接读1年前查看全部
- 初中化学题~~急问!1、具体区分硬度和强度2、清楚解释"机械性能"3、通常情况下是“正价+负价”如果遇到“CuFeS2”
初中化学题~~急问!
1、具体区分硬度和强度
2、清楚解释"机械性能"
3、通常情况下是“正价+负价”如果遇到“CuFeS2”这类情况呢 3755455501年前1
3755455501年前1 -
 谗豆 共回答了19个问题
谗豆 共回答了19个问题 |采纳率89.5%1.硬度是拿莫氏标准做标准的,金刚石是硬度最大的物质,强度简单的说是耐冲撞耐压的程度本领,强度和硬度没必然联系,比如玻璃硬度很大但强度不大
2.机械性能一般来说是指机械或金属带有的性质常说的机械性能的主要机械性能有:弹性、塑性、刚度、强度、硬度、冲击韧性、疲劳强度和断裂韧性等.首先解释一下相关概念:弹性:金属材料受外力作用时产生变形,当外力去掉后能恢复其原来形状的性能.塑性:金属材料在外力作用下,产生永久变形而不致引起破华的能力.刚度:金属材料在受力时抵抗弹性变形的能力.强度:金属材料在外力作用下抵抗塑性变形和断裂的能力.硬度:金属材料抵抗更硬的物体压入其内的能力.冲击韧性:金属材料抵抗冲击载荷作用下断裂的能力.疲劳强度:当金属材料在无数次重复活交变载荷作用下而不致引起断裂的最大应力.断裂韧性:用来反映材料抵抗裂纹失稳扩张能力的性能指标.
3.这个就是正价+负价啊,Cu.Fe都是+2价,S是-2价的,金属离子都是显正价,活泼非金属一般显负价,硫就是一种活泼非金属1年前查看全部
- CuFeS2怎么读啊?Cu2S这个又怎么读啊
 ami_04251年前5
ami_04251年前5 -
 6183299 共回答了20个问题
6183299 共回答了20个问题 |采纳率90%CuFeS2读作二硫化亚铁铜,是黄铜矿的主要成分
Cu2S读作硫化亚铜1年前查看全部
- 大苏打是什么?CuFeS2是是什么?怎么读?
 kobeandtmac1年前3
kobeandtmac1年前3 -
 summer19830623 共回答了18个问题
summer19830623 共回答了18个问题 |采纳率88.9%大苏打是Na2S2O3读作硫代硫酸钠
CuFeS2读作二硫化亚铁铜其实是黄铜矿的主要成分1年前查看全部
- 黄铜矿(主要成分CuFeS2)是提取铜的主要原料. 问:已知2 CuFeS2+4O2===Cu 2S+3S O2+2Fe
黄铜矿(主要成分CuFeS2)是提取铜的主要原料. 问:已知2 CuFeS2+4O2===Cu 2S+3S O2+2Fe O
产物Cu S2在1200度高温下继续反应:
2Cu S2+3 O2==== 2Cu2 O+2 S O2
2Cu2 O+ Cu2 S====6 Cu+ S O2
假设各步反应都完全,由184gCuFeS2生成64gCu,求消耗氧气质量 wfqz1234561年前1
wfqz1234561年前1 -
 上海被骗 共回答了17个问题
上海被骗 共回答了17个问题 |采纳率88.2%2CuFeS2+5O2--2Cu+4SO2+2FeO,需要2.5mol氧气,2.5*32=80g1年前查看全部
- cufes2燃烧 我怎么都配不平啊 急 谁出的题啊 气还有生成物为Cuo Fe2O3 SO2
 烛光苦咖啡1年前2
烛光苦咖啡1年前2 -
 心思0023 共回答了14个问题
心思0023 共回答了14个问题 |采纳率85.7%4 CuFeS2+ 13 O2=高温== 4 CuO + 2 Fe2O3 + 8 SO21年前查看全部
- 高一离子反应在酸性溶液中,软锰矿(MnO2)和黄铜矿(CuFeS2)可以相互作用,生成铜盐、锰盐和铁盐.请写出反应的离子
高一离子反应
在酸性溶液中,软锰矿(MnO2)和黄铜矿(CuFeS2)可以相互作用,生成铜盐、锰盐和铁盐.请写出反应的离子方程式.
找不到答案.下面的是我写的...不知道对不对,若有错误,望高手指正.若无错误,请高手帮忙分析S为什么要到+6价而不是其它价态(我是靠经验和感觉写的SO4 2-...)好的追加分数
9MnO2 + 2Fe2+ + 2S2- + 20H+ ------ 9Mn2+ + 2Fe3+ + 2SO4 2- + 10H2O
回2L,在CUFES2中CU是不是+2价啊...我刚学氧化还原,只知道最简单的情形:要是CU是+1价的话,那FE就是+3价,这两个离子不是不能共存的啊.,难道固态的时候可以?所以我觉的CUFES2中CU是+2价...没变价,就不要写了... 止风静树1年前1
止风静树1年前1 -
 大唐王朝300年 共回答了28个问题
大唐王朝300年 共回答了28个问题 |采纳率96.4%你写的是有问题的.
首先,MnO2和CuFeS2都是不溶于水的.所以不能写成离子.(通常矿石都是不溶于水的,要不下场雨不就没矿石了么?这是常识哦)
第二,CuFeS2中,Cu是+1价,Fe是+3价.注意一个问题.也许老师会告诉你,Cu2+比Cu+稳定,但是注意,那是在水溶液中而不是在空气中!水溶液中稳定的原因是存在水化热.在空气中,Cu+比较稳定.而同样在空气中,Fe2+很溶液被氧化成Fe3+.另外,Cu+不能和Fe3+共存是热力学问题,而在矿石中还存在动力学问题,这不在高中学习范围内.
在酸性条件下,+4价的Mn的确可以将S氧化到+6价.所以总反应方程式是
2CuFeS2 + 17MnO2 + 36H+ = 2Cu2+ + 2Fe3+ + 17Mn2+ +4SO4 2- +18H2O1年前查看全部
- 黄铜矿主要成分CuFeS2是合金还是盐
 STENT1年前1
STENT1年前1 -
 huangxiong635188 共回答了18个问题
huangxiong635188 共回答了18个问题 |采纳率77.8%CuFeS2是盐 ,是化合物,不是混合物.1年前查看全部
- 黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物.
(1)冶炼铜的反应为8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2高温 .
若CuFeS2中Fe的化合价为+2,反应中被还原的元素______(填元素符号).
(2)上述冶炼过程中产生大量SO2.下列处理方案合理的是______(填代号).
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3
d.用浓硫酸吸收
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3.方法为:
①用稀盐酸浸取炉渣,过滤.
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧制得.
据以上信息回答下列问题:
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸稀硫酸KSCN溶液KMnO4溶液NaOH溶液碘水
所选试剂为______.证明炉渣中含有FeO的实验现象为______. 花生乐橙搞联合1年前1
花生乐橙搞联合1年前1 -
 嘎嘎冷 共回答了16个问题
嘎嘎冷 共回答了16个问题 |采纳率100%解题思路:(1)8CuFeS2+21O2
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低;高温 .
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象来解答.(1)8CuFeS2+21O2
高温
.
8Cu+4FeO+2Fe2O3+16SO2中,Fe元素的化合价升高,Cu、O元素的化合价降低,则Cu、O元素被还原,故答案为:Cu、O;
(2)冶炼过程中产生大量SO2可制备硫酸或利用碱液吸收,与浓硫酸不反应,也不能直接排放,故答案为:bc;
(3)设计实验验证炉渣中含有FeO,利用酸溶液后,根据亚铁离子具有还原性,选氧化剂发生明显的现象即可证明,因盐酸能被高锰酸钾氧化,则选择试剂为稀硫酸、KMnO4溶液,证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色.点评:
本题考点: 氧化还原反应;物质的分离、提纯的基本方法选择与应用;物质的检验和鉴别的基本方法选择及应用.
考点点评: 本题考查氧化还原反应及应用,为高频考点,把握物质的性质、反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,(3)中易错选盐酸,题目难度不大.1年前查看全部
大家在问
- 1一:质量数和相对原子质量之间有关系吗?
- 2完成下列测量小灯泡电阻的相关实验内容 问:灯丝的电阻是否随电压而变化
- 3下列整式中哪些是单项式?哪些是多项式?是单项式的指出系数和次数,是多项式的指出项和次数:
- 4昆虫有哪些本领
- 5六年级小升初试题(语数都要(快))
- 6读你的时刻 作文
- 7You look pretty in red 的回答
- 8声音在15℃的空气中传播的速度为______m/s.打雷时,小品同学在看到闪电后经过6s才听到雷声,则打雷处离小品的距离
- 92.5吨大豆可榨油400千克,大豆的出油率是多少?
- 10温故而知新的作者是谁?
- 11把陈述句改为反问句
- 12抛物线y=ax+2x+c的顶点坐标是(1/3,-1),则a,c的值分别是多少?
- 13设n为自然数,关于x的一元二次方程x^2+(2n+1)x+n^2=0的两个根记作an、bn.
- 1415的倒数与1/5的和是几?急!
- 15在括号里填入适当的词(6年级)发展( ) 发布( ) ( )精当 ( )精良( )精美 ( )精致 ( )精致
