往1dm3 0.10mol/ dm3 HAc溶液中加入一些NaAc晶体并使之溶解,会发生的情况是
 sgdjzxxq2022-10-04 11:39:542条回答
sgdjzxxq2022-10-04 11:39:542条回答
已提交,审核后显示!提交回复
共2条回复
 wnanv 共回答了23个问题
wnanv 共回答了23个问题 |采纳率87%- 醋酸电离度减小,ph升高,这就是所谓的同离子效应
- 1年前
 0iof 共回答了1147个问题
0iof 共回答了1147个问题 |采纳率- NaAc是强电解质,所以马上电离出Na+和Ac-,使溶液中Ac-离子浓度增大,HAc电离平衡向左移动(即抑制了HAc的电离),从而使氢离子浓度下降,溶液酸性减弱。
- 1年前
相关推荐
- 化学计算条件电极电势已知298K时,E标准(H3AsO4/H3AsO3)=0.0575V,计算在0.10mol/L HC
化学计算条件电极电势
已知298K时,E标准(H3AsO4/H3AsO3)=0.0575V,计算在0.10mol/L HCl溶液中电对H3AsO4/H3AsO3的条件电极电势.
也不知道活度系数,但答案是求物质组份的,我更加迷惑,思路很混乱, 芸雾1年前2
芸雾1年前2 -
 史丢皮猪 共回答了23个问题
史丢皮猪 共回答了23个问题 |采纳率87%在0.10mol/L HCl溶液中,电对的反应式为:
H3AsO4 + 2H+ + 2e = H3AsO3 + H2O
忽略离子强度的影响则有
E=E标准 +0.059V/2 *lg([H3AsO4][H+]^2/[H3AsO3])
=E标准 +0.059Vlg[H+] + 0.059V/2 *lg([H3AsO4]/[H3AsO3])
当[H3AsO4]=[H3AsO3]=1.0mol/L时,E=E' 标准,故
E' 标准=0.559V + 0.059Vlg[H+] =0.500 V1年前查看全部
- 计算0.10mol/LNaAc水溶液的PH值(Ka(HAc)=1.8*10^-5)
计算0.10mol/LNaAc水溶液的PH值(Ka(HAc)=1.8*10^-5)
答案是8.88 ke_aizhu1年前3
ke_aizhu1年前3 -
 痛到想笑 共回答了12个问题
痛到想笑 共回答了12个问题 |采纳率91.7%NaAc在水中可以认为是完全电离的,于是有大量的Ac-存在.
Ac-是弱酸根,跟水结合生成OH-和HAc Ac- +H2O == HAc + OH- (1)
而对于HAc 的解离,则是 HAc=H+ +Ac- (2)
解离常数 K=[H+][Ac-]/[HAc]([]就是浓度的意思~)
于是就找出这三种物质的浓度了,[H+]可以通过pH求出了,而[HAc] 也可以通过方程(1)看出[HAc]=[OH-] (3)
,
对于Ac-的浓度,[Ac-]=[Ac-](总的浓度0.10)-[HAc],由于Ac-与水形成HAc的量特别少(即[HAc]1年前查看全部
- 用0.10mol/lHCl标准溶液滴定0.10mol/l乙醇胺(PKb=4.50)时,最宜选用的指示剂是
用0.10mol/lHCl标准溶液滴定0.10mol/l乙醇胺(PKb=4.50)时,最宜选用的指示剂是
A金莲橙oo(pka=2.0)
B甲基红(PKa=5.0)
C甲酚红(Pka=8.0)
D茜素黄R(PKa=11.1) 2296586721年前2
2296586721年前2 -
 heroaid 共回答了22个问题
heroaid 共回答了22个问题 |采纳率90.9%中和时产物是 HOCH2-CH2NH3+
HOCH2-CH2NH3+ + H2O HOCH2-CH2NH2 +H3O+
Ka= Kw /Kb=10^-14 /10^-4.5=10^-9.5
[H+]=(Ka*c)^1/2= (10^-9.5 *0.050)^1/2=4.0*10^-6
pH=5.4
指示剂:PH=pKa+1 (-1)
即要求指示的PKa :4.41年前查看全部
- 现有4.0L c(HCI) = 0.25mol/L HCL溶液,须加多少L 水才能使之成为c(HCI)=0.10mol/
现有4.0L c(HCI) = 0.25mol/L HCL溶液,须加多少L 水才能使之成为c(HCI)=0.10mol/L HCI溶液
 ymsdu18191年前1
ymsdu18191年前1 -
 盼盼sunny 共回答了22个问题
盼盼sunny 共回答了22个问题 |采纳率81.8%需要加入6L水.
HCl的物质的量是n=cV=0.25*4=1mol
设需要加入水的体积是x.
1/(4+x)=0.1
x=6L
所以需要加入6L水.1年前查看全部
- 将0.10molMgCl2(s)加入2升0.1mol/dm3的氨水,试根据计算结果说明有Mg(OH)2沉淀生成.继续向该
将0.10molMgCl2(s)加入2升0.1mol/dm3的氨水,试根据计算结果说明有Mg(OH)2沉淀生成.继续向该体系中滴加浓盐酸至沉淀恰好完全溶解时(忽略溶液体积变化),计算此时溶液的:
(1)pH=?(2)c(NH3·H2O)=?c(NH4+)=?已知:﹛Kob(NH3)=1.8×10-5,Kos[Mg(OH)2]=1.2×10-11﹜ 找找找找找1年前1
找找找找找1年前1 -
 gds_lee 共回答了15个问题
gds_lee 共回答了15个问题 |采纳率100%MgCl2溶解後Mg2+浓度为0.05mol/L
0.1mol/L的NH3·H2O,[OH-]=√(cKb)=1.3*10-3mol/L,[Mg2+][OH-]²=9*10-8>1.2*10-11,因此有沉淀.
(1)沉淀恰好溶解时,溶液中的溶质是MgCl2和NH4Cl.元素守恒,NH4Cl物质的量为0.2mol,浓度为[NH4Cl]=0.1mol/L
由於NH3·H2O碱性比Mg(OH)2弱,越弱越水解,因此NH4+首先水解,NH4++H2O=NH3·H2O+H+,产生H+之後又抑制了Mg2+的水解因此只需要考虑NH4+水解.
NH4++H2O=NH3·H2O+H+,K=Kw/Kb,pK=pKw-pKb=14+lg(1.8*10-5)=9.25,pH=1/2*(pK+p[NH4Cl])=5.1
(2)NH4++H2O=NH3·H2O+H+,[NH3·H2O]=[H+]=10^(-pH)=7.4*10-6mol/L,[NH4+]=[NH4Cl]=0.1mol/L1年前查看全部
- 50ml0.10mol/lHAc与25ml0.10mol/lNaOH混合后溶液的PH值为?
 daheigege1年前1
daheigege1年前1 -
 blayoar3 共回答了25个问题
blayoar3 共回答了25个问题 |采纳率84%属于缓冲溶液1年前查看全部
- 0.10mol/LNaCN的PH值
 ghost-roc1年前3
ghost-roc1年前3 -
 岛925 共回答了19个问题
岛925 共回答了19个问题 |采纳率89.5%HCN Pka=9.21
则CN-的水解平衡常数为10^(-14)/10(-9.21)=10^(-4.79)
0.1mol/L CN-溶液中的OH-浓度为
(10^(-4.79)*0.1)^(0.5)=10^(-2.895)
则H+浓度为
10^(-14)/10^(-2.895)=10(-11.105)
则溶液pH=11.1051年前查看全部
- 将浓度均为0.10mol'L的HAc溶液和?aAc溶液各50ml混合后,这种混合溶液H 及PH值各为多少
 水君白1年前1
水君白1年前1 -
 52609637 共回答了18个问题
52609637 共回答了18个问题 |采纳率88.9%将浓度均为0.10mol'L的HAc溶液和?aAc溶液,知为醋酸和醋酸钠的混合溶液,此时醋酸跟比钠离子还多,此时主要考虑醋酸的电离,而不考虑醋酸钠的水解,因为醋酸多于水解产生的醋酸,水解的可忽略,由平衡移动知CH3COOH==可逆==CH3COO^ + H+又CH3COO^ 增加所以平衡逆向移动,所以混合溶液H 减小,PH值增大大于2因为体积加倍再加上平衡移动.1年前查看全部
- 用0.10mol.L-1NaOH 溶液滴定100mL0.10mol.L-1盐酸时,如果滴定误差在正负0.1%以内,反应完
用0.10mol.L-1NaOH 溶液滴定100mL0.10mol.L-1盐酸时,如果滴定误差在正负0.1%以内,反应完毕后溶液的PH 范围为( C )A、6.7.1 C、4.9.7 .请问:若两个试剂中其中一个为弱酸或弱碱,则PH范围大概会怎样变化呢?
忘了写,为什么选C, tian79721年前3
tian79721年前3 -
 TVB我来也 共回答了16个问题
TVB我来也 共回答了16个问题 |采纳率81.3%滴定误差为正负0.1%,即误差为±100mL*0.1%=±0.1mL,就以多滴了0.1mLNaOH来计算,多了0.1mL 0.10mol.L-1NaOH,就在200mL(原来盐酸的100mL加上滴进去的100mL氢氧化钠的体积之和)中多了0.1mL 0.10mol.L-1NaOH,折算成OH-浓度为:(0.1*0.1)/200=0.00005mol/L,即5*10-5 mol/L,即H+浓度为2*10-10(水合离子常数为1*10-14),即pH=-㏒10(H+)……(公式记不是特别清楚了,大概是这样,LZ去翻翻书吧),算得pH就是9.7.
相反,若少滴了NaOH,pH就为4.3.
这类题目不会以弱酸弱碱来考的,因为会无法计算,况且,一个选择题,最多5分,所用的知识不会那么深入.1年前查看全部
- 0.10mol/LNaH2PO4溶液PH怎么算
 熟睡的人1年前1
熟睡的人1年前1 -
 西西公主的梦想 共回答了17个问题
西西公主的梦想 共回答了17个问题 |采纳率70.6%知道NaH2PO4的Ka2根据公式c(H+)==根号下Ka2*c就行啦!1年前查看全部
- 0.10mol/l氨水和0.010mol/l氯化铵等体积混合 .求ph
 loveatty1年前1
loveatty1年前1 -
 jmt蓝魄 共回答了12个问题
jmt蓝魄 共回答了12个问题 |采纳率83.3%混合后[NH3]=0.10/2=0.05molL [NH4+]=0.01/2=0.005mol/L
混合后PH=PKw-PKb+log[NH3]/[NH4+]=14-4.74+log(0.05/0.005)=10.261年前查看全部
- 室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所
室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体
 室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:
室温下,用0.10mol?L-1KOH溶液滴定10.00mL 0.10mol?L-1H2C2O4溶液所得的滴定曲线如图所示(混合溶液的体积可看成混合前两溶液的体积之和).请回答下列问题:
(1)点①所示的溶液中,Kw=______.
(2)点②所示的溶液中的电荷守恒式为______.
(3)点③所示的溶液中存在______种平衡.
(4)点④所示的溶液中的物料守恒式为0.10mol?L-1=______.
(5)点⑤所示的溶液中各离子浓度的大小顺序为______.
(6)上述5个点所示的溶液中,水的电离程度最大的是______(填序号,下同),最小的是______.
 moonboy0367971年前1
moonboy0367971年前1 -
 roseli 共回答了21个问题
roseli 共回答了21个问题 |采纳率76.2%(1)在任何的溶液中均存在水的离子积常数,室温下水的离子积为:KW=1×10-14,
故答案为:1×10-14;
(2)溶液中所有阳离子所带的正电荷总数一定等于阴离子所带的负电荷总数,即c(H+)+c(K+)=c(HC2O4-)+c(OH-)+2c(C2O42-),
故答案为:c(H+)+c(K+)=c(HC2O4-)+c(OH-)+2c(C2O42-);
(3)点③时两溶液恰好完全反应生成了KHC2O4,因此存在KHC2O4的电离平衡和水解平衡,还有水的电离平衡,总共存在3种平衡,
故答案为:3;
(4)点④所示的溶液的体积25mL,根据物料守恒:c(HC2O4-)+c(H2C2O4)+c(C2O42-)=0.10mol/L×[10mL/25mL]=0.04mol/L;c(K+)=0.10mol/L×[15mL/25mL]=0.06mol/L,所以0.10mol?L-1=c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+),
故答案为:c(HC2O4-)+c(H2C2O4)+c(C2O42-)+c(K+);
(5)点⑤所示的溶液中,溶质只有K2C2O4,水解后溶液酸性碱性,离子浓度大小关系为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),
故答案为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+);
(6)H2C2O4的存在会抑制水的电离,而K2C2O4的存在会促进水的电离,所以水的电离程度最大的是K2C2O4浓度最大的⑤,水的电离程度最小的是H2C2O4的浓度增大的①,
故答案为:⑤;①.1年前查看全部
- 在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得C(H2)=0.0
在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中,充分反应,达到平衡后,测得C(H2)=0.0080mol/L.
(1)求该反应的平衡常数.
(2)在上述温度下,该容器中若通入H2和I2蒸汽各0.20mol,试求达到平衡状态时,各物质的浓度. 牙嘉1年前1
牙嘉1年前1 -
 聪聪118 共回答了17个问题
聪聪118 共回答了17个问题 |采纳率94.1%解题思路:依据化学平衡三段式列式计算平衡浓度,结合平衡常数概念计算得到平衡常数的数值;
达到平衡时,测得c(H2)=0.0080mol/L,则
H2(g)+I2(g)⇌2HI(g)
起始时各物质的浓度(mol•L-1) 0.010 0.010 0
各物质的浓度变化量(mol•L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol•L-1) 0.0080 0.0080 0.0040
(1)利用平衡的浓度计算K,K为生成物浓度幂之积与反应物浓度幂之积的比;
(2)设转化的氢气为x,利用三段法得出各物质的平衡浓度,平衡常数与(1)相同,以此来计算.达到平衡时,测得c(H2)=0.0080mol/L,则
H2(g)+I2(g)⇌2HI(g)
起始时各物质的浓度(mol•L-1) 0.010 0.010 0
各物质的浓度变化量(mol•L-1) 0.0020 0.0020 0.0040
平衡时各物质的浓度(mol•L-1) 0.0080 0.0080 0.0040
(1)平衡时c(H2)=c(I2)=0.0080mol/L,c(HI)=0.0040mol/L,
则K=
(0.0040)2
0.0080×0.0080=0.25,
答:该反应的平衡常数为0.25;
(2)此温度下,起始量分别是c(H2)=0.02mol/L、c(I2)=0.02mol/L,
则 H2(g)+I2(g)⇌2HI(g)
起始时各物质的浓度(mol•L-1) 0.02 0.02 0
各物质的浓度变化量(mol•L-1) x x 2x
平衡时各物质的浓度(mol•L-1) 0.02-x 0.02-x 2x
K=
(2x)2
(0.02−x)×(0.02−x)=0.25,
解得:x=0.004 mol/L,
所以平衡时c(HI)=0.008mol•L-1,c(H2)=0.016mol/L;C(I2)=0.016mol/L;
答:化学平衡时HI(g)的平衡浓度为0.008mol/L.I2,H2平衡浓度都为0.016mol/L;点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查化学平衡的计算,明确化学平衡的三段法计算格式及平衡常数的计算方法是解答本题的关键,注意利用平衡浓度计算平衡常数,题目难度中等.1年前查看全部
- 分析化学问题,在线等欲使100ml0.10mol.l的HCL溶液的ph从1.00增加至5.04,需要加入固体NaAc多少
分析化学问题,在线等
欲使100ml0.10mol.l的HCL溶液的ph从1.00增加至5.04,需要加入固体NaAc多少克?(HAc的pk等于4.74.Mnaac等于82)
 xubaoyou19821年前0
xubaoyou19821年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 欲使0.10mol的ZnS溶于HCl得到1L的溶液,计算所需HCl起始浓度最低为多少?
欲使0.10mol的ZnS溶于HCl得到1L的溶液,计算所需HCl起始浓度最低为多少?
已知H2Ska1+1.3X10-7,ka2=7.1X10-15,ZnS=2.5X10-28) xiao小蚂蚁1年前1
xiao小蚂蚁1年前1 -
 空许 共回答了15个问题
空许 共回答了15个问题 |采纳率93.3%[Zn2+] [S2-]=2.5X10-28,要使溶解即[Zn2+]=0.1mol/L.为了方便下面单位不打出来.
则[S2-]=2.5X10-27
K=Ka1Ka2 = [H+]2 [ S2-]/[H2S]
其中硫元素基本都是以H2S存在为0.1mol,则1.3X10-7 *7.1X10-15 = [H+]2 *2.5X10-27 /0.1
[H+]2 = 3.692 X104 则,[H+] = 192.1.要判断能否溶于酸依据
KSP/Ka1*Ka2 >10 7能直发进行,如果是1年前查看全部
- 计算溶液的PH:100ml,0.10mol/LH3PO4与100ml,0.20mol/LNaOH相混合
 水镜先生也看股1年前2
水镜先生也看股1年前2 -
 提拉米苏2007 共回答了23个问题
提拉米苏2007 共回答了23个问题 |采纳率95.7%100ml,0.10mol/LH3PO4与100ml,0.20mol/LNaOH相混合,
刚好生成Na2HPO4
在酸碱质子论中Na2HPO4当两性物质
[H+ ]=(Ka2 ×Ka3)^(1/2)=[(6.23×10^-8) ×(2.2×10^-13)]^(1/2)=1.17×10^-10
pH=9.93
Ka数据来自张祖德无机化学1年前查看全部
- 在50.00mL 0.15mol/LNH3和0.20mol/LNH4Cl溶液中,加入1.00mL 0.10mol/LHC
在50.00mL 0.15mol/LNH3和0.20mol/LNH4Cl溶液中,加入1.00mL 0.10mol/LHCl溶液.计算加HCl溶液前后溶液的pH值各为多少?
 wfbzhl1年前1
wfbzhl1年前1 -
 闻风香儿来 共回答了13个问题
闻风香儿来 共回答了13个问题 |采纳率92.3%反应前:0.05L x 0.15mol/L = 0.0075mol MH3; 0.2mol/L x 0.05L = 0.01mol NH4Cl; 0.1mol/L x 0.001L = 0.0001mol HCl PKa (NH4Cl) = 10 PH = PKa + log [NH3] / [NH4+] = 10 + log (0.0075/0.01) = 10 - 0.12 = 9.875 NH3 + HCl --- NH4Cl 反应后:0.0074mol NH3 ; 0.0101mol NH4Cl PH = PKa + log [NH3] / [NH4+] = 10 + log (0.0074/0.0101) = 10 - 0.135 = 9.8651年前查看全部
- 若0.10mol·L-1 KNO3、0.10mol·L-1 HAc、0.10mol·L-1 尿素溶液的渗透压分别为、和,
若0.10mol·L-1 KNO3、0.10mol·L-1 HAc、0.10mol·L-1 尿素溶液的渗透压分别为、和,则三者之间的关系为
 北方酒仙1年前1
北方酒仙1年前1 -
 神仙朱朱 共回答了16个问题
神仙朱朱 共回答了16个问题 |采纳率93.8%渗透压看溶液中微粒总浓度即可.
尿素是非电解质
乙酸是弱电解质
KNO3是强电解质
总浓度KNO3>HAc>CO(NH2)21年前查看全部
- 帮忙解答一下 谢谢了急呀急0.20MOL每升氨水中同时含有0.10MOL每升氯化氨时的[OH]及PH值是多少?说下过程
帮忙解答一下 谢谢了
急呀急
0.20MOL每升氨水中同时含有0.10MOL每升氯化氨时的[OH]及PH值是多少?
说下过程 或者思路最好
谢谢大家了. 甘贞洁1年前1
甘贞洁1年前1 -
 huang-qiu 共回答了22个问题
huang-qiu 共回答了22个问题 |采纳率95.5%NH3 + H2O NH4+ + OH-
因为共二酸碱NH3/NH4+ 同时存在于体系中,这是一个缓冲溶液.
pH = pKa + log([NH3]/[NH4+]= 9.244 + log(0.2/0.1)= 9.551年前查看全部
- 欲配制pH=5.00的HAc-NaAc缓冲溶液1000mL,需要0.10mol.L-1的HAc和0.10mol.NaAc
欲配制pH=5.00的HAc-NaAc缓冲溶液1000mL,需要0.10mol.L-1的HAc和0.10mol.NaAc溶液各多少毫升HAcpK4.75
 还不是因为爱秋天1年前1
还不是因为爱秋天1年前1 -
 lovada 共回答了22个问题
lovada 共回答了22个问题 |采纳率90.9%【1】已知:缓冲溶液pH=5.00, 即:[H+] =1.0x10^ -5 . Ka = 10^-4.75
缓冲液体积V = Va+Vb=1L [HAc] = 0.1Va , [Ac-] = 0.1Vb
【2】依据缓冲溶液的公式 :[H+] = Ka ( [HAc] /[Ac-]) = Ka (0.1Va/0.1Vb) = Ka[(1-Vb)/Vb]
【3】代入已知数据: 1.0x10^ -5 /10^-4.75 = (1-Vb)/Vb, 求得 Vb = 0.64 (L); Va= 0.36(L)
【4】答案:,需要0.10mol.L-1的HAc360毫升和0.10mo/LlNaAc 640毫升相混合,即可.1年前查看全部
- 2,现有0.10mol/LNaH2PO4溶液50ml,欲配制pH=7.00的溶液,问需加入0.10mol/LNaOH溶液
2,现有0.10mol/LNaH2PO4溶液50ml,欲配制pH=7.00的溶液,问需加入0.10mol/LNaOH溶液多少毫升
如题 火艺1年前1
火艺1年前1 -
 126lala3 共回答了19个问题
126lala3 共回答了19个问题 |采纳率94.7%这个要用到缓冲溶液的pH计算公式,1年前查看全部
- 在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0
在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0.1
若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后,求n(SO3)的范围
解析:0.36 kengle1年前1
kengle1年前1 -
 深海里的泪 共回答了22个问题
深海里的泪 共回答了22个问题 |采纳率100%那么根据上述 三段式 SO2不是应该是0.18+02=0.38吗 怎么是0.4呢,这里的SO2应该是SO3吧.解析里说了:若继续通入同量的反应物,相当于增大压强,使平衡向正反应方向进行,这句话是关键,明白了这句话你就明白为什么n(SO3)>0.36mol,那个0.4是假设完全反应的结果,但是因为这个方程式是可逆反应,所以答案是所以0.361年前查看全部
- 某温度下,向容积为2L的密闭反应器中充入0.10mol SO3,当反应器中的气体压强不再变化时测得SO3的转化
某温度下,向容积为2L的密闭反应器中充入0.10mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2⇌2SO3(g)的平衡常数为( )
A.8.0×102mol-1•L
B.1.6×103mol-1•L
C.3.2×103mol-1•L
D.4.0×102mol-1•L yaoo221年前1
yaoo221年前1 -
 pigflyer 共回答了19个问题
pigflyer 共回答了19个问题 |采纳率94.7%解题思路:根据SO3的转化率计算转化的SO3的物质的量,再计算SO3的浓度变化量,根据三段式计算平衡时各组分的浓度,计算反应2SO3⇌2SO2+O2的平衡常数,相同温度下,同一反应的正、逆反应平衡常数互为倒数,据此计算.平衡时SO3的转化率为20%,转化的SO3的物质的量为0.1mol×20%=0.02mol,SO3的浓度变化量为0.02mol2L=0.01mol/L, 2SO3...
点评:
本题考点: 化学平衡的计算.
考点点评: 本题考查平衡常数的有关计算,难度中等,注意对平衡常数表达式的理解,确定相同温度下同一反应正、逆平衡常数互为倒数.1年前查看全部
- 常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL
常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1CH3COOH溶液
常温下,用0.10mol?L-1 NaOH溶液分别滴定20.00mL 0.10mol?L-1 HCl溶液和20.00mL 0.10mol?L-1CH3COOH溶液,得到2条滴定曲线,如图所示,则下列说法正确的是( )
A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂
 iii112221年前1
iii112221年前1 -
 火娘鸟 共回答了17个问题
火娘鸟 共回答了17个问题 |采纳率94.1%A、如果酸为强酸,则0.1000mol/L酸的pH为1,根据酸的初始pH知,图1为盐酸滴定曲线,故A错误;
B、根据图1知,a点氢氧化钠溶液的体积是20mL,酸和碱的物质的量相等,二者恰好反应生成强酸强碱盐,其溶液呈中性;醋酸溶液中滴入的氢氧化钠溶液,醋酸钠溶液呈碱性,所以氢氧化钠溶液的体积小于20.00ml,a>b,故B错误;
C、E点溶液的成分为醋酸钠和醋酸,溶液呈酸性,说明醋酸的电离程度大于醋酸钠的水解程度,盐类水解程度较小,则溶液中离子浓度为(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D、氢氧化钠和盐酸反应恰好呈中性,可以选择甲基橙或酚酞;氢氧化钠和醋酸恰好反应生成醋酸钠溶液呈碱性,只能选择酚酞,故D错误;
故选C.1年前查看全部
- 1、配制300ml 0.10mol?L-1 NaOH溶液,需称取固体NaOH的质量是:A、1.2g B、1.2mg C、
1、配制300ml 0.10mol?L-1 NaOH溶液,需称取固体NaOH的质量是:A、1.2g B、1.2mg C、4.0g D、4.0mg
2、在500ml生理盐水中,其渗透浓度为( )mOsmol?L-1
A、196 B、154 C、308 D、391
3、如果聚沉Fe(OH)3溶胶(正溶胶)下列电解质中聚沉能力最大的是:
A、AlCl3 B、NaNO3 C、Na2SO4 D、K3PO4
4、HPO42-的共轭碱是:
A、OH- B、H2PO42- C、PO43- D、H3PO4
5、下列叙述错误的是:
A、溶液中H+离子浓度愈大,pH愈低
B、在室温下,任何水溶液中都有[H+][OH-]=10-14
C、溶液的pH越大,其pOH就越小
D、在浓HCl溶液中,没有OH-离子存在
6、0.01mol?L-1 NaOH溶液的pH值等于( )
A、2 B、4 C、12 D、11
7、在配合物K[Co(en)(C2O4)2]中,中心离子的电荷数及配位数分别是( )
A、+3和3 B、+3和6 C、+3和4 D、+1和6 cctv901年前1
cctv901年前1 -
 jiangng 共回答了17个问题
jiangng 共回答了17个问题 |采纳率94.1%1、配制300ml 0.10mol?L-1 NaOH溶液,需称取固体NaOH的质量是:A、1.2g
2、在500ml生理盐水中,其渗透浓度为( )mOsmol?L-1: C、308
3、如果聚沉Fe(OH)3溶胶(正溶胶)下列电解质中聚沉能力最大的是:D、K3PO4
4、HPO42-的共轭碱是:C、PO43-
5、下列叙述错误的是:D、在浓HCl溶液中,没有OH-离子存在
6、0.01mol?L-1 NaOH溶液的pH值等于( C、12 )
7、在配合物K[Co(en)(C2O4)2]中,中心离子的电荷数及配位数分别是( B、+3和6)1年前查看全部
- 浓度为0.10mol·L-1的NaHCO3溶液的c(H+)近似等于(Ka1θ和Ka2θ分别代表H2CO3的一级和二级电离
浓度为0.10mol·L-1的NaHCO3溶液的c(H+)近似等于(Ka1θ和Ka2θ分别代表H2CO3的一级和二级电离常数)
希望给出过程 金蛋还是银蛋1年前1
金蛋还是银蛋1年前1 -
 13yiwan 共回答了23个问题
13yiwan 共回答了23个问题 |采纳率91.3%根号下Ka1·Ka2.
推导过程比较复杂,参阅任何一本无机化学或分析化学教材,都有的.1年前查看全部
- 溶液中含有Fe2+和Fe3+离子,它们的浓度是0.10mol.L-1,如果要求Fe(OH)3沉淀完全而Fe2+不生成Fe
溶液中含有Fe2+和Fe3+离子,它们的浓度是0.10mol.L-1,如果要求Fe(OH)3沉淀完全而Fe2+不生成Fe(OH)2沉淀,需要控制PH值在何范围?
已知:K sp(Fe(OH)3)=4.0*10-38 K sp(Fe(OH)2)=8.0*10-16 秋月含情轻叩窗1年前3
秋月含情轻叩窗1年前3 -
 綠茶好心情 共回答了20个问题
綠茶好心情 共回答了20个问题 |采纳率100%pH最大值就是Fe(OH)2刚沉淀时的pH
c(OH)==√(Ksp(Fe(OH)2)/0.01)==8.9*10^-9
pH==14+lgc(OH)==5.9
pH最小值就是Fe(OH)3刚沉淀时的pH
c(OH)==[Ksp(Fe(OH)3)/0.01]^(1/3)==1.6*10^-12==2.2
即 2.21年前查看全部
- 1、往1dm3 0.10mol/ dm3 HAc溶液中加入一些NaAc晶体并使之溶解,会发生的情况是 ( )
1、往1dm3 0.10mol/ dm3 HAc溶液中加入一些NaAc晶体并使之溶解,会发生的情况是 ( )
x05 (A)HAc的α值增大 (B)HAc的α值减小
x05 (C)溶液的PH不变 (C)溶液的PH减小
2、设氨水的浓度为C,若将其稀释一倍,则溶液中C(OH-)为( )
x05(A)C (B)
x05(C) (D)2C
3、下列各种物质的溶液浓度均为0.01 mol/ dm3,按它们的渗透压递减的顺序排列正确的是 ( )
(A)HAc—NaCl—C6H12O6—CaCl2 (B)C6H12O6—HAc—NaCl—CaCl2
(C)CaCl2—NaCl— HAc—C6H12O6 (D)CaCl2—HAc—C6H12O6—NaCl
4、设AgCl在水中、在0.01 mol/ dm3 CaCl2中,在0.01mol/dm3 NaCl中以及在0.05 mol/ dm3 AgNO3中的溶解度分别为S0、S1、S2和S3 ,这些量之间的正确关系是 ( )
(A)S0>S1>S2>S3 (B) S0>S2>S1>S3
x05(C) S0>S1=S2>S3 (D) S0>S2>S3>S1
x05 5、下列固体物质在同浓度Na2S2O3溶液中溶解度(以1dm3 Na2S2O3溶液中能溶解该物质的物质的量计)最大的是 ( )
x05(A)Ag2S (B)AgBr
x05(C)AgCl (D)AgI 雨后的一叶浮萍1年前4
雨后的一叶浮萍1年前4 -
 clara943 共回答了15个问题
clara943 共回答了15个问题 |采纳率86.7%1、B
2、根号下(CKb/2)
3、B
4、B
5、C1年前查看全部
- 化学平衡中总压力怎么算已知方程H2+I2=2HI Kc=57.0 700k1)计算再0.5L容器中放入0.10mol的I
化学平衡中总压力怎么算
已知方程H2+I2=2HI Kc=57.0 700k
1)计算再0.5L容器中放入0.10mol的I2和0.05mol的H2时的平衡总压力
2)将容器体积改为1L,平衡是否会调整?
3)当I2初始浓度为0.10 M,H2初始浓度为 0.10M,HI初始浓度为 0.20M,计算其反应物平衡时的浓度? 静静地走过1年前2
静静地走过1年前2 -
 佛尘1981 共回答了23个问题
佛尘1981 共回答了23个问题 |采纳率87%1.H2 + I2 = 2HI
1 1 2
起始 0.05 0.1 0
变化 x x 2x
平衡 0.05-x 0.1-x 2x
则:4x^2/(0.05-x)(0.1-x)=57,解得x=0.003344
n(H2)= 0.05-0.003344= 0.047
n(I2)= 0.1-0.003344= 0.097
n(HI)= 2*0.003344= 0.006688
n总=0.15
P=8.314*0.15*700*1000/0.5=1745940 Pa
2.容器体积改为1L,即压强增大,平衡不会调整
3.如1设HI反应了2xM
(0.2+2x)^2/(0.1-x)^2=57
x=0.058
C(H2)=0.042M
C(I2)=0.042M
C(HI)=0.284M1年前查看全部
- 0.10mol.L-1的NH3•H2O溶液20ml中加入0.10 mol.L-1的HCl溶液20ml,溶液C
0.10mol.L-1的NH3•H2O溶液20ml中加入0.10 mol.L-1的HCl溶液20ml,溶液C(H+)值为
A.0 B.√0.05×Ka(NH4+) C.0.05 D.0.20 liwentan11年前2
liwentan11年前2 -
 陆上来风 共回答了22个问题
陆上来风 共回答了22个问题 |采纳率90.9%等体积混合,混合后体积扩大两倍,浓度都缩小2倍,反应后恰好得到
NH4Cl 0.05mol/L 40ml
-----NH4+ + H20 === NH3.H2O + H+
总量 0.05
水解 x x x (水是纯液体,不考虑它的浓度)
平衡0.05-x x x
Ka(NH4+)=x*x/(0.05-x)
C(H+)=x=【(0.05-x)×Ka(NH4+)】开根号
近似等于【0.05×Ka(NH4+)】开根号1年前查看全部
- 物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可
物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
A. 3.2 g
B. 4.0 g
C. 4.2 g
D. 4.6 g 小东南1年前1
小东南1年前1 -
 cici8318 共回答了17个问题
cici8318 共回答了17个问题 |采纳率88.2%解题思路:金属Mg在只含有CO2和O2混合气体的容器中燃烧,固体的质量包括未反应镁的质量、生成的碳的质量和生成的氧化镁的质量,采用极限讨论法,若镁全部与二氧化碳反应生成固体量最大,假设镁没有反应,则固体量最少,计算出固体的范围,然后对各选项进行判断.镁条在只含有CO2和O2混合气体的容器中燃烧,反应后容器内固体物质的质量为:未反应镁的质量、生成的碳的质量及生成的MgO的质量,
若气体中无氧气,镁完全与二氧化碳反应时,反应后固体的质量最大,
2Mg+CO2
点燃
.
2MgO+C,
2 21
0.10mol0.10mol0.05mol
则0.1mol镁完全反应最多可生成固体的质量为:0.10mol×40g/mol+0.05mol×12g/mol=4.6g,
若金属镁没有反应,则固体的质量最少,固体质量最小为:0.10mol×24g/mol=2.4g,
由于含有二氧化碳和氧气,且镁条也参加了反应,
则反应后固体质量m的范围应为:2.4g<m<4.6g,
故选D.点评:
本题考点: 有关混合物反应的计算.
考点点评: 本题考查了有关混合物的计算,题目难度中等,明确镁与氧气、二氧化碳的反应原理为解答本题的关键,注意极限法在化学计算中的应用.1年前查看全部
- 试计算用1.0L盐酸来溶解0.10mol CdS固体所需的HCL浓度
试计算用1.0L盐酸来溶解0.10mol CdS固体所需的HCL浓度
如题 火车dududu1年前1
火车dududu1年前1 -
 可惜我是_双鱼座 共回答了16个问题
可惜我是_双鱼座 共回答了16个问题 |采纳率93.8%CdS制作方法:镉矿用硫酸浸出后成硫酸镉,调整PH=3.5左右用硫化纳沉淀即得,PH不能太低.所以用盐酸溶解CdS,其PH1年前查看全部
- 化学酸碱中和滴定题在40mL 0.10mol/L 氯化钡溶液中,加入过量0.10mol/L硫酸溶液,使沉淀完全.将反应后
化学酸碱中和滴定题
在40mL 0.10mol/L 氯化钡溶液中,加入过量0.10mol/L硫酸溶液,使沉淀完全.将反应后的混合物过滤,取滤液的一半,在滤液中加入25mL 0.20mol/L氢氧化钠溶液至恰好呈中性,计算过量的硫酸溶液的体积.
10mL yumiko7261年前1
yumiko7261年前1 -
 ghorse 共回答了23个问题
ghorse 共回答了23个问题 |采纳率100%思路很清晰:
求出总的加入的 V(H2SO4) ,去除掉和 BaCl2 反应的 V1(H2SO4)
1) 和 BaCl2 反应生成 BaSO4 沉淀,反应的 H2SO4 体积可求出
2) 和 NaOH 中和,可以求出 c(H+),而 H+ 来自于原来的 H2SO4 电离出的 H+ 的一半,所以可求出总的 V(H2SO4)
由 BaCl2 + H2SO4 = BaSO4 + 2HCl ,c(BaSO4) = c(H2SO4)得:
V1(H2SO4) = V(BaCl2) = 40mL
由 2NaOH + H2SO4 = Na2SO4 + 2H2O 得:(注意:是一半的滤液)
n(H+) = 2 * n(OH-) = 2 * 0.025 * 0.2 mol = 0.01 mol
c(H+) = 2 * c(H2SO4) = 2 * 0.1 mol/L = 0.2 mol/L
V(H2SO4) = n(H+) / c(H+) = (0.01 / 0.2) L = 50mL
所以 V2(H2SO4) = V(H2SO4) - V1(H2SO4) = (50 - 40) mL = 10mL1年前查看全部
- 如果在25℃0.1mol-1H2A溶液的PH=-log0.11,则0.10mol-1的H2A溶液中C(A2-)=____
如果在25℃0.1mol-1H2A溶液的PH=-log0.11,则0.10mol-1的H2A溶液中C(A2-)=_____MOL-1
 dangd1631年前1
dangd1631年前1 -
 刘刘66 共回答了31个问题
刘刘66 共回答了31个问题 |采纳率90.3%PH=-log0.11得出结论:c(H+)=0.11mol L-1,比0.1大.
对于本题可以这样理解,H2A第一步电离完全,第二步电离部分.
H2A=H+ +HA- HA-=可逆=H+ +A2-
0.1 0.1 0.1 0.01 0.01
所以答案为0.011年前查看全部
- (2014•长宁区一模)物质的量为0.10mol的镁条在足量的、且只含有CO2和O2混合气体的容器中充分燃烧(产物不含碳
(2014•长宁区一模)物质的量为0.10mol的镁条在足量的、且只含有CO2和O2混合气体的容器中充分燃烧(产物不含碳酸镁),反应后容器内固体物质的质量可能为( )
A.3.2g
B.4.2g
C.4.4g
D.4.8g 夏无鸢1年前1
夏无鸢1年前1 -
 summerlele 共回答了21个问题
summerlele 共回答了21个问题 |采纳率90.5%解题思路:镁和氧气反应生成氧化镁,和二氧化碳反应生成氧化镁和碳,采用极限的方法结合原子守恒确定容器中固体质量.如果只发生反应2Mg+O2
点燃
.
2MgO,根据镁原子守恒知,n(MgO)=n(Mg)=0.10mol,则固体质量=0.10mol×40g/mol=4g,
如果只发生反应2Mg+CO2
点燃
.
2MgO+C,根据镁原子守恒知,n(MgO)=n(Mg)=0.10mol,氧化镁的质量0.10mol×40g/mol=4g,根据镁和碳的关系式知,n(C)=[1/2]n(Mg)=0.05mol,碳的质量=0.05mol×12g/mol=0.6g,固体质量=6g+0.6g=4.6g,
实际上,镁和氧气、二氧化碳都反应,则生成固体的质量介于二者之间,即4g<固体质量<4.6g,
故选BC.点评:
本题考点: 镁的化学性质;化学方程式的有关计算.
考点点评: 本题以镁为载体考查了根据方程式进行计算,因为气体的量未知,可以采用极限的方法来分析解答,难度不大.1年前查看全部
- 将40ml0.10mol/lAgNO3溶液和20ml6mo/l氨水混合并稀释至100ml,求平衡时溶液中Ag+,Ag(N
将40ml0.10mol/lAgNO3溶液和20ml6mo/l氨水混合并稀释至100ml,求平衡时溶液中Ag+,Ag(NH3)2+和NH3浓度
 cc七大贱客之首1年前2
cc七大贱客之首1年前2 -
 woaizxm 共回答了15个问题
woaizxm 共回答了15个问题 |采纳率86.7%AgNO3物质的量=0.1*0.04=0.004摩尔,NH3物质的量=6*0.02=0.12摩尔,可以看出氨水远远过量,AgNO3将全部生成Ag(NH3)2+,即0.004摩尔的Ag(NH3)2+.此时NH3物质的量=0.12-0.004*2=0.112摩尔.浓度:Ag(NH3)2+=0.004/0.1=0.04摩尔/升、NH3=0.112/0.1=1.12摩尔/升.
在化学平衡 Ag(NH3)2+ = 2NH3 + Ag+ 中,
反应前:0.04摩尔/升 1.12摩尔/升 0
平衡时:0.04-x 1.12+2x x
K=x(1.12+2x)^2/(0.04-x)=5.9*10^-8,x=1.88*10^-9摩尔/升.
即:Ag+浓度=1.88*10^-9摩尔/升;Ag(NH3)2+浓度=0.04摩尔/升;NH3浓度=1.12摩尔/升.1年前查看全部
- (2010•桂林一模)以Pt为电极,电解含有金属离子M+、N3+各0.10mol的溶液,阴极析出的金属单质或气体的总物质
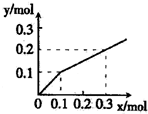 (2010•桂林一模)以Pt为电极,电解含有金属离子M+、N3+各0.10mol的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示.对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( )
(2010•桂林一模)以Pt为电极,电解含有金属离子M+、N3+各0.10mol的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示.对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( )
A.N3+>H+>M+
B.M+>N3+>H+
C.M+>H+>N3+
D.条件不足,无法确定 曾是1年前1
曾是1年前1 -
 553000 共回答了13个问题
553000 共回答了13个问题 |采纳率84.6%解题思路:根据图象可知,开始即析出固体或气体,有0.1mol电子通过时,析出固体或气体的物质的量为0.1mol,证明此时析出的固体是M,此后,根据失去电子数和析出物物质的量的关系可知,第二放电的离子是H+,N3+不放电,从而判断离子氧化性.通电后就有固体生成,当通过电子为0.1mol时,析出固体或气体的物质的量为0.1mol,证明此时析出的固体,而不是氢气(若是氢气,那么氢气的物质的量应该为0.05mol),第二阶段,失去电子0.2mol,对应物质0.1mol,可知该物质是氢气,后面失电子数和物质的量比例保持不变,说明X3+不放电,M+离子先于H+放电,故氧化能力为M+>H+>N3+.
故选C.点评:
本题考点: 电解原理.
考点点评: 本题考查学生根据图象获取信息、运用知识综合分析能力,难度中等,关键在确定曲线的转折点的含义.1年前查看全部
- 基础化学 求解答浓度均为0.10mol·L-1的Cuen22 和CuY2-分别计算溶液Cu2的浓度并比较它们的
基础化学 求解答
浓度均为0.10mol·L-1的Cuen22 和CuY2-分别计算溶液Cu2的浓度并比较它们的稳定性.5分 已知:KsCuen221.0×1020.0 Ks CuY2-1.0×1018.7

 曲水流觞意未央1年前3
曲水流觞意未央1年前3 -
 pan282 共回答了21个问题
pan282 共回答了21个问题 |采纳率90.5%Cu(en)22+ = Cu2+ + 2 en
0.1 - x x 2x
Ks = [Cu(en)22+] / [Cu2+][en]^2
Ks = ( 0.1 - x ) / 4x^3 = 10^20
所以[Cu2+] = x = 6.3 × 10^(-8)
CuY2- = Cu2+ + Y4-
0.1 -y y y
Ks = [Cu(en)22+] / [Cu2+][T4-]
( 0.1 - y ) / y^2 = 10^18.7
所以[Cu2+] = y = 1.4 × 10^(-10)
x>y,所以CuY2-更稳定.(因为电离出的Cu2+更少)1年前查看全部
- 计算PH=4.0时,0.10mol/LHAc溶液中,HAc和Ac-的分布分数和平衡浓度.(已知Ka=1.8*10-5)
 拉拉12341年前1
拉拉12341年前1 -
 zise32 共回答了28个问题
zise32 共回答了28个问题 |采纳率89.3%HAc的分布系数=c(H+)/(c(H+)+Ka)
Ac-的分布系数=Ka/(c(H+)+Ka)
带入已知数据c(H+)=1.0*10^-4,Ka=1.8*10^-5
可算得HAc分布系数=0.85,Ac-分布系数=0.15
分布系数乘以总浓度就是平衡浓度
二者浓度分别为0.085mol/L和0.015mol/L1年前查看全部
- 某金属单质0.10mol,直接跟氯气反应,固体增加10.65g,该金属单质是 以下 A钠 B镁 C铁 D铜
 jifeng8402061年前1
jifeng8402061年前1 -
 a3a3aa 共回答了17个问题
a3a3aa 共回答了17个问题 |采纳率88.2%铁,因为计算得知该金属是三价,选项中只有铁可以1年前查看全部
- 将0.10mol*L-1的NaOH溶液和0.60mol*L-1的NaOH溶液混合成0.20mol*L-1的NaOH溶液.
将0.10mol*L-1的NaOH溶液和0.60mol*L-1的NaOH溶液混合成0.20mol*L-1的NaOH溶液.求2中溶液的体积比.
(忽略混合时体积变化) 缘分牛牛1年前2
缘分牛牛1年前2 -
 landmark_43 共回答了16个问题
landmark_43 共回答了16个问题 |采纳率93.8%0.1x+0.6y=0.2(x+y)
0.1x=0.4y
x:y=4:11年前查看全部
- 普通化学B的一道复习题 将0.10molMgCl2(s)加入2升0.1mol/dm3的氨水,试根据计算结果说明有Mg(O
普通化学B的一道复习题
将0.10molMgCl2(s)加入2升0.1mol/dm3的氨水,试根据计算结果说明有Mg(OH)2沉淀生成.继续向该体系中滴加浓盐酸至沉淀恰好完全溶解时(忽略溶液体积变化),计算此时溶液的:
(1)pH=?(2)c(NH3·H2O)=?c(NH4+)=?已知:﹛Kob(NH3)=1.8×10-5,Kos[Mg(OH)2]=1.2×10-11﹜ jxlp123451年前1
jxlp123451年前1 -
 星砂蔷薇 共回答了29个问题
星砂蔷薇 共回答了29个问题 |采纳率75.9%此时[Mg2+]=0.05mol/L,[NH3]=0.1mol/L,所以溶液[OH-]^2=Kb×0.01 [OH-]=1.34×10-3mol/L
离子积为Q=0.05×(1.34×10-3)^2=9×10-8大于Ksp[Mg(OH)2].所以有沉淀生成.
沉淀恰好溶解时,[Mg2+]=0.05mol/L,由Ksp[Mg(OH)2]=[Mg2+]×[OH-]^2得出[OH-]=1.55×10-5mol/L
由Kb(NH3*H2O)=[NH4+]×[OH-]/[NH3*H2O]=1.8×10-5,[NH4+]+[NH3*H2O]=0.1,代入数值解方程,可以分别求出[NH4+]=0.077mol/L,[NH3*H2O]=0.023mol/L1年前查看全部
- 要配制450CM2 PH=4.70 的缓冲溶液 求0.10mol/dm3 HCL 和0.10mol/dm3 NAOH 溶
要配制450CM2 PH=4.70 的缓冲溶液 求0.10mol/dm3 HCL 和0.10mol/dm3 NAOH 溶液的体积.(ka(hac=1.8*10-5)
 可乐加味精1年前1
可乐加味精1年前1 -
 nicky2517 共回答了19个问题
nicky2517 共回答了19个问题 |采纳率100%你的题目抄错了啦.如果总溶液是450mL,HAc和NaOH溶液都是0.1mol/L,设需要HAc和NaOH体积分别为V1,V2
HAc + NaOH = NaAc + H2O; HAc = Ac- + H+
0.1V1-0.1V2 0.1V2 0.1V1-0.1V2 0.1V2
由:pH = pKa - lg[HAc]/[Ac-] ,已知pKa = 4.7,pH =4.7得[HAc]/[Ac-] =1
0.1V1-0.1V2 = 0.1V2 ,V1 = 2 L ,V2 = 1L,所以:
需要醋酸体积:450 * 2/3 = 300(mL)
需要NaOH体积:450 * 1/3 = 150(mL)1年前查看全部
- 室温下0.10mol/L一元弱酸溶液的PH为5.0,则其共轭碱溶液(Cb=0.10mol/L)的PH为
室温下0.10mol/L一元弱酸溶液的PH为5.0,则其共轭碱溶液(Cb=0.10mol/L)的PH为
( )
A.8.0 B.9.0
C.10.0 D.11.0 luoy89021年前1
luoy89021年前1 -
 wenggxx 共回答了19个问题
wenggxx 共回答了19个问题 |采纳率100%Ka=(H+)×(A-)/(HA)
Kb=(OH-)×(HA)/(A-)
由上式可得,Ka*Kb=Kw=10^-14 .
代入H+和A-(和H+相等)的浓度10^-5,和HA的浓度0.1(近似计算).可得Ka=10^-9,则Kb=10^-5 .
计算0.1mol/L共轭碱(A-)的PH,A-的浓度0.1mol/L,Kb=10^-5,分子上OH-的浓度和HA浓度相等,计算得OH-浓度为10^-3mol/L,PH=11.
如有疑惑,欢迎追问1年前查看全部
- 大学无机沉淀溶解平衡 欲使0.10mol的MnS和CuS溶于1.0L盐酸中,问所需盐酸的最低浓度各是多少?
大学无机沉淀溶解平衡 欲使0.10mol的MnS和CuS溶于1.0L盐酸中,问所需盐酸的最低浓度各是多少?
题目答案是先算溶解MnS所需盐酸,再算CuS的,然后相加
我认为这个方法不太对 我是列出总方程式MnS+CuS+4H+=2H2S+Mn2+Cu2+
然后再求所需盐酸
请问哪个正确? tom2161年前0
tom2161年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在100mLpH=7.00含有0.10mol·L-1Ca2+的溶液中,加入100mL0.50mol·L-1 (NH4)2
在100mLpH=7.00含有0.10mol·L-1Ca2+的溶液中,加入100mL0.50mol·L-1 (NH4)2CO3溶液(不考虑水解),K(CaCO3)=2.810-9,Mr(CaCO3)=100.试计算:
(1)CaCO3沉淀的质量;
(2)平衡时溶液中Ca2+的浓度. wwyy1年前1
wwyy1年前1 -
 uuajun 共回答了18个问题
uuajun 共回答了18个问题 |采纳率66.7%因为不考虑水解,(默认反应体系在常温下进行,PH值为7,溶液呈中性)加入碳酸铵溶液PH值不变,但钙离子的浓度变为原来的一半0.050mol/L,碳酸根离子的浓度也减半为0.25mol/L,由K(CaCO3)=2.810-9,得当溶液中的钙离子和碳酸根离子浓度之积,小于或等于则沉淀完全,所以可列方程(0.050-x)(0.25-x)=K(CaCO3)=2.810-9,x为反应的钙离子浓度,接着可求,沉淀的摩尔数,再求出CaCO3沉淀的质量.
(2)可以由(1)求出,重点是写反应方程式,列出方程,1年前查看全部
- 5.用只允许水分子透过的半透膜将0.10mol.L-1蔗糖溶液(左池)与0.010mol.L-1蔗糖溶液(右池)隔开
5.用只允许水分子透过的半透膜将0.10mol.L-1蔗糖溶液(左池)与0.010mol.L-1蔗糖溶液(右池)隔开
水分子将从 池向 池渗透. susan2006cy1年前1
susan2006cy1年前1 -
 cherjenny 共回答了25个问题
cherjenny 共回答了25个问题 |采纳率96%右池到左池
渗透作用发生在有半透膜和浓度差的地方.
既然有浓度差,就说明半透膜两边分子的浓度不同.因为半透膜只允许水分子通过而不允许溶质分子通过,而浓度差要平衡为零,所以为了使两边浓度相等,溶质分子不能动那就只有水分子动了,所以水在渗透作用中从低浓度到高的.1年前查看全部
- 0.10mol/dm^3醋酸溶液100mL与0.10mol/dm^3氢氧化钠溶液50ml混合后,溶液的pH
0.10mol/dm^3醋酸溶液100mL与0.10mol/dm^3氢氧化钠溶液50ml混合后,溶液的pH
如题,只是想知道答案 我爷爷啊1年前0
我爷爷啊1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0
在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10mol O2,半分钟后达到平衡,测容器中含SO3 0.18mol
若继续通入0.20mol SO2和0.10mol O2,再次达到平衡后,求n(SO3)的范围 sizicaco1年前3
sizicaco1年前3 -
 coollyone 共回答了20个问题
coollyone 共回答了20个问题 |采纳率90%解析:0.361年前查看全部
大家在问
- 1(2007•遂宁)某车间的甲、乙两名工人分别同时生产同种零件,他们一天生产零件y(个)与生产时间t(小时)的函数关系如图
- 2如图,三角形ABC为等腰三角形,D为AB中点,求阴影部分面积.单位厘米
- 3cos5分之π×cos5分之2π
- 4爱国诗歌的配乐祖国我们,在您的胸怀中生存了五千年,于是,骨子里便有了五千年不变的中华魂.您的疆域,辽阔而雄浑,如那拂晓高
- 5设a,b,c为非零有理数,且abc<0,求a/|a|+|b|/b+c/|c|+|ab|/ab+bc/|bc|+|c
- 6船速24节相当于多少公里每小时今天看到一个单位换算的问题1kn=1n mile/h=1852米/3600秒问24节航速是
- 7到一点的距离数为正数的点有两个,他们在这点的两侧.(数轴的定义)是什么意思,我怎么感觉不对
- 8三生莫逆,以心相悦;人生何求,知心把酒的意思
- 9(14分)大自然的语言(节选)物候现象的来临决定于哪些因素呢?首先是纬度。越往北桃花开得越迟,候鸟也来得越晚。值得指出的
- 10开心暑假四年级泉州篇34页念儿歌,填数字
- 11解方程:[x−4/x−5]+[x−8/x−9]=[x−7/x−8]+[x−5/x−6].
- 12一个总体分为A,B两层,其个体数之比为4:1,用分层抽样方法从总体中抽取一个容量为10的样本,已知B层中甲、乙都被抽到的
- 13(2013•朝阳区一模)如图1所示,一长木板静止放在光滑水平面上,一滑块(可视为质点)以水平初速度v0由左端滑上木板,滑
- 14Many boys _____ (swim) in this river last year.But they can'
- 15(3X)二的平方-(2X+1)(3X-2)=3(X+2)(X-2)怎么解
