若100mL0.1mol/L硫酸铝溶液和氢氧化钠溶液反应得到1.17g沉淀,则需要0.5mol/L的NaOH溶液多少毫升
 脑裂兔子2022-10-04 11:39:543条回答
脑裂兔子2022-10-04 11:39:543条回答
若100mL0.1mol/L硫酸铝溶液和氢氧化钠溶液反应得到1.17g沉淀,则需要0.5mol/L的NaOH溶液多少毫升?
当OH-过量时为什么 Al3+是0.02mol?谁给我讲明白追加20 我Q 10561252
当OH-过量时为什么 Al3+是0.02mol?谁给我讲明白追加20 我Q 10561252

已提交,审核后显示!提交回复
共3条回复
 83461138 共回答了11个问题
83461138 共回答了11个问题 |采纳率90.9%- 无论是否过量``铝离子总量都是0.02mol啊``
0.01mol硫酸铝Al2(SO4)3含有0.01*2=0.02mol的Al3+的·· - 1年前
 生的事 共回答了51个问题
生的事 共回答了51个问题 |采纳率- n(Al(OH)3)=1.17/78=0.015mol
OH-不足时 v(NaOH)=3*0.015/0.5=0.09L=90ml
OH-过量,V1(NaOH)=6*0.1*0.1/0.5=0.12L
AL(OH)3+NaOH=NaAlO2+2H2O
V2(NaOH)=(0.1*0.1*2-0.015)/0.5=0.01L
V=V1+V2=0.13L=130ml - 1年前
 idpgkbgp 共回答了2个问题
idpgkbgp 共回答了2个问题 |采纳率- 第一步反应 Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3 中消耗的NaOH的物质的量为0.1*0.1*6=0.06mol
沉淀全为Al(OH)3
故Al(OH)3的物质的量为1.17/78=0.015mol
而原来总共的Al的物质的量为0.1*0.1*2=0.02mol
故溶液中NaAlO2的物质的量为0.02-0.015=0.005mol - 1年前
相关推荐
- 这是一道选择A,相同溶度的两溶液氢离子溶度相同.B,100mL0.1mol的两溶液能中和等物质的量的氢氧化钠.
这是一道选择A,相同溶度的两溶液氢离子溶度相同.B,100mL0.1mol的两溶液能中和等物质的量的氢氧化钠.
C,PH=3的两溶液稀释100倍,PH为5.D,两溶液中分别加入少量对应的钠盐,氢离子溶度明显减小 小虫阿七1年前2
小虫阿七1年前2 -
 ququ32 共回答了16个问题
ququ32 共回答了16个问题 |采纳率93.8%D1年前查看全部
- 下列关于盐酸与醋酸两种稀溶液的说法正确的是( ) A.相同浓度的两溶液中c(H + )相同 B.100mL0.1mol
下列关于盐酸与醋酸两种稀溶液的说法正确的是( ) A.相同浓度的两溶液中c(H + )相同 B.100mL0.1mol/L的两溶液能中和等物质的量的氢氧化钠 C.pH=3的两溶液稀释100倍,pH都为5 D.两溶液中分别加入少量对应的钠盐,c(H + )均明显减小  彩虹制造者1年前1
彩虹制造者1年前1 -
 紫冥VV 共回答了17个问题
紫冥VV 共回答了17个问题 |采纳率100%A、醋酸是弱电解质,在其溶液中只有部分电离,氯化氢是强电解质,在其溶液中完全电离,所以相同浓度的两溶液中c(H + )不相同,故A错误.B、醋酸和盐酸都是一元酸,等体积、等浓度的两种酸的物质的量相等,所以...1年前查看全部
- 将100Ml0.1Mol每升的硫酸与同体积0.4Mol每升的Naoh混合 Kw为十的负十二次方 求PH
 sevenono1年前1
sevenono1年前1 -
 pcjsboss 共回答了13个问题
pcjsboss 共回答了13个问题 |采纳率84.6%反应剩余氢氧化钠,体积变为原来的两倍,OH-离子浓度为0.1mol/L,所以H+浓度为10的-11次方,PH=111年前查看全部
- 室温时,向100mL0.1mol/L NH 4 HSO 4 溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与Na
室温时,向100mL0.1mol/L NH 4 HSO 4 溶液中滴加0.1mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
(1)试分析图中a、b、c、d四个点,水的电离程度最大的是______;
(2)在b点,溶液中各离子浓度由大到小的排列顺序是______;
(3)在cd段发生反应的离子方程式______.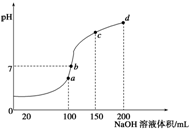
 胜之妮1年前1
胜之妮1年前1 -
 ftydoc 共回答了10个问题
ftydoc 共回答了10个问题 |采纳率100%(1)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H + ,溶液中只有(NH 4 ) 2 SO 4 与Na 2 SO 4 ;b、c、d三点溶液均含有NH 3 •H 2 O,(NH 4 ) 2 SO 4 可以促进水的电离,而NH 3 •H 2 O抑制水的电离.b点溶液呈中性,所以a点水的电离程度最大,故答案为:a;
(2)b点溶液为中性,溶质为(NH 4 ) 2 SO 4 与Na 2 SO 4 、NH 3 •H 2 O,V(NaOH)>V(NH 4 HSO 4 ),铵根离子水解,则离子浓度大小为c(Na + )>c(SO 4 2- )>c(NH 4 + )>c(OH - )=c(H + ),故答案为:c(Na + )>c(SO 4 2- )>c(NH 4 + )>c(OH - )=c(H + );
(3)cd段发生铵根离子与碱的反应,该离子反应为NH 4 + +OH - =NH 3 •H 2 O,故答案为:NH 4 + +OH - =NH 3 •H 2 O.1年前查看全部
- 常温下100mL0.1mol/L醋酸溶液中含醋酸分子0.01NA为什么是错的
 在水湄1年前1
在水湄1年前1 -
 凹-凸 共回答了19个问题
凹-凸 共回答了19个问题 |采纳率100%因为醋酸可以电离
虽然是弱酸但ph值为4点多,还是会发生电离
HAc=AC- + H+
(将等号改为可逆)
所以会有部分醋酸以离子形式存在在溶液中
所以
100mL0.1mol/L醋酸溶液中含醋酸分子
应当小于0.01NA1年前查看全部
- 完全中和100mL0.1mol·L - 1 NaOH溶液,需要( ) A.100mL0.1mol·L - 1 H 2
完全中和100mL0.1mol·L - 1 NaOH溶液,需要()
A.100mL0.1mol·L - 1 H 2 SO 4 溶液 B.100mL0.1mol·L - 1 CH 3 COOH溶液 C.50mL0.1mol·L - 1 MgCl 2 溶液 D.100mLpH=1CH 3 COOH溶液  n2pz1年前1
n2pz1年前1 -
 zplxm1991 共回答了18个问题
zplxm1991 共回答了18个问题 |采纳率72.2%B
100ml0.1mol/L氢氧化钠溶液中氢氧化钠的物质的量是0.1L×0.1mol/L=0.01mol,则需要消耗0.01mol氢离子。选项A中氢离子的物质的量是0.02mol,B中醋酸的物质的量是0.01mol,C中氯化镁的物质的量是0.005mol,醋酸是弱酸,所以选项D中醋酸的物质的量大于0.01mol,因此正确的答案选B。1年前查看全部
大家在问
- 1a month ago,i went to see my doctor.when i entered his home余
- 2(2005•上海)阴极射线是从阴极射线管的阴极发出的高速运动的粒子流,这些微观粒子是______.若在如图所示的阴极射线
- 3五谷五谷:稻、黍、稷、麦、豆五谷:稻、黍、稷、麦、豆其中黍、稷是指什么?
- 4短文改错I'm an senior high school student I once think life inse
- 5阿尔卑斯糖的意义各种不同的颜色分别达标什么
- 6已知点p在角α的终边上并且位于第三象限,又知点P的横坐标为-3,到原点的距离√10,求角α的三角函数值
- 7已知(a+b)的平方=22,(a-b)的平方=14求 a方+b方 ab的值
- 8翻译一小段话,很简单的!It was so good of you to give my husband and me
- 9下列选项不能看做一个生态系统的是( ) A.水族箱 B.一条河流 C.草丛中的小动物 D.一片树林
- 10本次出题是八上科学题目(PS:我是真的不会做) 下面是小琴同学测菜油密度的试验步骤
- 11已知函数f(x)=ax-1-lnx(a∈R).
- 12卤代烷的消去反应,取代反应的标准书写方程式
- 13有5个连续偶数,中间一个数为m,求出这五个数的和.
- 14CH3cooH和Mg(OH)2,CaCO3的反应
- 15You're Not Here…,
