H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1,表示:______mol H
 binwang112022-10-04 11:39:541条回答
binwang112022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 a5820721 共回答了19个问题
a5820721 共回答了19个问题 |采纳率100%- 解题思路:依据热化学方程式的表达意义分析,反应焓变和物质聚集状态有关和热化学方程式中物质的系数有关,系数只表示物质的量,可以用分数表示,焓变是指对应物质全部反应时的反应热,与变化过程无关.
H2(g)+[1/2]O2(g)═H2O(l)△H=-285.8kJ•mol-1,表示的是1mol氢气和0.5mol氧气恰好完全反应生成1mol液态水时放出的热量为285.8kJ,
故答案为:1,0.5,液,放出.点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式的表示意义,掌握基础是关键,题目较简单. - 1年前
相关推荐
- 已知下列热化学方程式:①H 2 (g)+ 1 2 O 2 (g)═H 2 O(l);△H=-285.8kJ•mol -1
已知下列热化学方程式:
①H 2 (g)+
O 2 (g)═H 2 O(l);△H=-285.8kJ•mol -11 2
②H 2 (g)+
O 2 (g)═H 2 O(g);△H=-241.8kJ•mol -11 2
③CO(g)═C(s)+
O 2 (g);△H=+110.5kJ•mol -11 2
④C(s)+O 2 (g)═CO 2 (g);△H=-393.5kJ•mol -1
回答下列问题:
(1)上述反应中属于放热反应的是______
(2)H 2 的燃烧热△H=______.
(3)燃烧10g H 2 生成液态水,放出的热量为______.
(4)表示CO燃烧热的热化学方程式为.______. 痞子卯1年前1
痞子卯1年前1 -
 aspac 共回答了24个问题
aspac 共回答了24个问题 |采纳率87.5%(1)△H<0的反应属于放热反应;△H>0的反应属于吸热反应.根据给出的热化学方程式可知:①②④三个反应的)△H<0属于放热反应;反应③△H>0属于吸热反应;
故答案为:①②④;
(2)根据燃烧热的定义知:H 2 燃烧时生成液态水更稳定,所以H 2 (g)+
1
2 O 2 (g)═H 2 O(l);△H=-285.8kJ•mol -1 就是氢气的燃烧热化学方程式,其燃烧热△H=-285.8kJ•mol -1 ;
故答案为:-285.8kJ•mol -1 ;
(3)由热化学方程式①可知
H 2 (g)+
1
2 O 2 (g)═H 2 O(l) Q
2g 285.8KJ
10g 1429KJ
故答案为:1429KJ;
(4)根据燃烧热的定义,碳燃烧生成的两种氧化物中,二氧化碳更稳定,故其燃烧的热化学方程式为:C(s)+O 2 (g)═CO 2 (g);△H=-393.5kJ•mol -1 ;
故答案为:C(s)+O 2 (g)═CO 2 (g);△H=-393.5kJ•mol -1 .1年前查看全部
- 已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ•mol-1、-283.0kJ•mol-1
已知H2(g)、CO(g)、CH3OH(l)的燃烧热△H分别是-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1.下列有关叙述正确的是( )
A.甲醇不完全燃烧生成CO和液态水的热化学方程式:CH3OH(l)+O2 (g)═CO(g)+2H2O(l)△H1=-1009.5kJ•mol-1
B.已知:S(s)+O2(g)=SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2;则△H1>△H2
C.2H2O(g)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1
D.△H>0的化学反应在高温条件下才能自发进行 fox123451年前1
fox123451年前1 -
 tuma 共回答了16个问题
tuma 共回答了16个问题 |采纳率93.8%解题思路:A、由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
B、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小;
C、H2(g)的燃烧热△H=-285.8kJ•mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1;
D、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发;A、由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJ•mol-1和-726.5kJ•mol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l),
该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
即为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1,故A错误;
B、S燃烧为放热反应,1mol气体S具有的能量必1mol固态S高,因此1mol气态S燃烧放热多,焓变小,即为△H1>△H2,故B正确;
C、H2(g)的燃烧热△H=-285.8kJ•mol-1,则2H2O(l)═2H2(g)+O2(g)△H1=+571.6 kJ•mol-1,注意水的状态,故C错误;
D、化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,所以焓变和熵变都不能独立地作为反应自发性的判据,故D错误;
故选B.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查了热化学方程式及反应热的计算、化学反应进行的方向的判断,难度中等,注意化学反应能否自发进行的判断依据是:△G=△H-T△S,当△G>0,反应一定不自发;当△G<0,反应一定自发,焓变和熵变都不能独立地作为反应自发性的判据,与是否加热无关.1年前查看全部
- 已知下列热化学方程式:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
已知下列热化学方程式:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ•mol-1
③C(s)+[1/2]O2(g)=CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是______.
(2)H2的燃烧热为______;C的燃烧热为______.
(3)燃烧10g H2生成液态水,放出的热量为______.
(4)又查得资料有下列热化学方程式:
⑤CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式______. 睡觉好安逸1年前1
睡觉好安逸1年前1 -
 玫瑰yh 共回答了20个问题
玫瑰yh 共回答了20个问题 |采纳率90%解题思路:(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热;
(3)燃烧10g H2生成液态水,依据热化学方程式①计算;
(4)根据已知的热化学方程式结合盖斯定律计算.(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ•mol-1
③C(s)+[1/2]O2(g)=CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1,
以上4个反应均为放热反应,故答案为:①②③④;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,H2的燃烧热为285.8 kJ•mol-1,C的燃烧热为393.5kJ/mol,
故答案为:285.8 kJ•mol-1;393.5kJ/mol;
(3)依据反应①进行计算燃烧10g H2生成液态水放出的热量;
H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
2g 285.8kJ
10gQ
Q=[10g×285.8KJ/10g]=1429kJ,故答案为:1429 kJ;
(4)已知 ④C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
①H2(g)+[1/2]O2(g)═H2O(l)△H2=-285.8kJ/mol
⑤CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律④×2-⑤+①×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△=-488.3 kJ/mol.点评:
本题考点: 热化学方程式;反应热和焓变.
考点点评: 本题考查了放热反应的判断、燃烧热的概念应用、盖斯定律的应用,侧重于反应热的计算的考查,题目难度中等.1年前查看全部
- 已知:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1;CH4(g)+2O2(g)=CO
已知:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是( )
A. 1:1
B. 1:3
C. 1:4
D. 2:3 luobl31181年前1
luobl31181年前1 -
 gongyi221 共回答了26个问题
gongyi221 共回答了26个问题 |采纳率80.8%解题思路:H2和CH4的混合气体112L(标准状况)物质的量为5mol,计算混合物的平均燃烧热为[3242.5/5]kJ/mol=648.5kJ/mol,根据十字交叉法计算原混合气体中H2和CH4的物质的量之比.H2和CH4的混合气体112L(标准状况)物质的量为[112L/22.4L/mol]=5mol,
所以混合气体的平均燃烧热为为[3242.5/5]kJ/mol=648.5kJ/mol,
由H2(g)+[1/2]O2(g)=H2O(1)△H=-285.8kJ•mol-1可知,氢气的燃烧热为285.8kJ/mol;
由CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.3kJ•mol-1可知,甲烷的燃烧热为890.3kJ/mol.
根据十字交叉法计算原混合气体中H2和CH4的物质的量之比: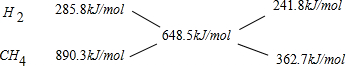
所以原混合气体中H2和CH4的物质的量之比为241.8kJ/mol:362.7kJ/mol=2:3.
故选:D.点评:
本题考点: 有关反应热的计算.
考点点评: 考查热化学方程式的意义与计算,难度中等,可以利用混合物的物质的量与放出的热量列放出计算,但计算量较大,计算容易出错,不如十字交叉法简单.根据情况选择方法.1年前查看全部
- 已知下列热化学方程式:①H2(g)+[1/2]O2(g)═H2O(l);△H=-285.8kJ•mol-1②H2(g)+
已知下列热化学方程式:
①H2(g)+[1/2]O2(g)═H2O(l);△H=-285.8kJ•mol-1
②H2(g)+[1/2]O2(g)═H2O(g);△H=-241.8kJ•mol-1
③CO(g)═C(s)+[1/2]O2(g);△H=+110.5kJ•mol-1
④C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1
回答下列问题:
(1)上述反应中属于放热反应的是______
(2)H2的燃烧热△H=______.
(3)燃烧10g H2生成液态水,放出的热量为______.
(4)表示CO燃烧热的热化学方程式为.______. 你怕什呀1年前1
你怕什呀1年前1 -
 我的树叶 共回答了17个问题
我的树叶 共回答了17个问题 |采纳率100%解题思路:(1)放热反应焓变小于零,吸热反应焓变大于零,据此解答;
(2)在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热;
(3)依据热化学方程式①计算;
(4)在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的化合物时所放出的热量,叫做该物质的燃烧热据此解答.(1)△H<0的反应属于放热反应;△H>0的反应属于吸热反应.根据给出的热化学方程式可知:①②④三个反应的)△H<0属于放热反应;反应③△H>0属于吸热反应;
故答案为:①②④;
(2)根据燃烧热的定义知:H2燃烧时生成液态水更稳定,所以H2(g)+[1/2]O2(g)═H2O(l);△H=-285.8kJ•mol-1 就是氢气的燃烧热化学方程式,其燃烧热△H=-285.8kJ•mol-1;
故答案为:-285.8kJ•mol-1;
(3)由热化学方程式①可知
H2(g)+[1/2]O2(g)═H2O(l) Q
2g 285.8KJ
10g 1429KJ
故答案为:1429KJ;
(4)根据燃烧热的定义,碳燃烧生成的两种氧化物中,二氧化碳更稳定,故其燃烧的热化学方程式为:C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1;
故答案为:C(s)+O2(g)═CO2(g);△H=-393.5kJ•mol-1.点评:
本题考点: 燃烧热;有关反应热的计算.
考点点评: 本题考查了焓变与反应吸热、放热的关系,燃烧热的定义,题目简单,理解燃烧热是注意两点:1必须是1mol的物质;2物质生成的氧化物必须稳定.1年前查看全部
- Ⅰ.H2(g)+[1/2]O2(g)=H2O(l)△H (298K)=-285.8kJ•mol-1的意义是__
Ⅰ.H2(g)+[1/2]O2(g)=H2O(l)△H (298K)=-285.8kJ•mol-1的意义是______
Ⅱ.根据事实,写出298K时下列反应的热化学方程式:
(1)1mol氮气与适量氢气起反应,生成2mol氨气,放热92.2KJ热量.______
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3KJ热量.______
Ⅲ.已知H+(aq)+OH-(aq)=H2O(l);Q=-57.3kJ/mol,求下列中和反应中放出的热量.
(1)用20gNaOH配稀溶液跟足量稀盐酸反应放出______kJ的热量.
(2)用2molH2SO4配稀溶液跟足量稀NaOH反应,放出______kJ的热量. 天兵下北荒1年前1
天兵下北荒1年前1 -
 iyzg4 共回答了16个问题
iyzg4 共回答了16个问题 |采纳率68.8%解题思路:Ⅰ、依据热化学方程式的含义分析;
Ⅱ、(1)依据热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
(2)依据热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
Ⅲ、(1)氢氧化钠和盐酸是强酸和强碱反应,依据中和热是强酸强碱完全反应生成1mol水放出的热量计算得到;
(2)硫酸和氢氧化钠是强酸强碱完全反应,依据中和热概念计算得到2mol硫酸反应放出的热量;Ⅰ、H2(g)+[1/2]O2(g)=H2O(l)△H (298K)=-285.8kJ•mol-1的意义是通常状况下1mol氢气完全燃烧生成液态水放出285.8kJ的热量;
故答案为:298K时1mol氢气与0.5mol氧气完全反应生成1mol液态水放出285.8kJ的热量;
Ⅱ.(1)1mol氮气与适量氢气起反应,生成2mol氨气,放热92.2KJ热量,热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3KJ热量,热化学方程式为:C(s)+H2O (g)=CO(g)+H2 (g)△H=-131.3kJ/mol;
故答案为:C(s)+H2O (g)=CO(g)+H2 (g)△H=-131.3kJ/mol;
Ⅲ.(1)已知H+(aq)+OH-(aq)=H2O(l);Q=-57.3kJ/mol,用20gNaOH配稀溶液中含有0.5molNaOH,跟足量稀盐酸反应,是强酸和强碱发生的中和反应,依据中和热概念计算可知,0.5molOH-完全反应放出热量28.65kJ;
故答案为:28.65kJ;
(2)已知H+(aq)+OH-(aq)=H2O(l);Q=-57.3kJ/mol,用2molH2SO4配稀溶液跟足量稀NaOH反应,是强酸和强碱发生的反应,依据中和热概念计算可知,是4molH+反应放出热量229.2KJ;
故答案为:229.2kJ;点评:
本题考点: 热化学方程式.
考点点评: 本题考查了热化学方程式的书写方法,燃烧热和中和热概念的分析计算,掌握基础是关键,题目难度中等.1年前查看全部
- 25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ•mol-1、285.8kJ•mol-1、89
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ•mol-1、285.8kJ•mol-1、890.3kJ•mol-1、2 800kJ•mol-1,则下列热化学方程式正确的是( )
A.C(s)+[1/2]O2(g)═CO(g);△H=-393.5 kJ•mol-1
B.2H2(g)+O2(g)═2H2O(g);△H=+571.6 kJ•mol-1
C.CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ•mol-1
D.[1/2]C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l);△H=-1 400 kJ•mol-1 zdf77551年前1
zdf77551年前1 -
 草鞋跟 共回答了23个问题
草鞋跟 共回答了23个问题 |采纳率95.7%解题思路:燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据燃烧热的定义判断热化学方程式是否正确.A、C完全燃烧应生成CO2,生成CO,反应热小于393.5kJ/mol,故A错误;
B、H2完全燃烧生成的稳定的氧化物为液态水,故B错误;
C、CH4完全燃烧生成稳定的氧化物为CO2和液态水,故C错误;
D、1mol葡萄糖完全燃烧生成CO2和H2O(l),燃烧热为2800kJ/mol,则[1/2]mol葡萄糖完全燃烧放出1400kJ热量,故D正确;
故选D.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查热化学方程式,题目难度不大,本题注意把握燃烧热的概念,特别是水,稳定状态为液态.1年前查看全部
- 已知CH4、H2、和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0k
已知CH4、H2、和CO的燃烧热(△H)分别为-890.3kJ•mol-1、-285.8kJ•mol-1和-283.0kJ•mol-1.
(1)用铂电极电解稀硫酸溶液,当阳极产生2.24L(标准状况)气体时需消耗的能量是(假设能量的利用率为80%)______.
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO(另一产物为H2),写出该反应的热化学方程式______;
(3)甲烷燃料电池是利用燃料甲烷跟氧气或空气反应,将化学能转化成电能的装置,电解质是强碱溶液.在甲烷燃料电池中:负极反应为______,放电时溶液中的阴离子向______极移动;随放电的进行,溶液的pH______(选填“增大”、“减小”或“不变”).若用该燃料电池电解氯化铜溶液,当消耗甲烷5.6L(标准状况)时,可生成铜的质量为(假设能量的利用率为100%)______. fantacy71年前1
fantacy71年前1 -
 kkdd11 共回答了25个问题
kkdd11 共回答了25个问题 |采纳率96%解题思路:(1)用铂电极电解稀硫酸溶液,阳极生成O2,n(O2)=[2.24L/22.4L/mol]=0.1mol,根据热化学方程式2H2O(l)=O2(g)+2H2(g)△H=+571.6kJ•mol -1计算消耗的能量;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式,利用盖斯定律书写该反应的热化学方程式;
(3)在甲烷燃料电池中负极甲烷发生氧化反应生成CO32-和H2O,根据电极方程式判断pH的变化,并计算铜的质量.(1)用铂电极电解稀硫酸溶液,阳极生成O2,n(O2)=[2.24L/22.4L/mol]=0.1mol,由氢气的燃烧热可知2H2O(l)=O2(g)+2H2(g)△H=+571.6kJ•mol -1,则生成0.1mol需要O2吸收0.1mol×571.6kJ•mol -1=57.16kJ,由于能量的利用率为80%,则实际应吸收[51.76kJ/80%]=71.5kJ,故答案为:71.5kJ;
(2)根据CH4、H2、和CO的燃烧热分别写出燃烧的热化学方程式:
①O2(g)+2H2(g)=2H2O(L)△H=-571.6kJ•mol -1;
②CH4(g)+2O2(g)=CO2(g)+2H2O(L)△H=-890.3kJ•mol-1;
③2CO(g)+O2(g)=2CO2(g)△H=-566.03kJ•mol-1,
利用盖斯定律将②-①-③可得:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ•mol -1,
故答案为:CH4(g)+CO2(g)=2CO(g)+2H2(g);△H=+247.3 kJ•mol -1;
(3)在甲烷燃料电池中负极甲烷发生氧化反应生成CO32-和H2O,负极电极反应式为CH4+10OH--8e═CO32-+7H2O,放电时溶液中的阴离子向负极,总反应式为CH4+2O2+2OH-═CO32-+3H2O,OH-浓度降低,则pH减小,当消耗甲烷5.6L(标准状况)时,转移电子的物质的量为[5.6L/22.4L/mol]×8=2mol,则生成铜1mol,质量为64g,
故答案为:CH4+10OH--8e═CO32-+7H2O;负;减小;64g.点评:
本题考点: 化学电源新型电池;热化学方程式.
考点点评: 本题考查较为综合,涉及电化学知识以及盖斯定律的应用,题目难度中等,解答本题的关键是能正确书写电极反应式以及总反应式,学习中注意体会盖斯定律的应用.1年前查看全部
- 已知:H 2 (g)+ 1 2 O 2 (g)=H 2 O(l)△H=-285.8kJ•mol -1 ;CH 4 (g)
已知:H 2 (g)+
O 2 (g)=H 2 O(l)△H=-285.8kJ•mol -1 ;CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(l)△H=-890.3kJ•mol -11 2
现有H 2 和CH 4 的混合气体112L(标准状况),使其完全燃烧生成CO 2 (g)和H 2 O(l),共放出热量3242.5kJ,则原混合气体中H 2 和CH 4 的物质的量之比是( )A.1:1 B.1:3 C.1:4 D.2:3  cocococo821年前1
cocococo821年前1 -
 第六感HXH 共回答了25个问题
第六感HXH 共回答了25个问题 |采纳率92%H 2 和CH 4 的混合气体112L(标准状况)物质的量为
112L
22.4L/mol =5mol,
所以混合气体的平均燃烧热为为
3242.5
5 kJ/mol=648.5kJ/mol,
由H 2 (g)+
1
2 O 2 (g)=H 2 O(1)△H=-285.8kJ•mol -1 可知,氢气的燃烧热为285.8kJ/mol;
由CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(1)△H=-890.3kJ•mol -1 可知,甲烷的燃烧热为890.3kJ/mol.
根据十字交叉法计算原混合气体中H 2 和CH 4 的物质的量之比: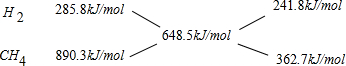
所以原混合气体中H 2 和CH 4 的物质的量之比为241.8kJ/mol:362.7kJ/mol=2:3.
故选:D.1年前查看全部
- 已知下列热化学方程式:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1②H2(g)+[
已知下列热化学方程式:
①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
②H2(g)+[1/2]O2(g)=H2O(g)△H=-241.8kJ•mol-1
③C(s)+[1/2]O2(g)=CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
回答下列问题:
(1)H2的燃烧热为△H=______;
(2)燃烧10g H2生成液态水,放出的热量为______.
(3)写出CO燃烧的热化学方程式CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ/molCO(g)+[1/2]O2(g)=CO2(g)△H=-283.0kJ/mol. 心如刀割无人可依1年前1
心如刀割无人可依1年前1 -
 穿山豹户外 共回答了19个问题
穿山豹户外 共回答了19个问题 |采纳率89.5%解题思路:(1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量分析;
(2)燃烧10g H2生成液态水,依据热化学方程式①计算;
(3)利用③④热化学方程式和盖斯定律计算得到一氧化碳燃烧的热化学方程式.(1)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量,反应①是表示燃烧热的热化学方程式:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1 ,所以氢气的燃烧热为△H=-285.8 kJ/mol,
故答案为:-285.8 kJ/mol;
(2)依据反应①进行计算燃烧10g H2生成液态水放出的热量;
H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1
2g 285.8KJ
10g 1429 kJ
故答案为:1429 kJ;
(3)③C(s)+[1/2]O2(g)=CO(g)△H=-110.5kJ•mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
依据盖斯定律④-③得到CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0 kJ/mol,
故答案为:CO(g)+[1/2]O2(g)=CO2(g)△H=-283.0 kJ/mol.点评:
本题考点: 反应热和焓变;热化学方程式.
考点点评: 本题考查了热化学方程式书写和盖斯定律的计算应用,注意燃烧热概念的理解应用,掌握基础是关键,题目较简单.1年前查看全部
- (2008•宁夏)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.
(2008•宁夏)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ•mol-1
B.+44.2 kJ•mol-1
C.-330 kJ•mol-1
D.+330 kJ•mol-1 ghasgdoie1年前1
ghasgdoie1年前1 -
 当花儿遇上四叶草 共回答了15个问题
当花儿遇上四叶草 共回答了15个问题 |采纳率100%解题思路:由燃烧热的概念写出各反应的热化学方程式,利用盖斯定律计算.已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则有:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol;
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol,
故选A.点评:
本题考点: 用盖斯定律进行有关反应热的计算.
考点点评: 本题考查反应热的计算,题目难度中等,注意盖斯定律应用于反应热的计算.1年前查看全部
- Ⅰ.H2(g)+[1/2]O2(g)=H2O(l)△H (298K)=-285.8kJ•mol-1的意义是__
Ⅰ.H2(g)+[1/2]O2(g)=H2O(l)△H (298K)=-285.8kJ•mol-1的意义是______.
Ⅱ.根据事实,写出298K时下列反应的热化学方程式:
(1)1mol氮气与适量氢气起反应,生成2mol氨气,放热92.2KJ热量.
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3KJ热量. tinghaix1年前1
tinghaix1年前1 -
 fawunuosi 共回答了17个问题
fawunuosi 共回答了17个问题 |采纳率88.2%解题思路:Ⅰ、依据热化学方程式的含义分析;
Ⅱ、(1)依据热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出;
(2)依据热化学方程式书写方法,标注物质聚集状态和对应反应的焓变写出.Ⅰ、H2(g)+[1/2]O2(g)=H2O(l)△H (298K)=-285.8kJ•mol-1的意义是通常状况下1mol氢气完全燃烧生成液态水放出285.8kJ的热量;
故答案为:298K时1mol氢气与0.5mol氧气完全反应生成1mol液态水放出285.8kJ的热量;
Ⅱ.(1)1mol氮气与适量氢气起反应,生成2mol氨气,放热92.2KJ热量,热化学方程式为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)⇌2NH3(g)△H=-92.2kJ/mol;
(2)1mol碳与适量水蒸气完全反应,生成一氧化碳气体和氢气,吸收131.3KJ热量,热化学方程式为:C(s)+H2O (g)=CO(g)+H2 (g)△H=+131.3kJ/mol;
故答案为:C(s)+H2O (g)=CO(g)+H2 (g)△H=+131.3kJ/mol.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了热化学方程式的书写方法及意义,书写热化学方程式除了要遵循书写化学方程式的要求外,还应注意以下几方面:
(1)必须注明各反应物、生成物的状态(s、l、g、aq),不标“↑”和“↓”符号.
(2)反应热△H与测定条件(温度、压强)有关,若不说明则指常温(25℃)、常压(101kPa)下.
(3)△H只能写在标有反应物或生成物状态的化学方程式的右边,并用“;”隔开.若为吸热反应,△H为“+”;若为放热反应,△H为“-”.△H的单位一般为kJ/mol.
(4)热化学方程式中的化学计量数仅表示该物质的物质的量,不表示物质的分子或原子数,因此可以是整数或分数.1年前查看全部
- 已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8kJ•mol -1 、-283.0kJ
已知H 2 (g)、CO(g)和CH 3 OH(l)的燃烧热△H分别为-285.8kJ•mol -1 、-283.0kJ•mol -1 和-726.5kJ•mol -1 .请回答下列问题:
(1)用太阳能分解5mol液态水消耗的能量是______kJ;
(2)液态甲醇不完全燃烧生成一氧化碳气体和液态水的热化学方程式为______;
(3)在以甲醇为燃料的燃料电池中,电解质溶液为酸性,则正极的电极反应式为______; 理想状态下,该燃料电池消耗2mol甲醇所能产生的最大电能为1162.4kJ,则该燃料电池的理论效率为______.(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比) jinguo13591年前1
jinguo13591年前1 -
 bvby 共回答了22个问题
bvby 共回答了22个问题 |采纳率86.4%(1)H 2 的燃烧热△H分别为-285.8kJ•mol -1 ,分解5mol液态水消耗的能量为5mol×285.8kJ•mol -1 =1429kJ,
故答案为:1429kJ;
(2)由CO(g)和CH 3 OH(l)的燃烧热△H分别为-283.0kJ•mol -1 和-726.5kJ•mol -1 ,则
①CO(g)+1/2O 2 (g)=CO 2 (g)△H=-283.0kJ•mol -1
②CH 3 OH(l)+3/2O 2 (g)=CO 2 (g)+2 H 2 O(l)△H=-726.5kJ•mol -1
由盖斯定律可知用②-①得反应CH 3 OH(l)+O 2 (g)=CO(g)+2 H 2 O(l),该反应的反应热△H=-726.5kJ•mol -1 -(-283.0kJ•mol -1 )=-443.5kJ•mol -1 ,
故答案为:CH 3 OH(l)+O 2 (g)=CO(g)+2 H 2 O(l)△H=-443.5kJ•mol -1 ;
(3)甲醇燃料电池,甲醇在负极失电子发生氧化反应,氧气在正极放电,酸性条件下生成水,正极电极反应式为:O 2 +4e - +4H + ═2H 2 O,
CH 3 OH(l)的燃烧热△H=-726.5kJ•mol -1 ,故2mol甲醇完全燃烧放出的热量为2mol×726.5kJ•mol -1 =1453kJ,故该燃料电池的理论效率为
1162.4kJ
1453kJ =80%,
故答案为:O 2 +4e - +4H + ═2H 2 O;80%.1年前查看全部
- (2013•常德模拟)(Ⅰ)已知:氢气的燃烧热为285.8kJ•mol-1;
(2013•常德模拟)(Ⅰ)已知:氢气的燃烧热为285.8kJ•mol-1;
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1
N2(g)+O2(g)═2NO(g)△H=+180.6kJ•mol-1
H2O(l)═H2O(g)△H=+44.0kJ•mol-1
写出氨气氧化生成一氧化氮气体和水蒸气的热化学方程式______;
(Ⅱ)已知X(g)+Y(g)═Z(g)+W(g)△H=akJ•mol-1,平衡常数与温度的关系如下:
(1)该反应的平衡常数表达式K=温度/℃ 300 400 500 750 1000 平衡常数 1.8 1.6 1.0 0.8 0.6 c(Z)•c(W) c(X)•c(Y) ,△H______0(填“<”,“>”或“=”);c(Z)•c(W) c(X)•c(Y)
(2)500℃时,在5L密闭容器中充入10mol X、5mol Y、5molZ、5molW,反应进行的方向是______,反应初始至10min时达到平衡,平衡时 c(W)=______mol/L,W在上述10min内的平均反应速率v(W)=______mol•L-1•min-1;
(3)能加快该化学反应速率的是______(填正确选项前的字母)
A.恒压充入5mol氩气B.降低反应温度
C.压缩容器体积增大压强 D.使用高效催化剂. asfas12341年前1
asfas12341年前1 -
 雨雷 共回答了18个问题
雨雷 共回答了18个问题 |采纳率77.8%解题思路:I、由已知热化学方程式根据盖斯定律构造目标热化学方程式,然后求出反应热,再写热化学方程式;
II、(1)根据已知反应的化学方程式和平衡常数的含义书写;根据K随温度的变化趋势判断;
(2)根据该温度下
与K的关系判断;利用三段式求出W的转化的量及平衡时的量,再求出反应速率;c(Z)•c(W) c(X)•c(Y)
(3)根据影响速率的因素分析.I、已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol②N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ/mol③2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol④H2O(l)═H2O(g)△H=+44.0kJ•mol-1由盖斯定律可知,①×2-...
点评:
本题考点: 用盖斯定律进行有关反应热的计算;反应热和焓变;化学平衡常数的含义;化学反应速率的影响因素.
考点点评: 本题考查了盖斯定律的应用及热化学方程式的书写、平衡常数K的有关计算、反应速率以及平衡移动的影响因素等,题目综合较强,难度中等.1年前查看全部
- 已知下列两个热化学方程式:H2(g)+O2(g)=H2O(l)△H=-285.8kJ•mol-1C3H8(g)+5O2(
已知下列两个热化学方程式:
H2(g)+O2(g)=H2O(l)△H=-285.8kJ•mol-1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2220.0kJ•mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热3847kJ,则混合气体中氢气和丙烷的体积比约是______(填字母,下同);两者放出的热量之比约为______.
A.1:3B.3:1C.1:4D.5:13. 眉凝网1年前1
眉凝网1年前1 -
 lanseyu_1986 共回答了24个问题
lanseyu_1986 共回答了24个问题 |采纳率79.2%解题思路:先根据方程式求出H2和C3H8的燃烧热,设H2的物质的量为nmol,则C3H8的物质的量为5mol-n,根据放出的热量列方程式解答.设混合气中H2的物质的量为n,则C3H8的物质的量为5mol-n.根据题意,列方程为:
285.8kJ/mol×n+2220.0kJ/mol×(5mol-n)=3847kJ
解得 n=3.75mol;C3H8的物质的量为5mol-3.75mol=1.25mol.
所以混合气体中H2与C3H8的体积比即物质的量之比为3.75 mol:1.25 mol=3:1,两者放出的热量之比约为(285.8kJ×3.75):(2220kJ×1.25)≈5:13.
故选:B;D.点评:
本题考点: 有关反应热的计算.
考点点评: 以常规方法进行计算求解,思路直接,便于理解,但是由于一般需要列方程,步骤烦琐,计算量较大,因此可以选用十字交叉法,比较方便.1年前查看全部
- 已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ•mol-1、-1411.0kJ•mol
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ•mol-1、-1411.0kJ•mol-1和-1366.8kJ•mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H是多少?写出推导过程.
 历史的尘埃1年前1
历史的尘埃1年前1 -
 fsssssssss 共回答了19个问题
fsssssssss 共回答了19个问题 |采纳率94.7%解题思路:写出各种物质燃烧的热化学方程式,运用盖斯定律求出C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H.有题意可知:
氢气燃烧的热化学方程式为:①H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8 kJ/mol;
C2H4(g)燃烧的热化学方程式为:②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
C2H5OH(1)燃烧的热化学方程式为:③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol;
利用盖斯定律②-③可得:
C2H4(g)+H2O(l)=C2H5OH(l)△H=(-1411.0kJ/mol)-(-1366.8kJ/mol)=-44.2kJ/mol,
故答案为:△H=-44.2kJ/mol.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查利用燃烧的热化学方程式求反应热的计算,题目难度中等,注意盖斯定律的应用.1年前查看全部
- 已知H 2 (g)、C 2 H 4 (g)和C 2 H 5 OH(l)的燃烧热分别是285.8kJ•mol -1 、14
已知H 2 (g)、C 2 H 4 (g)和C 2 H 5 OH(l)的燃烧热分别是285.8kJ•mol -1 、1411.0kJ•mol -1 和1366.8kJ•mol -1 ,则由C 2 H 4 (g)和H 2 O(l)反应生成C 2 H 5 OH(l)的△H为( ) A.-44.2 kJ•mol -1 B.+44.2 kJ•mol -1 C.-330 kJ•mol -1 D.+330 kJ•mol -1  诗龙1年前1
诗龙1年前1 -
 lalune1216 共回答了14个问题
lalune1216 共回答了14个问题 |采纳率78.6%已知H 2 (g)、C 2 H 4 (g)和C 2 H 5 OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,
则有:①H 2 (g)+
1
2 O 2 (g)=H 2 O(l)△H=-285.8kJ/mol;
②C 2 H 4 (g)+2O 2 (g)=2H 2 O(l)+2CO 2 (g)△H=-1411.0kJ/mol;
③C 2 H 5 OH(l)+2O 2 (g)=3H 2 O(l)+2CO 2 (g)△H=-1366.8kJ/mol;
根据盖斯定律 ②-③
可得:C 2 H 4 (g)+H 2 O(l)=C 2 H 5 OH(l)△H=-44.2kJ/mol,
故选:A.1年前查看全部
- (2010•海淀区二模)已知:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1;CH4(
(2010•海淀区二模)已知:H2(g)+[1/2]O2(g)=H2O(l)△H=-285.8kJ•mol-1;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是( )
A.1:1
B.1:3
C.1:4
D.2:3 linshuoyang1年前0
linshuoyang1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2008•宁夏)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.
(2008•宁夏)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol-1、1411.0kJ•mol-1和1366.8kJ•mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ•mol-1
B.+44.2 kJ•mol-1
C.-330 kJ•mol-1
D.+330 kJ•mol-1 宁子樱1年前1
宁子樱1年前1 -
 pigman0 共回答了16个问题
pigman0 共回答了16个问题 |采纳率93.8%已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则有:①H2(g)+
1
2O2(g)=H2O(l)△H=-285.8kJ/mol;
②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=-1411.0kJ/mol;
③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2 (g)△H=-1366.8kJ/mol;
根据盖斯定律 ②-③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2kJ/mol,
故选A.1年前查看全部
- 已知:H2的燃烧热为285.8KJ•mol-1,CO的燃烧热为282.8KJ•mol-1,现有CO、H2和CO2组成的混
已知:H2的燃烧热为285.8KJ•mol-1,CO的燃烧热为282.8KJ•mol-1,现有CO、H2和CO2组成的混合气体112.0L(标准状况),经完全燃烧后放出总热量为851.4KJ,并产生18g液态水,则燃烧前混合气体中CO的体积分数是( )
A.80%
B.40%
C.60%
D.20% SDGDFHGFJGHKJ1年前0
SDGDFHGFJGHKJ1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
大家在问
- 1等腰三角形一腰的中线把三角形的周长分成18cm,24cm两部分,求这个等腰三角形各边的长.
- 2我在考试中遇到一道不好解答的难题. 改病句
- 3一个高是31.4,底面直径是10厘米的圆柱体体积和表面积是多少
- 4下列有关碳和碳的氧化物的说法不正确的是( )
- 51.5×7.4+0.6×150%+2÷3分之2 37分之33×36 5又7分之6-(8分之3-7分之1)
- 6who remembers the time we lost帮翻一下
- 7x1服从均匀分布,x2服从均匀分布,x2-x1服从均匀分布吗
- 8水结冰时△U、△S和△G会大于零,小于零还是等于零?为什么?
- 9物质溶解时溶液温度的变化
- 10你能举出一个生活中的实例来说明不等式2x+5>11的实际意义吗?
- 11代数式表示并化简按下列程序计算n →平方 →+n → ÷n →-n ① 填写表格输入31/2-2-3······输出答案
- 12“这是个狗洞,不是城门.”和“只有访问‘狗国’,才从狗洞进去.”中包含什么意思?
- 13已知定义在区间[0,1]上的函数y=f(x)的图象如图所示,对于满足0<x1<x2<1的任意x1,
- 14下列关于我国河流的叙述,正确的是 [ ] A.只要是流向国外的河流就是外
- 15高等代数中的数环和数域与近代中的环与域有什么异同?
