晶体结构的衍射测量有哪些辐射源?他们的波长范围是多少?
 花落V流水2022-10-04 11:39:541条回答
花落V流水2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 fdsg42ff 共回答了16个问题
fdsg42ff 共回答了16个问题 |采纳率87.5%- 晶体结构的衍射测量有X射线、电子和中子辐射源.具体波长,对于X射线,与X射线的靶材选择有关;对于电子是和电镜选用的电子加速电压有关;中子源与加速器的出口站点选择有关.三种源没有统一、固定的波长范围,正常情况应视所研究的晶体条件而选用或者设定.
- 1年前
相关推荐
- 什么是金属?什么是合金?其常见的晶体结构类型有几种?
 september291年前2
september291年前2 -
 ymchen 共回答了16个问题
ymchen 共回答了16个问题 |采纳率100%常见金属的晶格类型
金属原子之间具有很强的结合力,所以金属晶体中的原子都趋向于紧密排列.但不同的金属具有不同的晶体结构,大多数金属的晶体结构都比较简单,其中常见的有以下三种:
(1)体心立方晶格(bcc)
体心立方晶格的晶胞是一个立方体,如图2-2-4.其晶格常数:a=b=c,α=β=γ=90.在立方体的八个角上和立方体的中心各有一个原子.每个晶胞中实际含有的原子数为1+8×1/8=2个.每个原子的最近邻原子数为8,所以其配位数为8.致密度0.68.具有体心立方晶格的金属有铬(Cr)、钨(w)、钼(Mo)、钒(V)、α铁(α—Fe)等.
(2)面心立方晶格(fcc)
面心立方晶格的晶胞也是一个立方体,金属原子分布在立方晶胞的八个角上和六个面的中心,如图2-2-5所示.其晶格常数:a=b=c,每个晶胞中实际含有的原子数为(1/8)× 8+6×(1/2)=4个.配位数为12;致密度为0.74.具有面心立方晶格的金属有铝(Al)、铜(Cu)、镍(Ni)、金(Au)、银(Ag)、γ铁(γ—Fe)等.
3)密排六方(hcp)
密排六方晶格的晶胞是个正六方柱体,它是由六个呈长方形的侧面和两个呈正六边形的底面所组成如图2-26所示.金属原子分布在六方晶胞的十二个角上以及上下两底面的中心和两底面之间的三个均匀分布的间隙里.该晶胞要用两个晶格常数表示,一个是六边形的边长a,另一个是柱体高度c.每个晶胞中实际含有的原子数为(1/6)× 12+2×(1/2)+3=6个.典型的密排六方晶格的晶格常数c和a之比约为1.633,配位数为12,致密度为 0.74.具有密排六方晶格的金属有:镁(Mg)、锌(Zn)、镉(Cd)等.
差异:
以上这三种晶格的原子排列不同,因此它们的性能也不同.一般来讲,体心立方结构的材料,其强度高而塑性相对低一些;面心立方结构的材料,其强度低而塑性好;密排六方结构的材料,其强度与塑性均低.1年前查看全部
- (2013•黄浦区二模)下列关于晶体结构的说法正确的是( )
(2013•黄浦区二模)下列关于晶体结构的说法正确的是( )
A.短周期、同主族非金属单质熔沸点都是第三周期大于第二周期
B.HF的沸点高于HCl,是因为H-F键能大于H-Cl键能
C.高熔点的固体如果不是离子晶体、则一定为原子晶体
D.金属氢氧化物中一定含有共价键 ax8k1年前1
ax8k1年前1 -
 sanshipower 共回答了13个问题
sanshipower 共回答了13个问题 |采纳率92.3%解题思路:A.晶体类型不同,熔沸点变化不同;
B.HF分子间含有氢键;
C.某些金属晶体的熔点较高;
D.氢氧化物中存在O-H键.A.C和Si都属于原子晶体,金刚石的熔点高于晶体硅,故A错误;
B.HF分子间含有氢键,沸点高于HCl,与键能无关,故B错误;
C.某些金属晶体的熔点较高,如钨,不一定为原子晶体,故C错误;
D.氢氧化物中存在O-H键,为共价键,故D正确.
故选D.点评:
本题考点: 晶体的类型与物质的性质的相互关系及应用.
考点点评: 本题考查晶体类型与化学键知识,题目难度不大,注意晶体类型的判断以及影响晶体熔沸点高低的因素.1年前查看全部
- 【无机化学-晶体】如图是硫化锌的种晶体结构,请问硫离子形成的八面体空隙是哪一个《硫离子六方密堆应该是两个八面体空隙》
 adda11年前1
adda11年前1 -
 18300050 共回答了22个问题
18300050 共回答了22个问题 |采纳率95.5%1年前查看全部
- 铁、镁、铜三种晶体结构的比较具体点.写的详细点最好.
 sun31161年前1
sun31161年前1 -
 济南兔巴哥 共回答了17个问题
济南兔巴哥 共回答了17个问题 |采纳率94.1%纯铁有三种同素异构状态:912℃以下为体心立方晶体结构:称α-Fe;912~1394℃为面心立方晶体结构,称γ-Fe;1394~1538℃(熔点),又呈体心立方,称δ-Fe.镁是六方晶胞铜是面心立方晶胞1年前查看全部
- 电介质材料中的压电性、铁电性与热释电性是如何产生的?这三种材料从晶体结构的角度看有何特点?
 zhenglanlan19881年前1
zhenglanlan19881年前1 -
 小女人1号 共回答了17个问题
小女人1号 共回答了17个问题 |采纳率94.1%压电晶体的结构是不具有对称中心.
铁电晶体也具有压电性,它的晶体结构也不具有对称中心;铁电体一定是离子性晶体,是具有自发极化的一种压电体,但并不是所有的压电体都是铁电体.
热释电体也是一种压电体,晶体结构同样不具有对称中心;温度变化可以引起极化强度改变,但不一定所有的压电体都是热释电体,有的铁电体也是热释电体.
总之,压电体、铁电体和热释电体都是不具有对称中心的晶体.1年前查看全部
- 什么叫"晶体结构"?
 youli1001年前1
youli1001年前1 -
 roy333 共回答了18个问题
roy333 共回答了18个问题 |采纳率72.2%固态物质分为晶体和非晶体.
晶体是由大量原子周期性的排列组合而成;反之,则为非晶体.1年前查看全部
- 怎么测量薄膜的晶体结构及如何区分非晶,纳米晶,多晶,单晶薄膜
 笑着悲伤91年前1
笑着悲伤91年前1 -
 fyyuu 共回答了17个问题
fyyuu 共回答了17个问题 |采纳率94.1%运用
X射线衍射法
电子衍射法
扫描电子显微镜分析法
分析薄膜的结构组成和形貌等
运用
俄歇电子能谱法
X射线光电子能谱法
二次离子质谱法
分析薄膜的表面成分
得出来图啊什么的一分析就知道是什么样的晶体了1年前查看全部
- 晶胞是晶体结构中可重复出现的最小的结构单位,C60晶胞结构,下列说法正确的是( )
晶胞是晶体结构中可重复出现的最小的结构单位,C60晶胞结构,下列说法正确的是( )
A.C60摩尔质量是720
B.C60属于离子晶体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围中的两种与它距离最近等距离的C60分子有12个 sqzzygjh1年前1
sqzzygjh1年前1 -
 冰点之风 共回答了23个问题
冰点之风 共回答了23个问题 |采纳率87%C60是单纯由碳原子结合形成的稳定分子,它具有60个顶点和32个面,其中12个为正五边形,20个为正六边形.其相对分子质量约为720.A正确.
C60是分子晶体,B错误.
C60晶体为面心立方排布,所以每个C60晶胞有4个C60分子 (面心3个,顶点1个),C错误.
C60晶体中C60分子的配位数是12,因此D也正确.1年前查看全部
- 简述金属常见的3种晶体结构的基本特点
 leungsc1年前1
leungsc1年前1 -
 bluetrace 共回答了14个问题
bluetrace 共回答了14个问题 |采纳率92.9%一种是立方体形状的,八个角为原子,第二种为立方体形状(八个角各一个),加上立方体几何中心一个原子,第三种为立方体形状(八个角各一个),加上六个面的面心各一个,共14个原子,这就是三种晶胞的结构,1年前查看全部
- 那些分子结构或晶体结构单元中存在正四面体?单质硅;铵离子;二氧化硅;石墨
那些分子结构或晶体结构单元中存在正四面体?单质硅;铵离子;二氧化硅;石墨
单质硅;铵离子;二氧化硅;石墨 这四个当中哪些是那些不是, 快乐成河1年前1
快乐成河1年前1 -
 毛无牙 共回答了16个问题
毛无牙 共回答了16个问题 |采纳率87.5%分子晶体:CH4 CCl4 CBr4 CI4 SiH4 SiCl4 SiBr4 SiI4 P4
原子晶体的话因为是空间网状结构 环环相扣 不是正四面体 但是金刚石 晶体硅的晶体单元为若干4个原子构成的正四面体.
单质硅、石墨是,铵离子;二氧化硅不是.1年前查看全部
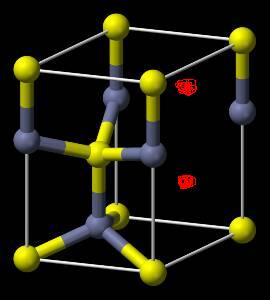
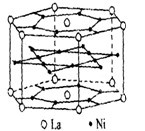
- 氢是重要而洁净的能源化学家研究出利角合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料.这种合金的晶体结构已
氢是重要而洁净的能源
化学家研究出利角合金储存氢气的方法,其中镧(La)镍(Ni)合金是一种储氢材料.这种合金的晶体结构已经测定.其基本结构单元如右图所示,则该合金的化学式可表示为( )
A.LaNi5 B.LaNi C.La14Ni24 D.La7Ni12
 ichliberdich1年前1
ichliberdich1年前1 -
 别nn 共回答了18个问题
别nn 共回答了18个问题 |采纳率88.9%选A ,
在顶角的La是有由六个基本结构平分,所以每个晶包分到六分之一的La,上下平面的La,每个占了二分之一,所以共有3个La,
同样上下底面和各个面上的Ni占了二分之一,内部的Ni为这个晶包独有,所以共有15个,
因此化学式为La3Ni15,即为LaNi51年前查看全部
- 下列有关晶体结构的叙述中不正确的是 [ ] A.氯化钠晶体中每个Na +
下列有关晶体结构的叙述中不正确的是 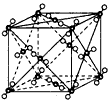 [ ]
[ ]A.氯化钠晶体中每个Na + 周围距离相等的钠离子共有6个
B.氯化铯晶体中每个Cs + 周围紧邻8个Cl -
C.干冰晶体(上图)中每个CO 2 分子周围紧邻12个CO 2 分子
D.在晶体中只要有阴离子就一定有阳离子 一寸相似1年前1
一寸相似1年前1 -
 孤独奇怪 共回答了14个问题
孤独奇怪 共回答了14个问题 |采纳率92.9%A1年前查看全部
- 有关晶体结构的问题,答案我看不懂 高手来解释下.
有关晶体结构的问题,答案我看不懂 高手来解释下.
题目是这样
已知灰锡(Sn)为面心立方金刚石型结构,晶胞参数a=648.9pm ,求Sn的原子半径.
参考答案上说的是
键长为立方晶胞对角线的1/4,2r = [ (根3) / 4 ] a = 281.0pm
所以半径为140.5pm
据我了解,体心立方结构是 3个原子在一条立方对角线上,2个键长 = 立方体对角线
这跟前几道题的答案说的也是一致的,没问题;
但金刚石结构是立方体8个顶点、6个面各有一个原子,然后里面空隙有4个
我觉得是4个原子在一条立方对角线上 那应该是 3个键长 = 立方体的对角线
为什么答案说的是 4个键长 = 立方体对角线呢. 我就不明白 aqi95281年前1
aqi95281年前1 -
 江枫渔 共回答了17个问题
江枫渔 共回答了17个问题 |采纳率100%金刚石结构是立方体8个顶点、6个面各有一个原子,然后里面空隙有4个原子,这是对的.
但四个原子并不在一条体对角线上,而只有两个原子在体对角线的一端,占据1/4的体对角线长度.
按照比例 8r =(根3) a ,所以2r = [ (根3) / 4 ] a = 281.0pm
如果不熟悉金刚石的晶体结构,可参看周公度版的结构化学习题集(这道题就是书上习题),在习题集第二部分综合习题解析的C-18题就有金刚石的晶体结构图.1年前查看全部
- ZnS晶体结构有两种型式,即立方ZnS和六方ZnS,如图所示,这两种型式的ZnS,化学键的性质相同,都是离子键向共价键过
ZnS晶体结构有两种型式,即立方ZnS和六方ZnS,如图所示,这两种型式的ZnS,化学键的性质相同,都是离子键向共价键过渡,具有一定的方向性.下列说法错误的是( ) A.Zn原子和S原子的配位数都是4,不同的是原子堆积方式有差别 B.在立方ZnS中,S原子作立方最密堆积,在六方ZnS晶体中,S原子作六方最密堆积 C.在立方ZnS中,Zn原子填充在所有的四面体空隙中,形成立方面心点阵 D.立方ZnS和六方ZnS不属于同分异构体 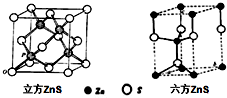
 潇潇宇1年前1
潇潇宇1年前1 -
 yijianbing 共回答了18个问题
yijianbing 共回答了18个问题 |采纳率83.3%A、由晶胞结构可知,每个Zn原子周围有4个S原子,每个S原子周围有4个Zn原子,立方ZnS中Zn原子面心立方堆积,S原子为体心立方堆积,六方ZnS中原子为六方最密堆积,故A正确;
B、由晶胞结构可知,立方ZnS中S原子作体心立方最密堆积,在六方ZnS晶体中,S原子作六方最密堆积,故B正确;
C、由立方ZnS晶胞可知,Zn原子填充在一半的四面体空隙中,Zn原子面心立方堆积,形成立方面心点阵,故C错误;
D、立方ZnS和六方ZnS属于晶体结构不同,不是分子结构不同,二者不是同分异构体,故D正确;
故选C.1年前查看全部
- 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确
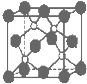 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 pengjianhang1年前1
pengjianhang1年前1 -
 sailor818 共回答了15个问题
sailor818 共回答了15个问题 |采纳率80%解题思路:A.利用均摊法计算化学式,根据物理性质判断晶体类型;
B.根据晶体类型判断;
C.根据晶胞配位数判断;
D.根据晶胞结构和NaCl晶胞结构判断.A.晶胞中:P位于顶点和面心,数目为8×[1/8]+6×[1/2]=4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,故A错误;
B.磷化硼晶体是原子晶体,熔点高,但熔融状态下没有自由的离子所以不能导电,故B错误;
C.该晶胞配位数为4,即每个原子均形成4条共价键,故C正确;
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠不相同.磷化硼晶体堆积方式与CuS晶胞类型相同,故D错误;
故选C.点评:
本题考点: 晶胞的计算.
考点点评: 本题考查晶胞计算、晶胞配位数和晶胞堆积方式,难度不大,必须牢固掌握基础知识.1年前查看全部
- 化学竞赛难题如图是金属Cr硼化物的晶体结构,每四个B原子连接成平面四方形基团,B-B键的键长为1.68A,它们处于同一高
化学竞赛难题
如图是金属Cr硼化物的晶体结构,每四个B原子连接成平面四方形基团,B-B键的键长为1.68A,它们处于同一高度水平上,不同高度的四方形按图中所示的方式和上下八个平面四边形基团连接成三维骨架,四方形基团之间B-B键的键长为1.91A,如图中的双线所示.骨架中的大空穴放Cr原子.
请问每个Cr原子周围多少个B原子?
原题答案是20,请问为什么呀?
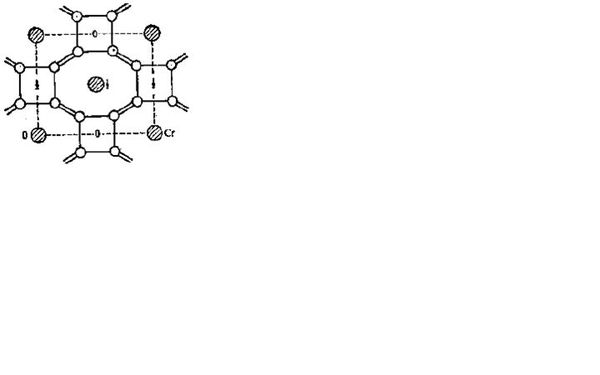
 引水站1年前1
引水站1年前1 -
 胡ANGEL 共回答了18个问题
胡ANGEL 共回答了18个问题 |采纳率94.4%12个吧,可能是答案错了 = =b
图看不清,有没有清楚一点的,表示平面的0、1、2很重要啊,题目说的云里雾里的.1年前查看全部
- 下列有关化学键与晶体结构说法正确的是( )
下列有关化学键与晶体结构说法正确的是( )
A.原子晶体中共价键越强,熔点越高
B.金属元素和非金属元素形成的化合物一定是离子化合物
C.含有阴离子的化合物一定含有阳离子
D.分子晶体中分子间作用力越大,分子越稳定 donggua00081年前1
donggua00081年前1 -
 杨我的 共回答了17个问题
杨我的 共回答了17个问题 |采纳率100%解题思路:A.原子晶体中共价键越强,原子之间结合的越牢固,想熔化它所需要的能量越多,熔点就越高;
B.金属元素和非金属元素形成的化合物可能是共价化合物;
C.金属晶体由阳离子与自由电子构成;离子化合物由阴离子和阳离子构成;
D.分子稳定性与分子内共价键的强弱有关.A.原子晶体中共价键越强,熔化它所需要的能量越多,熔点就越高,故A错误;
B.金属元素和非金属元素形成的化合物可能是共价化合物,如氯化铝,故B错误;
C.含有阴离子的化合物一定含有阳离子,只能是离子化合物,故C正确;
D.分子稳定性与分子内共价键的强弱有关,与分子间作用力无关,故D错误.
故选AC.点评:
本题考点: 化学键;不同晶体的结构微粒及微粒间作用力的区别.
考点点评: 本题考查晶体的组成、性质,注意含有阴离子的物质一定含有阳离子,但含有阳离子的物质不一定含有阴离子,为易错点.1年前查看全部
- 五水硫酸铜晶体的结构五水硫酸铜的晶体结构是怎么样的?水分子在哪里?离子又怎样排部?
 椰风19721年前2
椰风19721年前2 -
 xbdemail 共回答了21个问题
xbdemail 共回答了21个问题 |采纳率95.2%H2O和Cu之间是配位键
H2O^^^^OH2^^^H…O^^^^^O
^^\^/^^\/^^^^\^/
^^^ Cu^^^^^O^^^^^^^S
^^/^\^^/\^^^^/^\
H2O^^^^OH2^^^H…O^^^^^
注:用^^^^代替空格键,看懂就行.1年前查看全部
- 下列关于SiO 2 和金刚石的叙述正确的是 A.SiO 2 晶体结构中,每个Si原子与2个O原子直接相连 B.通常状况下
下列关于SiO 2 和金刚石的叙述正确的是
A.SiO 2 晶体结构中,每个Si原子与2个O原子直接相连 B.通常状况下,60 g SiO 2 晶体中含有的分子数为N A (N A 表示阿伏加德罗常数) C.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子 D.1 mol金刚石含4 mol C—C键  tomohisa071年前1
tomohisa071年前1 -
 阿飞0502 共回答了15个问题
阿飞0502 共回答了15个问题 |采纳率93.3%C
1年前查看全部
- )固体PCl5的结构实际上是PCl4+和PCl6-构成的离子晶体,其晶体结构与CsCl相似,
)固体PCl5的结构实际上是PCl4+和PCl6-构成的离子晶体,其晶体结构与CsCl相似,
固体PCl5的结构实际上是PCl4+和PCl6-构成的离子晶体,其晶体结构与CsCl相似,则晶胞的组成为P2Cl10
问:这是怎么判断出来的 bobovan1年前1
bobovan1年前1 -
 T最后的ll 共回答了20个问题
T最后的ll 共回答了20个问题 |采纳率95%结构和CsCl相似,是由阴阳离子1:1构成的,所以其实可以看成是[PCl4][PCl6],所以组成为P2Cl101年前查看全部
- 水的状态除了气.液和固态外,还有玻璃态。它是由液态水急速冷却到l 6 5K时形成的,玻璃态的水无固定形状,不存在晶体结构
水的状态除了气.液和固态外,还有玻璃态。它是由液态水急速冷却到l 6 5K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是
A.玻璃态是水的一种特殊状态 B.玻璃态水是透明晶体 C.水由液态变为玻璃态,体积膨胀 D.水由液态变为玻璃态,体积缩小  梧桐芭蕉客1年前1
梧桐芭蕉客1年前1 -
 KELIANDEYAOYAO 共回答了14个问题
KELIANDEYAOYAO 共回答了14个问题 |采纳率100%A
由玻璃态的水密度与普通液态水的密度相同,质量不变,所以体积不变,所以C、D都错;由水的状态除了气、液和固态外,还有玻璃态,可知玻璃态是水的一种特殊状态,故A正确;根据玻璃态的水无固定形状,不存在晶体结构,所以不存在晶体状态,所以B错.
故选A.1年前查看全部
- 晶胞是晶体结构中可重复出现的最小的结构单元,C 60 晶胞结构如右图所示,下列说法正确的是 ( &
晶胞是晶体结构中可重复出现的最小的结构单元,C 60 晶胞结构如右图所示,下列说法正确的是 ()
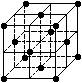
A.C 60 摩尔质量是720 B.C 60 属于离子晶体 C.在C 60 晶胞中有4个C 60 分子 D.每个C 60 分子周围与它距离最近等距离的C 60 分子有12个  普提葡萄1年前1
普提葡萄1年前1 -
 cspbxrd 共回答了16个问题
cspbxrd 共回答了16个问题 |采纳率87.5%D
1年前查看全部
- 晶体结构系列问题1已知C3N4晶体很可能具有比金刚石更大的硬度,其原子间均以单键结合.下列关于C3N4晶体的说法正确的是
晶体结构系列问题1
已知C3N4晶体很可能具有比金刚石更大的硬度,其原子间均以单键结合.下列关于C3N4晶体的说法正确的是
A.C3N4晶体是分子晶体
B.C3N4晶体晶体中.C—N键的键长比金刚石中的C—C键的键长要长
C.C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子
D.C3N4晶体中微粒间通过离子键结合
石墨是层状结构的晶体,每一层内碳原子排成平面网状结构,则石墨晶体每一层内碳原子数与正六边形数之比为
A.2:1
B.6:1
C.3:1
D.3:2 曾如意1年前1
曾如意1年前1 -
 tokieba 共回答了18个问题
tokieba 共回答了18个问题 |采纳率94.4%1)
选C
C3N4比金刚石有更大的硬度,只能说明它是原子晶体.
键长越长能量越低,而C3N4比金刚石牛X只能说明C—N键的键长比金刚石中的C—C键的键长要短.
C3N4晶体为原子晶体,微粒间通过分子共价键结合.
排除法选C.
2)
选A
石墨是层状结构的晶体,每一层内碳原子排成平面网状结构.(这是显然的- -!)蜂窝状结构.
1个C原子组成3个正六边形的一个点.每个正六边形由6个C组成.即每个正六边形上有6/3=2个C原子.
即比为2:1.1年前查看全部
- (1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为______.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为______.在四大晶体类型中,GaN属于______晶体.
(2)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有______的原子或离子
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子:请回答下列问题:
①H、N、O三种元素的电负性由大到小的顺序是______.
②SO2分子的空间构型为______.与SnCl4互为等电子体的一种离子的化学式为______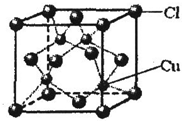
③乙二胺分子中氮原子轨道的杂化类型为______.乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是______.
④(3)中所形成的配离子中含有的化学键类型有______.
a.配位键b.极性键c.离子键d.非极性键
⑤CuCl的晶胞结构如图所示,其中Cl原子的配位数为______. stefinia18261年前1
stefinia18261年前1 -
 住天才呀 共回答了23个问题
住天才呀 共回答了23个问题 |采纳率91.3%解题思路:(1)Ga原子是31号元素,根据核外电子排布规律书写原子的电子排布式;单晶硅是Si正四面体向空间延伸的立体网状结构,为原子晶体,GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为与但晶硅中Si的结构相似;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子;
(3)①根据电负性的变化规律比较电负性大小;
②根据判断SO2分子含有的δ键以及孤电子对数判断空间构型,根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;
③根据价层电子对数判断乙二胺分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;
④根据成键原子的特点判断化学键类型;
⑤根据晶体结构特点分析Cl原子的配位数.(1)Ga原子是31号元素,Ga原子的电子排布式为1s22s22p63s23p63d104s24p1;GaN晶体结构与单晶硅相似,GaN属于原子晶体,与同一个Ga原子相连的N原子构成的空间构型为正四面体,
故答案为:1s22s22p63s23p63d104s24p1;正四面体;原子;
(2)微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有能够接受孤电子对的空轨道的原子或离子,
故答案为:能够接受孤电子对的空轨道;
(3)①在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,
故答案是:O>N>H;
②SO2分子中含有2个δ键,孤电子对数=[6−2×2/2]=1,所以分子为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之为电子体的离子有SO42-、SiO44-等,
故答案为:V形; SO42-、SiO44-等;
③乙二胺分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,
故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
④)②中所形成的配离子中含有的化学键中N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,
故答案为:abd;
⑤从CuCl的晶胞可以判断,每个铜原子与4个Cl距离最近且相等,即Cu的配位数为4,根据化学式可知Cl的配位数也为4,
故答案为:4.点评:
本题考点: 原子核外电子排布;元素电离能、电负性的含义及应用;配合物的成键情况;晶胞的计算;原子轨道杂化方式及杂化类型判断.
考点点评: 本题考查较为综合,涉及电子排布式、分子的立体构型、杂化轨道类型、氢键、化学键类型以及晶体结构分析等知识,题目具有一定难度,本题注意晶胞配位数的判断方法,可根据CuCl的化学式进行比较.1年前查看全部
- CsCl晶体结构如图所示,有关相邻的两个
CsCl晶体结构如图所示,有关相邻的两个
Cs+与Cl-之间夹角的判断正确的是( )
A.120° B.90°
C.109°28′ D.以上均不正确
Cs+和Cl-之间的夹角究竟怎么算? 奕龙宫凝落1年前2
奕龙宫凝落1年前2 -
 gshuang 共回答了18个问题
gshuang 共回答了18个问题 |采纳率77.8%8个Cs+构成正方形,Cl-位于中心.答案会与选择的Cs+有关.其中有4个Cs+能成正四面体.所以C是其中一个答案吧!选D1年前查看全部
- 为什么晶体结构中没有底心立方结构?
 lirongshi11171年前4
lirongshi11171年前4 -
 有球就来 共回答了23个问题
有球就来 共回答了23个问题 |采纳率87%首先底心改变了立方晶系的对称性(4个三重轴等),另外底心立方可以用更小的晶胞去代替.1年前查看全部
- 从晶体结构差异的角度分析金属和陶瓷的热膨胀系数存在差异的原因.这题怎么答啊!
 漫风女人1年前3
漫风女人1年前3 -
 泰坦之剑 共回答了16个问题
泰坦之剑 共回答了16个问题 |采纳率87.5%楼上两位都有一定道理,不过不太准确,补充一下.
金属晶体中原子间以金属键相连,金属受热后,原子振动加剧,晶胞尺寸变大,而自由电子离域程度很大,即便因膨胀导致了错位,金属键仍可近乎保持原有强度.表现为金属具有较大的热膨胀系数.
而陶瓷中存在的化学键是离子键和共价键.对于离子键一旦原子间距因受热膨胀增大,库伦力将显著降低,势能显著增加,即只需膨胀少许,就会将外界的能量吸收掉.换句话说,要膨胀较多的话必须提供更多的能量(而外界提供能量太大时,离子键将断裂,陶瓷就会开裂,而不是继续发生膨胀).对于共价键,由于共价键具有显著的方向性,陶瓷授热膨胀时,原子发生一定程度的错位,将导致共价键显著削弱,势能显著增大,同样吸收大量外界能量,使膨胀不能继续增大.因此陶瓷具有较小的热膨胀系数.1年前查看全部
- X射线衍射为什么能测定晶体结构
 ff聆风1年前1
ff聆风1年前1 -
 天天喜洋洋 共回答了15个问题
天天喜洋洋 共回答了15个问题 |采纳率80%1912年,德国物理学家劳厄发现,X射线通过晶体时,产生强度随方向而变化的散射效应,其强度变化是由于次生电磁波互相叠加和干涉造成的,这就是晶体X射线衍射.如果能找到一种波长适当的电磁波,让它通过晶体发生衍射,就能提供晶体内原子排布的信息,从而测定出晶体结构.1914年,劳厄因这一发现而荣获诺贝尔物理学奖金.X射线波长很短,约为10^-8厘米,晶体中原子间距离也在这个范围内,晶体恰好可以做为X射线的衍射光栅.X射线射入晶体使晶体中原子的电子发生周期性振动,并向周围空间发出电磁波,即次生X射线,从而引起散射.散射能力的大小与原子序和方向有关,原子序数大的原子具有较多的电子,散射能力强;在X射线入射的方向上散射能力强.在晶体结构研究中,劳厄提出了描述晶体X衍射基本条件的劳厄方程;1913年,英国物理学家布喇格提出了比较直观的X射线衍射方程,即布喇格方程,并因此荣获1915年度的诺贝尔物理学奖金.这两个方程的实质是一样的,都把X射线衍射方向和晶体单元晶胞参数联系起来,是确定晶体结构的重要依据.用X射线衍射测定单晶结构的具体方法有几种,依衍射强度记录方式不同可分为照相法和衍射仪法.例如,劳厄照相法,是用连续的X射线照射在静止不动的单晶体上,用平板底片拍摄衍射图,测量底片上衍射图的黑度获得衍射强度的数据,来测量晶体的对称性晶体的定向.韦森堡照相法是在晶体转动时底片也来回摆动,将原在同一层线的衍射线感光点分开,这种方法可以确定晶体微观对称性和晶格参数.现在最为通用的四圆单晶衍射仪,晶体取向和计数器调节都很方便,能准确测定晶体参数,并将衍射点的强度数据依次自动收集,简化了实验过程,提高了测试精确度,是当前晶体结构分析的强有力工具.用X射线衍射测定多晶样品成分和结构的方法即多晶X射线衍射法,也叫粉末法.1年前查看全部
- 为什么氯化铯晶体结构不能说成体心立方(本人看到一本无机化学上这么写,但并未作解释)
 yangshifeng1年前1
yangshifeng1年前1 -
 wanghual 共回答了19个问题
wanghual 共回答了19个问题 |采纳率100%说体心立方应该是正方体的八个顶点与体心原子相同
比如钾 它就属于体心立方
而氯化铯位于正方体八个顶点的是氯离子(或铯离子)处于正方体中心的是铯离子(或氯离子) 因此不能说它的晶体结构是体心立方
它应该是两个简单立方的结合1年前查看全部
- 怎么通过金属的晶体结构来判断金属的熔沸点?
 陈莫强求1年前1
陈莫强求1年前1 -
 huanglei1100 共回答了18个问题
huanglei1100 共回答了18个问题 |采纳率94.4%1.原子晶体中原子间键长越短,共价键越稳定,物质熔沸点越高,反之越低.
2.离子晶体中阴阳离子半径越小,电荷数越多,离子键越强,熔沸点越高,反之越低.
3.分子晶体中分子间作用力越大,物质熔沸点越高,反之越低.其中组成和结构相似的分子,相对分子质量越大,分子间作用力越大.(但这不包括具有氢键的分子晶体其熔沸点出现反常得高的现象,如H2O、HF等)
4.金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子的静电作用越强,金属键越强,熔沸点越高,反之越低.
5.晶体的类型不同时一般规律为:原子晶体>离子晶体>金属晶体>分子晶体但需注意金属晶体的熔沸点差别很大.如W的熔沸点甚至高于有些原子晶体,而Hg的熔点则很低,常温下呈液体状态.1年前查看全部
- 化学中分为哪些结构?如晶体结构那些.要全部
 蓝牙1251年前1
蓝牙1251年前1 -
 hy流动的蔚蓝 共回答了13个问题
hy流动的蔚蓝 共回答了13个问题 |采纳率84.6%固态物质可分为晶体和非晶体两大类,固态的金属与合金大都是晶体.晶体与非晶体的最本质差别在于组成晶体的原子、离子、分子等质点是规则排列的(长程序),而非晶体中这些质点除与其最近邻外,基本上无规则地堆积在一起(短程序).金属及合金在大多数情况下都以结晶状态使用.金刚石的晶体结构单质的晶体结构 名称 英文名称 代号 晶格类型 晶系1年前查看全部
- 同种阳离子在不同的晶体结构中,配位数是否相同?为什么?
 行至水穷处1年前1
行至水穷处1年前1 -
 谜失的永恒 共回答了18个问题
谜失的永恒 共回答了18个问题 |采纳率100%配位数肯定不相同的,晶系可以有,三.四.六.立.方晶系,单斜.三斜.正交.晶系.共7种晶系,仅仅以最简单的CaO和CaF2为例来说明,其中氧化钙中钙离子是面心立方堆积堆积方式和氯化钠一样,配位数是6,而氟化钙中的钙同样是面心立方堆积,但是F离子的填充方式不同导致钙的配位数是8.
所以可以总结,同一种阳离子在不同晶体结构中有不同配位数的原因主要有两个1是阳离子本身的堆积方式不同,其二是堆积方式相同但是阴离子的填充方式不同也会导致不同的配位数.
ps钙的其他堆积方式我有点想不起来了,我回去上书上找找看.1年前查看全部
- 请问:聚合物晶体结构和结晶过程 与 小分子晶体结构与结晶过程 有何区别?造成这些区别的原因是什么?这是高分子物理里面的知
请问:
聚合物晶体结构和结晶过程 与 小分子晶体结构与结晶过程 有何区别?
造成这些区别的原因是什么?
这是高分子物理里面的知识,望智者高知! x30251年前1
x30251年前1 -
 xacvgy 共回答了15个问题
xacvgy 共回答了15个问题 |采纳率80%高聚物与小分子不同表现在其分子的长上.这影响分子的运动,结晶是分子的有续排列,所以高聚物结晶慢,且结晶度底.1年前查看全部
- 关于晶体结构的问题六方最密堆积模型中的球数与围成的四面体空隙和八面体空隙的比值是多少?为什么?请写明理由,
 枫少爷shmily1年前1
枫少爷shmily1年前1 -
 a6a9999 共回答了25个问题
a6a9999 共回答了25个问题 |采纳率88%六方最密堆积中球数∶四面体空隙数∶八面体空隙数=1:2:1,在最密堆积中,许多等径球并置在一起,其空间利用率达到最大.三维的最密堆积是由若干二维密置层叠合起来的.密置层中相邻的等径球都相切,3个两两相切的等径球的球心构成一个等边三角形,每个球周围有6个球与之相切.球与球之间留下了一些类似三角形的空穴,球数与空穴数之比为1:2.三维密堆积中出现了由4个球围成的四面体空隙和由6个球构成的八面体空隙.1年前查看全部
- 一题化学竞赛晶体题(1)一种金属化合物中晶体结构为立方面心点阵,Mg原子采用类似金刚石的排列,每4个Cu原子形成四面体,
一题化学竞赛晶体题(1)
一种金属化合物中晶体结构为立方面心点阵,Mg原子采用类似金刚石的排列,每4个Cu原子形成四面体,相互之间共用顶点连接起来,排布在Mg原子的空隙中.请问该晶胞中有 个原子,该金属化合物最简式为 . wzz611年前1
wzz611年前1 -
 CAunique 共回答了10个问题
CAunique 共回答了10个问题 |采纳率100%Mg原子个数:8(顶点1个,面心3个,四面体空隙4个)
Cu原子个数:4(四面体空隙4个)
所以12个,最简式Mg2Cu1年前查看全部
- 高中二氧化硅晶体结构上课应该怎么讲?急
 1帮主11年前2
1帮主11年前2 -
 特产xxxx 共回答了16个问题
特产xxxx 共回答了16个问题 |采纳率93.8%可以从金刚石的结果入手(学生都是比较了解金刚石的结构的),然后用硅原子去替换结构中的碳原子,就得到晶体硅的结构,最后在每两个硅原子之间各插入一个氧原子,就自然而然地得到二氧化硅的晶体结构了.还可以给学生分析一下,硅氧原子的个数比.1年前查看全部
- 一氮化硼(BN)的一种晶体结构和金刚石相似,密度为3.52g.cm-3,求B-N的键长.我算出来了一个晶胞的边长,用d表
一氮化硼(BN)的一种晶体结构和金刚石相似,密度为3.52g.cm-3,求B-N的键长.我算出来了一个晶胞的边长,用d表示,答案是(√3╱4)d.为什么呢?
二磷酸(H3PO4)中P与非羟基的O之间的共价键为什么不是普通的共价键,而是配位键? 心是乱乱的1年前3
心是乱乱的1年前3 -
 苏零一 共回答了20个问题
苏零一 共回答了20个问题 |采纳率85%(1)金刚石的晶格,是碳原子sp3杂化,所以可以看做是4个碳分布于正四面体的端点,另一个在中心.氮化硼的晶胞和它类似,只不过不同取向的碳原子分别对应于N和B.所以一个氮化硼的晶胞有八个分子,(2^3)我们先算晶胞的C3轴,...1年前查看全部
- 3.合金的晶体结构有哪些类型?性能如何?
 mlzhangjian1年前2
mlzhangjian1年前2 -
 鹰儿宝宝 共回答了19个问题
鹰儿宝宝 共回答了19个问题 |采纳率89.5%根据合金中各组元之间结合方式的不同,合金的组织可分为固溶体.金属化合物和混合物三类.
强度 硬度较高 ,熔点较低1年前查看全部
- 氯化钠和氯化铯的化学式可用同一通式(AB型)表示,但晶体结构却不相同,
 vi28011年前3
vi28011年前3 -
 gayboy3477 共回答了17个问题
gayboy3477 共回答了17个问题 |采纳率88.2%半径比不同1年前查看全部
- 晶体结构概念中点阵的结构基元怎么选取?是一个原子还是几个原子?或者其它.
晶体结构概念中点阵的结构基元怎么选取?是一个原子还是几个原子?或者其它.
搞不懂点阵,晶格,晶胞之间的关系
好多被称为经典的固体物理或材料科学的书,都没有讲清楚
点阵结点究竟是什么的抽象?原子集合?有人说点阵结点就是晶胞, 芷岸枫华1年前1
芷岸枫华1年前1 -
 dasanxie 共回答了12个问题
dasanxie 共回答了12个问题 |采纳率83.3%看黄昆写的书.
我这些搞的也似懂非懂的
简单格子的结构基元就是一个原子
复式格子的结构基元就是几个原子
点阵结点应该就是格点,格点代表原子或原子周围相应点的位置,若晶体由多种原子组成,通常把由这几种原子构成晶体的基本结构单元称为基元,格点代表基元的重心位置.
点阵不是晶胞.晶体可以看成由相同的格点在三维空间作周期性无限分布所构成的系统,这些格点的总和称为点阵.
晶胞是反应晶体周期性和对称性所选取的最小重复单元.1年前查看全部
- 磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确
磷化硼是一种超硬耐磨涂层材料.如图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构.下列有关说法正确的是( )
 A. 磷化硼晶体的化学式为BP,属于离子晶体
A. 磷化硼晶体的化学式为BP,属于离子晶体
B. 磷化硼晶体的熔点高,且熔融状态下能导电
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构微粒的空间堆积方式与氯化钠相同 zenh41年前1
zenh41年前1 -
 落花满砚 共回答了19个问题
落花满砚 共回答了19个问题 |采纳率78.9%解题思路:A.利用均摊法计算化学式,根据物理性质判断晶体类型;
B.根据晶体类型判断;
C.根据晶胞配位数判断;
D.根据晶胞结构和NaCl晶胞结构判断.A.晶胞中:P位于顶点和面心,数目为8×[1/8]+6×[1/2]=4,B位于晶胞内,数目为4,则磷化硼晶体的化学式为BP,由于磷化硼是一种超硬耐磨涂层材料,属于原子晶体,故A错误;
B.磷化硼晶体是原子晶体,熔点高,但熔融状态下没有自由的离子所以不能导电,故B错误;
C.该晶胞配位数为4,即每个原子均形成4条共价键,故C正确;
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠不相同.磷化硼晶体堆积方式与CuS晶胞类型相同,故D错误;
故选C.点评:
本题考点: 晶胞的计算.
考点点评: 本题考查晶胞计算、晶胞配位数和晶胞堆积方式,难度不大,必须牢固掌握基础知识.1年前查看全部
- 不仅与金属的晶体结构有关,而且与金属原子本身的性质有关的是金属的A导电性B导热性C密度D熔点
 感受美好1年前1
感受美好1年前1 -
 fengpanpan1994 共回答了19个问题
fengpanpan1994 共回答了19个问题 |采纳率94.7%选 A
A 导电性与金属原子本身的最外层电子数 以及 金属的晶体结构有关.
其他三个都只与金属的晶体结构有关.1年前查看全部
- A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似,B、C、D为含元素A的化合物,其中B可用作木材防火剂.
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似,B、C、D为含元素A的化合物,其中B可用作木材防火剂.他们之间的相互转化关系如下所示(部分生成物和反应条件已略去)请回答:
A +NaOH→B
↑↓ ↗↓CO⒉
↑↓ ↗ ↓
C↗ ←←← D
1、写出下列物质的化学式:A ( ) B () C () D()
2.C的主要用途是制作:
3.写出实现下列转化的化学方程式:
B→D:
C→B: 星空下的呼唤1年前3
星空下的呼唤1年前3 -
 夙浊 共回答了6个问题
夙浊 共回答了6个问题 |采纳率100%A ( Si ) B (Na2SiO3) C (SiO2) D(H2SiO3)
C的主要用途是制作:制作光导纤维
Na2SiO3+2HCl=H2SiO3+2NaCl
SiO2+2NaOH=Na2SiO3+H2O1年前查看全部
- (2009•湘潭一模)某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,
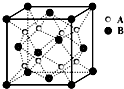 (2009•湘潭一模)某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
(2009•湘潭一模)某离子晶体的晶体结构中最小重复单元如图所示:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
A.B2A
B.BA2
C.B7A4
D.B4A7 marry-小蓉儿1年前1
marry-小蓉儿1年前1 -
 xiaole0212 共回答了24个问题
xiaole0212 共回答了24个问题 |采纳率87.5%解题思路:A位于晶胞的体内,共8个,B位于晶胞的顶点和面心,可利用均摊法计算.A位于晶胞的体内,共8个,B位于晶胞的顶点和面心,晶胞中B的个数为8×[1/8]+6×[1/2]=4,
则B与A的离子个数为4:8=1:2,则化学式为BA2,
故选B.点评:
本题考点: 晶胞的计算.
考点点评: 本题考查晶胞的计算,题目难度不大,解答该类题目注意组成粒子在晶胞的分布,注意均摊法的计算方法的应用.1年前查看全部
- 晶体结构单元和晶胞的区别RT 最好能举些简单的例子
 衣雪夜行1年前2
衣雪夜行1年前2 -
 舞萤姬 共回答了21个问题
舞萤姬 共回答了21个问题 |采纳率85.7%晶胞是晶体中最小的重复单元.
注意:一是最小,二是重复.
晶体结构单元不一定是晶胞,大多数情况下常常是晶胞.
画图有点难,说一说吧,
CsCl
立方体晶胞中,Cl-在8个顶点,Cs+在立方体的中心,这个立方体也经常作为结构单元出现.
NaCl
立方体晶胞中,Cl-处于8个顶点和6个面心,Na+处于12条棱的中心和了个立方体的中心.
但有时这个大立方体的1/8的小立方体也会作为结构单元出现,即Cl-和Na+分别处于互不相邻的顶点.
所以这个结构单元就不是晶胞,而只是晶胞的1/8.1年前查看全部
- 晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )
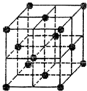 晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )
晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如图所示,下列说法正确的是( )
A.C60摩尔质量是720
B.C60与苯互为同素异形体
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个 道曰云1年前1
道曰云1年前1 -
 小木香 共回答了20个问题
小木香 共回答了20个问题 |采纳率75%A、C60的相对分子质量是12×60=720,所以摩尔质量为720g/mol,故A错误;
B、由同种元素形成的不同种单质互为同素异形体,而苯是碳氢形成的化合物,故B错误;
C.根据均摊法可知,在C60晶胞中含有有C60分子的个数为:8×
1
8+6×
1
2=4,故C错误;
D.根据晶胞的结构可知,以晶胞中顶点上的C60分子为研究对象,与它距离最近等距离的C60分子分布在立方体的面心上,每个C60分子被8个立方体共用,有12个面与之相连,所以每个C60分子周围与它距离最近等距离的C60分子有12个,故D正确;
故选D.1年前查看全部
- 什么是晶体衍射的两个要素?他们与晶体结构有何对应关系?晶体衍射两要素在衍射图上
 ygjzyz1年前1
ygjzyz1年前1 -
 zym66858 共回答了11个问题
zym66858 共回答了11个问题 |采纳率90.9%两个要素是衍射方向和衍射强度,分别遵循Laun方程和布拉格方程,见周公度结构化学基础和李奇材料化学.1年前查看全部
- 下列有关化学键与晶体结构说法正确的是( ) A.非金属元素组成的化合物一定是共价化合物 B.对于组成结构相似的分子晶体
下列有关化学键与晶体结构说法正确的是( ) A.非金属元素组成的化合物一定是共价化合物 B.对于组成结构相似的分子晶体,相对分子质量越大,熔沸点一定越高 C.两种元素组成的分子一定只有极性键 D.含阴离子的化合物一定有阳离子  望之水玉1年前1
望之水玉1年前1 -
 zhaohappy2008 共回答了18个问题
zhaohappy2008 共回答了18个问题 |采纳率88.9%A、NH 4 Cl全部是由非金属元素组成的,但氯化铵是离子化合物,故A错误;
B、如卤族元素的氢化物中,氯、溴、碘的氢化物随着相对分子质量的增其熔沸点逐渐增大,但氟化氢中含有氢键导致其熔沸点较大,故B错误;
C、烃是由两种元素组成的化合物,不仅含有极性键还含有非极性键,故C错误;
D、离子化合物中阴阳离子所带电荷相等,所以含有阳离子的化合物一定含有阴离子,故D正确;
故选D.1年前查看全部
- MgO的晶体结构与NaCl的晶体结构相似,Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,请以单个原子形式填入四面
MgO的晶体结构与NaCl的晶体结构相似,Ni的堆积与MgO中氧原子堆积相同,Ni可以吸附H2,请以单个原子形式填入四面体空隙,则Ni最大量吸收H2后,n(Ni):n(H)=( )
2,为什么? 风之舞者-20011年前2
风之舞者-20011年前2 -
 白果心情 共回答了14个问题
白果心情 共回答了14个问题 |采纳率100%Ni占据晶胞的顶点和面心,所以四面体空隙位于八个1/8晶胞的中心,一共为8个;而Ni显然为4个,所以是1:2.1年前查看全部
大家在问
- 1关于导体电阻的大小,下列说法中正确的是( )
- 2快速提高计算能力 我朋友买了一本书:《快速提高计算能力》 我看了一下:比如:33÷25=?这本书教了一个方法:看到÷25
- 3有一道简单的物理题请大家帮忙!不是计算.
- 4有关专心致志的好词好句
- 5在word中修改英文单词时,每改一个字母后面那个字母也消失了,怎么调整成一个一个改
- 6如图所示,在△ABC中,∠B=90°,AB=BC,BD=CE,M是AC边的中点,
- 7足球由白色六边形与黑色五边形组成,共32块,求白块有几块,黑块几块?
- 8(2014•南京二模)下列关于声音的说法,正确的是( )
- 9一道高中水解电离题在0.1 mol L—的醋酸钠溶液中,OH-的离子浓度=醋酸浓度+H+浓度为什么对呀按照阳离子和阴离子
- 102.计算:30°15′×3+27°18′÷6要解题步骤!
- 11专题 第四题怎么写
- 12名著《水浒》阅读题。(6分)小题1:根据下面诗句,选择恰当的人物。(只填序号)①他曾题诗道:“心在山东身在吴,飘蓬江海漫
- 13试分析一下《三峡》第一段是怎样描写夏天水势特征的?
- 14汽车的英语单词怎么写,求学霸指点
- 15[ ] are you going 括号填什么.并且肯定回答和否定回答.