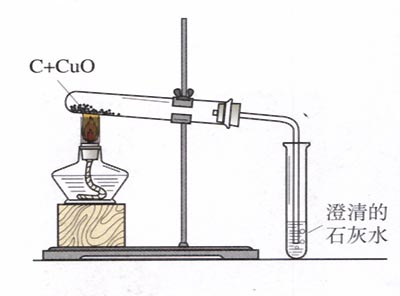
用弹簧夹夹紧导气管后为什么观察到试管的盐酸和金属锌反应的现象气泡减少?
 小丫小丫小丫2022-10-04 11:39:542条回答
小丫小丫小丫2022-10-04 11:39:542条回答注明.试管内的锌放在有空塑料板上.
原来正在反应,可是夹紧导气管后看到的现象是气泡减少

已提交,审核后显示!提交回复
共2条回复
 都市的精灵 共回答了12个问题
都市的精灵 共回答了12个问题 |采纳率100%- 弹簧夹夹紧后试管内的气体导不出去,使试管内的气压增大,将试管内的液体压入长劲漏斗中,使液体和有孔塑料板上的金属锌不能完全接触,所以反应现象慢慢减弱,最后反应会停止.
- 1年前
 伞洱 共回答了16个问题
伞洱 共回答了16个问题 |采纳率- 该反应不是可逆反应,所以不会是反应速度降低。“气泡减少”现象严格说是“气泡变小”,因为试管内气压增大,所以反应产生的气泡形成的体积变小,气泡析出液面的剧烈程度降低,所以会误以为气泡变少。
- 1年前
相关推荐
- 测定空气中氧气含量的实验(如图),实验前,用弹簧夹夹紧乳胶管,这样做的目的是______,集气瓶底部留有少量水的目的是_
测定空气中氧气含量的实验(如图),实验前,用弹簧夹夹紧乳胶管,这样做的目的是______,集气瓶底部留有少量水的目的是______.反应中观察到的实验现象是______,冷却至室温后,打开夹子观察到的实验现象是______,解释产生上述现象的原因是______. 
 yjhmtvc1年前1
yjhmtvc1年前1 -
 moren 共回答了24个问题
moren 共回答了24个问题 |采纳率87.5%由于红磷燃烧放出大量的热,用弹簧夹夹紧乳胶管,目的是防止热胀使气体从导管益处.
由于红磷燃烧会放出大量的热,集气瓶内的气体受热膨胀,可能会把橡胶塞崩开,故集气瓶底部留有少量的水用于吸热降温减压,以防胶塞崩开.
红磷燃烧生成五氧化二磷白色固体,故实验现象为红磷燃烧发光、放热、产生白烟.
由于红磷燃烧消耗了集气瓶中的占空气体积约
1
5 的氧气生成五氧化二磷固体,使集气瓶中的压强减小小于外界大气压,故冷却至室温后,可看到烧杯中的水沿导管进入集气瓶内使液面上升到约刻度1处.
故答案为:防止热胀使气体从导管逸出;
吸热降温减压,以防胶塞迸开(水的比热较大可以吸热降低集气瓶内压力或压强);
红磷燃烧、发光、放热、产生白烟;烧杯中的水沿导管进入集气瓶内使液面上升到约刻度1处;
空气中氧气约占体积的
1
5 ,红磷燃烧消耗空气中的氧气生成五氧化二磷固体;
集气瓶内压强小于外界大气压,大气压将水压入瓶内;1年前查看全部
- 如图所示,装置中a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO
如图所示,装置中a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO 2 气体由左侧导管通入,充分反应后,排出的气体主要是______;然后关闭a,打开b,一段时间后排出的气体主要是______. 
 temp20091年前1
temp20091年前1 -
 yin1985119 共回答了14个问题
yin1985119 共回答了14个问题 |采纳率85.7%先关闭b,打开a,将混有少量CO的CO 2 气体由左侧导管通入,充分反应后,混合气中的二氧化碳会与氢氧化钠反应生成碳酸钠和水而被吸收,只剩下一氧化碳;
然后关闭a,打开b,一段时间后,盐酸会与碳酸钠反应生成氯化钠、水和二氧化碳.
故答案为:CO,CO 21年前查看全部
- 根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①反应原理:铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O△ .Cu+2H2SO4(浓).
CuSO4+SO2↑+2H2O△ .
②实验步骤:连接仪器、______、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③试剂选择:装置A中试剂是______.
④结论:能说明碳的非金属性比硅强的实验现象是______.
(2)验证SO2的氧化性、还原性和酸性氧化物的通性.
①在(1)②操作后打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是______.
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
写出其中SO2显示还原性生成沉淀的离子方程式______.滴加的溶液 氯水 氨水 沉淀的化学式 ______ ______  雪冰伟1年前1
雪冰伟1年前1 -
 LovGiGi1314 共回答了20个问题
LovGiGi1314 共回答了20个问题 |采纳率95%解题思路:(1)①铜与浓硫酸反应生成硫酸铜和二氧化硫、水;
②反应生成气体,在加入药品之前需要检验装置的气密性;
③装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
④利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水;
③氯气具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀.(1)①铜与浓硫酸反应生成硫酸铜和二氧化硫、水,所以反应方程式为:Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
△
.
CuSO4+SO2↑+2H2O;
②装置A中反应制备气体,在加入药品之前需要检验装置的气密性,故答案为:检验装置的气密性;
③装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液,
故答案为:酸性高锰酸钾溶液;
④利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强,A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强,
故答案为:A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应离子方程式为:2H2S+SO2=3S↓+2H2O,故答案为:2H2S+SO2=3S↓+2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应的方程式为Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,
故答案为:
BaSO4BaSO3Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-.点评:
本题考点: 性质实验方案的设计.
考点点评: 本题考查实验方案的设计,涉及化学用语、物质性质、对装置的理解等,为高频考点,题目难度中等,试题侧重于学生的分析能力和实验能力,理解实验原理是解题的关键,试题有利于培养学生灵活应用所学知识的能力.1年前查看全部
- (2006•南京)某班同学如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并
 (2006•南京)某班同学如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的[1/5],乙同学的广口瓶内水面上升明显大于瓶内空气体积的[1/5].
(2006•南京)某班同学如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的[1/5],乙同学的广口瓶内水面上升明显大于瓶内空气体积的[1/5].
下列对这两种现象解释合理的是( )
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗完
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出.
A.只有①③
B.只有②④
C.只有①②③
D.①②③④ springemile1年前1
springemile1年前1 -
 SunnySnake 共回答了22个问题
SunnySnake 共回答了22个问题 |采纳率95.5%解题思路:根据红磷测定空气里氧气含量的实验原理、操作步骤、注意事项进行
1、造成测得氧气的体积分数小于五分之一的因素可以从以下四个方面考虑:
(1)、装置是否漏气;(2)、红磷的用量是否充足;(3)、瓶内的氧气是否耗尽;(4)、装置是否冷却到室温.
2、造成测得氧气的体积分数大于五分之一的因素可以从以下两各方面考虑:(1)、止水夹有没有夹紧;(2)、燃烧匙伸入是否过慢.①实验中所取红磷的量不足时,会导致装置内氧气不能全部消耗,因此使测得氧气的体积分数会小于五分之一,正确.
②实验装置若漏气,会使空气进入集气瓶内,因此测得氧气的体积分数小于五分之一,正确;
③实验前若没有将弹簧夹夹紧,会导致实验中装置内的气体受热膨胀而逸出,因此测得氧气的体积分数会大于五分之一,正确;
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出,因此测定氧气体积分数增大,正确.
故选D点评:
本题考点: 空气组成的测定.
考点点评: 本题主要考查用红磷测定空气里氧气含量的实验原理、操作步骤、实验现象、实验结论和注意事项等,解答本题可以运用排除选择法,即分析每一选项导致的后果,从而得出正确答案.1年前查看全部
- 根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)
根据要求完成下列各小题实验目的。(a、b为弹簧夹,加热及固定装置已略去)

(1)验证碳、硅非金属性的相对强弱。(巳知酸性:亚硫酸 >碳酸)
①接仪器并_________________、加药品后,打开a关闭 b,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是: 。
装置A中的试剂可以是: 。
③能说明碳的非金属性比硅强的实验现象是: 。
(2)验证 SO 2 的氧化性、还原性和酸性氧化物的通性。
①打开b,关闭a。
②H 2 S溶液中有浅黄色浑浊出现,化学方程式是:
③BaCl 2 溶液中无明显现象,将其分成两份,分別滴加下列溶液,将产生的沉淀的化学式填人下表相应位置:
写出SO 2 与氯水反应的离子方程式 。 诗曼青藤1年前1
诗曼青藤1年前1 -
 zhu145688 共回答了22个问题
zhu145688 共回答了22个问题 |采纳率90.9%(1) ①检查装置气密性(2分) ②Cu + 2H 2 SO 4( 浓 ) CuSO 4 + SO 2 ↑+ 2H 2 O(2分)
CuSO 4 + SO 2 ↑+ 2H 2 O(2分)
酸性KMnO 4 溶液或溴水或饱和NaHCO 3 溶液(2分)③Na 2 SiO 3 溶液中产生胶状沉淀(2分)
(2) ②2H 2 S + SO 2 =" 3S↓+" 2H 2 O(2分)③BaSO 4 (2分) BaSO 3 (2分)
Cl 2 + SO 2 + 2H 2 O = SO 4 2 - + 4H + + 2Cl - (2分)
(1)装置图组装好以后,首先要检验装置的气密性。浓硫酸具有强氧化性,在加热的条件下能把铜氧化生成硫酸铜、SO 2 和水。由于亚硫酸的酸性强于碳酸的,所以生成的SO 2 通入到碳酸氢钠溶液中,会生成CO 2 气体。而碳酸的酸性又强于硅酸的,所以CO 2 通入到硅酸钠溶液中,会析出硅酸晶体。为了防止SO 2 的存在干扰CO 2 和硅酸钠的反应,需要在通入硅酸钠溶液之前,先把SO 2 除去,可以选择酸性高锰酸钾溶液或溴水或饱和碳酸氢钠溶液等。
(2)H 2 S中的硫元素处于最低价,SO 2 能把硫化氢氧化生成单质硫,反应式为2H 2 S + SO 2 =" 3S↓+" 2H 2 O。氯气具有强氧化性,能把SO 2 氧化生成硫酸,从而产生硫酸钡沉淀。氨水和亚硫酸反应生成亚硫酸铵,进而生成亚硫酸钡沉淀。1年前查看全部
- (2009•惠州二模)下列各装置中,夹紧②、③、④中的弹簧夹,并作相关操作,会漏气的装置是( )
(2009•惠州二模)下列各装置中,夹紧②、③、④中的弹簧夹,并作相关操作,会漏气的装置是( )

A.对装置①,双手移去后.导管中水面与烧杯水面相平
B.对装置②,长颈漏斗内液面高度保持不变
C.对装置③,长导管内形成一段水柱
D.对装置④,上移a管后,a、b两端液面形成了一段稳定的高度差 贝齐1年前1
贝齐1年前1 -
 aa得离谱 共回答了20个问题
aa得离谱 共回答了20个问题 |采纳率95%解题思路:装置气密性检验有多种方法,原理都是根据装置内外的压强差形成水柱或气泡,据此分析各种检查方法.A.双手移去后,应上升的水柱不下降,导管中水面与烧杯水面相平,说明漏气,故A正确;
B.用弹簧夹夹住右边导管,向长颈漏斗中倒水,液面高度不变,说明装置气密性良好不漏气,故B错误;
C.用弹簧夹夹住右边导管,双手捂住烧瓶,烧瓶内气体受热膨胀,使集气瓶中气体压强增大,在玻璃管中形成一段水柱,说明装置气密性良好不漏气,故C错误;
D.用弹簧夹夹住右边导管,上下移动,两边液面应形成一定的高度差,说明装置气密性良好不漏气,故D错误.
故选A.点评:
本题考点: 气体发生装置的气密性检查.
考点点评: 本题考查装置气密性的检查,装置气密性检验原理都是依据密闭装置中气体存在压强差,形成水柱或气泡的现象进行判断是解答本题的关键,该题易错点是D选项的判别,题目难度不大.1年前查看全部
- 红磷在氧气中燃烧实验这个实验中的弹簧夹有什么作用?没有行不行?为什么?
 catrinahuangyu1年前4
catrinahuangyu1年前4 -
 jacow 共回答了27个问题
jacow 共回答了27个问题 |采纳率96.3%不行,
燃烧的时候,弹簧夹起到密封装置的作用,
如果没有弹簧夹,就无法在瓶内形成负压,水就无法回流到瓶中了1年前查看全部
- 就是那个类似连通器,右边配有塞子和夹了弹簧夹的导管,为什么上下移动,两液面水平?
就是那个类似连通器,右边配有塞子和夹了弹簧夹的导管,为什么上下移动,两液面水平?
没有图,抱歉
为什么上下移动,两液面水平,装置就会漏气?
如果不漏气,那上下移动左边液面会怎样?说明原理 vicenaive1年前1
vicenaive1年前1 -
 上嘴唇碰上嘴唇 共回答了14个问题
上嘴唇碰上嘴唇 共回答了14个问题 |采纳率85.7%压强相等啊
你的现象对应的原因是对的
在上下移动液面时
压强关系存在:
P(外)=P(液柱高度差)+P(空气柱)
若气密性良好,空气柱被压缩有一定的压强,但不等于外界大气压,即:
P(外)≠P(空气柱)
那么P(液柱高度差)≠0,即有液面高度差
哪一边液面偏高都有可能,看你移动的位置了,若位置较低,则另一侧高些,反之亦反
但是,气密性不好,那段密封的空气就与外界相连,P(外)=P(空气柱)
此时P(液柱高度差)=0,没有液面高度差,即两液面相平1年前查看全部
- 脚蹬是滑轮吗?把手,车轮和车轴是轮轴吗?刹车,后架上的弹簧夹和车龄上的按钮是杠杆吗?
脚蹬是滑轮吗?把手,车轮和车轴是轮轴吗?刹车,后架上的弹簧夹和车龄上的按钮是杠杆吗?
确定的在回答!回答最佳者给分! 小肚兜5201年前2
小肚兜5201年前2 -
 r凌凌 共回答了15个问题
r凌凌 共回答了15个问题 |采纳率80%脚蹬不是滑轮,但你指的是脚蹬的哪一部分呢?算上转盘应该是轮轴,但若单单是脚蹬的地方,那不是什么省力机械,只是滑动摩擦而已,上了润滑油.
车轮和车轴是轮轴.
后架上的弹簧夹和车龄上的按钮是杠杆.
其实轮轴本质就是杠杆1年前查看全部
- 为测定空气中氧气与氮气的体积比,某同学设计了如图所示的装置进行实验.具体操作是:先关闭弹簧夹;再将螺旋状的铜丝在酒精灯上
 为测定空气中氧气与氮气的体积比,某同学设计了如图所示的装置进行实验.具体操作是:先关闭弹簧夹;再将螺旋状的铜丝在酒精灯上灼烧后迅速插入大试管接触试管底部的白磷(过量);然后立即塞紧橡胶塞.他观察到大试管中产生大量的白烟.请你帮他解答下列问题:
为测定空气中氧气与氮气的体积比,某同学设计了如图所示的装置进行实验.具体操作是:先关闭弹簧夹;再将螺旋状的铜丝在酒精灯上灼烧后迅速插入大试管接触试管底部的白磷(过量);然后立即塞紧橡胶塞.他观察到大试管中产生大量的白烟.请你帮他解答下列问题:
(1)写出自磷燃烧的化学方程式4P+5O2
2P2O5点燃 .4P+5O2
2P2O5点燃 .
(2)待试管冷却后打开弹簧夹,此时可观察到的现象为水倒流入试管内,约占试管容积的[1/5]水倒流入试管内,约占试管容积的[1/5],据此可证实空气中O2与N2的体积比大约为______
(3)如果装置气密性不好,测出氧气与氮气的体积比将______ (填偏大、偏小、不变). mark05111年前1
mark05111年前1 -
 检测邮箱有效 共回答了17个问题
检测邮箱有效 共回答了17个问题 |采纳率94.1%解题思路:(1)默写白磷燃烧的化学方程式;
(2)根据白磷燃烧生成白色固体五氧化二磷而使试管内气体体积减小,结合空气中氧气含量分析实验中出现的现象,并利用对压强的认识解释出现该现象的原因;
(3)分析装置气密性不好在冷却过程中可能出现的意外,判断该意外情况对实验测出氧气与氮气的体积比的影响.(1)白磷在空气中燃烧,与空气中氧气反应生成五氧化二磷,反应的化学方程式为4P+5O2
点燃
.
2P2O5;
(2)白磷燃烧消耗氧气,待试管冷却后,由于占空气体积[1/5]的氧气被完全反应,管内气体体积减小,使试管内压强减小的缘故,打开弹簧夹,水倒流入试管内,填补原来氧气所占体积,因此进入的水的体积约占试管容积的[1/5];据此可证实空气中O2与N2的体积比大约为 1:4.
(3)如果装置气密性不好,在进行冷却过程中,外界空气进入试管,而导致进入水的体积偏小,则测出氧气与氮气的体积比偏小;
故答案为:
(1)4P+5O2
点燃
.
2P2O5
(2)水倒流入试管内,约占试管容积的[1/5]; 1:4
(3)偏小点评:
本题考点: 空气组成的测定;书写化学方程式、文字表达式、电离方程式.
考点点评: 利用可燃物耗尽空气中氧气,测量所剩余气体的体积而得到空气中氧气的体积分数,实验中要求可燃物燃烧不能产生新的气体.1年前查看全部
- 用下图所示装置进行CO和CO 2 的分离与干燥(其中A为弹簧夹,B为分液漏斗活塞)。
用下图所示装置进行CO和CO 2 的分离与干燥(其中A为弹簧夹,B为分液漏斗活塞)。

已知:浓硫酸具有很强的吸水性;氢氧化钠溶液可以快速吸收二氧化碳,若将二氧化碳通入足量的氢氧化钠溶液可以生成碳酸钠和水,该反应的化学方程式为 。
(1)广口瓶(甲)中盛有 ;广口瓶(乙)中盛有浓硫酸,其作用是 ;分液漏斗(丙)中盛有 。
(2)先分离出的气体是 ;丙中液体将后一种气体分离出时发生反应的化学方程式为 。 danielchi1年前1
danielchi1年前1 -
 猪小闲 共回答了20个问题
猪小闲 共回答了20个问题 |采纳率95%(每空1分,共6分)
CO 2 +2NaOH==Na 2 CO 3 +H 2 O
(1)NaOH溶液干燥气体稀盐酸
(2)CO Na 2 CO 3 +2HCl==2NaCl+H 2 O+CO 2 ↑
甲中装有NaOH溶液,用来吸收CO 2 ,此时从乙中出来的是被乙中浓硫酸干燥过的纯净的CO,因为该题中要求分离CO和CO 2 ,所以最终还要求把甲中吸收的CO 2 再放出来,所以丙中装稀盐酸,用来生成CO 2 ,
故答案为:(1)NaOH溶液;干燥气体,稀盐酸
(2)CO;CO 2 +2NaOH==Na 2 CO 3 +H 2 O1年前查看全部
- 红磷在氧气中燃烧的实验如果红磷燃烧后没有等集气瓶内的温度冷却到室温就打开弹簧夹,会怎么样?为什么?
 dlyhh1年前4
dlyhh1年前4 -
 ye6f 共回答了16个问题
ye6f 共回答了16个问题 |采纳率93.8%会使实验结果的氧气含量偏低,因为热的N2气压大,会导致体积变大,从而使测算的O2 体积变小1年前查看全部
- 如图所示,装置a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO2
 如图所示,装置a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO2气体由左侧导管通入,充分反应后,排出的气体主要是______;然后关闭a,打开b,一段时间后,排出的气体主要是______.写出反应过程中发生的有关化学方程式为______;______.
如图所示,装置a为弹簧夹,b为分液漏斗的活塞(通过开、关活塞可以随时滴加液体).先关闭b,打开a,将混有少量CO的CO2气体由左侧导管通入,充分反应后,排出的气体主要是______;然后关闭a,打开b,一段时间后,排出的气体主要是______.写出反应过程中发生的有关化学方程式为______;______.  禾下甜1年前1
禾下甜1年前1 -
 wdw23 共回答了16个问题
wdw23 共回答了16个问题 |采纳率87.5%解题思路:根据氢氧化钠会与二氧化碳反应进行分析;
根据碳酸盐会与酸反应生成二氧化碳进行分析.先关闭b,打开a,将混有少量CO的CO2气体由左侧导管通入,充分反应后,混合气中的二氧化碳会与氢氧化钠反应生成碳酸钠和水而被吸收,只剩下一氧化碳;
然后关闭a,打开b,一段时间后,盐酸会与碳酸钠反应生成氯化钠、水和二氧化碳,
故答案为:CO;CO2;2NaOH+CO2═Na2CO3+H2O;Na2CO3+2HCl═2NaCl+H2O+CO2↑.点评:
本题考点: 常见气体的检验与除杂方法;气体的净化(除杂);书写化学方程式、文字表达式、电离方程式.
考点点评: 在解此类题时,首先分析所给的试剂和需要分离的气体会发生的反应,然后结合具体装置的原理进行分析解答.1年前查看全部
- 空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.
 空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
(1)从上述实验现象可知:氧气约占空气总体积的[1/5][1/5].
请写出其中两点关于剩余气体的有关性质:①______、②______;
(2)而某同学在做该实验中,A内气体减少的体积小于[1/5],试问导致该实验结果的原因可能是______(答一种就可). anlltsw661年前1
anlltsw661年前1 -
 神秘花园之海角 共回答了15个问题
神秘花园之海角 共回答了15个问题 |采纳率80%解题思路:本题是测定空气中氧气的含量,我们常用燃烧红磷或白磷的方法,因为磷燃烧生成白色固体五氧化二磷,几乎不占空间,使得内外产生气压差,从而得到正确的结论;保证本实验成功的关键是:①装置气密性好;②红磷要足量;③要冷却至室温再读数.(1)从上述实验现象可知,进入集气瓶中的水约占集气瓶剩余体积的[1/5],说明了:氧气约占空气总体积的[1/5].红磷在空气里燃烧消耗了氧气,剩余的气体主要氮气.由红磷的熄灭,说明了氮气不燃烧、不支持燃烧;由冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到一定高度不再上升.说明了氮气的溶解性是难溶于水.;
(2)而某同学在做该实验中,A内气体减少的体积小于[1/5],导致该实验结果的原因可能是红磷的量不足、装置漏气等.
故答为:(1)[1/5],不燃烧、不支持燃烧,难溶于水;(2)红磷的量不足等.点评:
本题考点: 空气组成的测定.
考点点评: 本考点考查的是空气中氧气含量的探究实验,根据实验操作图,回忆实验中现象,由实验中的注意事项,对实验结果进行评价,从而理解该实验的探究目的.对实验结果进行评价,是近几年中考的重点之一,要好好把握.1年前查看全部
- 右图是实验室制备CO2的装置图.该装置的特点是:打开弹簧夹,大理石和稀盐酸接触,发生反应;关闭弹簧夹后,稀盐酸被反应产生
右图是实验室制备CO2的装置图.该装置的特点是:打开弹簧夹,大理石和稀盐酸接触,发生反应;关闭弹簧夹后,稀盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停止反应.用该装置制备CO2可起到节约药品和使用方便的效果.下图的装置中哪些可以起到与图的装置相同的效果?______(填写编号).

 朱掌柜的1年前1
朱掌柜的1年前1 -
 11cc 共回答了13个问题
11cc 共回答了13个问题 |采纳率92.3%解题思路:根据实际操作看是否适合于控制反应的发生和停止的效果.A、看起来行,但由于锥形瓶中液体太多,所以不适合将液体压回的操作,故A错误;
B、用弹簧夹夹住橡胶管时气体排不出去,球形瓶中的气体压强变大从而迫使稀盐酸排出球形瓶并与大理石分离,反应停止.放开弹簧夹时,稀盐酸进入球形瓶,并和烧杯中的液面相平同时与大理石接触,发生化学反应.所以该装置可以通过控制弹簧夹来达到使盐酸和大理石分离,从而控制反应的发生和停止,故B正确;
C、操作错误导管在液面以下,不适合气体的排出,导管应该刚露出试管塞为宜.故C错误;
D、该装置可以通过控制弹簧夹来达到使盐酸和大理石分离,从而控制反应的发生和停止,故D正确.
故选:BD.点评:
本题考点: 二氧化碳的实验室制法.
考点点评: 通过回答本题掌握了控制反应的发生和停止的实验装置的设计方法,学会了根据实验结论考虑实验目的,根据实验过程考虑所用仪器的方法.1年前查看全部
- 有如图实验装置,其中a、b、c为弹簧夹.
 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.
(1)如果开启a和c,关闭b,则Ⅰ中发生Cu与稀硝酸反应;
(2)如果将Ⅰ管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会儿观察,可以看到Ⅱ里浸入水中的导管口有气泡冒出,导管内气体呈______色,液面上气体为______色.
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭______(填a或b,下同),开启______和c,使产生的CO2气体排尽II里的空气,再关闭______打开______.
(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.则原硝酸溶液的浓度为______mol•L-1. 东北1231年前1
东北1231年前1 -
 haitanglei 共回答了19个问题
haitanglei 共回答了19个问题 |采纳率100%解题思路:(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;
(3)始终保持无色,装置Ⅱ中不能含有空气,需要Ⅲ反应生成二氧化碳把装置Ⅱ中的空气赶净,生成的二氧化氮与水反应生成无色气体;
(4)根据化学方程式计算,可以利用氧化还原反应的电子守恒列式计算.(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;导管内气体呈红棕色,液面上气体是无色,
故答案为:红棕;无;
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应,
故答案为:a;b;b;a;
(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L物质的量为0.5mol;依据氧化还原反应的电子守恒计算,设生成NO物质的量为x,则NO2物质的量为0.5mol-x;失电子的铜物质的量为0.5mol,Cu~Cu2+~2e-;失电子总数为1mol;得电子的是硝酸分别为:
HNO3~NO~3e-;
x 3x
NO3-~NO2 ~e-;
0.5-x 0.5-x
则:3x+0.5-x=1
解得:x=0.25mol
依据氮元素守恒得到,原硝酸溶液中溶质物质的量=0.25 mol+(0.5-0.25)+0.5×2=1.5mol;原硝酸浓度=[1.5mol/0.15L]=10mol/L,
故答案为:10.点评:
本题考点: 实验装置综合;硝酸的化学性质.
考点点评: 本题考查了硝酸性质的应用,实验装置的反应原理的应用分析,铜和稀硝酸、浓硝酸反应产物的性质判断和应用,氧化还原反应的电子守恒的计算应用,难度中等.1年前查看全部
- 如下图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能是气球a明显鼓起的是
如下图所示,装置气密性良好,弹簧夹处于关闭状态。挤压胶头滴管加入液体,一段时间后,打开弹簧夹,能是气球a明显鼓起的是

试管内物质 胶头滴管内物质 A 氢氧化钠固体 水 B 氧化铁 稀盐酸 C 氯化钡溶液 稀硫酸 D 二氧化碳 氢氧化钠溶液  冷雪心1年前1
冷雪心1年前1 -
 530799426 共回答了22个问题
530799426 共回答了22个问题 |采纳率90.9%D
1年前查看全部
- 在测定氧气的体积分数的实验中,为什么橡皮塞塞得过慢和弹簧夹未夹紧会导致测得氧气体积偏大?
 陌阡人1年前1
陌阡人1年前1 -
 出22张图纸 共回答了12个问题
出22张图纸 共回答了12个问题 |采纳率100%橡皮塞塞得过慢,红磷燃烧时集气瓶内部分空气受热在瓶口跑出
没夹紧弹簧夹,红磷燃烧时集气瓶内部分空气受热从导管逸出
这个题目有些理想化,实际上橡皮塞塞得过慢外界空气进入,测的结果偏小才对1年前查看全部
- (2010•上海二模)在探究“杠杆平衡的条件”实验中,所用的器材有带刻度的杠杆、铁架台、钩码、线(或弹簧夹)和_____
(2010•上海二模)在探究“杠杆平衡的条件”实验中,所用的器材有带刻度的杠杆、铁架台、钩码、线(或弹簧夹)和______等.将杠杆的中点固定在支架上,若发现杠杆右端下沉,则应将杠杆左侧的平衡螺母向______调,直到杠杆在水平位置平衡为止,这样做的目的是______.
 爱海无边1年前1
爱海无边1年前1 -
 abc李冰 共回答了16个问题
abc李冰 共回答了16个问题 |采纳率100%解题思路:探究杠杆平衡条件的实验中,带刻度的杠杆支在铁架台上,用弹簧测力计测量钩码的重,钩码用细线挂在杠杆的一端,用弹簧测力计竖直拉动杠杆,使杠杆在水平位置平衡,杠杆在水平位置平衡,力臂在杠杆上,便于测量力臂大小,同时消除杠杆自重对杠杆平衡的影响.
探究杠杆平衡之前,首先调节杠杆两端的平衡螺母使杠杆在水平位置平衡.平衡螺母向上翘的一端移动.实验中还要用弹簧测力计测量钩码的重力,当钩码挂在杠杆上,还要测量杠杆上加多大的力使杠杆重新在水平位置平衡.
杠杆右端下沉,杠杆的左端上翘,平衡螺母向上翘的左端移动.
杠杆在水平位置平衡,力臂在杠杆上,便于测量力臂大小,同时杠杆的重心作用在支点上,消除杠杆自重对杠杆平衡的影响.
故答案为:弹簧测力计;左;为了方便准确测出力臂,同时消除杠杆自重对杠杆平衡的影响.点评:
本题考点: 探究杠杆的平衡条件实验.
考点点评: 用实验探究物理问题时,要明确探究的内容,根据探究的内容,会选择实验器材,设计实验步骤,进行实验,知道实验中注意事项,并能对实验数据进行总结得出实验结论.1年前查看全部
- 某同学利用右图所示装置测定空气中氧气的含量,先用弹簧夹夹住橡皮管,点燃红磷,伸入瓶中并塞上瓶塞.等红磷燃烧熄灭后再打开弹
某同学利用右图所示装置测定空气中氧气的含量,先用弹簧夹夹住橡皮管,点燃红磷,伸入瓶中并塞上瓶塞.等红磷燃烧熄灭后再打开弹簧夹,发现集气瓶中的水少于其容积的
,可能的原因有( )1 5 A.实验装置的气密性良好 B.实验时迅速插入燃烧匙,并将瓶塞立即塞紧 C.红磷熄灭后没等集气瓶冷却就立刻打开弹簧夹 D.实验时使用的红磷过量 
 倚诺1年前1
倚诺1年前1 -
 trojanman 共回答了16个问题
trojanman 共回答了16个问题 |采纳率81.3%选项A、B、D中的措施导致的结果都是让流入水的体积接近集气瓶容积的 1 5 ,而不是少于 1 5 .选项C中的措施进行时,由于瓶内剩余气体温度较高,体积膨胀,气压较大,与外界的压力差较小,...1年前查看全部
- 如图所示,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,看到的现
如图所示,等体积的A、B两集气瓶充满空气,燃烧匙内分别盛有过量的红磷和硫,当完全燃烧后,冷却至室温,打开弹簧夹,看到的现象是( )
(A) A瓶中有水流入
(B) B瓶中有水流入
(C) A、B瓶中有水流入
(D) 无法确定

硫在空气中燃烧消耗氧气后生成的二氧化硫气体的体积大于等于还是小于消耗的氧气体积?
我知道S+O2=SO2,但和只能看出参加反应的氧气与反应生成的二氧化硫质量之比为1:如何看出体积相等? fufuhao1年前2
fufuhao1年前2 -
 lutherhead2005 共回答了12个问题
lutherhead2005 共回答了12个问题 |采纳率83.3%等於
S+O2=SO2可以看出,消耗1体积O2,就产生1体积SO21年前查看全部
- 如图所示装置,可用来粗略测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的
如图所示装置,可用来粗略测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.由此实验不能得到的结论是( ) A.空气中氧气的含量约为 1 5 B.氮气不易溶于水 C.氮气不支持燃烧 D.空气中氮气的含量为78% 
 受贼的1年前1
受贼的1年前1 -
 嘿龍马 共回答了18个问题
嘿龍马 共回答了18个问题 |采纳率88.9%测定空气中氧气含量的原理是利用磷燃烧只消耗氧气,且不生成新气体,由于氧气被消耗,瓶内气压减小,水倒吸入瓶内,进入水的体积即为空气中氧气的体积.
A、红熄灭后烧杯中的水倒流进集气瓶中,液面上升到图中A位置,即原瓶中空气体积的
1
5 ,所以正确.
B、红磷熄灭后集气瓶中剩余的气体主要是氮气,由于液面不再变化,可知氮气不易溶于水,所以正确.
C、红磷熄灭后集气瓶中剩余的气体主要是氮气,说明氮气不支持燃烧,所以正确.
D、红磷熄灭后液面上升到图中A位置,即原瓶中空气体积的
1
5 ,说明空气中氧气的含量约为
1
5 ,而氮气约为
4
5 ,不能精确到78%,所以错误.
故选D.1年前查看全部
- 这个东西我一直没弄明白,解析是说:用弹簧夹夹住右边导管,上下移动,若装置不漏气,两边液面应形成一定的高度差,而图示两端液
这个东西我一直没弄明白,

解析是说:
用弹簧夹夹住右边导管,上下移动,若装置不漏气,两边液面应形成一定的高度差,而图示两端液面相平,说明装置漏气;
有两个疑问:1.上下移动的是哪一部分?
2.上下移动,为什么会引起压强差?这个装置里的气体有什么运动变化吗? 黑色_礼服1年前1
黑色_礼服1年前1 -
 米小叶 共回答了10个问题
米小叶 共回答了10个问题 |采纳率90%1.上下移动的是左边那根试管,当然,两根试管相对上下运动都行.
2.假设装置不漏气,就是右边橡胶塞密闭良好,当两个试管上下移动时,首先液面会不平齐,产生液压差,但同时左边管液面上方的大气压和右边管中封闭气体的气压也会产生压力差,这两个压力差相互影响,使得两处液面不会平齐;如果左管高于右管,那么右管内空气被稍稍压缩,反之则稍稍膨胀;
但如果气密性不好,两边液面表面都是大气压,那么根据压力平衡,两关内液面压差为0,液面相平齐.1年前查看全部
- 用来测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气
 用来测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,并且进入集气瓶中水的体积约为集气瓶总容积的五分之一
用来测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,并且进入集气瓶中水的体积约为集气瓶总容积的五分之一
请回答下列问题:
(1)集气瓶中剩余的气体主要是______.
(2)组成空气的各气体的体积分数氮气______氧气______稀有气体______二氧化碳______其他气体______
(3)某同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是______. 一抹云aaaa1年前1
一抹云aaaa1年前1 -
 gg030951 共回答了20个问题
gg030951 共回答了20个问题 |采纳率90%解题思路:本题中空气中氧气的含量,是用红磷测定的,保证该实验成功的关键是:①装置的气密性要好;②红磷要足量;③必须冷却到室温再读数;④做实验要迅速等.做本实验时,要注意把空气中的氧气充分消耗掉,而又不能加入新的气体.改进后的装置的优点是:不用在瓶外点燃红磷.(1)集气瓶中剩余的气体主要是氮气,因为氮气占空气体积的78%.故答案为:氮气.(2)空气中各成分的体积分数分别是:氮气78%、氧气21%、稀有气体0.94%、二氧化碳0.03%、其它气体和杂质0.03%.故答案为:78%;21%;...
点评:
本题考点: 空气组成的测定.
考点点评: 本考点考查了空气中氧气含量的探究,选择药品时要注意:空气中的氧气要充分消耗掉,而又不能加入新的气体.因此应该考虑用红磷、白磷、铜丝等,他们与氧气反应生成物是固体,几乎不占空间.本考点主要出现在填空题和实验题中.1年前查看全部
- (2014•栾城县三模)如图所示是某兴趣小组同学设计的趣味实验装置,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入
 (2014•栾城县三模)如图所示是某兴趣小组同学设计的趣味实验装置,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,打开弹簧夹,能使气球a明显鼓起的是______(填序号);能使气球b明显鼓起的是______(填序号),气球b鼓起的原因是______.
(2014•栾城县三模)如图所示是某兴趣小组同学设计的趣味实验装置,装置气密性良好,弹簧夹处于关闭状态.挤压胶头滴管加入液体,打开弹簧夹,能使气球a明显鼓起的是______(填序号);能使气球b明显鼓起的是______(填序号),气球b鼓起的原因是______.序号 试管内物质 胶头滴管内物质 A 氢氧化钠固体 水 B 氯化钡溶液 稀硫酸 C 二氧化碳 氢氧化钠溶液  同心恋人1年前1
同心恋人1年前1 -
 湘西自助游 共回答了25个问题
湘西自助游 共回答了25个问题 |采纳率84%解题思路:当锥形瓶中的空气减少时,压强减小,在外界大气压的作用下,气球a会鼓起来;当锥形瓶中的空气增多时,压强增大,气球b会鼓起来.A、氢氧化钠固体溶于水时,放出大量的热,试管中的空气膨胀,压强变大,气体进入锥形瓶,气球b会鼓起来.
B、氯化钡和稀硫酸反应生成硫酸钡沉淀和盐酸,锥形瓶中的空气没有明显变化,气球也没有明显变化.
C、二氧化碳能和氢氧化钠溶液反应生成碳酸钠和水,试管中的二氧化碳减少,锥形瓶中的空气进入试管,从而使锥形瓶中的空气减少,当锥形瓶中的空气减少时,压强减小,在外界大气压的作用下,气球a会鼓起来.
所以打开弹簧夹,能使气球a明显鼓起的是C;能使气球b明显鼓起的是A,气球b鼓起的原因是氢氧化钠固体溶于水时,放出大量的热,试管中的空气膨胀,压强变大.
故答案为:C;A;氢氧化钠固体溶于水时,放出大量的热,试管中的空气膨胀,压强变大.点评:
本题考点: 反应现象和本质的联系;溶解时的吸热或放热现象;酸的化学性质;碱的化学性质.
考点点评: 本题主要考查了物质之间相互作用时出现的实验现象,并且与气体压强相联系,属于化学与物理之间的综合运用.1年前查看全部
- 空气中氧气含量测定实验的问题1.为什么胶塞塞入过慢和弹簧夹未夹紧会导致结果大于五分之一?2.装置漏气为什么会使结果小于五
空气中氧气含量测定实验的问题
1.为什么胶塞塞入过慢和弹簧夹未夹紧会导致结果大于五分之一?2.装置漏气为什么会使结果小于五分之一?3.为什么要冷却至室温再读数? 四个月就该离婚吗1年前3
四个月就该离婚吗1年前3 -
 ywl8310 共回答了16个问题
ywl8310 共回答了16个问题 |采纳率81.3%1.胶塞塞入过慢和弹簧夹未夹紧,会导致空气进入集气瓶,从而把这部分空气算入了氧气了.
2.装置漏气,瓶内氧气散逸到空气中了.
3.不冷却,瓶内压强大会有氧气散逸出,结果偏小.
新年快乐!1年前查看全部
- 若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹.可观察到的现象为?
 liyuxi07231年前1
liyuxi07231年前1 -
 zhqao 共回答了24个问题
zhqao 共回答了24个问题 |采纳率83.3%若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹.可观察到的现象为白磷燃烧,产生白烟,活塞前沿约在12mL的刻度线上
因为若先夹紧弹簧夹,用酒精灯加热白磷,这时白磷燃烧消耗掉的只是试管内的氧气为40mL×1 5 =8mL,所以活塞应停在20mL-8mL=12mL的刻度处;
另附:若不使用弹簧夹,用酒精灯加热白磷,白磷实际消耗掉的是试管40mL和注射器内20mL的氧气为(40mL+20mL)×1 5 =12mL,所以活塞应停在20mL-12mL=8mL的刻度处;1年前查看全部
- 空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.
 空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
空气是一种宝贵的资源.用如图所示装置,测定空气里氧气的含量.实验时先在集气瓶里加入少量水,做上记号.用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.待红磷熄灭后,发现红磷还有剩余,冷却,打开弹簧夹,烧杯中的水倒流进集气瓶中,液面上升到图中A位置.
(1)从上述实验现象可知:氧气约占空气总体积的[1/5],氮气约为[4/5].能够得到该结论主要是运用了氮气的有关性质,请写出其中两点氮气的有关性质:①______、②______.
(2)拉瓦锡通过实验得出的结论是氧气约占空气总体积的[1/5],而某同学在做该实验中,A内气体减少的体积小于1/5,试问导致该实验结果的原因可能有哪些?______、______. 风风随风1年前1
风风随风1年前1 -
 dododzjj 共回答了18个问题
dododzjj 共回答了18个问题 |采纳率94.4%解题思路:利用氧气与红磷反应但氮气不反应分析氮气不支持燃烧的性质,利用水进入的体积测定证明剩余气体难溶于水;实验测定值偏小从试验原理分析,实验中利用氧气被消耗大气压降低进行测定.用红磷燃烧测定空气中氧气的体积分数,红磷燃烧消耗氧气但氮气不与红磷反应,故(1)答案:氮气不能支持燃烧、难溶于水
(2)装置漏气装置内氧气被消耗但又有气体进入装置所以相当于还有氧气没被消耗故结果偏小;红磷不足氧气未被全部消耗,故结果偏小;未等冷却就打开止水夹,也相当于氧气未全部被消耗;故答案:装置漏气、红磷不够、未等冷却就打开止水夹等合理即可.点评:
本题考点: 测定空气里氧气含量的探究;实验数据处理或者误差分析的探究;化学性质与物理性质的差别及应用.
考点点评: 本题开放性的考查了空气中氧气含量的测定,有利于培养学生分析总结能力和实验探究能力.1年前查看全部
- 红磷燃烧过程中打开弹簧夹,则进入瓶里的水会大于5分之一
红磷燃烧过程中打开弹簧夹,则进入瓶里的水会大于5分之一
这是为什么啊 Rekcuf1年前5
Rekcuf1年前5 -
 agv54h 共回答了20个问题
agv54h 共回答了20个问题 |采纳率85%因为O2已经全部和P反应,而O2大约占空气中的21%,瓶内的气压只有当空间缩小21%时才能与外界大气压平衡,所以水会进入,占据瓶内21%的体积.不过这是理论上的,实际上应该在1/5左右才对,毕竟有一些水在导管中进不来,当然,空气中其他一些成分也会和P微量反应,如果单纯是考试,那么就忽略其他微小因素,就是21%体积.1年前查看全部
- 右图是实验室制备二氧化碳的装置图.该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应,关闭弹簧夹后,盐酸被反应产生的
右图是实验室制备二氧化碳的装置图.该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应,关闭弹簧夹后,盐酸被反应产生的二氧化碳气体压回长颈漏斗,与大理石分离,停止反应.用该装置制备二氧化碳可起到节约药品和取用方便的效果.下列装置中与图示装置具有相同效果的是()

 哗啦11621年前3
哗啦11621年前3 -
 lyx东边日出 共回答了18个问题
lyx东边日出 共回答了18个问题 |采纳率77.8%高中的题吧,我上高中时做了好多
选择启普发生器
其实这就是简易启普发生器,以后碰到好多这种题1年前查看全部
- (2010•通州区二模)为测定空气中氧气与氮气的体积比,某同学设计了如图所示的装置进行实验.具体操作是:先关闭弹簧夹;再
 (2010•通州区二模)为测定空气中氧气与氮气的体积比,某同学设计了如图所示的装置进行实验.具体操作是:先关闭弹簧夹;再将螺旋状的铜丝在酒精灯上灼烧后,迅速插入大试管接触试管底部的白磷(过量);然后立即塞紧橡胶塞.他观察到大试管中产生大量的白烟.请你帮他解答下列问题:
(2010•通州区二模)为测定空气中氧气与氮气的体积比,某同学设计了如图所示的装置进行实验.具体操作是:先关闭弹簧夹;再将螺旋状的铜丝在酒精灯上灼烧后,迅速插入大试管接触试管底部的白磷(过量);然后立即塞紧橡胶塞.他观察到大试管中产生大量的白烟.请你帮他解答下列问题:
(1)写出白磷燃烧的化学方程式4P+5O2
2P2O5点燃 .4P+5O2.
2P2O5点燃 .
(2)待试管冷却后打开弹簧夹,此时可观察到的现象为水倒流入试管内,约占试管容积的[1/5]水倒流入试管内,约占试管容积的[1/5],产生该现象的原因是______.
(3)如果装置气密性不好,测出氧气与氮气的体积比将______(填偏大、偏小、不变). 最后的尘埃1年前1
最后的尘埃1年前1 -
 高加索的雪风 共回答了18个问题
高加索的雪风 共回答了18个问题 |采纳率94.4%解题思路:(1)默写白磷燃烧的化学方程式;
(2)根据白磷燃烧生成白色固体五氧化二磷而使试管内气体体积减小,结合空气中氧气含量分析实验中出现的现象,并利用对压强的认识解释出现该现象的原因;
(3)分析装置气密性不好在冷却过程中可能出现的意外,判断该意外情况对实验测出氧气与氮气的体积比的影响.(1)白磷在空气中燃烧,与空气中氧气反应生成五氧化二磷,反应的化学方程式为4P+5O2
点燃
.
2P2O5;
(2)白磷燃烧消耗氧气,待试管冷却后,由于占空气体积[1/5]的氧气被完全反应,管内气体体积减小,使试管内压强减小的缘故,打开弹簧夹,水倒流入试管内,填补原来氧气所占体积,因此进入的水的体积约占试管容积的[1/5];
(3)如果装置气密性不好,在进行冷却过程中,外界空气进入试管,而导致进入水的体积偏小,则测出氧气与氮气的体积比偏小;
故答案为:
(1)4P+5O2
点燃
.
2P2O5
(2)水倒流入试管内,约占试管容积的[1/5];白磷燃烧消耗氧气,使试管内压强减小的缘故
(3)偏小点评:
本题考点: 测定空气里氧气含量的探究;实验数据处理或者误差分析的探究;书写化学方程式、文字表达式、电离方程式.
考点点评: 利用可燃物耗尽空气中氧气,测量所剩余气体的体积而得到空气中氧气的体积分数,实验中要求可燃物燃烧不能产生新的气体.1年前查看全部
- 某班同学如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹
某班同学如图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的[1/5],乙同学的广口瓶内水面上升明显大于瓶内空气体积的[1/5].
下列对这两种现象解释合理的是( )
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗完
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出.
 A. 只有①③
A. 只有①③
B. 只有②④
C. 只有①②③
D. ①②③④ xieq09081年前1
xieq09081年前1 -
 makoto320 共回答了25个问题
makoto320 共回答了25个问题 |采纳率76%解题思路:根据红磷测定空气里氧气含量的实验原理、操作步骤、注意事项进行
1、造成测得氧气的体积分数小于五分之一的因素可以从以下四个方面考虑:
(1)、装置是否漏气;(2)、红磷的用量是否充足;(3)、瓶内的氧气是否耗尽;(4)、装置是否冷却到室温.
2、造成测得氧气的体积分数大于五分之一的因素可以从以下两各方面考虑:(1)、止水夹有没有夹紧;(2)、燃烧匙伸入是否过慢.①实验中所取红磷的量不足时,会导致装置内氧气不能全部消耗,因此使测得氧气的体积分数会小于五分之一,正确.
②实验装置若漏气,会使空气进入集气瓶内,因此测得氧气的体积分数小于五分之一,正确;
③实验前若没有将弹簧夹夹紧,会导致实验中装置内的气体受热膨胀而逸出,因此测得氧气的体积分数会大于五分之一,正确;
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出,因此测定氧气体积分数增大,正确.
故选D点评:
本题考点: 空气组成的测定.
考点点评: 本题主要考查用红磷测定空气里氧气含量的实验原理、操作步骤、实验现象、实验结论和注意事项等,解答本题可以运用排除选择法,即分析每一选项导致的后果,从而得出正确答案.1年前查看全部
- 用如下图所示的装置制取氢气,在多孔塑料板上放锌粒,稀H 2 SO 4 由A 中加入,若打开弹簧夹,酸液由A 中流下与锌粒
用如下图所示的装置制取氢气,在多孔塑料板上放锌粒,稀H 2 SO 4 由A 中加入,若打开弹簧夹,酸液由A 中流下与锌粒接触即发生反应,产生的氢气由支管导出,试完成下列问题: 
(1) 仪器A 的名称是_________ 。
(2) 检查此装置的气密性时,关闭弹簧夹,从仪器A 处注入适量的___________ 形成液封后,若看到仪器A 内___________ ,则表明装置气密性良好。
(3) 若关闭弹簧夹,容器内继续反应产生的氢气会使容器内___________ ,将酸液压回仪器A 中,使酸液与锌粒___________ ,反应即自行停止。
(4) 若氢气发生装置气密性良好,该同学用排水法收集一试管氢气,经检验不纯,你认为可能的原因是__________________________________________________________ 。
(5) 若在塑料隔板上放小块大理石,A 中放稀HCl ,__________( 填“能”或“否”) 用弹簧夹控制CO 2 的发生和停止。 爱糊基地1年前1
爱糊基地1年前1 -
 爱蓝小麦猪 共回答了24个问题
爱蓝小麦猪 共回答了24个问题 |采纳率83.3%(1)长颈漏斗
(2)水;液面不变
(3)压强增大;脱离接触
(4)开始冒气泡就收集,氢气中混有了原试管中的空气
(5)能1年前查看全部
- c、d分别是橡胶管上的弹簧夹.c、d分别是橡胶管上的弹簧夹,请你设计一个实验来检验该装置的气密性.简叙你的操作顺序,观察
c、d分别是橡胶管上的弹簧夹.
c、d分别是橡胶管上的弹簧夹,请你设计一个实验来检验该装置的气密性.简叙你的操作顺序,观察及相应结论.
本题还有一图,没法打出来,故只能让各位想象了.
图:一个瓶子,有瓶塞,a b两个橡胶管分别从瓶塞插入瓶内(a长,b短),c d分别是橡胶管上的弹簧夹.
另外,dnf里鬼泣这个职业怎么样?都说前期很难练!
暗黑雷鸣废墟这个图老怪长什么样?最好发个图过来!
光属性,暗属性这些属性都是干什么的? 金斯沃1年前3
金斯沃1年前3 -
 shuiling200319 共回答了25个问题
shuiling200319 共回答了25个问题 |采纳率92%1、把dnf里面的鬼泣塞入瓶塞中,他不检验出气密性,则不让她出来.
2、雷鸣废墟的老怪就像两个橡胶管支撑的酒精灯.
3、光属性就是酒精喷灯,暗属性就是用灯帽盖灭酒精灯1年前查看全部
- 测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中
测定空气成分的方法很多,如图1所示的是用红磷在空气中燃烧的测定方法.待红磷熄灭并冷却后,打开弹簧夹,发现水被吸入集气瓶中,并且进入集气瓶中水的体积约为集气瓶总容积的[1/5].请回答下列问题:

(1)集气瓶中剩余的气体主要是______.
(2)实验完毕,若进入集气瓶中水的体积不到总容积的[1/5],你认为导致这一结果的原因可能是______.
(3)某同学对实验进行反思后,提出了改进方法(如图2所示),你认为改进后的优点是______. leiwenliang1年前1
leiwenliang1年前1 -
 低调害虫 共回答了12个问题
低调害虫 共回答了12个问题 |采纳率83.3%解题思路:本题中空气中氧气的含量,是用红磷测定的,保证该实验成功的关键是:①装置的气密性要好;②红磷要足量;③必须冷却到室温再读数;④做实验要迅速等.做本实验时,要注意把空气中的氧气充分消耗掉,而又不能加入新的气体.改进后的装置的优点是:不用在瓶外点燃红磷.(1)集气瓶中剩余的气体主要是氮气,因为氮气占空气体积的78%.
(2)若进入集气瓶中水的体积不到总容积的[1/5],导致这一结果的原因可能是,红磷过少,氧气没有耗尽;装置漏气、未冷却到室温就打开止水夹等.
(3)由于在燃烧过程中释放出大量的热,导致气体的体积会膨胀,所以原有装置会在插入燃烧匙的过程中有气体逸出,所以改进装置就克服了这一点.故改进后装置的优点是:不用在瓶外点燃红磷,使测量不准确.
故答案为:(1)氮气.
(2)红磷过少、点燃红磷后,未迅速插入橡胶塞、装置漏气、
未冷却到室温就打开止水夹、红磷中含有燃烧时产生不溶于水气体的杂质等
(3)不用在瓶外点燃红磷,不会因插入不迅速而发生瓶内外气体交换,使测量不准确.点评:
本题考点: 空气组成的测定.
考点点评: 本考点考查了空气中氧气含量的探究,选择药品时要注意:空气中的氧气要充分消耗掉,而又不能加入新的气体.因此应该考虑用红磷、白磷、铜丝等,他们与氧气反应生成物是固体,几乎不占空间.本考点主要出现在填空题和实验题中.1年前查看全部
- 红磷燃烧完毕 冷却室温后打开弹簧夹 从而使集气瓶内气体增多还是少 集气瓶内气体压强大于小于还是等于
 qianzhiheyao11年前6
qianzhiheyao11年前6 -
 坏坏拽拽 共回答了13个问题
坏坏拽拽 共回答了13个问题 |采纳率92.3%集气瓶内气体.会变么
进来的是水啊 气体怎么会变呢
气体压强在打开弹簧夹之前是小于大气压强.
打开之后气压开始变大直到等于大气压强(理论上要减去水的压强差不过无所谓啦啊哈哈.)1年前查看全部
- 高中化学,此题中,为什么打开弹簧夹,干燥管中加碱石灰,再通入二氧化氮,充满二氧化氮,就可以排尽空气?
 yanpeng36691年前1
yanpeng36691年前1 -
 海之-2000 共回答了23个问题
海之-2000 共回答了23个问题 |采纳率82.6%二氧化氮把里面的空气“挤”出来了,所以先通入二氧化氮,过一会儿在加热1年前查看全部
- 有如图实验装置,其中a、b、c为弹簧夹.
 有如图实验装置,其中a、b、c为弹簧夹.
有如图实验装置,其中a、b、c为弹簧夹.
(1)如果开启a和c,关闭b,则I中反应的离子方程式为______.
(2)如果将I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,过一会儿观察,可以看到II里浸入水中的导管口有气泡冒出,导管内气体呈______色,液面上气体为______色.
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭______(填a或b,下同),开启______和c,使产生的CO2气体排尽II里的空气,再关闭______打开______.
(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.则NO为______mol.原硝酸溶液的浓度为______mol•L-1. 蒲公英种子1年前1
蒲公英种子1年前1 -
 dongfeng369 共回答了21个问题
dongfeng369 共回答了21个问题 |采纳率90.5%解题思路:(1)开启a和c,关闭b,装置中压强减小,长颈漏斗中硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜一氧化氮和水;
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;
(3)始终保持无色,装置Ⅱ中不能含有空气,需要Ⅲ反应生成二氧化碳把装置Ⅱ中的空气赶净,生成的二氧化氮与水反应生成无色气体;
(4)根据化学方程式计算,可以利用氧化还原反应的电子守恒列式计算.(1)开启a和c,关闭b,装置中压强减小,长颈漏斗中硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜一氧化氮和水;反应的化学方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)I管中的稀硝酸换成浓硝酸,开启a和c,关闭b,装置中压强减小,长颈漏斗中浓硝酸液体流下浸没铜后发生氧化还原反应生成硝酸铜二氧化氮和水,二氧化氮和水反应生成一氧化氮;导管内气体呈红棕色,液面上气体是无色,故答案为:红棕;无;
(3)在问题(1)的实验中,要使II里的气体始终保持无色,应先关闭a,开启b和c,使产生的CO2气体排尽II里的空气,再关闭 b打开a,二氧化碳环境中,一氧化氮不再反应,
故答案为:a;b;b;a;
(4)若将32g铜加入盛有150mL一定浓度硝酸的I中使之恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L物质的量为0.5mol;依据氧化还原反应的电子守恒计算,设生成NO物质的量为x,则NO2物质的量为0.5mol-x;失电子的铜物质的量为0.5mol,Cu~Cu2+~2e-;失电子总数为1mol;得电子的是硝酸分别为:
HNO3~NO~3e-;
x 3x
NO3~NO2~e-;
0.5-x 0.5-x
3x+0.5-x=1
x=0.25mol
依据氮元素守恒得到,原硝酸溶液中溶质物质的量=0.25 mol+(0.5-0.25)+0.5×2=1.5mol;原硝酸浓度=[1.5mol/0.15L]=10mol/L,
故答案为:0.25;10.点评:
本题考点: 硝酸的化学性质.
考点点评: 本题考查了硝酸性质的应用,实验装置的反应原理的应用分析,铜和稀硝酸、浓硝酸反应产物的性质判断和应用,氧化还原反应的电子守恒的计算应用,难度中等.1年前查看全部
- (2005•闸北区一模)在“研究杠杆平衡条件”的实验中,实验器材有支架、弹簧夹、杠杆、钩码和______.实验时,先要调
(2005•闸北区一模)在“研究杠杆平衡条件”的实验中,实验器材有支架、弹簧夹、杠杆、钩码和______.实验时,先要调节______,使杠杆在水平位置平衡.实验中,小明和小吴先做了第一次实验,方法是:先确定动力F1=2.0牛,动力臂L1=0.2米,阻力F2=4.0牛,此时小吴认为L2的位置应通过公式F1L1=F2L2计算得到,而小明认为L2的位置应通过移动另一组钩码,使杠杆在水平位置平衡时,从杠杆上读出.你认为______的想法是正确的.此时______(选填“能”或“不能”)调节平衡螺母,使杠杆在水平位置平衡.
 米找虫1年前1
米找虫1年前1 -
 简单简单爱 共回答了28个问题
简单简单爱 共回答了28个问题 |采纳率96.4%解题思路:(1)要研究杠杆平衡的条件,我们要测力与力臂的关系,因此用到测量工具是弹簧测力计和刻度尺;
(2)为了避免杠杆重力对杠杆平衡产生的影响和便于测量力臂,实验前,应首先进行杠杆平衡调节.但实验过程中,螺母再调节会改变杠杆重心的位置,使杠杆重力对杠杆平衡又产生影响,因此不能再调节平衡螺母.
(3)在此实验中我们的实验目的是探究杠杆平衡的条件,则杠杆的几个要素(动力、动力臂、阻力、阻力臂)是需要实验测量得出的,然后寻找杠杆平衡普遍规律,不能直接用F1×L1=F2×L2进行判断.要研究杠杆平衡的条件,我们要测力的大小,所以实验器材还有弹簧测力计.
实验时,为了避免杠杆重力对杠杆平衡产生的影响和便于测量力臂,实验前,应首先调节平衡螺母,使杠杆在水平位置平衡;但实验过程中,螺母再调节会改变杠杆重心的位置,使杠杆重力对杠杆平衡又产生影响,因此不能再调节平衡螺母.
小明和小吴的第一次实验,小吴是通过公式F1L1=F2L2计算得到L2的位置,而小明通过移动另一组钩码,使杠杆在水平位置平衡时,从杠杆上读出L2的位置,可见:小明是实验测量的,符合实验的原则,是正确的.
故答案为:弹簧测力计、平衡螺母、小明、不能.点评:
本题考点: 探究杠杆的平衡条件实验.
考点点评: 本题考查杠杆的重心变动通过螺母的调节来实现的,使它在支点上,就不会对杠杆平衡产生影响,一定注意的是实验过程中螺母的移动会改变杠杆重心的位置,因此一定不能再调节平衡螺母.
小明和小吴的第一次实验方案不同,就是一个是计算结果,一个是实验结果,他们方案的正确与否是要根据实验的要求来判断.1年前查看全部
- 等体积的甲乙两密闭集气瓶内充满了空气,燃烧匙内分别盛有过量的红磷和硫,点燃使其充分反应后,冷却至室温,打开弹簧夹,出现的
等体积的甲乙两密闭集气瓶内充满了空气,燃烧匙内分别盛有过量的红磷和硫,点燃使其充分反应后,冷却至室温,打开弹簧夹,出现的现象是(甲乙两瓶均有水流入)
图就是验证氧气占空气中的五分之一的那个图,只不过两个瓶子连在一条导管,接在同一杯水中 木樨花1年前1
木樨花1年前1 -
 threest6302 共回答了13个问题
threest6302 共回答了13个问题 |采纳率92.3%因为红磷燃烧后会生成固态的五氧化二磷,消耗了瓶内氧气,使得那个集气瓶中的气压减小,硫燃烧消耗多大体积的氧气就生成多大体积的二氧化硫,但因为两个集气瓶是相通的,所以两个集气瓶中的气体压强都减小,所以水会进入两个集气瓶中.1年前查看全部
- 首先,在集气瓶里加入少量的水,并做上记号,用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.观察红磷燃
首先,在集气瓶里加入少量的水,并做上记号,用弹簧夹夹紧乳胶管.点燃燃烧匙内的红磷后,立即伸入瓶中并把塞子塞紧.观察红磷燃烧的现象.待红磷熄灭并冷却后,打开弹簧夹,观察实验现象及水面的变化情况.
为什么要加入少量的水? 饿昏的小猪1年前5
饿昏的小猪1年前5 -
 名叫三儿的天使 共回答了17个问题
名叫三儿的天使 共回答了17个问题 |采纳率88.2%固体物质在集气瓶中燃烧,瓶底加细沙或水是为了防止产生的熔融物落到瓶底使集气瓶炸裂 ,另外,磷燃烧生成P2O5小颗粒,可与水蒸气反应生成剧毒的偏磷酸,所以用水吸收P2O51年前查看全部
- 空气中氧气含量的测定请回答乙同学的原因,越具体越好,越通俗越好某班同学用右图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶
空气中氧气含量的测定
请回答乙同学的原因,越具体越好,越通俗越好
某班同学用右图装置测定空气里氧气的含量.先用弹簧夹夹住乳胶管.点燃红磷,伸入瓶中并塞上瓶塞.待红磷熄灭并冷却后,打开弹簧夹,观察广口瓶内水面变化情况.实验完毕,甲同学的广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学的广口瓶内水面上升明显大于瓶内空气体积的1/5.下列对这两种现象解释合理的是
①甲同学可能使用红磷的量不足,瓶内氧气没有消耗完
②甲同学可能未塞紧瓶塞,红磷熄灭冷却时外界空气进入瓶内
③乙同学可能没夹紧弹簧夹,红磷燃烧时瓶内部分空气受热从导管逸出
④乙同学可能插入燃烧匙太慢,塞紧瓶塞之前,瓶内部分空气受热逸出
A.只有①③ B.只有②④ C.只有①②③ D.①②③④ 清风慢雪1年前1
清风慢雪1年前1 -
 000955 共回答了19个问题
000955 共回答了19个问题 |采纳率94.7%4是正确的,气体受热膨胀,在红磷放进瓶中前已经有一部分空气因受热跑出瓶子,可以假设说,现在的瓶中只有原来空气的80%(20%受热跑出).
放入红磷后,有消耗了其中的氧气,所以,待冷却到室温后,进入的水不光消耗掉的氧气体积,还要加上最初跑出的空气体积.也就是说,水面上升远大于1/51年前查看全部
- (1)开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:____________,B中可以观察到的现象是_____
 西西1231年前1
西西1231年前1 -
 ajzhangbin 共回答了20个问题
ajzhangbin 共回答了20个问题 |采纳率85%Fe+2H+=Fe2++H2,产生气泡,溶液进入c.1年前查看全部
- (2001•上海)在“研究杠杆平衡条件“的实验中,所用的器材有带刻度的杠杆、铁架台、钩码、线(弹簧夹)和______等,
 (2001•上海)在“研究杠杆平衡条件“的实验中,所用的器材有带刻度的杠杆、铁架台、钩码、线(弹簧夹)和______等,在如图中,每个钩码的质量均相同,杠杆己平衡,如在支点左侧的钩码下加挂一个相同的钩码,支点右侧的钩码一起向右移一格,则这时杠杆______(填“能“或“不能“)平衡.
(2001•上海)在“研究杠杆平衡条件“的实验中,所用的器材有带刻度的杠杆、铁架台、钩码、线(弹簧夹)和______等,在如图中,每个钩码的质量均相同,杠杆己平衡,如在支点左侧的钩码下加挂一个相同的钩码,支点右侧的钩码一起向右移一格,则这时杠杆______(填“能“或“不能“)平衡.  _简单爱_1年前1
_简单爱_1年前1 -
 千百帆 共回答了17个问题
千百帆 共回答了17个问题 |采纳率100%解题思路:研究杠杆的平衡条件,要测量力的大小,因此,弹簧测力计是不可缺少的.判断杠杆是否平衡,要依据杠杆的平衡条件,即“动力×动力臂=阻力×阻力臂”来进行计算.弹簧测力计用来在实验中测量钩码的重,或直接拉杠杆测力的大小,因此是必备的.读图可知,在支点左侧加挂一个钩码,左侧为:“在三格处挂三个钩码”,支点右侧的钩码一起向右移一格,此时,右侧也为:“在三格处挂三个钩码”.两侧的力和力臂都相等,根据杠杆的平衡条件,这时杠杆仍能平衡.
故答案为:弹簧测力计,能.点评:
本题考点: 探究杠杆的平衡条件实验.
考点点评: 在需要测量力的大小的实验中,弹簧测力计往往是首选的测量工具.杠杆的平衡条件是我们判断杠杆是否平衡的唯一依据,因此一定要熟练掌握.1年前查看全部
- 为什么用红磷燃烧测定空气中氧气含量时,没夹弹簧夹,进入集气瓶的体积会大于1/5?为什么为什么啊.
 回轮月1年前1
回轮月1年前1 -
 vivian_zlt 共回答了11个问题
vivian_zlt 共回答了11个问题 |采纳率100%红磷燃烧放热,集气瓶内空气膨胀通过导管排出,待集气瓶内冷却后,内部形成低压,水倒吸入集气瓶,进入集气瓶的体积会大于1/5.1年前查看全部
- (1)开始实验时弹簧夹e是打开的,A中发生反应的离子方程式为:____________,B中可以观察到的现象是_____
 dczpg1年前1
dczpg1年前1 -
 海豚do 共回答了14个问题
海豚do 共回答了14个问题 |采纳率92.9%A中Fe+2H+==Fe2+ +H2↑ B中有气泡产生.1年前查看全部
- 如图是用木炭还原氧化铜的装置,请回答下列问题,王强同学认为该装置还可以改进,即在C处接一根橡胶管,实验结束后用弹簧夹夹住
如图是用木炭还原氧化铜的装置,请回答下列问题,王强同学认为该装置还可以改进,即在C处接一根橡胶管,实验结束后用弹簧夹夹住橡胶管,这样做的目的是① ,②
 XINGTINGZHILIAN1年前2
XINGTINGZHILIAN1年前2 -
 心是海 共回答了20个问题
心是海 共回答了20个问题 |采纳率85%防止澄清石灰水倒流,炸裂试管.
防止空气进入试管,使铜再次氧化.1年前查看全部
- 在做镁条燃烧实验时,用于夹持镁条的仪器是( ) A.弹簧夹 B.坩埚钳 C.铁夹 D.试管夹
 零落瓢城1年前1
零落瓢城1年前1 -
 langlee 共回答了22个问题
langlee 共回答了22个问题 |采纳率81.8%A、弹簧夹的作用主要是用来夹持橡皮管,如验证氧气的实验中用来夹住导气管,保持装置的气密性;
B、坩埚钳一般用来夹持坩埚加热,或往热源中取、放坩埚,在初中化学中也常用作给固体物质加热的夹持工具,如实验室加热铜、高温煅烧石灰石、镁条燃烧等实验中;
C、铁夹一般是配合铁架台使用,用来夹持试管等反应装置;
D、试管夹的主要作用是用来夹持试管.
故选B.1年前查看全部
- 拉瓦锡实验,测得水未满容器体积的1/5,有这么一个原因:未等冷却后打开弹簧夹,这是为什么?
拉瓦锡实验,测得水未满容器体积的1/5,有这么一个原因:未等冷却后打开弹簧夹,这是为什么?
刚才还没说完,我一直很困惑,为什么要冷却,实验中冷却和安装弹簧夹的目的是什么,我觉得没必要呀,要详细说明,好的再加分. robertzhang19781年前5
robertzhang19781年前5 -
 i黑夜里抛媚眼 共回答了17个问题
i黑夜里抛媚眼 共回答了17个问题 |采纳率100%这实验是求氧气占空气的体积分数.我们可以举一下例子:开始是首先记录空气体积(假设是100ML)才开始加热 由于反应时放热(一般用红磷燃烧消耗氧气)未冷却会使容器内压强增大,气体膨胀.剩余气体实际只有80ML却可以测出85ML的体积, 计算的话氧气只有15ML. 如果冷却后测剩余就是80ML那么氧气就是20ML.15的错误结果比正确的20小 不是偏低了吗?
以上是通过取特殊值的办法,数学当中的解题思路也是可以用于化学的,这种方法较理论解释便于理解(简单的说这原理与你们初中物理上的压强有关,具体理论以后高中或者大学老师会讲到的,呵呵虽然没这么简单的问题,实验就是:))
安装弹簧夹就是为了防止上述现象的发生
希望以上讲解对你有用1年前查看全部
大家在问
- 1利用橡皮泥 量筒 水 测牛奶的密度
- 2得到y=cos 2x的图像,将y=sin 2x的图像的图像沿x轴怎么平移啊,
- 3一个慢钟每隔66分钟重合一次,这个钟每昼夜慢多少分钟!
- 4【英语周报上的题、】section b 3a-self check II急!
- 5若规定C十二的相对原子质量为100;并将用C十二规定的其他物理量的值做相应的调整,则下列各项发生变化且为原来值的12\1
- 6关于英语“词性”的详细解说求最基础-最全面的.
- 7中原汉人为避战乱,流离迁徙至闽南山区,为防野兽及匪盗侵扰,便聚族而居,建造了一座座继承完整黄河流域汉族建筑文化传统并综合
- 8小学数学难题(回答了并对我会给你20分)
- 9找一篇《心灵踱步》,讲述生活喜怒哀乐的作文,字数350,记住是13岁孩子的作文,别整爱情.我是小学六级学
- 10初中三年级物理考试中倒数第二题经常出的 就是根据一些材料表达出物体 液体
- 11初1语文第1课在山那边的意时
- 12一个惯性系中不可能通过物理实验判断惯性系的运动状态
- 13下列关于人体细胞内水的叙述正确的是
- 14功率P=Fv使用范围P=Fv是矢量式么?算的时候是要把v分解为沿力方向的分速度吧?
- 15朝花夕拾中的五猖会的五猖是什么意思?
