在桶中盛水,水中有一块冰,外界给的热量恰好能使冰全部熔解,则( )
 gekudsx2022-10-04 11:39:541条回答
gekudsx2022-10-04 11:39:541条回答A. 由于冰的熔解水温下降
B. 由于冰的熔解水温升高
C. 水的温度不随冰的熔解而改变
D. 由于冰的熔解水面将升高

已提交,审核后显示!提交回复
共1条回复
 成都王子 共回答了13个问题
成都王子 共回答了13个问题 |采纳率69.2%- 解题思路:①发生热传递的条件是存在温度差;
②冰水混合物的温度是0℃.在桶中盛水,水中有一块冰,外界给的热量恰好能使冰全部熔解,由于冰熔化过程吸收热量,温度保持不变,所以水的温度不随冰的熔解而改变.
故选C.点评:
本题考点: 熔化与熔化吸热特点.
考点点评: 冰水混合物的温度始终是0℃,只有冰全部熔化成水或水全部结冰后,温度才发生变化. - 1年前
相关推荐
- 如图所示,甲、乙两个容器都是圆柱形的,但乙容器比较粗.两容器中盛的都是水,放在水平桌面上时液面一样高.那么下列说法中正确
 如图所示,甲、乙两个容器都是圆柱形的,但乙容器比较粗.两容器中盛的都是水,放在水平桌面上时液面一样高.那么下列说法中正确的是( )
如图所示,甲、乙两个容器都是圆柱形的,但乙容器比较粗.两容器中盛的都是水,放在水平桌面上时液面一样高.那么下列说法中正确的是( )
A.甲容器中的水少些,所以水对甲容器底的压强小些
B.乙容器底面积大些,所以水对乙容器底的压强小些
C.水对两容器底的压力不相等,压强相等
D.无法判断 pblboy1年前1
pblboy1年前1 -
 zly168 共回答了23个问题
zly168 共回答了23个问题 |采纳率95.7%解题思路:甲、乙两个容器都是圆柱形的,水对容器底的压力等于水重;
两容器放在水平桌面上时液面一样高,由此可使水深相同,根据液体压强公式可知水对容器底压强的大小关系,据此判断.由图可知V甲<V乙,则G甲<G乙,
∵甲、乙两个容器都是圆柱形的,
∴水对容器底的压力:
F=ps=ρghs=ρVg=mg=G,
即:水对容器底的压力等于水重;
∴甲容器中水对容器底的压力比乙容器中水对容器底的压力小;
由题知,两容器放在水平桌面上时,液面一样高,
∴两容器内水深h相同,
∵p=ρgh,装的都是水,
∴水对容器底的压强相同.
故选C.点评:
本题考点: 压强大小比较.
考点点评: 本题考查了学生对压强定义式和液体压强公式的掌握和运用,对于方形或圆柱形的容器,对容器底的压力F=G.1年前查看全部
- 在一个长30厘米,宽30厘米,高20厘米的长方体玻璃容器中盛了一些水,现将一块长15厘米,宽10厘米,高不超过20厘米的
在一个长30厘米,宽30厘米,高20厘米的长方体玻璃容器中盛了一些水,现将一块长15厘米,宽10厘米,高不超过20厘米的长方体钢材放入水底,有水溢出;再将钢材慢慢取出,水面下降3厘米.求钢材的高是多少?
 zengzhibin1年前5
zengzhibin1年前5 -
 80年代的爱情 共回答了19个问题
80年代的爱情 共回答了19个问题 |采纳率78.9%水面下降部分的水的体积就相当于取出来物体的体积,所以钢材的体积为30×30×3=2700立方厘米,求高用体积除以底面积.所以高为2700÷15÷10=18厘米1年前查看全部
- 在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯
在一支25mL的酸式滴定管中盛入0.1mol/L HCl溶液,其液面恰好在5mL的刻度处,若把滴定管中的溶液全部放入烧杯中,然后以0.1mol/L NaOH溶液进行滴定,则所需NaOH溶液的体积( )
A. 大于20mL
B. 小于20mL
C. 等于20mL
D. 等于5mL 叶落秋无声20071年前1
叶落秋无声20071年前1 -
 lvbfb 共回答了20个问题
lvbfb 共回答了20个问题 |采纳率95%解题思路:滴定管的刻度从上到下,25mL刻度以下还有没有刻度的一部分,若把到5mL刻度位置的液体放出,其液体体积大于(25-5)mL.滴定管的刻度从上到下,25mL刻度以下还有没有刻度的一部分,若把到5mL刻度位置的液体放出,其液体体积大于(25-5)mL,消耗0.lmol/LNaOH溶液的体积大于20 mL.
故选A.点评:
本题考点: 中和滴定.
考点点评: 本题考查滴定管的使用,难度不大,注意滴定管的刻度从上到下,最大刻度以下还有没有刻度的一部分.1年前查看全部
- 实验室用下图所示装置制取乙烯。 (1)①仪器A的名称________;②依器B中盛装的试剂是________。
实验室用下图所示装置制取乙烯。 
(1)①仪器A的名称________;②依器B中盛装的试剂是________。
(2)仪器B中盛装的试剂是________。
(3)装入药品前,应检查装置的气密性。检查该套装置气密性的操作是________________。
(4)若在导管口点燃乙稀,观察到的现象是________________。 琦风1年前1
琦风1年前1 -
 绝缘极限 共回答了20个问题
绝缘极限 共回答了20个问题 |采纳率80%1年前查看全部
- 质量为200g的铝壶中盛一定质量的水后加热,当壶中的水吸收5.04×105J的热量后,水温由20℃升高到80℃.[水的比
质量为200g的铝壶中盛一定质量的水后加热,当壶中的水吸收5.04×105J的热量后,水温由20℃升高到80℃.[水的比热容是4.2×103J/(kg℃),铝的比热容是0.88×103J/(kg℃),煤的热值为3×107J/(kg℃)]求:(1)壶中所装水的质量是多少kg?(2)这个过程中铝壶吸收了多少热量?(3)若烧水时用煤做燃料,煤炉的效率为20%,这时需燃烧多少kg的煤?求精准答案,
 hhxxttss1年前2
hhxxttss1年前2 -
 牧落血 共回答了17个问题
牧落血 共回答了17个问题 |采纳率94.1%1、
Q吸=c水m水△t水
得:m水=Q吸/c水△t水=5.04×10^5/4200×(80-20)=2kg
2、Q铝=c铝m铝△t铝,m铝=200g=0.2kg
得:Q铝=880×0.2×60=10560J
3、
η=Q总/Q放,且:Q放=mq
即:η=(Q吸+Q铝)/mq
得:m=(Q吸+Q铝)/qη=(5.04×10^5+10560)/20%×3×10^7=0.08576kg
不明追问.1年前查看全部
- 溴乙烷的沸点是38.4℃,密度是1.46g/cm 3 .如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去),其中G中盛
溴乙烷的沸点是38.4℃,密度是1.46g/cm 3 .如图为实验室制备溴乙烷的装置示意图(夹持仪器已略去),其中G中盛蒸馏水.实验时选用的药品有:溴化钠、95%乙醇、浓H 2 SO 4 .制备过程中边反应边蒸馏,蒸出的溴乙烷用水下收集法获得.
可能发生的副反应:H 2 SO 4 (浓)+2HBr→Br 2 +SO 2 +2H 2 O
(1)为防止副反应的发生,向圆底烧瓶内加入药品时,还需适量的______.
(2)反应采用水浴加热的目的是:①反应容器受热均匀,②______.温度计显示的温度最好控制在______℃左右;
(3)装置B的作用是:①使溴乙烷蒸馏出,②______;
(4)采取边反应边蒸馏的操作方法可以提高乙醇的转化率,主要原因是______;
(5)溴乙烷可用水下收集法的依据是______、______,接液管口恰好浸入到液面的目的是______;
(6)粗产品用水洗涤后有机层仍呈红棕色,欲除去该杂质,加入的最好试剂为______(填编号)
A.碘化钾溶液B.亚硫酸氢钠溶液C.氢氧化钠溶液.
 cfanit1年前1
cfanit1年前1 -
 DoNna08 共回答了15个问题
DoNna08 共回答了15个问题 |采纳率100%(1)浓硫酸具有强氧化性,易与NaBr发生氧化还原反应,可能发生的副反应有:2HBr+H 2 SO 4 (浓) △ . Br 2 +SO 2 ↑+2H 2 O,为减少副反应发生,可先加...1年前查看全部
- 下列说法正确的是( )A.连通器中液体静止时,各液面一定相平B.连通器中盛水时,各水面一定相平C.连通器中的水静止时,
下列说法正确的是( )
A.连通器中液体静止时,各液面一定相平
B.连通器中盛水时,各水面一定相平
C.连通器中的水静止时,各水面一定相平
D.只要在连通器中装有同种液体,各液面就一定相平 大梦一觉方知醒1年前1
大梦一觉方知醒1年前1 -
 tt傅建华zz 共回答了14个问题
tt傅建华zz 共回答了14个问题 |采纳率100%解题思路:底部相连通,上端开口的容器称为连通器,当其内部装有同一种液体且在液体不流动时,液面总是保持相平的.A、若其内部装的不是同一种液体,即使连通器中液体静止时,各液面不一定相平,故错误;
B、连通器中盛水时,且在水不流动时,各水面一定是相平的,故错误;
C、连通器中装的都是水,且水静止时,各水面一定相平,故正确;
D、连通器中装有同种液体,且液体不流动时,各液面就一定相平,故错误;
故选C.点评:
本题考点: 连通器原理.
考点点评: 知道连通器的定义和特点是解决该题的关键.1年前查看全部
- 一个棱长为10厘米的正方体容器中盛了8厘米深的水,红红把一个小铁球完全浸没在容器里,水满并溢出12.56克,你能求出这小
一个棱长为10厘米的正方体容器中盛了8厘米深的水,红红把一个小铁球完全浸没在容器里,水满并溢出12.56克,你能求出这小球的体积吗?(1m³水重1g)
 一个忠诚的oo1年前1
一个忠诚的oo1年前1 -
 tiger_042 共回答了15个问题
tiger_042 共回答了15个问题 |采纳率93.3%8*8*2-12.56=115.44cm³.1年前查看全部
- 稀释浓硫酸装置中,在锥形瓶中盛浓硫酸,在分液漏斗中装水.打开分液漏斗的活塞,让水滴入锥形瓶
稀释浓硫酸装置中,在锥形瓶中盛浓硫酸,在分液漏斗中装水.打开分液漏斗的活塞,让水滴入锥形瓶
1、你可观察到什么现象?
2、分析产生上述现象的原因? lee19871年前2
lee19871年前2 -
 小林夕 共回答了13个问题
小林夕 共回答了13个问题 |采纳率92.3%水沸腾,硫酸液滴飞溅
原因:由于水的密度比硫酸小,将水加入硫酸中,水会浮在硫酸表面.溶解过程放出大量的热,使水沸腾,硫酸液滴飞溅1年前查看全部
- 两个容器中盛同种相同的质量的液体,哪个容器底受到的压强大?
两个容器中盛同种相同的质量的液体,哪个容器底受到的压强大?
两个圆柱形的容器,一个水位低而且受力面积大,另一个水位高受力面积小.【人教版九年级上册P85 1, 大连061年前2
大连061年前2 -
 希熙yaoyao 共回答了19个问题
希熙yaoyao 共回答了19个问题 |采纳率84.2%P=pgh知液体内部压强与压力,面积无关,只与深度,密度有关,所以深度大的压强大.1年前查看全部
- 如表是三种液体的沸点,如图容器甲中盛水,乙容器盛一定量的某中液体,在一个标准大气压下,若在容器底部继续加热,最终会发现乙
如表是三种液体的沸点,如图容器甲中盛水,乙容器盛一定量的某中液体,在一个标准大气压下,若在容器底部继续加热,最终会发现乙容器内的液体发生沸腾现象,但甲容器中的水还没有沸腾,则乙容器的液体可能是什么液体?你的判断依据是什么?
酒精 78℃ 水 100℃ 食用油 250℃ 
 charlie86z1年前1
charlie86z1年前1 -
 canon950 共回答了26个问题
canon950 共回答了26个问题 |采纳率92.3%答:乙容器内装的可能是酒精.
因为甲容器中装的是水,在一标准大气压下其沸点是100℃,并且在沸腾过程中温度保持不变.酒精的沸点78℃,低于水的沸点,当水沸腾时,酒精沸腾.而油的沸点250℃,水沸腾时达不到油的沸点,所以油不会沸腾.1年前查看全部
- (2008•大庆模拟)有CO2和CO组成的混合气体,为了将他们分开,有同学设计了如图的实验装置.图中烧瓶中盛的是NaOH
 (2008•大庆模拟)有CO2和CO组成的混合气体,为了将他们分开,有同学设计了如图的实验装置.图中烧瓶中盛的是NaOH溶液,分液漏斗中盛的是稀盐酸.
(2008•大庆模拟)有CO2和CO组成的混合气体,为了将他们分开,有同学设计了如图的实验装置.图中烧瓶中盛的是NaOH溶液,分液漏斗中盛的是稀盐酸.
①实验开始时关闭活塞b,让混合气体从导管口进入,所得纯净气体从导管c逸出(假设反应完全进行),此时逸出的气体是______;
②混合气体通入完毕后,再关闭活塞a,打开活塞b,使分液漏斗中的稀盐酸进入广口瓶,这时逸出的气体是______. thisisyujie1年前1
thisisyujie1年前1 -
 sunjc73 共回答了18个问题
sunjc73 共回答了18个问题 |采纳率88.9%解题思路:要分离一氧化碳和二氧化碳的混合物,可以依据物质的性质差异进行,首先将二氧化碳转化生成其他的物质,分离得到一氧化碳,再通过物质间的反应生成二氧化碳.①一氧化碳不能和氢氧化钠溶液反应,关闭活塞b,让混合气体从导管口进入,则二氧化碳能与氢氧化钠反应,一氧化碳从c逸出,所以本题答案为:CO;
②氢氧化钠能与二氧化碳反应生成碳酸钠,关闭活塞a,打开活塞b,则碳酸钠溶液和稀盐酸反应生成二氧化碳气体,从c导管逸出,故填:CO2.点评:
本题考点: 混合物的分离方法;二氧化碳的实验室制法;二氧化碳的化学性质.
考点点评: 本题主要考查混合物的分离方法,关键是熟练掌握物质之间的反应原理,根据物质的性质差异进行.1年前查看全部
- 火箭推进器中盛有强还原剂N2H4(l)和强氧化剂H2O2(l),当它们混合反应时,即产生大量N2(g)和H2O(g),并
火箭推进器中盛有强还原剂N2H4(l)和强氧化剂H2O2(l),当它们混合反应时,即产生大量N2(g)和H2O(g),并放出
火箭推进器中盛有强还原剂N2H4(l)和强氧化剂H2O2(l),当它们混合反应时,即产生大量N2(g)和H2O(g),并放出大量热,已知0.4molN2H4(l)和0.8molH2O2(l)反应生成N2和H2O(g)时,放出256.7kJ热量。
(
已知H2O(l)=H2O(g);△H=+44kJ/mol,则16gN2H4(l)与足量H2O2(l)反应生成N2和H2O(l)时,放出的热量为______________kJ。 柳焚余1年前1
柳焚余1年前1 -
 cjfg 共回答了21个问题
cjfg 共回答了21个问题 |采纳率85.7%N2H4(l)+2H2O2(l)=N2(g)+4H2O(g) △H=-641.63kJ/mol
(641.63=-256.652/0.4)
而4H2O(g)=4H2O(l) △H=-44×4=-176KJ/mol
一加
N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) △H=-817.63kJ/mol
而1molN2H4是 32g,放热是817.63kJ
那么16g就是817.63/2=408.815kJ1年前查看全部
- 在一个2升的容器中盛入2.0mol某气态反应物,2s后该气态物还剩余1.6mol.2s内它的反应速率为( )
在一个2升的容器中盛入2.0mol某气态反应物,2s后该气态物还剩余1.6mol.2s内它的反应速率为( )
A. 0.1 mol/(L•s)
B. 0.2 mol/(L•s)
C. 0.3 mol/(L•s)
D. 0.4 mol/(L•s) 435rtwert1年前1
435rtwert1年前1 -
 the_boy 共回答了22个问题
the_boy 共回答了22个问题 |采纳率90.9%解题思路:结合△v=[△c/△t]计算.2升的容器中盛入2.0mol某气态反应物,2s后该气态物还剩余1.6mol,
△c=[2.0mol−1.6mol/2L]=0.2mol/L,
△v=[△c/△t]=[0.2mol/L/2s]=0.1 mol/(L•s),
故选A.点评:
本题考点: 反应速率的定量表示方法.
考点点评: 本题考查化学反应速率的计算,为基础性习题,把握反应速率的计算公式为解答的关键,侧重计算能力的考查,题目较简单.1年前查看全部
- 用惰性电极电解烧杯中盛装的100ml,含0.2molCuCl2.0.4molMgCl2的溶液,一段时间后
用惰性电极电解烧杯中盛装的100ml,含0.2molCuCl2.0.4molMgCl2的溶液,一段时间后
在阳极上产生标准状况下气体22.4L,则阴极增重:8g sui-pumpkin1年前1
sui-pumpkin1年前1 -
 cxbctp 共回答了21个问题
cxbctp 共回答了21个问题 |采纳率95.2%设阳极失去电子的物质的量为X
溶液中含氯离子的物质的量=2*0.2mol+2*0.4mol=1.2mol
溶液中含铜离子的物质的量=0.2mol
阳极阴离子的放电顺序为Cl^->OH^-
根据题意可知氯离子先放电,然后氢氧根离子放电,
阳极反应:2Cl^- -2e^-=Cl2↑
2 2 22.4
1.2mo X Y
X=1.2mol
Y=13.44L
4OH^--4e^-=2H2O+O2↑
4 22.4
Z 22.4L-13.44L
Z=1.6mol
一共失去电子的物质的量=1.2mol+1.6mol=2.8mol
阴极的放电顺序是Cu^2+>H^+Mg^2+
阴极反应:Cu^2++2e^-=Cu
1 2 64
0.2mol W m
W=0.4mol
m=12.8g
其余电子由H^+得到,H^离子得到电子生成氢气,电极不增重,所以电极增重的质量就是铜的质量.
2H^++2e^-=H2↑1年前查看全部
- 已知Na2CO3的水溶液呈碱性,在一烧杯中盛21.4gNa2CO3和NaCL组成的固体混合物.向其中逐渐加溶质质量分数为
已知Na2CO3的水溶液呈碱性,在一烧杯中盛21.4gNa2CO3和NaCL组成的固体混合物.向其中逐渐加溶质质量分数为百分之十的稀盐酸.放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示,请根据题意回答问题:
(1)当滴加稀盐酸至图中A点时,放出气体的质量为多少克? (2)当滴加稀盐酸至图中B点时,烧杯溶液溶质是什么? (3)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数.

 竺木羽1年前1
竺木羽1年前1 -
 单蓝 共回答了15个问题
单蓝 共回答了15个问题 |采纳率86.7%(1)∵Na2CO3+2HCl==2NaCl+H2O+CO2↑
Mr 2*(1+35.5) 12+2*16
m 73g*10% m(CO2)
∴m(CO2)=73g*10%*(12+2*16)/[ 2*(1+35.5)]=4.4g
(2)NaCl,HCl
(3)∵Na2CO3+2HCl==2NaCl+H2O+CO2↑
Mr 106 73 117
m 10.6g 7.3g 11.7g
mA(NaCl)=21.4-10.6+11.7=22.5g
m总=21.4+73-4.4=90g
NaCl%=22.5/90*100%=25%1年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量.
①写出该反应的热化学方程式______.
②又已知H2O(l)=H2O(g),△H=44kJ•mol-1,则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的是______.
①加入少量固体碳酸钠;②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液;④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液;⑥加热. 美凝1年前1
美凝1年前1 -
 四毛天圣 共回答了16个问题
四毛天圣 共回答了16个问题 |采纳率68.8%解题思路:(1)①反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
②结合上述写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(2)要使氢气的生成速率减慢,但又不影响其总量,则减小氢离子浓度,而不能减小氢离子的物质的量,以此来解答.(1)①反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[256/0.4]kJ=640kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640 kJ•mol-1;
②a、N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
b、H2O(g)=H2O(l)△H=-44KJ/mol;
依据盖斯定律a+b×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817KJ/mol;化学方程式中32g全部反应放热817KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408kJ,
故答案为:408;
(2)①加入少量固体碳酸钠,会和硫酸之间反应,产生二氧化碳,能使使反应速率减慢,会影响产生氢气的总量,故错误;
②加入少量固体醋酸钠,会和硫酸之间反应生成醋酸,醋酸是弱酸,能使使反应速率减慢,不会影响产生氢气的总量,故正确;
③加入适量的硫酸钠溶液,减小氢离子浓度,而不能减小氢离子的物质的量,则反应速率减慢,不影响氢气的总量,故正确;
④加入适量的硝酸钠溶液,相当于溶液中含有硝酸,和金属反应不会产生氢气,所以会影响氢气的总量,故错误;
⑤滴加少量CuSO4溶液,会形成原电池,加快反应速率,故错误;
⑥加热会加快反应速率,故错误;
故选②③.点评:
本题考点: 热化学方程式;化学反应速率的影响因素.
考点点评: 本题考查热化学方程式的书写、化学反应速率的影响因素,为高频考点,把握氢离子浓度、物质的量的变化为解答的关键,注意发生的氧化还原反应是否生成氢气,题目难度不大.1年前查看全部
- (2008•抚州)“嫦蛾一号”发射的火箭推进器中盛有液态肼(X)和双氧水(H2O2),当它们混合反应时放出大量的热,其反
(2008•抚州)“嫦蛾一号”发射的火箭推进器中盛有液态肼(X)和双氧水(H2O2),当它们混合反应时放出大量的热,其反应为:X+2H2O2═N2+4H2O.据此判断该液态肼(X)的化学式是( )
A.N2H2
B.N2H4
C.NH2
D.N2H4O2 xixihahano11年前1
xixihahano11年前1 -
 藤儿sunshine 共回答了24个问题
藤儿sunshine 共回答了24个问题 |采纳率95.8%解题思路:由题意“X+2H2O2═N2+4H2O”,根据化学反应前后原子的种类与数目不发生改变可以推测液态肼(X)的化学式.由反应为:X+2H2O2═N2+4H2O,根据质量守恒定律的元素守恒,可知肼(X)中含有氮元素、氢元素;在根据元素的一种个数反应前后不变,则可以推测液态肼(X)的化学式为N2H4.
故选B.点评:
本题考点: 质量守恒定律及其应用.
考点点评: 本题是运用化学中的基本思想质量守恒思想,根据反应前后元素种类、原子的个数不变,来处理问题.1年前查看全部
- 如图所示,广口瓶中盛有气体X胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间否可见小气球a膨胀鼓起.下
如图所示,广口瓶中盛有气体X胶头滴管中盛有液体Y,若挤压胶头滴管使液体滴入瓶中,振荡,一段时间否可见小气球a膨胀鼓起.下表中的各组物质不出现上述现象的是( ) X Y A CO Ca(OH) 2 B CO 2 NaOH C HCl Ba(OH) 2 D SO 2 NaOH A.A B.B C.C D.D 
 gxsuzuki1年前1
gxsuzuki1年前1 -
 缄默之声 共回答了24个问题
缄默之声 共回答了24个问题 |采纳率95.8%A、一氧化碳不能与氢氧化钙反应,不会出现小气球a膨胀鼓起来的现象,故此选项错误.
B、二氧化碳能与氢氧化钠反应生成碳酸钠与水,能使瓶内气压减小,小气球a膨胀鼓起来,故此选项正确.
C、氯化氢气体与氢氧化钡溶液发生中和反应,能使瓶内气压减小,小气球a膨胀鼓起来,故此选项正确.
D、二氧化硫与氢氧化钠反应生成亚硫酸钠与水,能能使瓶内气压减小,小气球a膨胀鼓起来,故此选项正确.
故选A.1年前查看全部
- 铁与水蒸气反应干燥管中盛装的物质是什么,作用是什么,
铁与水蒸气反应干燥管中盛装的物质是什么,作用是什么,
碱石灰是什么 jeannezjw1年前0
jeannezjw1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,将这二种物质混合时可发生如下反应:N2H4+2H2O2?N2+4H2O,已知0.4mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量.
(1)反应的热化学方程式为______.
(2)又已知:H2O(l)?H2O(g);△H=+44kJ/mol.则16g液态肼和足量的液态双氧水反应生成液态水时放出的热量是______kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有很大的优点是______
(4)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是______
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
C.2H2(g)+O2(g)=2H2O(1)△H<0
以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极反应为______.
 qx5121年前1
qx5121年前1 -
 Ailiangliang 共回答了17个问题
Ailiangliang 共回答了17个问题 |采纳率82.4%(1)已知0.4mol液态肼和足量的液态双氧水反应,生成氮气和水蒸汽,放出256.6kJ的热量,肼和双氧水反应的热化学方程式:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.5KJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.5KJ/mol;
②H2O(l)=H2O(g);△H=+44KJ/mol,408.8KJ;
由盖斯定律①-②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(L)△H=-817.6KJ/mol;化学方程式中32g全部反应放热817.5KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408.75KJ,
故答案为:408.75;
(3)强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合时,即产生大量的氮气和水蒸汽,除释放大量热量和快速产生大量气体外,还有很突出的优点是,产物为氮气和水,无污染;
故答案为:产物为氮气和水,无污染;
(4)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0,为氧化还原反应,但为吸热反应,不能设计为原电池,故A错误;
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0,不属于氧化还原反应,不能设计为原电池,故B错误;
C.2H2(g)+O2(g)=2H2O(1)△H<0,为氧化还原反应,为放热反应,能设计为原电池,故C正确;
以KOH溶液为电解质溶液,氢氧燃料碱性电池中,负极上氢气失去电子,负极反应为H2+2OH--2e-=2H2O;
故答案为:C;H2+2OH--2e-=2H2O.1年前查看全部
- 快啊,越快越好,同学们还记得"乌鸦喝水"的故事吧,在一片树林里有一只丢弃的圆柱体玻璃瓶中盛了一点水,由于瓶口直径D 较小
快啊,越快越好,同学们还记得"乌鸦喝水"的故事吧,在一片树林里有一只丢弃的圆柱体玻璃瓶中盛了一点水,由于瓶口直径D 较小,水又比较少,只有h高,而瓶高有H (H>h)乌鸦根本喝不到水,那么乌鸦需叨( )的碎石子才能喝到水(与瓶口持平)又不至于溢出来.
 江思恩1年前1
江思恩1年前1 -
 creo 共回答了20个问题
creo 共回答了20个问题 |采纳率90%π(½D)平方X(H-h)除以小石子的体积1年前查看全部
- 标准大气压下,B试管中盛有下表中某一种液体,A烧杯中盛有水,对烧杯底部持续加热,发现试管B内的液体沸腾了,则试管中盛的液
标准大气压下,B试管中盛有下表中某一种液体,A烧杯中盛有水,对烧杯底部持续加热,发现试管B内的液体沸腾了,则试管中盛的液体是 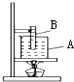
 [ ]
[ ]A.水
B.甘油
C.煤油
D.酒精 I-LOVE_CHEN4EVER1年前1
I-LOVE_CHEN4EVER1年前1 -
 又到夏天 共回答了17个问题
又到夏天 共回答了17个问题 |采纳率88.2%D1年前查看全部
- 两只形状,大小相同的量杯中盛的水相差200毫升.放入两块形状不同的石头后,如果水面升一样高,那么这两块石头的体积相差多少
两只形状,大小相同的量杯中盛的水相差200毫升.放入两块形状不同的石头后,如果水面升一样高,那么这两块石头的体积相差多少立方厘米?
 acarpouslove1年前1
acarpouslove1年前1 -
 阅B无数 共回答了17个问题
阅B无数 共回答了17个问题 |采纳率88.2%2001年前查看全部
- 有一容器中盛有足量的水,物体可以在水中缓慢地匀速上升,那么此物体在水中不能( )
有一容器中盛有足量的水,物体可以在水中缓慢地匀速上升,那么此物体在水中不能( )
A. 静止在水中任何位置
B. 缓慢地匀速下降
C. 漂浮在水面
D. 沉到水底,但对容器底没有压力 幽冥雪狐1年前1
幽冥雪狐1年前1 -
 yyboy 共回答了16个问题
yyboy 共回答了16个问题 |采纳率93.8%解题思路:(1)静止或匀速直线运动属于平衡状态,物体处于平衡状态时,受到的是平衡力的作用,即力的大小是相等的.
(2)若物体在水中处于匀速运动状态,即此时所受的浮力等于自身的重力.物体可以在水中缓慢地匀速上升,即物体处于平衡状态,即此时的重力和浮力是一对平衡力,其大小是相等的;所以物体可以悬浮在水中的任意一个位置,也可能沉到水底,但对容器没有压力,且若原来有一个向下的初速度时,物体也可以向下做匀速直线运动.故ABD不合题意,C符合题意.
故选C.点评:
本题考点: 物体的浮沉条件及其应用.
考点点评: 知道物体在水中所处的状态,并能准确的判断出浮力和重力的关系是解决该题的关键.1年前查看全部
- 如图,在三个广口瓶中,A、B两瓶中盛 少量水并各放入一铁块,且各挂有一束新鲜的 绿色植物;C瓶内放入干燥
如图,在三个广口瓶中,A、B两瓶中盛 少量水并各放入一铁块,且各挂有一束新鲜的 绿色植物;C瓶内放入干燥
如图,在三个广口瓶中,A、B两瓶中盛
少量水并各放入一铁块,且各挂有一束新鲜的
绿色植物;C瓶内放入干燥剂后也放入一铁块,
三瓶均用瓶塞封住.将A瓶用黑布包住放置一
昼夜;将B瓶放在强光下照射一段时间.试分
析铁块的生锈情况:
(1)A与B装置相比, 瓶中的铁块容易生锈,两瓶的差异是 .
(2)B与C相比较,条件相同点是都有 ,不同点是 .
(3)通过比较得出铁生锈的条件是 . 大王及黯31年前4
大王及黯31年前4 -
 尽情YY 共回答了25个问题
尽情YY 共回答了25个问题 |采纳率88%(1)A与B装置相比(B); 瓶中的铁块容易生锈,两瓶的差异是(B中有氧气,A中没有)
(2)B与C相比较,条件相同点是都有(氧气);不同点是(C中没有水分)
(3)通过比较得出铁生锈的条件是(需要空气和水分)1年前查看全部
- 在底面积为S的圆柱形容器中盛又一定量的气体,在等温条件下,由于气体的膨胀,把容器中的一个活塞(面积为S)从点a处推到点b
在底面积为S的圆柱形容器中盛又一定量的气体,在等温条件下,由于气体的膨胀,把容器中的一个活塞(面积为S)从点a处推到点b处,求在移动过程中,气体压力所作的功
难死了,知道的帮个忙! 疏远五点1年前1
疏远五点1年前1 -
 jljtf 共回答了17个问题
jljtf 共回答了17个问题 |采纳率88.2%参考资料1年前查看全部
- 如图所示A、B两个轻质圆柱形容器放在水平桌面上,A容器中盛水2×10-4米3,B容器内盛有质量为0.64千克、深为0.2
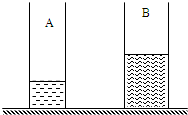 如图所示A、B两个轻质圆柱形容器放在水平桌面上,A容器中盛水2×10-4米3,B容器内盛有质量为0.64千克、深为0.2米的液体,已知SB=2SA=4×10-3米2,两容器高均为0.4米,求:
如图所示A、B两个轻质圆柱形容器放在水平桌面上,A容器中盛水2×10-4米3,B容器内盛有质量为0.64千克、深为0.2米的液体,已知SB=2SA=4×10-3米2,两容器高均为0.4米,求:
①A容器中水的质量;
②A容器对水平桌面的压强;
③若要使液体对容器底的压强相等,小张想分别在两个容器中加入等高的液体.请你通过计算说明,他的设想是否可行. 耐糖薄荷1年前1
耐糖薄荷1年前1 -
 xielizhen 共回答了17个问题
xielizhen 共回答了17个问题 |采纳率88.2%解题思路:(1)已知A容器中盛水的体积,利用m=ρV即可求出A容器中水的质量.
(2)根据(1)求出的A容器中水的质量.利用G=mg可求出其重力,此时的重力即为压力,再根据p=[F/S]即可求出A容器对水平桌面的压强.
(3)根据密度公式求得B容器内液体的密度,若要使液体对容器底的压强相等,根据p=ρgh列出等式计算即可.①由ρ=mV可得,mA=ρ水VA=1.0×103kg/m3×2.0×10-4m3=0.2kg. ②FA=GA=mAg=0.2kg×9.8N/kg=1.96N,pA=FASA=1.96N2×10−3m2=980Pa,③ρB=mBVB=0.64kg4×10−3m2×0.2m=0.8×103kg/m3,ρ水g(hA+△h)=ρBg(hB+...
点评:
本题考点: 压强的大小及其计算;液体的压强的计算.
考点点评: 本题考查了学生对密度公式、重力公式、液体压强公式、压强定义式的掌握和运用,关键是公式及其变形的灵活运用,要知道在水平面上压力等于物体自身的重力.1年前查看全部
- 为了测出玻璃的密度,小明利用一个玻璃制的小瓶,一个量筒和水做了如下探究活动.先在量筒中盛入50cm3的水,然后让小瓶口朝
为了测出玻璃的密度,小明利用一个玻璃制的小瓶,一个量筒和水做了如下探究活动.先在量筒中盛入50cm3的水,然后让小瓶口朝上漂浮在量筒内的水面上,如图甲所示,这时水面与80cm3刻度线相平,再让小瓶口朝下,沉没在量筒中,如图乙,这时量筒内水面与62cm3刻度线相平,请你根据以上测出的数据推算出这个玻璃小瓶的密度是多大.

 我怕谁2341年前4
我怕谁2341年前4 -
 恰似赵深深的温柔 共回答了15个问题
恰似赵深深的温柔 共回答了15个问题 |采纳率80%解题思路:(1)由左、中两图的两次读数之差得出玻璃瓶排开水的体积;求出了玻璃瓶排开水的体积,利用阿基米德原理求玻璃瓶受到水的浮力;
(2)根据漂浮条件求玻璃瓶重,再利用重力公式求玻璃瓶的质量;
(3)由左、右两图可得玻璃瓶的体积,再利用密度公式求玻璃的密度.(1)由中图可知,
V排=80cm3-50cm3=30cm3=30×10-6m3,
F浮=G排=ρ水V排g=1×103kg/m3×30×10-6m3×10N/kg=0.3N;
(2)玻璃瓶漂浮,所以玻璃瓶重:G=F浮=0.3N,
由G=mg得,玻璃瓶的质量:m=[G/g]=[0.3N/10N/kg]=0.03kg=30g;
(3)由右图知玻璃瓶下沉,玻璃瓶的体积:
v=62cm3-50cm3=12cm3,
玻璃的密度:
ρ玻=[m/V]=
30g
12cm3=2.5g/cm3=2.5×103kg/m3.
答:这只小瓶的玻璃的密度是2.5×103kg/m3.点评:
本题考点: 固体的密度测量实验.
考点点评: 本题考查了学生对量筒的使用、物体的漂浮条件的掌握和运用,能读出两个体积(排开水的体积、玻璃瓶的体积)是本题的关键.1年前查看全部
- 2、 在一个装有单孔胶塞的圆底烧瓶中,放入碘晶体和锌粉的混合物,插入单孔胶塞的胶头滴管中盛有少量水,当水滴入混合物后,观
2、 在一个装有单孔胶塞的圆底烧瓶中,放入碘晶体和锌粉的混合物,插入单孔胶塞的胶头滴管中盛有少量水,当水滴入混合物后,观察到烧瓶里有紫红色的气体产生,根据实验现象进行推断
(1) 紫红色气体是_____________.
(2) 反应中的能量变化_____(吸热或放热),理由_______________________________________________________________________________________________________________________________.
(3) 反应中水的作用____________.
(4) 写出反应中的化学方程式______________________________________. 化小冲1年前1
化小冲1年前1 -
 joyee 共回答了21个问题
joyee 共回答了21个问题 |采纳率85.7%碘蒸气
放热 使碘升华
氧化剂
这些应该是没问题的1年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大
(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水,当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256kJ的热量.
①写出该反应的热化学方程式______.
②又已知H2O(l)=H2O(g),△H=44kJ•mol-1,则16g液态肼与液态双氧水反应生成液态水时放出的热量是______kJ.
(2)实验室用足量的金属锌与体积、浓度一定的稀硫酸反应制取氢气时(不考虑温度变化),要想使反应速率减慢,又不影响产生氢气的总量,下列措施中能达到目的是______.
①加入少量固体碳酸钠;②加入少量固体醋酸钠;
③加入适量的硫酸钠溶液;④加入适量的硝酸钠溶液;
⑤滴加少量CuSO4溶液;⑥加热. dzuojun1年前1
dzuojun1年前1 -
 yinger365 共回答了19个问题
yinger365 共回答了19个问题 |采纳率89.5%解题思路:(1)①反应方程式为:N2H4+2H2O2=N2+4H2O,根据0.4mol液态肼放出的热量,计算1mol液态肼放出的热量,进而写出热化学方程式;
②结合上述写出的热化学方程式和谁转化的热化学方程式,根据盖斯定律合并写出生成液态水时的热化学方程式进行计算;
(2)要使氢气的生成速率减慢,但又不影响其总量,则减小氢离子浓度,而不能减小氢离子的物质的量,以此来解答.(1)①反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[256/0.4]kJ=640kJ,
所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-640kJ/mol,
故答案为:N2H4(l)+2H2O2(l)=N2(g)+4H2O(g)△H=-640 kJ•mol-1;
②a、N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63KJ/mol;
b、H2O(g)=H2O(l)△H=-44KJ/mol;
依据盖斯定律a+b×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817KJ/mol;化学方程式中32g全部反应放热817KJ,16g液态肼与足量双氧水反应生成氮气和液态水时,放出的热量是408kJ,
故答案为:408;
(2)①加入少量固体碳酸钠,会和硫酸之间反应,产生二氧化碳,能使使反应速率减慢,会影响产生氢气的总量,故错误;
②加入少量固体醋酸钠,会和硫酸之间反应生成醋酸,醋酸是弱酸,能使使反应速率减慢,不会影响产生氢气的总量,故正确;
③加入适量的硫酸钠溶液,减小氢离子浓度,而不能减小氢离子的物质的量,则反应速率减慢,不影响氢气的总量,故正确;
④加入适量的硝酸钠溶液,相当于溶液中含有硝酸,和金属反应不会产生氢气,所以会影响氢气的总量,故错误;
⑤滴加少量CuSO4溶液,会形成原电池,加快反应速率,故错误;
⑥加热会加快反应速率,故错误;
故选②③.点评:
本题考点: 热化学方程式;化学反应速率的影响因素.
考点点评: 本题考查热化学方程式的书写、化学反应速率的影响因素,为高频考点,把握氢离子浓度、物质的量的变化为解答的关键,注意发生的氧化还原反应是否生成氢气,题目难度不大.1年前查看全部
- 如图所示,在甲、乙两个完全相同的容器中,一个装有500g水,一个装有500g酒精.已知ρ酒精<ρ水,则甲容器中盛的液体是
 如图所示,在甲、乙两个完全相同的容器中,一个装有500g水,一个装有500g酒精.已知ρ酒精<ρ水,则甲容器中盛的液体是______;A、B两点距各自容器底部的距离相等,受到的液体压强分别为PA和PB,则PA______PB.(选填“大于”、“等于”或“小于”)
如图所示,在甲、乙两个完全相同的容器中,一个装有500g水,一个装有500g酒精.已知ρ酒精<ρ水,则甲容器中盛的液体是______;A、B两点距各自容器底部的距离相等,受到的液体压强分别为PA和PB,则PA______PB.(选填“大于”、“等于”或“小于”)  h686421861年前1
h686421861年前1 -
 zjsxbyg 共回答了19个问题
zjsxbyg 共回答了19个问题 |采纳率94.7%解题思路:(1)水和酒精的质量相同,根据密度公式可以判断体积的大小;
(2)容器是形状规则的相同容器,所以两个容器底部所受压强相同;A、B在同一高度,水的密度大于酒精的密度,A点以下水对容器底部的压强大于B点以下酒精对容器底部的压强,根据此关系可求A、B两点压强的大小.(1)质量相同时,密度越大,体积越小,因为水的密度大,所以体积小的是水,故甲容器中盛的液体是水;
(2)水和酒精的质量相同,容器是形状规则的相同容器,容器底受到的压力相同,两个容器底部所受压强相同,
∵P=ρgh,A、B两点等高,即hA下=hB下,ρ酒精<ρ水,
∴A、B以下液体对底部压强PA下>PB下,
∵A、B两点压强为PA=P甲-PA下,PB=P乙-PB下,
∴PA<PB.
故答案为:水;小于.点评:
本题考点: 液体的压强的计算.
考点点评: 本题考查容器底部所受液体压强的计算,最关键的是知道液体中某一点的深度指的是这一点到液面的垂直距离,而不是距离容器底的距离,这是最容易出错的1年前查看全部
- 如图所示两端封口的圆台形玻璃容器中盛了一定量的水,水和容器共重70N,容器的下底面积为300cm2,放在水平
如图所示两端封口的圆台形玻璃容器中盛了一定量的水,水和容器共重70N,容器的下底面积为300cm2,放在水平
木板上,水的高度为30cm,则容器底受到水的压强为 Pa,压力为 N;木板受到容器的压力为 N,
压强为 Pa. 阿比李白更gg1年前1
阿比李白更gg1年前1 -
 iyguo33 共回答了28个问题
iyguo33 共回答了28个问题 |采纳率85.7%3000Pa 容器底受到水的压强P=ρgh=3000Pa
90N 容器底受到水的压力F=PS=3000Pa*0.03m^2=90N
70N 木板受到容器的压力F=G总=70N
2333.3Pa 木板受到容器的压强P=F/S=70N/0.03m^2=7000/3Pa约为2333.3Pa
有问题可以继续追问,对我的回答还算满意,1年前查看全部
- 一个棱长是2分米的正方体鱼缸中盛水5升,若将一条鱼放入水中,这时量得水深15厘米,这条鱼的体积是多少?
 蓝海ii1年前1
蓝海ii1年前1 -
 妖妖耍的就是拽 共回答了23个问题
妖妖耍的就是拽 共回答了23个问题 |采纳率100%5/2/2=1.25dm
2*2*(15-1.25)=55dm³1年前查看全部
- 过氧化氢 红砖烧杯中盛放过氧化氢溶液,小木块上有一支点燃的蜡烛.向烧杯中撒入红砖粉末,发现烧杯中有大量气泡产生,同时蜡烛
过氧化氢 红砖
烧杯中盛放过氧化氢溶液,小木块上有一支点燃的蜡烛.向烧杯中撒入红砖粉末,发现烧杯中有大量气泡产生,同时蜡烛燃烧得更旺.
(1)产生的气体是___________.如何检验____________________写出有关反应的化学方程式________________________________
(2)红砖粉末的作用__________________理由__________________
1 我觉得是氧气,用带火星的木条检验,复燃的是氧气.
化学式中的反应条件是什么啊?
如果是 【红砖粉末】 的话,那【点燃】要不要?
题目中的点燃的蜡烛和条件有关吗?
2 催化剂,理由是什么呢? 碧荷青青1年前6
碧荷青青1年前6 -
 西水常东 共回答了17个问题
西水常东 共回答了17个问题 |采纳率94.1%烧杯中盛放过氧化氢溶液,小木块上有一支点燃的蜡烛.向烧杯中撒入红砖粉末,发现烧杯中有大量气泡产生,同时蜡烛燃烧得更旺.
(1)产生的气体是(氧气).如何检验(用带火星的木条检验)写出有关反应的化学方程式O2 + C =点燃= CO2
(2)红砖粉末的作用(催化剂)理由(加快了化学反应 本身不参加反应)
红砖粉末含有铁离子Fe3+ 可以催化过氧化氢分解1年前查看全部
- 有一容器中盛有足量的水,物体可以在水中缓慢地匀速上升,那么此物体在水中不能( )
有一容器中盛有足量的水,物体可以在水中缓慢地匀速上升,那么此物体在水中不能( )
A. 静止在水中任何位置
B. 缓慢地匀速下降
C. 漂浮在水面
D. 沉到水底,但对容器底没有压力 林冠邦1年前2
林冠邦1年前2 -
 别用我的id 共回答了22个问题
别用我的id 共回答了22个问题 |采纳率95.5%解题思路:(1)静止或匀速直线运动属于平衡状态,物体处于平衡状态时,受到的是平衡力的作用,即力的大小是相等的.
(2)若物体在水中处于匀速运动状态,即此时所受的浮力等于自身的重力.物体可以在水中缓慢地匀速上升,即物体处于平衡状态,即此时的重力和浮力是一对平衡力,其大小是相等的;所以物体可以悬浮在水中的任意一个位置,也可能沉到水底,但对容器没有压力,且若原来有一个向下的初速度时,物体也可以向下做匀速直线运动.故ABD不合题意,C符合题意.
故选C.点评:
本题考点: 物体的浮沉条件及其应用.
考点点评: 知道物体在水中所处的状态,并能准确的判断出浮力和重力的关系是解决该题的关键.1年前查看全部
- 铁与水蒸气的反应中,圆底烧瓶中盛装有水,该装制受热后的作用是提供水蒸气..为什么啊,
 小草0011年前1
小草0011年前1 -
 aa1222 共回答了21个问题
aa1222 共回答了21个问题 |采纳率90.5%∵圆底烧瓶中盛装有水,加热水就变味水蒸气呀1年前查看全部
- 两只形状、大小相同的量杯中盛的水相差200毫升.放入两块形状不同的石头后,如果水面升到一样高,那么这两
两只形状、大小相同的量杯中盛的水相差200毫升.放入两块形状不同的石头后,如果水面升到一样高,那么这两
块石头的体积相差多少立方厘米? flys_bird1年前1
flys_bird1年前1 -
 Amaymingming 共回答了10个问题
Amaymingming 共回答了10个问题 |采纳率90%200立方厘米!1年前查看全部
- 两只形状,大小相同的量杯中盛的水相差200毫升.放入两块形状不同的石头后,如果水面升到一样高,呢么两块
 夕天1年前1
夕天1年前1 -
 泡妞状元 共回答了16个问题
泡妞状元 共回答了16个问题 |采纳率93.8%两块石头的体积差是200cm³1年前查看全部
- 有一容器中盛有足量的水,物体可以在水中缓慢地匀速上升,那么此物体在水中不能( )
有一容器中盛有足量的水,物体可以在水中缓慢地匀速上升,那么此物体在水中不能( )
A. 静止在水中任何位置
B. 缓慢地匀速下降
C. 漂浮在水面
D. 沉到水底,但对容器底没有压力 宁远书生1年前4
宁远书生1年前4 -
 gususima 共回答了11个问题
gususima 共回答了11个问题 |采纳率100%解题思路:(1)静止或匀速直线运动属于平衡状态,物体处于平衡状态时,受到的是平衡力的作用,即力的大小是相等的.
(2)若物体在水中处于匀速运动状态,即此时所受的浮力等于自身的重力.物体可以在水中缓慢地匀速上升,即物体处于平衡状态,即此时的重力和浮力是一对平衡力,其大小是相等的;所以物体可以悬浮在水中的任意一个位置,也可能沉到水底,但对容器没有压力,且若原来有一个向下的初速度时,物体也可以向下做匀速直线运动.故ABD不合题意,C符合题意.
故选C.点评:
本题考点: 物体的浮沉条件及其应用.
考点点评: 知道物体在水中所处的状态,并能准确的判断出浮力和重力的关系是解决该题的关键.1年前查看全部
- 归园田居中盛、秽、沾的读音
 西厂仅一位1年前1
西厂仅一位1年前1 -
 秋仪 共回答了22个问题
秋仪 共回答了22个问题 |采纳率86.4%盛shèng
秽huì
沾zhān1年前查看全部
- 点燃氢气前一定要验纯吗这个我不确定..另外氢气还原氧化铜实验中盛氧化铜的试管口是不是应该向下倾斜?为什么?
 铭铭夏1年前7
铭铭夏1年前7 -
 去驱走 共回答了14个问题
去驱走 共回答了14个问题 |采纳率92.9%一定要验纯的,只有在一定范围内点燃,才不会爆炸.爆炸后果很严重的说..
然后氢气还原氧化铜,管口要向下,原因两个.
1.氢气比空气轻,管口向下,氢气就会向上走到管底触及到管底的氧化铜发生反应.
2.氢气还原氧化铜,生成铜和水,如果管口向上,水就会流到管底,试管外面在加热,里面是冷水的触及,会发生试管爆裂的.1年前查看全部
- 试管A和烧杯B中盛的都是水,现用一酒精灯对烧杯底部不断加热,试管A和烧杯B的底部并未接触.烧杯B中的水会沸腾,但试管A中
试管A和烧杯B中盛的都是水,现用一酒精灯对烧杯底部不断加热,试管A和烧杯B的底部并未接触.烧杯B中的水会沸腾,但试管A中的水不会沸腾,为什么?请用初一的知识详细说明.
 行云cc1年前4
行云cc1年前4 -
 武林门外 共回答了19个问题
武林门外 共回答了19个问题 |采纳率100%首先沸腾是气化的一种剧烈的表现,它产生的条件是:物体达到沸点,并继续吸热.水的沸点在标准大气压下是100℃,当烧杯B中的水沸腾时,B中水的温度为100℃,试管A中的水温度为100℃,也达到了沸点.但是如果要让水沸腾就还让水要继续吸热.因为两个的温度都为100℃,所以没有温差就无法继续吸热,所已不能沸腾.1年前查看全部
- 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热.已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量.
(1)反应的热化学方程式为______.
(2)又已知H2O(l)=H2O(g);△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是______KJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______.
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.
已知:N2 (g)+2O2 (g)=2NO2 (g)△H=+67.7kJ/mol
N2H4 (g)+O2 (g)=N2(g)+2H2O (g)△H=-543kJ/mol
1/2H2 (g)+1/2F2 (g)=HF (g)△H=-269kJ/mol
H2 (g)+1/2O2(g)=H2O (g)△H=-242kJ/mol
(4)肼和二氧化氮反应的热化学方程式为______
(5)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:______. eriiba1年前1
eriiba1年前1 -
 特别爱特别井 共回答了15个问题
特别爱特别井 共回答了15个问题 |采纳率93.3%解题思路:(1)依据反应物和生成物配平书写化学方程式,根据定律关系判断,0.4mol液态肼和0.8mol H2O2混合恰好反应,所以1mol液态肼完全反应放出641.75kJ的热量;
(2)H2O(l)=H2O(g)△H=+44kJ/mol,依据盖斯定律计算分析得到;
(3)根据肼燃烧产物是氮气和水蒸气,都是无污染的物质来回答;
(4)依据热化学方程式和盖斯定律计算得到;
(5)依据热化学方程式,结合目标热化学方程式,利用盖斯定律计算得到.(1)反应方程式为:N2H4+2H2O2═N2+4H2O,0.4mol液态肼放出256.652KJ的热量,则1mol液态肼放出的热量为[256.625kJ/0.4]=641.63kJ,所以反应的热化学方程式为:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.63kJ/mol,
故答案为:N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-641.63kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.75kJ/mol;②H2O(l)=H2O(g)△H=+44kJ/mol;
依据盖斯定律①-②×4得到N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-817.75kJ/mol,
而16g液态肼物质的量为0.5mol,与液态双氧水反应生成液态水时放出的热量=0.5mol×817.75kJ/mol=408.875kJ,
故答案为:408.875.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是氮气和水是无污染物质,故答案为:产物环保无污染;
(4)①N2(g)+2O2(g)=2NO2(g)△H=67.7kJ•mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
依据盖斯定律②×2-①得到,2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1153.7kJ•mol-1 ;
(5)①N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ•mol-1
②[1/2]H2(g)+[1/2]F2(g)=HF(g)△H=-269kJ•mol-1
③H2(g)+[1/2]O2(g)=H2O(g)△H=-242kJ•mol-1
依据盖斯定律①-③×2+②×4得到:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1;
故答案为:N2H4(g)+2F2(g)=N2(g)+4HF (g)△H=-1135kJ•mol-1.点评:
本题考点: 有关反应热的计算;热化学方程式.
考点点评: 本题考查了热化学方程式的书写,盖斯定律的应用和反应热的计算,其中盖斯定律的应用一直是考查的热点,注意掌握,题目难度中等.1年前查看全部
- 甲,乙两圆锥体容积形状相等,甲容器里水的高度是圆锥高的三分之一,乙容器里的高度是圆锥高的 三分之二,哪一个容器中盛水多,
甲,乙两圆锥体容积形状相等,甲容器里水的高度是圆锥高的三分之一,乙容器里的高度是圆锥高的 三分之二,哪一个容器中盛水多,多的是少的几倍?
(两个大小相等,但有一个圆锥体是倒着放的) 娃涯涯1年前2
娃涯涯1年前2 -
 都是平凡人 共回答了29个问题
都是平凡人 共回答了29个问题 |采纳率86.2%假设甲是正着放的,则甲容器盛水多,甲:乙=19:8
假设此圆锥容器底面半径为r,高为h
则圆锥的容积为:π*r^2*h/3(圆锥体积公式:1/3*π*r^2*h)
乙中水的体积好求,根据比例,有水圆锥底面的半径为2r/3,高为2h/3
乙=1/3*π*(2r/3)^2*(2h/3)=8*π*r^2*h/81
甲中水的体积这样求:
整个容器的体积-乙的体积(无水部分圆锥的体积与乙相等)
甲=πr^2h/3-1/3*π*(2r/3)^2*(2h/3)=19*π*r^2*h/81
甲:乙=19:81年前查看全部
- (1)火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产
(1)火箭推进器中盛有强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量.请写出该反应的热化学方程式:______.
(2)工业上由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:TiO 2 →(步骤Ⅰ)TiCl 4
(步骤Ⅱ)TiMg.800℃.Ar
写出步骤Ⅱ中TiCl 4 →Ti的化学反应方程式______.
已知:①C(s)+O 2 (g)=CO 2 (g)△H=-393.5kJ-mol -1
②2CO(g)+O 2 (g)=2CO 2 (g)△H=-566kJ-mol -1
③TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g)△H=+141kJ-mol -1
则反应TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=______kJ-mol -1 . 巴雅1年前1
巴雅1年前1 -
 南美漂流瓶 共回答了16个问题
南美漂流瓶 共回答了16个问题 |采纳率100%(1)强还原剂液态肼(N 2 H 4 )和强氧化剂液态双氧水(H 2 O 2 ),当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热;已知0.4mol液态肼与足量液态双氧水反应时,放出256kJ的热量;则1mol液态肼完全反应放出热量为:640KJ;标注物质聚集状态和对应焓变,热化学方程式为:N 2 H 4 (l)+2H 2 O 2 (l)=N 2 (g)+4H 2 O(g)△H=-640KJ/mol
故答案为:N 2 H 4 (l)+2H 2 O 2 (l)=N 2 (g)+4H 2 O(g)△H=-640KJ/mol;
(2)工业上由金红石(TiO 2 )制取单质Ti,涉及到的步骤为:TiO 2 →(步骤Ⅰ)TiCl 4
Mg.800℃.Ar
(步骤Ⅱ)Ti
步骤Ⅱ中TiCl 4 →Ti的化学反应方程式为:TiCl 4 +2Mg=MgCl 2 +Ti;
依据盖斯定律结合热化学方程式计算:
①C(s)+O 2 (g)=CO 2 (g)△H=-393.5kJ?mol -1
②2CO(g)+O 2 (g)=2CO 2 (g)△H=-566kJ?mol -1
③TiO 2 (s)+2Cl 2 (g)=TiCl 4 (s)+O 2 (g)△H=+141kJ?mol -1
①×2-②+③得到:TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=-80KJ/mol;
故答案为:TiCl 4 +2Mg=MgCl 2 +Ti;
TiO 2 (s)+2Cl 2 (g)+2C(s)=TiCl 4 (s)+2CO(g)的△H=-80KJ/mol;1年前查看全部
- 如图,有6个杯子放成一排,前三个杯子中盛了一些水,而后三个杯子是空的,要使得盛水的杯子和空杯子相互交叉排成一排,最少要动
如图,有6个杯子放成一排,前三个杯子中盛了一些水,而后三个杯子是空的,要使得盛水的杯子和空杯子相互交叉排成一排,最少要动几个杯子?

 kk给零用钱了1年前1
kk给零用钱了1年前1 -
 年终奖没听说 共回答了20个问题
年终奖没听说 共回答了20个问题 |采纳率85%解题思路:把左边盛水的三个的中间那个,也就是左数第二个中的水,倒入右边中间没水的那个杯子里,然后放回原位就使得盛水的杯子和空杯子相互交叉排成一排了.据此解答即可.根据分析可知,只要动一个杯子就可以使盛水的杯子和空杯子相互交叉排成一排.
答:最少动一个杯子.点评:
本题考点: 最佳方法问题.
考点点评: 根据要求只要动一个有水的杯子就可以解决问题.1年前查看全部
- 发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气
发射宇宙飞船的火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水(H2O2),当它们混合时,即产生大量的氮气和水蒸气,并放出大量的热,写出该反应的化学方程式______,该反应用于火箭推进器的优点是______.
 臻锋1年前3
臻锋1年前3 -
 liuliju 共回答了20个问题
liuliju 共回答了20个问题 |采纳率85%解题思路:根据偏二甲肼和双氧水反应水生成氮气和水蒸气进行分析;根据化学方程式所表现出的信息进行分析第二个空.液态肼和过氧化氢反应会生成水蒸气和氮气,故答案为:N2H4+2H2O2=4H2O↑+N2↑
因为从液态肼和双氧水反应的化学方程式可以看出,生成物只有水和氮气,不会造成粉尘等污染,故答案为:产物无污染.
故答案为:N2H4+2H2O2=4H2O↑+N2↑;产物无污染.点评:
本题考点: 书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生对所学知识在特殊环境下的应用.学生需充分考虑特定因素,才能正确答题.1年前查看全部
- (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“
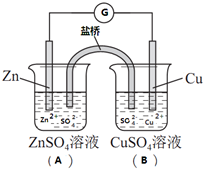 (2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
(2014•浦东新区二模)图为一种铜锌原电池的示意图,A中盛ZnSO4溶液并插入锌片,B中盛CuSO4溶液并插入铜片,“盐桥”是一支U型管,内装用饱和KCl溶液和琼脂混合制成的胶状溶液,其作用是形成闭合回路.该原电池工作时电流计指针偏转,溶液始终保持电中性,则下列说法正确的是( )
A.导线上的电流方向为A→B
B.A中SO42-浓度有所减小
C.盐桥中Cl-向A中移动
D.B中铜片质量有所增加 cc帮女八路1年前1
cc帮女八路1年前1 -
 南极北熊 共回答了33个问题
南极北熊 共回答了33个问题 |采纳率87.9%解题思路:将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液构成的原电池中,金属锌是负极,发生氧化反应,铜是正极,发生还原反应,根据原电池的工作原理来回答.A.Zn为负极,Cu为正极,则导线上的电流方向为B→A,故A错误;B.原电池工作时,阴离子向负极移动,A中SO42-浓度基本不变,故B错误;C.原电池工作时,阴离子向负极移动,盐桥中的氯离子可向A移动,故C正确;D.Cu为...
点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查学生盐桥原电池的工作原理知识,为高频考点,侧重于学生的分析能力的考查,注意正负极的判断以及电解质中阴阳离子的移动是解题的关键,难度不大.1年前查看全部
大家在问
- 1一般书本纸张是原纸张多少次对开得到的,矩形ABCD沿EF对开后,再把矩形EFCD沿MN对开,依次类推,若各种开本矩形都相
- 2Heparkedhiscarinfrorltofthehouse justnow改为否定句,一般疑问句
- 3如何求四次方和五次方的各项和,公式+推导
- 4如图,∠A+∠B+∠C+∠D+∠E等于( )
- 5北大出版的高等数学第二版上册P52习题1.4中3的(4)求极限
- 6反问句和陈述句句式的区别?什么是句式?
- 7已知方程x2+(a-2)x+a-1=0的两根x1,x2,则点P(x1,x2)在圆x2+y2=4则实数a=
- 8.设A为n阶矩阵,秩(A)=n-1,,是齐次线性方程组Ax=0两个不同的解,则Ax=0的通解是
- 9已知甲数比乙数多80,甲数的三分之一与乙数的五分之二相等,甲数是?
- 10读句子,给下列加粗的字选择合适的解释。
- 11下面五个命题:(1)所有的单位向量相等;(2)长度不等且方向相反的两个向量不一定是共线向量;(3)由于零向量的方向不确定
- 12求一篇英语作文about tourist attractions.
- 137 3 3 7用加减乘除和括号,不可以调换位置,怎样才可以使得数是24
- 14根据以下内容,写一篇介绍无锡简况的英语短文,词数100左右....
- 15the treffic accident happened on______ A.last morning B. sat

