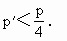绝热膨胀可逆与不可逆的区别?相同始态,膨胀到相同温度.终态时P、S、△G、△H、W相同吗?不可逆膨胀时环境的S怎么变化?
 emirateyi2022-10-04 11:39:541条回答
emirateyi2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 b3498 共回答了15个问题
b3498 共回答了15个问题 |采纳率86.7%- 作为状态函数、△G、△H是相同的,而其他不是状态函数会根据过程不同而不同.
- 1年前
相关推荐
- 2mol单原子理想气体,始态为298K、30p,经绝热膨胀压力突然降到10p,做了2095J的膨胀功,求该系统的熵变.
 罗纳这多1年前1
罗纳这多1年前1 -
 fayene 共回答了21个问题
fayene 共回答了21个问题 |采纳率90.5%糟糕,绝热过程pV^γ为常数.
了单原子理想气体的γ是多少了.总之就是先用上述关系求出变化后的体积,然后根据状态方程求状态函数,不过我比较奇怪的是不是应该是求焓变么?
对不起我只能帮你到这了.我只记得γ是一个大约为1.4的指数.1年前查看全部
- 大学物理热力学证明题。理想气体由初状态(p1,v1)经绝热膨胀至末状态〈p2,v2〉,试证明过程中气体所做的功为A=(P
大学物理热力学证明题。理想气体由初状态(p1,v1)经绝热膨胀至末状态〈p2,v2〉,试证明过程中气体所做的功为A=(P1V1-P2V2)/(γ-1),其中γ是气体的比热容比。
 dqdqcl1年前0
dqdqcl1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 空气1kg由25度经绝热膨胀降温到-55度,设空气为理想气体,求过程的Q、W、ΔH,ΔU
 芳菲的天堂1年前1
芳菲的天堂1年前1 -
 乌溜溜881 共回答了20个问题
乌溜溜881 共回答了20个问题 |采纳率90%1kg空气的摩尔数: n=1/0.029=34.48
空气的定体摩尔热容: Cv=5R/2=2.5×8.31=20.8J/K·mol绝热过程不吸热: Q=0内能增量: ΔU=nCvΔT=34.48*20.8*(-55-25)=-5.74*10^4J对外做功: W=-ΔU=5.74*10^4J焓增量: ΔH=ΔU+nRΔT=-5.74*10^4+34.48*8.31*(-55-25)=-8.03*10^4J1年前查看全部
- 4mol氧气在330K时的体积为0.1m³,分别经(1)等压膨胀(2)等温膨胀(3)绝热膨胀,最后体积均变为0
4mol氧气在330K时的体积为0.1m³,分别经(1)等压膨胀(2)等温膨胀(3)绝热膨胀,最后体积均变为0.5m³.在同一个p-v图上画出这三个过程的过程曲线.
 bananaceline1年前1
bananaceline1年前1 -
 jzxtom 共回答了25个问题
jzxtom 共回答了25个问题 |采纳率92%用matlab画,可以的1年前查看全部
- 下列说法正确的是( ) A.绝热膨胀的物体,其内能一定减少 B
下列说法正确的是()
A.绝热膨胀的物体,其内能一定减少 B.物体吸收热量,内能一定增加 C.物体温度不变,内能可能改变 D.在热传递过程中,一定有内能大的物体向内能小的物体传热  stonesailzp1年前1
stonesailzp1年前1 -
 huchecker 共回答了17个问题
huchecker 共回答了17个问题 |采纳率100%解题思路:因为是绝热膨胀,所以物体不吸热,根据热力学第一定律,物体对外做功,内能一定减小,
A 正确,物体吸收热量,还可能对外做功,所以内能不一定增大,B 错误;物体温度不变,即不吸热不放热,但是做功,故内能可能变化,C 正确;在热传递过程中,从温度高的物体传向温度低的物体,D 错误故选
AC AC
1年前查看全部
- 理想气体向真空做绝热膨胀,温度,压强如何变化?
 乌鸦城主1年前3
乌鸦城主1年前3 -
 太阳忘记发光 共回答了19个问题
太阳忘记发光 共回答了19个问题 |采纳率100%理想气体向真空做绝热膨胀,温度不变,压强减小.
理想气体向真空做绝热膨胀,不对外界做功,不发生热传递,内能不变,温度不变;体积增大单位体积内的分子数减少,压强减小.1年前查看全部
- 可以用绝热膨胀法测氧气的比热容比吗?
可以用绝热膨胀法测氧气的比热容比吗?
为什么能或者不能 我爱的我爱啊秒1年前1
我爱的我爱啊秒1年前1 -
 新华时代 共回答了21个问题
新华时代 共回答了21个问题 |采纳率90.5%空气的 我知道能测 氧气的就不清楚了.你可以搜一下 这方面的数据参考一下1年前查看全部
- 一定质量的理想气体,绝热膨胀时,内能一 定减小
 天藏1年前2
天藏1年前2 -
 思得西西 共回答了25个问题
思得西西 共回答了25个问题 |采纳率92%q=0 w<0 所以内能减小1年前查看全部
- 一定质量的气体经历一缓慢的绝热膨胀过程.设气体分子间的势能可忽略,则在此过程中( )
一定质量的气体经历一缓慢的绝热膨胀过程.设气体分子间的势能可忽略,则在此过程中( )
A. 外界对气体做功,气体分子的平均动能增加
B. 外界对气体做功,气体分子的平均动能减少
C. 气体对外界做功,气体分子的平均动能增加
D. 气体对外界做功,气体分子的平均动能减少 nn父中山先生1年前1
nn父中山先生1年前1 -
 搞个ID真不容易 共回答了13个问题
搞个ID真不容易 共回答了13个问题 |采纳率100%解题思路:根据题意可知气体做功及吸放热情况,由热力学第一定律可知内能的变化,由温度和分子平均动能的关系可知分子平均动能的变化.因气体绝热膨胀,故气体对外做功,但没有热交换,由热力学第一定律可知,气体内能减小;
而气体不计分子势能,故内能只与温度有关,因内能减小,故温度降低,则可知分子的平均动能减小;
故选D.点评:
本题考点: 热力学第一定律;温度是分子平均动能的标志;理想气体的状态方程.
考点点评: 气体分子间势能不计,故气体可看作理想气体,其内能只与温度有关;同时还应明确,温度是分子平均动能的标志,温度越高,分子的平均动能越大.1年前查看全部
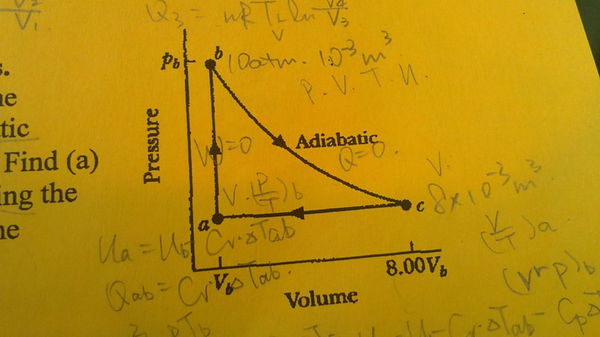
- 一摩尔单原子理想气体经历可逆循环a->b->c->a,如下:ab过程体积不变,压强增大;bc是绝热膨胀,Pb=10.0a
一摩尔单原子理想气体经历可逆循环a->b->c->a,如下:ab过程体积不变,压强增大;bc是绝热膨胀,Pb=10.0atm,Vb=1.00E-,Vc=8Vb;ca是等压收缩.求(a)气体吸收的热量;(b)气体释放的热量;(c)气体做的功;(d)整个循环的效率.
英文原题:One mole of a monatomic ideal gas is taken through the reversible cycle shown below.Process bc is an adiabatic expansion,with Pb=10.0atm and Vb=1.00*10^(-3)m^3.Find (a)the energy added to the gas as heat; (b)the energy leaving the gas as heat; (c)the net work done by the gas; (d)the efficiency of the cycle.
 股迷0071年前1
股迷0071年前1 -
 晴天小霹靂 共回答了17个问题
晴天小霹靂 共回答了17个问题 |采纳率82.4%c绝热过程 p*V^γ = C
pb*Vb^(5/3) = pc*Vc^(5/3) ,求出:pc = 5/16 atm
(a)气体吸收的热量
ab过程吸热 Qab = 3/2 R (Tb - Tc) = 3/2 (pb*Vb - pc*Vc) = 1472.02 J
(b)气体释放的热量
ca过程放热 Qca = 5/2 R (Ta - Tc) = 5/2 (pa*Va - pa*Vc) = -553.984 J
(c)气体做的功 (待求)
(d)整个循环的效率
η = 1 - │Qca│/Qab = 62.3657%
(c)气体做的功
A = Qab * η = 918.036 J1年前查看全部
- 请问恒温绝热膨胀过程存在吗,因为绝热所以Q=0,膨胀的话W
 另一个我1年前2
另一个我1年前2 -
 老透明 共回答了20个问题
老透明 共回答了20个问题 |采纳率90%膨胀可以W=0,例如一个容器被一块板从中间分成两半,一边是气体,一边是真空.去掉木板,气体膨胀,但不对外做功1年前查看全部
- 向真空绝热膨胀为什么不做功啊
 lliinnaa1年前4
lliinnaa1年前4 -
 yy一菲 共回答了21个问题
yy一菲 共回答了21个问题 |采纳率90.5%首先要保证是理想气体~才是不做功的~否则即使分子势能变化再微小,也要考虑的~
然后~
在绝热状态下 气体总内能保持不变(理想气体的内能只和温度有关)~就意味着没有动能的改变~所以不做功~
简单的说~就是向真空中输入的过程中没有任何力的阻拦~绝热状态下就是不做功的1年前查看全部
- 有一定质量的理想气体,如果发生绝热膨胀的过程,则在这个过程中下列说法正确的是 [
有一定质量的理想气体,如果发生绝热膨胀的过程,则在这个过程中下列说法正确的是 [ ]A.气体分子的平均动能必定增大
B.单位时间内,气体分子撞击同一容器壁的次数一定减小
C.气体的内能可能不变
D.气体对外做功,有内能转化为机械能 xiechangjiang1年前1
xiechangjiang1年前1 -
 comejl 共回答了17个问题
comejl 共回答了17个问题 |采纳率88.2%BD1年前查看全部
- 理想状态气体的选择题》》》一定量某理想气体所经历的循环过程是:从初态(Vo,To)开始,先经绝热膨胀使其体积增大1倍,再
理想状态气体的选择题》》》
一定量某理想气体所经历的循环过程是:从初态(Vo,To)开始,先经绝热膨胀使其体积增大1倍,再经等容升温恢复到初态温度To,最后经等温过程使其体积恢复Vo,则气体咋此循环过程中( )
(A)对外做的净功为正值
(B)对外作的净功为负值
(C)内能增加了
(D)从外界净吸收的热量为正值
我能够画出图来,很疑惑,无从下手,请严谨,简洁,通俗易懂地以公式为基础讲解, gaozhichang1年前3
gaozhichang1年前3 -
 清扬扬 共回答了18个问题
清扬扬 共回答了18个问题 |采纳率83.3%选B
首先,功可以用PV图的面积表示.
在绝热过程中,对外做功;等温过程外界对气体做功.等温过程的PV线在绝热过程的PV线上方,所以循环结果是对外做负功.内能不变,对外放热.1年前查看全部
- 热学2mol单原子理想气体,初始体积为20L,温度为27摄氏度,该气体先经过等压膨胀到体积为原体积的二倍,然后作绝热膨胀
热学
2mol单原子理想气体,初始体积为20L,温度为27摄氏度,该气体先经过等压膨胀到体积为原体积的二倍,然后作绝热膨胀到其温度恢复到初始值.求两个过程中的热力学内能变化、吸收的热量、做的总功. xiyangxueying1年前2
xiyangxueying1年前2 -
 追寻ff人生 共回答了22个问题
追寻ff人生 共回答了22个问题 |采纳率95.5%内能变化:
1.
r表示物质的量r=2,R为常量=?.(在下高中生,初略学了点奥赛的东西,忘了R叫什么了,有些地方也用k表示),
以下T为绝对温度,即T=300
由PV=rRT 知T变为原来2倍,即2T
由内能公式E=r*(i/2)*R*T (此处单原子分子i=3) 知E的变化量为r*(3/2)*R*T,即增加 3RT的内能
2.
由于恢复初始值,减少 3RT的内能
热量转移与做功:
1.
由于等压膨胀,对外做功 W=P*(V2-V1)=P*V
又PV=rRT
所以:W= rRT
所以:吸收的热量Q=内能增量+W=rRT+3RT=4RT.
2.
全程考虑内能不变,所以对外作的总功为 4RT
------------------------------------------
看来需要复习了,都做了很久的说.1年前查看全部
- 等温绝热膨胀可能发生吗?一个中间有挡板的容器,挡板一侧为理想气体,另一侧为真空,抽掉挡板,在绝热状态下让气体自由膨胀.这
等温绝热膨胀可能发生吗?
一个中间有挡板的容器,挡板一侧为理想气体,另一侧为真空,抽掉挡板,在绝热状态下让气体自由膨胀.这个过程中气体做功了吗?压强是否下降?温度如何变化?内能怎样变化?(参考PV=MRT/u)
我先阐述一下我自己的观点,膨胀的空间为真空,那么就没有对环境做功,则A=PV=0;V变大,P变小;PV乘积没变,则T不变;由于内能E=(M/u)(i/2)RT,所以E不变.
以上是我的观点,简单的说就是等温绝热膨胀可以发生.但是书上说等温绝热膨胀在任何情况下都不能发生!
看看我是不是哪里理解错了, 飞扬-无名1年前3
飞扬-无名1年前3 -
 offemma 共回答了26个问题
offemma 共回答了26个问题 |采纳率88.5%状态方程中的pv和做功的pdv不是一回事.
状态方程只表示挡板没取的时候和自由膨胀结束气体充满容器的两个时间点的状态理想气体的各个参数符合理想气体状态方程
气体对外做功的计算公式中,p是理想气体对外的压力,v是理想气体体积的变化量,如果p是一直变化的,要求功就要用微积分,求功就成了求过程量.而在真空膨胀气体只有体积变化,气体对外无p,所以气体对位做功为0,但是这个pdv的乘积和状态方程pv一个是过程量一个是状态量,做功的v指的是体积变化量,状态方程的v是气体总体积,做功的p恒为o,状态p不断变化.两者没有必然的联系,不能从做功为0推断pv不变.只能肯定pv/t是不变的.1年前查看全部
- 将温度为27度的空气定温压缩到原来容积的0.5,再使它可逆绝热膨胀但定温压缩前的压力.求最终温度…
将温度为27度的空气定温压缩到原来容积的0.5,再使它可逆绝热膨胀但定温压缩前的压力.求最终温度…
并画出p-v图…(k=1.40) milofei1年前1
milofei1年前1 -
 eattree 共回答了14个问题
eattree 共回答了14个问题 |采纳率71.4%利用气体物态方程,pv=μRT,温度为27度的空气定温压缩到原来容积的0.5,此时压强为2p,绝对温度T=27+273=300k,对于绝热过程,p*v的k次方=常数,求导可以求得1年前查看全部
- 今天大学物理课 老师一道题想不通 绝热膨胀为什么会等温的
 商高人为疯1年前1
商高人为疯1年前1 -
 dfdfh 共回答了23个问题
dfdfh 共回答了23个问题 |采纳率95.7%首先你要理解绝热膨胀的概念,所谓绝热就是隔绝与外界的热传递,比如在一个真空的环境下,由于没有了热量的传递,自然温度就没有变化,没有变化那肯定在膨胀的过程中是等温的!1年前查看全部
- 为什么气团在绝热膨胀时温度降低?
为什么气团在绝热膨胀时温度降低?
答案是这么分析的:∵△U=W+Q ,Q=0 ,气体对外做功
∴内能减小→温度降低
我的问题是:内能减小时,温度不是不一定降低吗?(内能不是还应与势能有关?) xy02071年前1
xy02071年前1 -
 fangaihan 共回答了12个问题
fangaihan 共回答了12个问题 |采纳率91.7%对于理想气体来说,分子之间因平均距离较大,不计分子力影响所以分子势能恒为零,因此,气体内能就是其总能.根据温度是分子平均动能的标志,气体内能减小等价于温度降低.1年前查看全部
- 卡诺循环中的第二步——绝热膨胀做功是否可以不存在,直接进入下一步——等温放热?
卡诺循环中的第二步——绝热膨胀做功是否可以不存在,直接进入下一步——等温放热?
请物理高手帮忙
 瑁瑁瑁1年前1
瑁瑁瑁1年前1 -
 江湖不由己 共回答了16个问题
江湖不由己 共回答了16个问题 |采纳率81.3%不可以.卡诺循环的四个过程缺一不可,否则PV图怎么画,W是理想气体(工作物质)对外所作的净功,在数值上等于p-V图上封闭曲线所包围的面积.1年前查看全部
- 一定质量的理想气体,在空气中进行绝热膨胀,当其体积变为原来的4倍时,其压强将 A.减小为原来的 B.大于原来的 C.小于
一定质量的理想气体,在空气中进行绝热膨胀,当其体积变为原来的4倍时,其压强将
A.减小为原来的 
B.大于原来的 
C.小于原来的 
D.上述情况均有可能  风中迷了路1年前1
风中迷了路1年前1 -
 cyykao 共回答了16个问题
cyykao 共回答了16个问题 |采纳率100%1年前查看全部
- 两道大学热力学思考题“理想气体在恒外压下绝热膨胀,因为恒外压,所以Qp=△H;又因绝热,所以Qp=0.由此得出Qp=△H
两道大学热力学思考题
“理想气体在恒外压下绝热膨胀,因为恒外压,所以Qp=△H;又因绝热,所以Qp=0.由此得出Qp=△H=0”.这一结论是否正确,为什么?
在一绝热钢瓶中发生一化学反应,温度和压力均升高了,这一过程的△U,△H是大于零,小于零还是等于零?
 一分钟追悔6271年前1
一分钟追悔6271年前1 -
 湘筠 共回答了15个问题
湘筠 共回答了15个问题 |采纳率73.3%“理想气体在恒外压下绝热膨胀,因为恒外压,所以Qp=△H;又因绝热,所以Qp=0.由此得出Qp=△H=0”.这一结论是错的
绝热过程Q=0,则有
△U=Q+W=-p外△V,p外 恒大于零,膨胀过程△V>0,故△U1年前查看全部
- 一道气动理论地题 理想气体向真空作绝热膨胀,( ) A膨胀后,温度不变,压强减小 B膨胀后,温度降低,压
 huanlegu04261年前2
huanlegu04261年前2 -
 jcxwfc 共回答了20个问题
jcxwfc 共回答了20个问题 |采纳率90%绝热膨胀,体系与外界没有热量交换,Q=0
向真空膨胀,体系对外不做功,W=0
根据热力学第一定律,内能变化U=Q+W
所以内能不变
由于内能只与温度有关,所以温度不变
膨胀后体积增大,由pV=nRT,
n,T不变,V增大,则p减小,即压强减小1年前查看全部
- 大学物理热力学2摩尔双原子理想气体,起始温度为27摄氏度,先做等压膨胀至原体积2倍,然后做绝热膨胀至起始温度,求吸收总热
大学物理热力学
2摩尔双原子理想气体,起始温度为27摄氏度,先做等压膨胀至原体积2倍,然后做绝热膨胀至起始温度,求吸收总热量.(答案是14750,我算了快两万···麻烦解释一下)
在一绝热容器中,温度为T1,质量为M的液体与质量为M、温度为T2的同类液体等压混合,达到平衡态.求系统从初态到终态的熵变.
一楼你等压熵变公式用错了·····题中就没有U,你不能用这个做最后结果吧 咖啡TT1年前2
咖啡TT1年前2 -
 百越飓风 共回答了22个问题
百越飓风 共回答了22个问题 |采纳率90.9%第一题,一楼正解.第二题,一楼错误.现将熵变计算如下:1、求混合后的平衡温度 T 将两个液体作为一个系统,并假定cp不变,液体膨胀系数也与温度无关,因而有 Q=0 与 W=0于是 Mcp(T-T1)+Mcp(T-T2)=0求得 ...1年前查看全部
- 气体绝热膨胀,温度急剧下降,使气体达到过饱和状态
气体绝热膨胀,温度急剧下降,使气体达到过饱和状态
威尔逊云室
开始工作时,迅速将活塞同下移动,容器内气体绝热膨胀,温度急剧下降,使气体达到过饱和状态
为什么体积变大,压强变小.温度就会下降?还是迅速的下拉才会温度下降?
与PV=NRT有关么?
谢绝粘贴不配套的答案! halfwolves1年前1
halfwolves1年前1 -
 就这么样 共回答了14个问题
就这么样 共回答了14个问题 |采纳率92.9%可以不用那个方程来解释的~
同学应该学过气体内能与做功的关系吧?
气体体积膨胀,对外做功,就是气体对容器壁做正功
这时气体内能减少
而理想气体的内能由气体分子动能决定
分子的平均动能又是气体温度的定义
动能减少,温度就下降了
其实原则上讲,下拉速度快慢是不影响最后温度的
但是实际上气体不会与外界隔绝
如果下拉慢了,气体与外界热交换(也是热传递),温度下降得不明显
因此才快速下拉,使温度迅速下降.1年前查看全部
- 大学物理热学,求过程.以氢为工作物质进行卡诺循环,如果在绝热膨胀时末状态的压强p2是初状态压强p1的一半,求循环的效率.
 谁是谁的谁谁谁呢1年前1
谁是谁的谁谁谁呢1年前1 -
 梁柯0622 共回答了11个问题
梁柯0622 共回答了11个问题 |采纳率100%在一次循环中,气体对外作净功为 |W|= Q1-Q2 效率为因得1年前查看全部
- 1KG干度为0.9的水蒸气,压力为2.31*10^5 pa,经过绝热膨胀,压力变为3.12*10^6 pa,然后又恒容加
1KG干度为0.9的水蒸气,压力为2.31*10^5 pa,经过绝热膨胀,压力变为3.12*10^6 pa,然后又恒容加热到饱和蒸汽,问两个过程的Q和W?
数据可能记得不太清楚,但是题目意思是对的! xiaoke197806131年前1
xiaoke197806131年前1 -
 jessica5 共回答了24个问题
jessica5 共回答了24个问题 |采纳率87.5%第一个过程Q=0,W=Q-H差=-H差
H差可以在热工基础与应用上查,别忘了干度是0.9.这个你应该会算的吧,不会算发信给我.
第二个过程你忘了一个参数,干度不知道,你算不出来的,方法同上,自己查图查H差1年前查看全部
- 一道大学热学题 可追加分数一摩尔双原子分子理想气体,原来温度为300K,体积为4L,首先等压膨胀到6.3L,然后绝热膨胀
一道大学热学题 可追加分数
一摩尔双原子分子理想气体,原来温度为300K,体积为4L,首先等压膨胀到6.3L,然后绝热膨胀回原来温度,最后等温压缩回到原状态.
(1)画出P-V图.
(2)计算此循环效率.
 luobodong1年前1
luobodong1年前1 -
 左妞 共回答了13个问题
左妞 共回答了13个问题 |采纳率84.6%已知:N=1mol,Cp=(7/2)R,γ=7/5=1.4,R=8.31(J/K),T=300K,V=0.004(m^3),V'=0.0063(m^3),P=P'(等压膨胀),Q2=0(绝热膨胀),T"=T(等温压缩).
求:1)(P,V,T),(P',V',T'),(P",V",T")(有此三对数据就不难确定P-V图);2)η.
一
PV=NRT,所以,P=NRT/V=1*8.31*300/0.004=6.23*10^5(Pa).
二
①等压膨胀过程中:V/T=V'/T',所以,T'=(V'/V)T=(6.3/4)*300=472.5(K);吸热Q1=N*Cp*(T'-T)=1*3.5*8.31*(472.5-300)=5017(J).
②绝热膨胀过程中:P'V'^γ=P"V"^γ,P"V"=NRT",P=P',T"=T,所以,PV'^γ=P"V"^γ,P"V"=NRT,所以,V"^(γ-1)=(PV'^γ)/(NRT)=V'^γ/V,所以,V"=(V'^γ/V)^[1/(γ-1)]=(0.0063^1.4/0.004)^[1/(1.4-1)]=0.0196(m^3),所以,P"=NRT/V"=1*8.31*300/0.0196=1.27*10^5(Pa).
③等温压缩过程中:内能ΔU3=0(因为是等温过程),外界对气体做功W3,气体放热Q3,由热力学第一定律可知:W3=Q3;(上下限分别是V和V")W3=∫dW=-∫p*dv=-∫(P"V"/v)*dv=-∫(NRT/v)*dv=NRT*ln(V"/V)=1*8.31*300*ln(0.0196/0.004)=3962(J).
三
对整个循环的始末来说,ΔU=0,而ΔU3=0,所以,ΔU1+ΔU2=0,所以由热力学第一定律可知:对外所做的总功W1+W2=Q1+Q2=Q1,所以有用的净输出功W=W1+W2-W3=Q1-W2=5017-3962=1055(J).
四
1)(P,V,T)=(6.23*10^5Pa,4L,300K),(P',V',T')=(6.23*10^5Pa,6.3L,472.5K),(P",V",T")=(1.27*10^5Pa,19.6L,300K)……
2)η=W/Q1=1055/5017=21%.1年前查看全部
- (2011•河北模拟)一定质量的气体经历一缓慢的绝热膨胀过程.设气体分子间的势能可忽略,则在此过程中( )
(2011•河北模拟)一定质量的气体经历一缓慢的绝热膨胀过程.设气体分子间的势能可忽略,则在此过程中( )
A.外界对气体做功,气体分子的平均动能增加
B.外界对气体做功,气体分子的平均动能减少
C.气体对外界做功,气体分子的平均动能增加
D.气体对外界做功,气体分子的平均动能减少 诺底留斯1年前1
诺底留斯1年前1 -
 ekyyy 共回答了17个问题
ekyyy 共回答了17个问题 |采纳率94.1%解题思路:根据题意可知气体做功及吸放热情况,由热力学第一定律可知内能的变化,由温度和分子平均动能的关系可知分子平均动能的变化.因气体绝热膨胀,故气体对外做功,但没有热交换,由热力学第一定律可知,气体内能减小;
而气体不计分子势能,故内能只与温度有关,因内能减小,故温度降低,则可知分子的平均动能减小;
故选D.点评:
本题考点: 热力学第一定律;温度是分子平均动能的标志;理想气体的状态方程.
考点点评: 气体分子间势能不计,故气体可看作理想气体,其内能只与温度有关;同时还应明确,温度是分子平均动能的标志,温度越高,分子的平均动能越大.1年前查看全部
大家在问
- 1“春种一粒粟,秋收万颗籽。”据考古发现,使用磨制石器.种植粟的是(
- 2一个无盖的圆柱形铁皮水桶底面直径是0.4米高是0.8米,然后在水桶里,外,两面都刷防锈漆.刷油漆的面积大约是多少平方米?
- 3地震光的种类和原因
- 4建筑平面图上这个图代表什么意思(一条斜线划分一个区域)
- 5已知二次函数y=-x2+2x+m的部分图象如图所示,则关于x的-x2+2x+m=0一元二次方程的解为______.
- 6在《三峡》中,作者在文中描写三峡春冬景物是,抓住了趣,请结合文章内容谈谈何趣之有
- 7走出____作文这是半命题 比如走出阴影 走出骄傲 等..谁帮我写篇 要求别举自己经历过的事.就是说自己什么小时候
- 8A、B、C是中学中常见的单质,A是金属单质,B、C是气体单质,甲、乙两化合物在常温下分别是
- 9孩子作业题.每个字代表一个数字,完成 以下计算:
- 10下列关于电流的说法中正确的是( )
- 11在下面的方框里填上数字,使每个算式中1到9这九个数字各出现一次.5796÷□□=□□□5346÷□□=□□
- 12问下,下个学期读初三可以转校吗,转了有学籍吗?
- 13把一个竹竿插入水里,竹竿湿了50厘米,然后将竹竿倒过来插入水里,这时,竹竿湿的部分比它的一半长20厘米,求竹竿的长?
- 14依次填入下列横线处的词语,最恰当的一组是
- 15原来在电路中正常发光的电灯突然熄灭是短路还是断路?