在1L含氢溴酸浓度为0.001mol/L的溴水中,通入足量的二氧化硫,反应后加入足量的NaHCO3,产生标准状况下气体0
 牛不过2022-10-04 11:39:541条回答
牛不过2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 wqy_1117 共回答了22个问题
wqy_1117 共回答了22个问题 |采纳率95.5%- SO2+Br2+2H2O===4H+ + SO4(2-)+2Br-
HCO3+H+===CO2(气体符号)+H2O
气体0.224L=0.224/22.4=0.01moL
H+=0.01mol
Br2=0.0025mol
溴水的物质的量浓度=0.0025/1=0.0025mol - 1年前
相关推荐
- 下列说法中,正确的是( )A.在NaAlO2溶液中,HCO3-不可能大量存在B.在0.1mol•L-1的氢溴酸中加入适
下列说法中,正确的是( )
A.在NaAlO2溶液中,HCO3-不可能大量存在
B.在0.1mol•L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)增大
C.在由水电离出的c(OH-)=1×10-12mol•L-1的溶液中,Al3+不可能大量存在
D.向Ca(ClO)2溶液中通入二氧化硫,反应的离子方程式为:Ca2++2ClO-+H2O+SO2═CaSO3↓+2HClO 干打雷不下雨01年前1
干打雷不下雨01年前1 -
 robert1984 共回答了9个问题
robert1984 共回答了9个问题 |采纳率100%解题思路:A、偏铝酸根离子能够与碳酸氢根离子能够反应生成氢氧化铝和碳酸根离子,在溶液中不能够大量共存;
B、氢溴酸为强酸,加入蒸馏水后,氢溴酸被稀释,溶液中氢离子浓度减小;
C、由水电离出的c(OH-)=1×10-12mol•L-1的溶液为酸性或者碱性溶液,若是酸性溶液中,铝离子可以共存;
D、次氯酸具有强氧化性,能够将亚硫酸根离子氧化成硫酸根离子.A、碳酸氢根离子能够与偏铝酸根离子反应生成氢氧化铝沉淀,在溶液中不能够大量共存,故A正确;
B、氢溴酸为强电解质,在溶液中完全电离,氢溴酸中进入蒸馏水后,溶液中氢离子浓度减小,故B错误;
C、该溶液为酸性或者碱性溶液,铝离子能够存在与酸性溶液中,若是酸性溶液,铝离子可能存在,故C错误;
D、次氯酸具有强氧化性,能够氧化亚硫酸根离子,反应产物为硫酸钙,反应的离子方程式为:Ca2++ClO-+SO2+H2O═CaSO4↓+Cl-+2H+,故D错误;
故选A.点评:
本题考点: 离子共存问题;离子方程式的书写;水的电离.
考点点评: 本题考查离子共存的正误判断、离子方程式的书写判断,该题是高考中的高频题,属于中等难度的试题,侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力;注意明确离子不能大量共存的一般情况:(1)能发生复分解反应的离子之间;(2)能生成难溶物的离子之间;(3)能发生氧化还原反应的离子之间;(4)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有:(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”.1年前查看全部
- 高锰酸钾和氢溴酸反应的离子反应式
 文新页1年前2
文新页1年前2 -
 julylfish 共回答了24个问题
julylfish 共回答了24个问题 |采纳率83.3%2Br-2e==Br2
MnO4-+8H++5e-==Mn2++4H2O,所以:10Br+2MnO4-+16H+==2Mn2++5Br2+8H2O.
随着反应进行,溶液的酸度降低,还原产物会变成MnO2,这种情况一般不考,如果需要那个方程,
希望对你有所帮助!1年前查看全部
- 氢溴酸和四氧化三铁反应怎么写的?还有溴化铁跟什么反应能有红色溶液?
氢溴酸和四氧化三铁反应怎么写的?还有溴化铁跟什么反应能有红色溶液?
溴化铁跟KSCN的离子方程式 顺便把化学方程式也写出来 木丁06291年前1
木丁06291年前1 -
 尘眉 共回答了20个问题
尘眉 共回答了20个问题 |采纳率90%8HBr+Fe3O4===2FeBr3+FeBr2+4H2O
溴化铁跟KSCN反应能有红色溶液 这是三价铁离子检验用的.1年前查看全部
- (2014•房山区一模)氢溴酸在医药和石化工业上有广泛用途.下图是模拟工业制备氢溴酸粗品及精制的流程:
(2014•房山区一模)氢溴酸在医药和石化工业上有广泛用途.下图是模拟工业制备氢溴酸粗品及精制的流程:
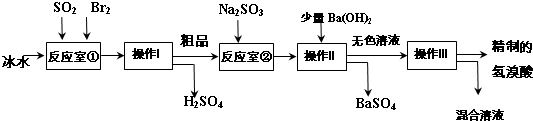
已知:Br2是易挥发、深红棕色的液体;氢溴酸是易挥发、无色液体.
根据上述流程回答下列问题:
(1)反应室①中发生反应的化学方程式为______.
(2)反应室①使用冰水的目的______.
(3)操作I的名称______,操作Ⅱ用到的玻璃仪器有______.
(4)反应室②中加入Na2SO3的目的是______.
(5)工业生产中制得的氢溴酸带有淡淡的黄色.于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为______,若假设成立可观察到的现象为______.
②乙同学假设工业氢溴酸呈淡黄色是因为______,其用于证明该假设成立的方法为______. 紫血清霜1年前1
紫血清霜1年前1 -
 我迷糊 共回答了14个问题
我迷糊 共回答了14个问题 |采纳率92.9%解题思路:流程反应室①中发生反应 SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),反应室②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42- 加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到精致的氢溴酸.
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr;
(2)Br2氧化SO2放出很多热量,Br2和HBr挥发;
(3)由工艺流程可知,操作Ⅰ为互溶的溶液组分的分离,应是蒸馏,操作Ⅱ分离固体与液体,应是过滤;
(4)粗品中可能含有为反应的Br2,应除去Br2;
(5)用KSCN溶液检验Fe3+,滴加KSCN溶液,溶液变成血红色;
由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验;流程分析:反应室①中发生反应 SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),反应室②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42- 加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到精致的氢溴酸.
(1)Br2具有强氧化性,在溶液中将SO2氧化为H2SO4,自身被还原为HBr,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4,
故答案为:SO2+Br2+2H2O=2HBr+H2SO4;
(2)Br2氧化SO2放出很多热量,Br2和HBr易挥发,使用冰水,降低体系温度,防止Br2和HBr挥发,使反应完全,故答案为:Br2和HBr挥发;
(3)由工艺流程可知,操作Ⅰ为互溶的溶液组分的分离,应是蒸馏,操作Ⅱ分离固体与液体,应是过滤,用到的玻璃仪器有漏斗、玻璃棒、烧杯;故答案为:蒸馏,漏斗、玻璃棒、烧杯;
(4)粗品中可能含有为反应的Br2,加入Na2SO3,除去粗品中未反应完的溴,故答案为:除去粗品中未反应完的溴;
(5)①用KSCN溶液检验Fe3+,取少许溶液滴加KSCN溶液,溶液变成血红色,说明氢溴酸呈淡黄色是因为含Fe3+.故答案为:KSCN溶液;溶液变成血红色;
②由工艺流程可知,溶液中可能含有Br2,证明该假设成立的方法:用玻璃棒蘸取制得的氢溴酸,点在湿润淀粉KI试纸上变蓝(或用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止,下层呈橙红色),证明因含Br2而显黄色;故答案为:含有Br2;用玻璃棒蘸取制得的氢溴酸,点在湿润淀粉KI试纸上变蓝(或用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止,下层呈橙红色),证明因含Br2而显黄色.点评:
本题考点: 物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计.
考点点评: 本题以制备氢溴酸为载体,考查学生对工艺流程的理解、物质的分离提纯等基本操作、离子检验、物质性质等,难度中等,是对知识的综合运用,需学生具有扎实的基础知识与灵活运用知识解决问题的能力.1年前查看全部
- 2. 和氢卤酸反应:【乙醇+氢溴酸=溴乙烷+水;取代反应】顺序!【蒸馏水、浓硫酸、乙醇、溴化钠】为什么?
 ss尼熊1年前4
ss尼熊1年前4 -
 zpy88888 共回答了19个问题
zpy88888 共回答了19个问题 |采纳率89.5%如果你是问括号里的顺序,先加水再加浓硫酸应该没问题吧,因为浓硫酸密度大,要使它们充分混合必须这样,然后加乙醇是因为浓硫酸和水会放热,会导致乙醇的挥发,所以要等前两者冷却后加入.最后溴化钠是固体,就最后加咯.1年前查看全部
- 氢溴酸与铁反应的化学方程式
 rr再生1年前3
rr再生1年前3 -
 nathan0 共回答了17个问题
nathan0 共回答了17个问题 |采纳率70.6%Fe+2HBr=FeBr2+H21年前查看全部
- 哪些物质和氢溴酸反应有淡黄色沉淀?
 lihe0001年前1
lihe0001年前1 -
 渝辣椒 共回答了16个问题
渝辣椒 共回答了16个问题 |采纳率100%有银离子的物质1年前查看全部
- 怎样用碘制取氢碘酸氢溴酸有怎样制取
 千年一见1年前1
千年一见1年前1 -
 bushezhishe 共回答了20个问题
bushezhishe 共回答了20个问题 |采纳率90%实验室氢碘酸一般这么制
氢溴酸用浓磷酸与NaBr加热,生成的HBr用水吸收
都不可以用浓硫酸,会氧化HI或HB1年前查看全部
- 氢碘酸和氢溴酸见光和受热会不会分解
氢碘酸和氢溴酸见光和受热会不会分解
还有如何加速分解? 水榭西花1年前1
水榭西花1年前1 -
 爱昵的云 共回答了16个问题
爱昵的云 共回答了16个问题 |采纳率93.8%会~
1.分解的本质是键能小
就是说碘原子不能很好的拉住氢
溴原子也不行
2.原因是碘原子的半径很大 对外层电子束缚力相对小
你可以对比HF就知道 HF基本不分解 因为F是小强 紧紧拉着H不放手
连水分子都不在乎(HF是中弱酸 在水中电离的少)呵呵
3.和酸的强弱没关系 浓硝酸见光分解 放在棕色瓶里
4.这样你应该能猜出氢碘酸和氢溴酸哪个更容易分解了吧
答案是氢碘酸 因为碘与溴结构类似 而层数更多 对H的束缚更小 分解需要的能量更小(与此同时氢碘酸比氢溴酸酸性更强)
希望我的回答对你有帮助1年前查看全部
- 下列事实与氢键有关的是水加热到很高的温度都难以分解氢氟酸是弱酸 盐酸 氢溴酸 氢碘酸都是强酸CH4 SiH4 GeH4
下列事实与氢键有关的是
水加热到很高的温度都难以分解
氢氟酸是弱酸 盐酸 氢溴酸 氢碘酸都是强酸
CH4 SiH4 GeH4 SnH4 的沸点随着相对分子质量的增加而升高
H2O H2S H2Se H2Te的热稳定性以此减弱
前4楼的答案都不对! 余申1年前5
余申1年前5 -
 xuedehao 共回答了17个问题
xuedehao 共回答了17个问题 |采纳率94.1%个人觉得选第二个.首先我们要弄清楚的是,氢键是范德华力,是分子间的作用力.所以,第一个和第四个都是错误的.水的分解要破坏的是分子内的作用力,即化学键,不是氢键.第四个和第一个同样的原理,都是要破坏化学键.第三个是元素的周期性质,与氢键无关,而且这四个分子也不存在氢键.
解释一下第二个吧,氢氟酸比同主族氢卤酸弱本在意料之中,但是如此之弱似乎有些反常,这主要有两个方面:1.这是由于氢-氟健一旦形成就相当的牢固很难打开(氟的极高电负性造成的),故较难电离出氢离子,所以是弱酸 2.HF分子中存在氢键,这是由于氟原子电负性高,半径很小,使得它吸引氢原子能力很强,氢原子出现“裸漏”现象(几乎无孤对电子),而在此同时另一个氟原子也可吸引这个氢原子,从而形成氢键,使HF分子出现蹄合现象(HF)n,这样对于氢氟酸电离不利,故HF是个弱酸,电离不完全!
再一个,若形成分子内氢键,也是可以影响酸性的.如部分有机酸.1年前查看全部
- 请问可不可以用氢溴酸出去乙醇中的溴乙烷
请问可不可以用氢溴酸出去乙醇中的溴乙烷
不好意思,是除溴乙烷中的乙醇,请大家重新看看, 海蚌的沙1年前1
海蚌的沙1年前1 -
 断了的翅膀1 共回答了14个问题
断了的翅膀1 共回答了14个问题 |采纳率92.9%觉得这样不好.虽然理论上乙醇是可以和氢溴酸反应生成溴乙烷,但有机反应本身就不完全.我记得我们当时用一个醇来制备溴代烷烃的时候产率并不高.
还是分离吧,比如说蒸馏,还有用浓硫酸洗也可以,我们当时做实验是用浓硫酸洗的1年前查看全部
- 混在溴乙烷中的乙醇可加入适量氢溴酸除去 正确,取代后分液 为什么这句话是错误的?
混在溴乙烷中的乙醇可加入适量氢溴酸除去 正确,取代后分液 为什么这句话是错误的?
混在溴乙烷中的乙醇可加入适量氢溴酸除去
正确,取代后分液
为什么这句话是错误的? 乐置1年前1
乐置1年前1 -
 liyang400 共回答了16个问题
liyang400 共回答了16个问题 |采纳率100%乙醇不能直接与氢溴酸反应,因此不能用这种方法除去乙醇,所以是错误的1年前查看全部
- 怎么鉴别四氯化碳、乙醇、己烷、己烯?A钠 B溴水 C氢溴酸 D氢氧化钠溶液
 四脚鱼1年前3
四脚鱼1年前3 -
 bun01 共回答了25个问题
bun01 共回答了25个问题 |采纳率84%对
CCl4:分层,下层有机层橙红色,上层水层无色
乙醇:混溶,不分层
乙烷:没有变化,有气泡排出
乙烯:溶液褪色1年前查看全部
- 氢碘酸和氢溴酸,氢氟酸是什么颜色的?暴晒氢碘酸能否制H2?
 Xinfo1年前1
Xinfo1年前1 -
 茗薇阳光1 共回答了15个问题
茗薇阳光1 共回答了15个问题 |采纳率86.7%氢碘酸是无色或黄色的氢溴酸也一样,氢氟酸是白色或黄色的.
暴晒氢碘酸能制H2,但不纯,而且很少.但加热氢碘酸能分解它:
2HI==加热==H2+I2.小心,别这么做,氢碘酸很贵的.1年前查看全部
- 高中化学亚硫酸钠和氢溴酸反应?会有so2生成吗 强酸制弱酸理论?
 江湖传说2021年前2
江湖传说2021年前2 -
 cj1276 共回答了15个问题
cj1276 共回答了15个问题 |采纳率93.3%如果加热会有SO2生成,如果不加热反应为Na2SO3+2HBr===H2SO3+2NaB1年前查看全部
- 为什么氯化银溶解度比溴化银大,氢溴酸的酸性比盐酸强?
 konnie311年前2
konnie311年前2 -
 月英露 共回答了17个问题
月英露 共回答了17个问题 |采纳率88.2%溶解度也是有规律可循的
比如卤族元素形成的盐类,特别是微溶和不溶的盐类是随着元素的非金属性变化的,非金属性越强,溶解度越大,氟有时候不符合规律
比如:以铅为例,含铅的眼泪溶解度都很小
氯化铅,是微溶,溶解度0.9
溴化铅,0.08,碘化铅,0.06
银也是这样,氯化银,溴化银,碘化银均难溶于水,溶解度越来越小
酸性,主族元素氢化物的酸性均由上到下依次增强.很好理解,主族元素越往下非金属性越弱,和氢元素结合越不牢固,越容易电离出氢离子,所以酸性越来越强.1年前查看全部
- 1,2–二甲基–1–环己烯与氢溴酸发生加成反应为什么更容易得到反式产物
 海的沉默3451年前1
海的沉默3451年前1 -
 StillWaitHere 共回答了18个问题
StillWaitHere 共回答了18个问题 |采纳率88.9%Br原子较大,若形成顺势 则空间张力太大不稳定1年前查看全部
- 浓的氢溴酸有挥发性吗?除了浓盐酸,浓硝酸 ,还有那些酸又挥发性?
 muzis1年前1
muzis1年前1 -
 桥段Y昆明湖 共回答了17个问题
桥段Y昆明湖 共回答了17个问题 |采纳率88.2%是的,挥发性的酸还有氢氟酸HF、氢溴酸HBr,氢碘酸HI,亚硫酸H2SO3、硫化氢(氢硫酸)H2S、醋酸CH3COOH,和其他一些有机酸.1年前查看全部
- 下列物质中能区分乙醇.己烯.己烷的是 溴水 氢溴酸 氢氧化钠
 wf19001年前1
wf19001年前1 -
 brianwy 共回答了20个问题
brianwy 共回答了20个问题 |采纳率90%溴水,对于乙醇没现象,己烯褪色,己烷分层1年前查看全部
- 溴蒸汽加水得到的是氢溴酸还是溴水啊,为什么
 duo-er1年前2
duo-er1年前2 -
 hsxdf 共回答了16个问题
hsxdf 共回答了16个问题 |采纳率87.5%溴蒸气加水得到的是溴水,即大部分溴以单质形式存在,但溴水中有少量的溴发生了以下反应:
Br2 + H2O = HBr + HBrO,所以,溴水中也含有少量的氢溴酸.1年前查看全部
- 氢溴酸和氢碘酸被浓硫酸氧化的产物是什么
 ws_2001年前1
ws_2001年前1 -
 xf2zhs 共回答了24个问题
xf2zhs 共回答了24个问题 |采纳率79.2%先说氢碘酸:
6HI+H2SO4(较浓)===3I2+S+4H2O
8HI(过量)+H2SO4(浓)===H2S↑+4I2+4H2O
2HI+H2SO4(过量)===(加热)H2SO3+I2+H2O
再说氢溴酸:
2HBr+H2SO4(浓)===(加热)SO2↑+Br2↑+2H2O1年前查看全部
- 氢溴酸(HBr)是否有挥发性?它与硫酸、盐酸有何区别?请详细说明.
 wendy10011年前2
wendy10011年前2 -
 用钱赎身 共回答了15个问题
用钱赎身 共回答了15个问题 |采纳率86.7%氢溴酸(HBr)有挥发性
从酸分子电离生成的H+个数上分氢溴酸(HBr)、盐酸(HCl)为一元酸,硫酸(H2SO4)为二元酸,
从是否含有氧元素分氢溴酸(HBr)、盐酸(HCl)为无氧酸,硫酸(H2SO4)为含氧酸1年前查看全部
- 锌粉与氢溴酸反应方程式
 鬼满哥是我1年前1
鬼满哥是我1年前1 -
 zlymt 共回答了13个问题
zlymt 共回答了13个问题 |采纳率92.3%Zn+2HBr=ZnBr2+H21年前查看全部
- 氢溴酸能与哪些盐发生反应?能与哪些金属的氧化物发生反应?请写出方程式
 wukejia0081年前2
wukejia0081年前2 -
 jiaoueioawuu8 共回答了9个问题
jiaoueioawuu8 共回答了9个问题 |采纳率100%氢溴酸与硝酸银:
HBr+AgNO3==AgBr↓+HNO3
氢溴酸与氧化铜:
2HBr+CuO==H2O+CuBr21年前查看全部
- 铁和氢溴酸反应生成什么呢
 想开酒吧1年前1
想开酒吧1年前1 -
 灵魂游走夜的边缘 共回答了22个问题
灵魂游走夜的边缘 共回答了22个问题 |采纳率100%Fe+2HBr==FeBr2+H21年前查看全部
- 溴化碘和水反应为什么生成次碘酸和氢溴酸
 kkd4125131年前1
kkd4125131年前1 -
 ruihua801 共回答了18个问题
ruihua801 共回答了18个问题 |采纳率88.9%解析:溴化碘(IBr)是共价化合物,又因为溴碘的原子半径大,溴化碘(IBr)受到极性水分子的作用,使得I-Br键断裂,生成I带正电,生成Br带负电,水能电离出H+和OH-,它们相互结合,I带正电和OH-生成HIO(即次碘酸),Br带负电和H+结合生成HBr(即氢溴酸).
化学方程式:IBr+H2O=HIO+HB1年前查看全部
- 乙醇与氢溴酸反应为什么断碳氧键而不是氧氢键
 niehui891年前2
niehui891年前2 -
 小样儿贼个性 共回答了20个问题
小样儿贼个性 共回答了20个问题 |采纳率90%乙醇与氢溴酸反应是亲核取代反应,溴原子进攻和羟基相连的碳原子,然后碳氧键逐渐断裂,羟基被溴原子取代.1年前查看全部
- 氢氯酸、氢溴酸、氢碘酸; 硫化氢、硒化氢、碲化氢; 氨、磷化氢、砷化氢; 为什么他们的熔点依次升高?
 realtyy1年前1
realtyy1年前1 -
 落梅初1 共回答了27个问题
落梅初1 共回答了27个问题 |采纳率88.9%同主族元素 从上到下 范德华力越来越大 因此熔点越来越高 所以例如同主族Cl Br I 的氢化物熔点越来越高 不过也有例外 如N O F的氢化物 由于有氢键 比同主族的熔沸点高1年前查看全部
- 乙醇在氢溴酸中,用浓硫酸催化制得溴乙烷的化学方程式
 chendongdong1年前1
chendongdong1年前1 -
 兔子156153997 共回答了21个问题
兔子156153997 共回答了21个问题 |采纳率85.7%CH3CH2OH+HBr→CH3CH2Br+H2O1年前查看全部
- 浓氢溴酸离子反应不拆为什么如题
 swwls11年前4
swwls11年前4 -
 魔眼 共回答了22个问题
魔眼 共回答了22个问题 |采纳率100%知道为什么浓硫酸反应为什么不拆吗?高中课本制取氯气是,浓盐酸(就是浓的氢氯酸,和浓溴酸化学性质相似)不也是不拆吗?这也是书本上的规定,浓的酸,比如浓硫酸和浓盐酸的,水分子就很少了,很多的物质还是以分子形式存在,水分子都不够用.因此,课本上就规定了,浓的酸就不能拆了,因为实际反应的粒子还是分子多.那么,浓氢溴酸不拆,也就符合人家课本的要求了.其实,这都是我们学习时的规定,灵活掌握就好了.1年前查看全部
- 乙醇与氢溴酸反应需要浓硫酸做催化剂吗
 苹果熊-applebear1年前2
苹果熊-applebear1年前2 -
 月亮的弯弯 共回答了23个问题
月亮的弯弯 共回答了23个问题 |采纳率87%需要,没有浓硫酸反应很慢的
在高中阶段是不考虑这个的,
可以反应但是很慢,
用浓硫酸一是催化剂,二是生成的水可以被浓硫酸吸收,有利于反应的进行1年前查看全部
- 氢溴酸,氢碘酸分别是弱酸还是强酸啊
 rr之路1年前5
rr之路1年前5 -
 lucky55cn 共回答了18个问题
lucky55cn 共回答了18个问题 |采纳率94.4%都是氧化性强的元素
所以它们的氢化物都是具有强酸性
但氢碘酸酸性比氢溴酸强1年前查看全部
- 正丁醇与氢溴酸直接反应制备1-溴丁烷如何反应
 thresholdsw1年前1
thresholdsw1年前1 -
 417young 共回答了20个问题
417young 共回答了20个问题 |采纳率95%原理:主反应:
NaBr + H2SO4 → HBr + NaHSO4
n-C4H9OH + HBr → C4H9Br + H2O1年前查看全部
- 在亚硫酸和氢溴酸的混合溶液中通氯气,氯气怎么反应?
 wangyc31年前2
wangyc31年前2 -
 moxiang1987 共回答了20个问题
moxiang1987 共回答了20个问题 |采纳率95%因为亚硫酸的还原性比溴离子强,所以氯气先氧化亚硫酸,再氧化溴离子.
1、H2SO3+Cl2+H2O==H2SO4+2HCl
2、2HBr+Cl2==2HCl+Br21年前查看全部
- 氢溴酸、氢碘酸与稀硝酸反应 方程式
氢溴酸、氢碘酸与稀硝酸反应 方程式
如题 sevra1年前2
sevra1年前2 -
 hjbboy 共回答了17个问题
hjbboy 共回答了17个问题 |采纳率82.4%我还是写离子方程式吧,因为反应的是原理,比方程式更重要
2NO3- +6I- +8H+3Br2+2NO↑+4H2O
要注意这些反应必须得在酸性条件下才可以,不是酸性条件就不反应1年前查看全部
- 高锰酸钾和氢溴酸溶液可以发生下列反应:KMnO4+HBr——Br2+MnBr2+KBr+H2O,怎样配平(讲解一下)?
高锰酸钾和氢溴酸溶液可以发生下列反应:KMnO4+HBr——Br2+MnBr2+KBr+H2O,怎样配平(讲解一下)?
消耗0.1mol氧化剂,则被氧化的还原剂的物质的量是多少? tingsweet1年前1
tingsweet1年前1 -
 微笑成诗 共回答了20个问题
微笑成诗 共回答了20个问题 |采纳率100%2KMnO4 + 16HBr = 5Br2 + 2MnBr2 + 2KBr + 8H2O
反应里还原剂是10 molHBr,6mol HBr没有被氧化.
2KMnO4 10 HBr
0.1 X
得到X=5 mol
被氧化的还原剂的有5 mol1年前查看全部
- 请比较下 碳酸,乙酸,苯酚,次氯酸,高氯酸,氢硫酸,氢溴酸,氢碘酸,磷酸,亚硫酸 的酸性强弱.
 zhouguihua171年前3
zhouguihua171年前3 -
 啊理狼 共回答了19个问题
啊理狼 共回答了19个问题 |采纳率84.2%高氯酸 氢溴酸 氢碘酸 磷酸 乙酸 亚硫酸 氢硫酸 碳酸 苯酚1年前查看全部
- 溴水为什么是橙色?氢溴酸是什么颜色?次溴酸是什么颜色?
 wk703231年前2
wk703231年前2 -
 空心水竹 共回答了17个问题
空心水竹 共回答了17个问题 |采纳率76.5%Br2溶于水中才是橙色的,单质溴是红色的
至于颜色为什么是橙色,是因为距反射白光中的橙光.至于为什么距反射白光中的橙光,
HBr,HBrO都是无色的1年前查看全部
- 如何测定氢溴酸中溴离子的含量?
 shenbo2261年前2
shenbo2261年前2 -
 zybn2004 共回答了22个问题
zybn2004 共回答了22个问题 |采纳率90.9%用标准AgNO3溶液进行滴定1年前查看全部
- 在水中,盐酸、氢溴酸、氢碘酸、高氯酸都是强酸,很难区别它们的强弱,这是由于________________引起的.
在水中,盐酸、氢溴酸、氢碘酸、高氯酸都是强酸,很难区别它们的强弱,这是由于________________引起的.
在水中,盐酸、氢溴酸、氢碘酸、高氯酸都是强酸,很难区别它们的强弱,这是由于__________________________________
引起的.如果把HCl、HBr、HI等溶于纯的醋酸中,它们的强弱就可以明显地区别开来.这种作用叫
_________________________________. SUCIOIMS1年前1
SUCIOIMS1年前1 -
 萨King 共回答了20个问题
萨King 共回答了20个问题 |采纳率90%(1)它们都是强电解质,水中完全电离
(2)区分效应1年前查看全部
- 在水中,盐酸,氢溴酸,氢碘酸,高氯酸都是强酸,很难区别它们的强弱,这是由于________
 Ashley洛诗1年前1
Ashley洛诗1年前1 -
 fish827 共回答了18个问题
fish827 共回答了18个问题 |采纳率94.4%它们都是强电解质,水中完全电离.
不过其实只能说绝大部分电离,同浓度HI酸酸性最大.1年前查看全部
- 氢氟酸为什么是弱酸?氟、氯、溴是同一族的,为什么氢溴酸、氢碘酸是强酸,氢氟酸是弱酸?
 xiaoyu5215261年前5
xiaoyu5215261年前5 -
 碧空孤鹰 共回答了26个问题
碧空孤鹰 共回答了26个问题 |采纳率96.2%HF在水中不完全电离,因为F的半径太小,电负性太高,HF之间氢键太强,F-离子在水中溶剂化过于明显,所以导致HF电离不顺利1年前查看全部
- 工业五强酸中弱电解质是否含有氢碘酸,氢溴酸.能否被电离.
 花拈叶1年前1
花拈叶1年前1 -
 红景天 共回答了26个问题
红景天 共回答了26个问题 |采纳率92.3%氢碘酸,氢溴酸酸性比盐酸强,属于强酸,完全电离.1年前查看全部
- 化学书上有乙醇与氢溴酸的反应,那乙醇与盐酸反映吗
化学书上有乙醇与氢溴酸的反应,那乙醇与盐酸反映吗
其它醇呢 zjlxl1年前2
zjlxl1年前2 -
 yefenggulang 共回答了20个问题
yefenggulang 共回答了20个问题 |采纳率80%不反应,但是乙醇在浓盐酸和氯化锌下可以发生卤化反应
浓盐酸加氯化锌就是传说中的卢卡斯试剂啊,专门鉴定低级伯仲叔醇的.1年前查看全部
- 在100ml含等物质的量氢溴酸和亚硫酸的溶液里通入0.01mol氯气,
在100ml含等物质的量氢溴酸和亚硫酸的溶液里通入0.01mol氯气,
有一半溴离子变为溴单质(溴单质能氧化亚硫酸)求原溶液氢溴酸的浓度?
反应中+有H2S生成吗?请详写。 vvhua1年前1
vvhua1年前1 -
 我家的oo数不清 共回答了11个问题
我家的oo数不清 共回答了11个问题 |采纳率90.9%方程懒得写了
设原溶液含HBr xmol,一半参加反应:故0.5xmolBr2 故反应掉Cl2 0.25xmol
所以含H2SO3 xmol
x+0.25x=0.01
x=0.008mol
故.008/.1=.08mol/L
写错了………………不过没影响1年前查看全部
- 溴化钠,溴化钾,溴酸钠,氢溴酸分别属于几级危险品
 josephine02111年前1
josephine02111年前1 -
 魂没 共回答了17个问题
魂没 共回答了17个问题 |采纳率82.4%溴化钠,溴化钾,溴酸钠属于危险品的第六等级,是有毒物质;氢溴酸属于危险品的第八等级,是腐蚀品.1年前查看全部
- 为什么氢氟酸,氢氯酸,氢溴酸,氢碘酸它们的酸性逐渐增强?
为什么氢氟酸,氢氯酸,氢溴酸,氢碘酸它们的酸性逐渐增强?
用高二学生能听懂的话解释. 雪侯鸟1年前1
雪侯鸟1年前1 -
 bbkcwch 共回答了17个问题
bbkcwch 共回答了17个问题 |采纳率88.2%虽然据元素周期表的规律,卤族元素从上到下氧化性是逐渐减弱的,但是在这里需要考虑到氢键.原因:H-F键的键能比其它的H-X键能大得多,大约是H-I 键能的两倍,且在水溶液中HF分子由于形成氢键而不同程度地缔合着(主要原因是氢键的作用),这种缔合作用降低了HF的电离程度,所以HF的酸性比其它的HX要弱,同理,其它的也是这样的原因,所以氢氟酸,氢氯酸,氢溴酸,氢碘酸它们的酸性是逐渐增强的.
求最佳1年前查看全部
- 分离 硝酸 盐酸 氢硫酸 氢碘酸 氢溴酸 用什么试剂
分离 硝酸 盐酸 氢硫酸 氢碘酸 氢溴酸 用什么试剂
只能用一种试剂 wushiwu551年前2
wushiwu551年前2 -
 Yangxinzhen 共回答了18个问题
Yangxinzhen 共回答了18个问题 |采纳率83.3%太简单了,滴加硝酸银,有黑色沉淀的是硫化氢,黄色沉淀的是碘化氢,有淡黄色沉淀的是溴化氢,白色沉淀的是盐酸,没反应的是硝酸!1年前查看全部
- 比较下列物质的酸性次氯酸 氢硫酸 碳酸 硅酸 乙酸 氢碘酸 氢溴酸
 swinfo1年前3
swinfo1年前3 -
 gigilau 共回答了26个问题
gigilau 共回答了26个问题 |采纳率92.3%氢碘酸 氢溴酸 乙酸 碳酸 氢硫酸 次氯酸 硅酸 (强到弱)
高氯酸,氢碘酸,硫酸,氢溴酸,盐酸,硝酸,碘酸(以上为强酸,了解即可,大学涉及强弱排序),草酸(乙二酸),亚硫酸,磷酸,丙酮酸,亚硝酸(以上五种为中强酸),柠檬酸,氢氟酸,苹果酸,葡萄糖酸,甲酸,乳酸,苯甲酸,丙烯酸,乙酸,丙酸,硬脂酸,碳酸,氢硫酸,次氯酸,硼酸,硅酸,苯酚
以上强到弱,有时间看看、背背.1年前查看全部
大家在问
- 1初三英语选择填空题解答1.Mike was tired because he didn't___well last ni
- 2佚之狐言于郑伯曰 的之 用法和意义
- 3关于定语从句 whom的用法.① whom的用法是什么?This is the house in which Lu Xu
- 4从第一段看,作者认为“凡职业没有不是可敬的”的原因是什么?
- 51,已知锐角三角形的两边长为2和3,那么第三边长Ⅹ的取值范围----- 2,在△ABC中,已知A=60度,a=1,b+c
- 6如何一定上图的火柴棒,使得上图的面积是下图面积的3倍?
- 7根据意思完成句子 1 What was the weather like last week?It______ ____
- 8《刻舟记》中描写景色与高峡出平湖的美景相似的两句是
- 9袋子摸球概率题有48个球 25个白球 23个黑球,一次任取3个,问取到3个,2个,1个,0个白球的概率
- 10太阳活动的类型 类型 活动周期为
- 11求 关于志愿者的作文 谢谢学霸
- 12读长江某年的汛期水位、流量变化过程线图和流域内4个行政区的灾情统计表,回答问题。
- 13thanksgiving in the united states课文中有几个短语
- 14y=−x2−2x+3的单调减区间是______.
- 15多少钱打七折等于70元
