1-18号元素的化合价(多种)
 sunxiaomei282022-10-04 11:39:544条回答
sunxiaomei282022-10-04 11:39:544条回答
已提交,审核后显示!提交回复
共4条回复
 晨风ny 共回答了19个问题
晨风ny 共回答了19个问题 |采纳率89.5%- H:0价H2,+1价HCl,-1价NaH.
He:只有0价.
Li:+1价.LiCl
Be:+2价.BeCl2
B:-3价BH3
C:0,+2.+4,-4分别有C,CO,CO2,CH4.
N:-3.0.+3.+4.+5分别有NH3,N2,N2O3 ,NO2,HNO3
O:-2.-1.0分别有CO,Na2O2,O2
F:0.-1分别有F2,HF
Ne:0
Na:0.+1分别有Na,NaCl
Mg:0+2分别有Mg,MgO
Al:0.+3分别有Al,AlCl3
Si:0.-4.+4分别有Si,SiH4,SiO2
P:0.+3+5有P,P2O5,PCl3
S:-2.0.+4.+6分别有H2S,S,SO2,SO3
Cl:-1.0.+4.+7+5分别有HCl,Cl2,ClO2,HClO4,HClO3.
Ar:0 - 1年前
 ee红颜 共回答了3个问题
ee红颜 共回答了3个问题 |采纳率- 钠钾银氢正一价,镁钙锌钡正二价,通常氧显负二价
- 1年前
 youlidou 共回答了12个问题
youlidou 共回答了12个问题 |采纳率- 1:1
2:0
3:1
4:2
5:3
6:很多
7:-3 1 2 3 4 5
8:-2 -1 2
9:-1
10:0
11:1
12:2
13:3
14:4
15:-3~5
16:-2~6
17:-1
18:0 - 1年前
 gerenbeya 共回答了6个问题
gerenbeya 共回答了6个问题 |采纳率- 1:1 2:0 3:1 4:2 5:3 7:-3 1 2 3 4 5 8:-2 -1 2
9:-1 10: 011:1 12:2 13:3 14:4 15:-3~5 16:-2~6 17:-1 18:0 - 1年前
相关推荐
- 有什么沉淀是淡黄色的?它是由1-18号元素和氯元素中的一种或几种组成的
 文明医生1年前1
文明医生1年前1 -
 nananananana 共回答了14个问题
nananananana 共回答了14个问题 |采纳率92.9%硫单质 S(16号)1年前查看全部
- (2014•湘潭)1869年,门捷列夫发现了元素周期律,使得化学学习和研究变得有规律可循.下表列出的是1-18号元素的部
(2014•湘潭)1869年,门捷列夫发现了元素周期律,使得化学学习和研究变得有规律可循.下表列出的是1-18号元素的部分最高正化合价和最低负化合价.请阅读并回答下列问题:

(1)12号元素属于______元素(填“金属”或“非金属”),它在化学反应中形成的离子与______ (填元素符号)原子具有相同的核外电子排布;
(2)16号元素的原子核外电子数为______,推测该元素最高正化合价为______,最低负化合价与氢形成的化合物的化学式为______;
(3)从上表,我们可以发现一些规律______(写一条即可) evenyi1年前1
evenyi1年前1 -
 wenwth 共回答了18个问题
wenwth 共回答了18个问题 |采纳率88.9%解题思路:根据已有的知识进行分析,镁元素属于金属元素,在化学反应中易失去电子,硫元素在化学反应中易得到电子,形成硫离子,根据表格提供的信息可以看出,同一列元素具有相同的化合价.(1)12号元素是镁元素,属于金属元素,失去电子后,形成的镁离子与氖原子具有相同的核外电子排布,故填:金属,Ne;
(2)16号元素的原子核外电子数为16,最外层电子数为6,该元素最高正化合价为+6价;最低负化合价为-2价,氢的化合价为+1价,最低负化合价与氢形成的化合物的化学式为:H2S;故填:16,+6,H2S;
(3)根据表格提供的信息可以看出,最高正化合价的数值与最外层电子数相同;故填:最高正化合价的数值与最外层电子数相同.点评:
本题考点: 元素周期表的特点及其应用;化学式的书写及意义.
考点点评: 本题考查了元素周期表的应用,完成此题,可以依据已有的知识进行.1年前查看全部
- 试着画出1-18号原子的原子结构示意图
 tymb1年前0
tymb1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2008•肇庆一模)已知1-18号元素的离aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方
(2008•肇庆一模)已知1-18号元素的离aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
A.四种元素位于同一周期
B.氢化物的稳定性H2Y>HZ
C.离子的氧化性aW3+>bX+
D.a+3=c-2 li09881年前1
li09881年前1 -
 开始喜欢文学 共回答了19个问题
开始喜欢文学 共回答了19个问题 |采纳率78.9%解题思路:1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,结合元素周期律解答.1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,处于第二周期,故Y为O元素,Z为F元素,W、X为金属处于第三周期,W为Al元素,X为Na元素,
A.Y为O元素,Z为F元素,处于第二周期,W为Al元素,X为Na元素,处于第三周期,故A错误;
B.非金属性F>O,非金属性越强氢化物越稳定性,氢化物稳定性为HZ>H2Y,故B错误;
C.金属性Na>Al,金属性越强,阳离子氧化性越弱,故氧化性Al3+>Na+,故C错误;
D.离子核外电子数相等,所以a-3=c+2,故D错误.
故选A.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.1年前查看全部
- 已知A、B、C、D四种1-18号元素,核电荷数依次增大,单质A是最轻的气体,A、B形成的化合物是实验室中最常见的溶剂,单
已知A、B、C、D四种1-18号元素,核电荷数依次增大,单质A是最轻的气体,A、B形成的化合物是实验室中最常见的溶剂,单质C常用于做导线,D的单质呈黄色.则:
(1)B元素符号是:______;
(2)画出D的原子结构示意图______;
(3)B与C形成的化合物的化学式是:______;
(4)由上述四种元素形成的化合物发生中和反应的化学方程式是:______. 北岸哥哥1年前1
北岸哥哥1年前1 -
 chaping 共回答了18个问题
chaping 共回答了18个问题 |采纳率83.3%解题思路:(1)已知:A、B、C、D四种1-18号元素,核电荷数依次增大,单质A是最轻的气体,A、B形成的化合物是实验室中最常见的溶剂,单质C常用于做导线,D的单质呈黄色;则A为氢元素,B为氧元素,C为铝元素,D为硫元素;
(2)因为D为硫元素,质子数=核外电子数=16,故可画出D的原子结构示意图;
(3)已知B为氧元素,C为铝元素,则可书写B与C形成的化合物的化学式;
(4)由上述四种元素形成的化合物发生中和反应(酸与碱的反应)的化学方程式是:Al(OH)3与H2SO4反应.(1)由题意,推测B为氧元素,故其元素符号是:O;
(2)因为D为硫元素,质子数,=核外电子数=16,故可画出D的原子结构示意图 ;
;
(3)已知B为氧元素,C为铝元素,则可书写B与C形成的化合物的化学式是:已知铝元素的化合价为+3价,氧元素的化合价为-2价,标注化合价,利用化合价数值交叉法书写化学式为Al2O3;
(4)由上述四种元素形成的化合物,发生中和反应(酸与碱的反应)的化学方程式是:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.
故答为:(1)O;
(2) ;
;
(3)Al2O3;
(4)2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O.点评:
本题考点: 化学符号及其周围数字的意义;原子的定义与构成;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写;根据题意正确书写化学方程式.1年前查看全部
- 在1-18号化学元素中,含氢质量分数最高的气态氢化物是?
在1-18号化学元素中,含氢质量分数最高的气态氢化物是?
水溶液能使红色石蕊试纸变蓝色的气态氢化物是? 940914411年前1
940914411年前1 -
 傻子小白 共回答了12个问题
傻子小白 共回答了12个问题 |采纳率83.3%CH4
NH31年前查看全部
- 1-18号元素中最高正价为+6价的是
 寻找BY1年前3
寻找BY1年前3 -
 121414 共回答了21个问题
121414 共回答了21个问题 |采纳率85.7%硫,常见的是SO3就是正六价嘛1年前查看全部
- ABCD是1-18号元素,AB元素的阳离子和CD无素的阴离子都具有相同的电子层结构,且B无不原子的最外层电子数比A元素原
ABCD是1-18号元素,AB元素的阳离子和CD无素的阴离子都具有相同的电子层结构,且B无不原子的最外层电子数比A元素原子的最外层电子数少,C的阴离子所带的负电荷多,则它们的核电荷数大小关系是()
A.A大于B大于D大于C
B.C大于B大于A大于D
C.A大于B大于C大于D
D.B大于A大于C大于D 323239101年前1
323239101年前1 -
 猪年有猪运 共回答了22个问题
猪年有猪运 共回答了22个问题 |采纳率100%AB元素的阳离子和CD无素的阴离子都具有相同的电子层结构
所以AB(第三周期)>CD(第二周期)
且B元素原子的最外层电子数比A元素原子的最外层电子数少
所以A>B
C的阴离子所带的负电荷多
所以C>D
结果A>B>C>D 选C1年前查看全部
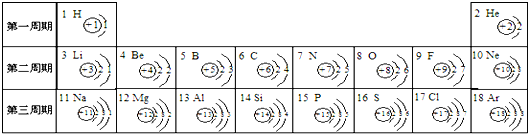
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图:
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图:
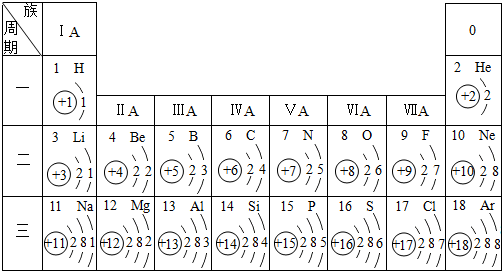
(1)核电荷数为11的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;核电荷数为9的元素属于______元素(填“金属”或“非金属”),与该元素化学性质相似的另一元素是______.
(2)对1-18号元素的原子结构示意图进行分析,可以发现许多规律,如第一周期元素的原子核外只有一个电子层.请再总结出其它规律,并写出其中两条:
①______;
②______. wuwazhi1年前1
wuwazhi1年前1 -
 两富事 共回答了20个问题
两富事 共回答了20个问题 |采纳率95%解题思路:根据元素周期表中每一个周期都从金属元素开始,到稀有气体元素结束(第一周期从非金属元素氢开始).根据图表找规律的一般方法是对比分析法,即将表中所给的信息,从横向和纵向及整体进行对比,找出其相同点和不同点,综合提炼出新的信息也就是其中隐含的规律.在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化,元素的种类(金属、非金属、稀有气体)和元素性质,也发生规律性的变化,解答本题.(1)从元素周期表中可查出核电荷数为11的元素符号Na则名称是钠,是金属元素,最外层电子的数目一般少于4个,在化学反应中金属元素的原子比较容易失去最外层电子,非金属元素的原子比较容易获得电子得到稳定结构;根据最外层电子数,核电荷数为9的元素属于非金属元素,根据元素周期律与该元素化学性质相似的另一元素是最外层电子数相同,为氯,故答案为:钠;失;非金属;氯(Cl);
(2)在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化,元素的种类(金属、非金属、稀有气体)和元素性质,也发生规律性的变化,故答案为:
①每一周期元素的原子的核外电子层数相同;第二周期元素的原子核外有两个电子层
②第三周期元素的原子核外有三个电子层.每一周期元素原子的最外层电子数从左到右逐渐增加;每一纵列元素原子的最外层电子数相同等.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期表中的一些变化规律的归纳和总结,并学以致用.1年前查看全部
- 在1-18号元素中,与氟化学性质相似的另一元素是
 zhang9710031年前3
zhang9710031年前3 -
 tjwxg 共回答了15个问题
tjwxg 共回答了15个问题 |采纳率86.7%应该是Cl(氯)元素,在化学元素周期表中与其在同一竖列,比它多一个电子层(8个电子)1年前查看全部
- (2013•黔东南州)A,B,C,D是1-18号元素中的四种元素,B原子有三个电子层,第一层与最外层电子数相等;A原子的
(2013•黔东南州)A,B,C,D是1-18号元素中的四种元素,B原子有三个电子层,第一层与最外层电子数相等;A原子的核外电子数比B原子核外电子数少1;C原子的最外层电子数是次外层电子数的2倍;D原子核电荷数比C原子核电荷数多2.请回答:

(1)请在表格中用实线完善元素周期表的边框,并标出C在元素周期表的位置.
(2)B的离子符号______原子结构示意图为______;
(3)A与D两种元素可组成微粒个数比为1:1的物质______.(填化学式) phl131年前1
phl131年前1 -
 东啊子东 共回答了13个问题
东啊子东 共回答了13个问题 |采纳率92.3%解题思路:(1)根据元素周期表的结构以及元素的分布情况来画;
(2)依据该元素的核外电子层结构推知元素的种类,依据其最外层电子数确定其离子的带电情况;
(3)依据AD两元素的特点推知元素的名称,而后利用条件确定该物质的化学式;(1)元素周期表的结构以及元素的分布情况,绘制部分边界如下:
C原子的最外层电子数是次外层电子数的2倍,则说明C元素的原子核外有6个电子,则其原子序数是6,则是碳元素,故该元素在周期表中的位置是: ;
;
(2)B原子有三个电子层,第一层与最外层电子数相等,则B的核外电子数是12,由于核外电子数等于其核内质子数,所以该元素是镁元素,化学反应中易失掉核外最外层的两个电子,故其离子符号是Mg2+;原子结构示意图是 ;
;
(3)A原子的核外电子数比B原子核外电子数少1,则A的核外电子数是11,质子数也为11是钠元素,D原子核电荷数比C原子核电荷数多2,故D元素是氧元素,两种元素可组成微粒个数比为1:1的物质是Na2O2;
故答案为:(1) ;
;
(2)Mg2+; ;(3)Na2O2;
;(3)Na2O2;点评:
本题考点: 物质的鉴别、推断;元素周期表的特点及其应用;化学符号及其周围数字的意义.
考点点评: 本题考查元素周期表和元素周期律,熟悉元素周期表的结构及元素的推断是解答本题的关键,并注重利用元素周期律、单质、化合物的性质、化学用语来解答即可,难度不大.1年前查看全部
- 下表是1-18号元素的排列情况,在空白处填写元素的名称与符号
下表是1-18号元素的排列情况,在空白处填写元素的名称与符号
3锂Lix094铍Bex095硼Bx096碳Cx097氮Nx098氧Ox099氟Fx0910氖Ne
11钠Nax0912镁Mgx0913铝Alx0914硅Six0915磷Px0916硫Sx0917氯Clx0918氩Ar
找出它们的规律 东方赤子20041年前2
东方赤子20041年前2 -
 2007进ss 共回答了17个问题
2007进ss 共回答了17个问题 |采纳率100%化学元素周期表
1氢H
2氦He
3锂Li
4铍Be
5硼B
6碳C
7氮N
8氧O
9氟F
10氖Ne
11钠Na
12镁Mg
13铝Al
14硅Si
15磷P
16硫S
17氯Cl
18氩A1年前查看全部
- 1-18号元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是____
1-18号元素中,最活泼的金属元素是_____,最活泼的非金属元素是_____,最不活泼的元素是____
最高价氧化物对应水化物中,酸性最强的是_______,碱性最强的是______,呈两性的氢氧化物是______.原子半径最大的是_____,原子半径最小的是_____.在11与13号元素中,化学性质较活泼的是______,怎样用化学实验证明_____ . 英雄0081年前2
英雄0081年前2 -
 浮尘海沙 共回答了22个问题
浮尘海沙 共回答了22个问题 |采纳率100%Na
F
He
HClO4
Al(OH)3,Be(OH)2
Na
H
Na
Na与冷水直接反应,Al不反应.1年前查看全部
- (8分)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:
(8分)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

(1)画出D的原子结构示意图 ;
(2)写出C的最高价氧化物的电子式 ;
(3)E和F分别形成的气态氢化物中最稳定的是 (填写氢化物的化学式)
(4)A最高价氧化物的水化物的化学式 。 清新风吹1年前1
清新风吹1年前1 -
 永咏 共回答了12个问题
永咏 共回答了12个问题 |采纳率83.3%1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图:
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图:

(1)核电荷数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子,形成______(填“阳”或“阴”)离子.
(2)原子的化学性质比较稳定的元素是______(填一种元素名称),写出核电荷数为13的元素的原子形成的离子的符号:______.
(3)对1-18号元素的原子结构示意图进行分析,可以发现许多规律,如第一周期元素的原子核外只有一个电子层.请再总结其它规律,写出其中一条:______. 76297641年前1
76297641年前1 -
 yadali0 共回答了20个问题
yadali0 共回答了20个问题 |采纳率85%解题思路:(1)根据元素周期表的信息以及最外层电子数来分析解答;
(2)最外层有8个电子的原子结构(氦为2个)为稳定结构;根据核电荷数确定元素名称,根据最外层电子数确定离子带电情况;
(3)在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化,元素的种类(金属、非金属、稀有气体)和元素性质,也发生规律性的变化,解答本题.(1)核电荷数为17的元素是氯元素;其最外层有7个电子,在化学反应中易得电子,而形成阴离子;
(2)最外层有8个电子的原子结构(氦为2个)为稳定结构,则上表中化学性质比较稳定的元素是氦、氖和氩;13号元素是铝元素,最外层有3个电子,在化学反应中易失去最外层的3个电子,形成带三个单位正电荷的铝离子;
(3)在元素周期表中,随原子序数的递增,原子结构中电子层数、最外层电子数发生规律性的变化,元素的种类(金属、非金属、稀有气体)和元素性质,也发生规律性的变化.
故答案为:
(1)氯,得,阴;(2)氦(氖或氩),Al3+;(3)第二周期元素的原子核外有两个电子层等(合理答案均可).点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期表中的一些变化规律的归纳和总结,并学以致用.1年前查看全部
- 已知1-18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构, 下列
已知1-18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构, 下列关系正确的是 [ ]A.质子数c>b
B.离子的还原性Y 2- >Z -
C.氢化物的稳定性H 2 Y>HZ
D.原子半径X 好奇uu猪1年前1
好奇uu猪1年前1 -
 zhenzhen5166 共回答了27个问题
zhenzhen5166 共回答了27个问题 |采纳率96.3%B1年前查看全部
- 在原子序数为1-18号元素中: (1)与水反应最剧烈的金属是_____________(填元素符号)。(2)与水反应最剧
在原子序数为1-18号元素中:
(1)与水反应最剧烈的金属是_____________(填元素符号)。
(2)与水反应最剧烈的非金属单质是_____________(填分子式)。
(3)最高价氧化物对应水化物的酸性最强的元素是_____________(填元素符号)。 仿如流星1年前1
仿如流星1年前1 -
 hysitaria 共回答了24个问题
hysitaria 共回答了24个问题 |采纳率83.3%(1)Na
(2)F 2
(3)Cl1年前查看全部
- 在原子序数1-18号元素中:(1)与水反应最剧烈的金属是?(2)与水反应最剧烈的非金属单质是?(3)原子半经最...
在原子序数1-18号元素中:(1)与水反应最剧烈的金属是?(2)与水反应最剧烈的非金属单质是?(3)原子半经最...
在原子序数1-18号元素中:(1)与水反应最剧烈的金属是?(2)与水反应最剧烈的非金属单质是?(3)原子半经最小的元是? 峰林晚1年前4
峰林晚1年前4 -
 dd和尚 共回答了14个问题
dd和尚 共回答了14个问题 |采纳率92.9%1)与水反应最剧烈的金属是:Na
2)与水反应最剧烈的非金属单质是:F2
3)原子半经最小的元素:H1年前查看全部
- 原子序数为1-18号的元素中,下列叙述正确的是( )
原子序数为1-18号的元素中,下列叙述正确的是( )
A. 最外层只有1个电子的元素一定是金属元素
B. 最外层只有2个电子的元素一定是金属元素
C. 原子核外各层电子数相等的元素不一定是金属元素
D. 核电荷数为17的元素的原子在化学反应中容易得到1个电子 落日风雪1年前1
落日风雪1年前1 -
 ecmen 共回答了16个问题
ecmen 共回答了16个问题 |采纳率100%解题思路:A.最外层只有一个电子的元素可能是非金属元素;
B.最外层只有2个电子的元素可能是非金属元素;
C.原子核外各层电子数相等的元素可能是金属元素;
D.核电荷数为17的元素是Cl元素,其最外层有7个电子,在反应中易得电子.A.最外层只有一个电子的元素可能是非金属元素,如H元素,故A错误;
B.最外层只有2个电子的元素可能是非金属元素,如He元素,故B错误;
C.原子核外各层电子数相等的元素可能是金属元素,如Be元素,故C错误;
D.核电荷数为17的元素是Cl元素,其最外层有7个电子,在反应中易得1个电子使最外层达到8电子稳定结构,故D正确;
故选D.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查了元素原子结构和元素周期表,根据原子结构确定元素,会利用反例法分析解答,题目难度不大.1年前查看全部
- 1、1-18号元素中X元素原子最外层只有1个电子.Y元素中原子的第3层有6个电子.Z元素第二层也有6个电子.在化合物中只
1、1-18号元素中X元素原子最外层只有1个电子.Y元素中原子的第3层有6个电子.Z元素第二层也有6个电子.在化合物中只有Z元素的化合价为负,由3种元素组成的化合物的化学式可能是什么?1、XYZ4 2、X2YZ3 3、X3YZ4 4、XYZ3
2、已知R元素的相对原子质量是M与其原子核内的质子数和中子数之和在数值上相等.若R(2+)-(标在R右上边的) 核外又X个电子.则这个原子核的总指数为? 离开以后1231年前3
离开以后1231年前3 -
 网球好男儿 共回答了25个问题
网球好男儿 共回答了25个问题 |采纳率100%1. 由已知,得:X元素显+1价(应是Na),Y元素为S元素,可能显+4或+6价,Z元素为O
显-2价,所以化学式可能为X2YZ4(Na2SO4)或X2YZ3(Na2SO3亚硫酸钠),而答案中只有X2YZ3(Na2SO3),所以选B.
2. 由已知,得:该元素得核电荷数为 X+2 ,若质子数=中子数,
则中子数=M/2=X+21年前查看全部
- 图表是整理数据,发现其中规律的一种重要工具. 1-18号元素原子最外层电子数与原子序数的关系如图.
图表是整理数据,发现其中规律的一种重要工具. 1-18号元素原子最外层电子数与原子序数的关系如图.

试回答:
(1)第三周期11-18号元素原子最外层电子数变化的趋势是______.
(2)图中He与Ne.Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因是:______.
(3)某粒子的结构示意图为: 则该粒子有______个电子层,X的值为______
则该粒子有______个电子层,X的值为______
(4)该粒子的化学性质与下列______ (填 序号)元素的化学性质最相似.
(5)如果该粒子带一个单位的负电荷,则离子符号为______. 心中之歌1年前1
心中之歌1年前1 -
 千米不是距离 共回答了25个问题
千米不是距离 共回答了25个问题 |采纳率100%解题思路:(1)根据原子最外层电子数分析
(2)根据最外层电子数是否达到稳定结构分析
(3)根据最外层电子数确定是原子还是离子,从而确定质子数
(4)最外层电子数决定元素化学性质
(5)根据离子符号的书写方法书写(1)由原子结构最外层电子数可以看出从11~18号元素原子最外层电子数从1递增到8(2)He只有一个电子层,排布两个电子达到相对稳定结构,Ne.Ar原子最外层电子数为8,也达到相对稳定结构(3)该粒子最外层有7个电子...
点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查原子结构示意图与元素周期表的关系,最外层电子数相同化学性质相似.1年前查看全部
- 如图是元素周期表中1-18号元素的原子结构示意图,观察图,探究下列问题:
如图是元素周期表中1-18号元素的原子结构示意图,观察图,探究下列问题:

(1)核外电子是______排布的.第一层电子数不超过______个;第二层电子数不超过______个;最外层电子数不超过______个.
(2)周期数═______.同一周期的元素,①______相同;
②______逐渐递增;③每周期开头的是______类型的元素,靠近尾部的是______类型的元素,结尾的是______类型的元素.
(3)族数═______.同族元素,①______相同;②______相似;③______逐渐递增.
(4)填充下表:
(5)最外层为______个电子(只有1个电子层时______个)的结构称为稳定结构.在化学反应中,元素的原子通过得或失电子形成相对稳定结构.元素种类 举 例 原子的最外层电子数 得失电子的趋势 元素的化学性质 ①金属元素 Na、Mg、Al ______ ______ ______ ②非金属元素 O、Cl、S、P ______ ______ ______ ③稀有气体元素 He、Ne、Ar ______ ______ ______
结论:元素的化学性质与______,特别是______有密切的关系.即______决定元素的化学性质. 0醉生梦yy01年前1
0醉生梦yy01年前1 -
 414972728 共回答了25个问题
414972728 共回答了25个问题 |采纳率84%解题思路:(1)根据核外电子的排布规律进行解答;
(2)根据周期数等于原子的电子层数以及同一周期中分布规律进行解答;
(3)根据族数原子的最外层电子数以及同一主族中分布规律进行解答;
(4)根据金属元素、非金属元素、稀有气体元素的最外层电子数进行归纳总结;
(5)根据最外层为8个电子(只有1个电子层时2个)的结构称为稳定结构以及元素的化学性质与最外层电子的数目最为紧密进行解答.(1)核外电子是排布的.第一层电子数不超过2个;第二层电子数不超过8个;最外层电子数不超过8个.
(2)周期数═.原子的电子层数,同一周期的元素,①原子的电子层数相同;②从左到右原子的最外层电子数逐渐递增;③每周期开头的是金属类型的元素,靠近尾部的是非金属类型的元素,结尾的是稀有气体类型的元素.
(3)族数═原子的最外层电子数.同族元素,①原子的最外层电子数相同;②元素的化学性质相似;③从上到下原子的电子层数逐渐递增.
(4)
元素种类 举 例 原子的最外层电子数 得失电子的趋势 元素的化学性质
①金属元素 Na、Mg、Al 一般少于4个 失电子 不稳定
②非金属元素 O、Cl、S、P 一般多于或等于4个 得电子 不稳定
③稀有气体元素 He、Ne、Ar 8个电子(He为2个) 一般不得失电子 比较稳定(5)最外层为8个电子(只有1个电子层时2个)的结构称为稳定结构.在化学反应中,元素的原子通过得或失电子形成相对稳定结构.
结论:元素的化学性质与其原子的核外电子排布,特别是最外层电子的数目有密切的关系.即原子的最外层电子数决定元素的化学性质.
故答案为:(1)分层;2;8;8;(2)原子的电子层数; ①原子的电子层数; ②从左到右原子的最外层电子数;③金属;非金属;稀有气体;
(3)原子的最外层电子数;①原子的最外层电子数;②元素的化学性质;③从上到下原子的电子层数;
(4)①一般少于4个;失电子;不稳定;②一般多于或等于4个;得电子;不稳定;③8个电子(He为2个);一般不得失电子;比较稳定;
(5)8;2;原子的核外电子排布;最外层电子的数目;原子的最外层电子数.点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对原子结构示意图、元素周期律知识的理解与在解题中灵活应用的能力.1年前查看全部
- X、Y为1-18号元素X原子最外层有1个电子X与Y可形成化合物X2Y,则是什么化合物?(离子or共价)
 sunsunday_1年前3
sunsunday_1年前3 -
 reichtiger 共回答了15个问题
reichtiger 共回答了15个问题 |采纳率93.3%X:H,Li,Na
可以是H2O H2S Li2O Na2O Li2S Na2S
水 硫化氢 氧化锂 氧化钠 硫化锂 硫化钠
此类问题 看着元素周期表 很好做 记熟了就好 可以是离子化合物 也可以是共价化合物1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图如图.我
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图如图.我对它进行研究:
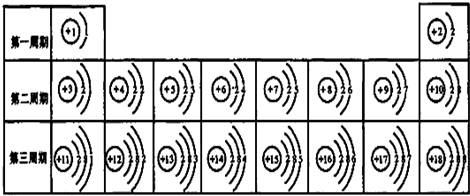
(1)原子序数为17的元素的原子容易______(填“得”或“失”)电子;原子序数为11的元素属于______元素(填“金属”或“非金属”).
(2)原子序数为16的元素与原子序数为______的元素的具有相似的化学性质.
(3)图甲是两种元素在周期表中的信息,图乙是氟原子的原子结构示意图.请完成下列问题:
①图甲方框的横线上填的是______,图乙方框横线上的数字是______;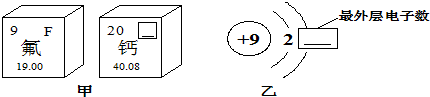
②钙元素的相对原子质量为______;
(4)如图为粒子的结构示意图,表示原子的是______;表示阳离子的是______;属于同种元素的是______.
 楚如天1年前1
楚如天1年前1 -
 57645682 共回答了18个问题
57645682 共回答了18个问题 |采纳率100%解题思路:(1)根据原子结构示意图的特点:非金属元素的最外层电子数一般多余4,易得电子;金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;
(2)根据元素的化学性质与最外层电子数的关系来分析;
(3)①根据元素的名称写出元素符号;根据在原子中,原子序数=质子数=核外电子数,计算出原子结构示意图中最外层电子数即可;②根据元素周期表中的信息分析解答;
(4)根据核内质子数与核外电子数的关系来区分原子和离子;根据质子数或核电荷数来确定元素种类.(1)根据原子结构示意图可知,最外层电子多于4个易得电子;原子序数为11的元素是钠元素,属于金属元素;
(2)最外层电子数决定元素的化学性质,16号元素和8号元素的最外层都有6个电子,所以化学性质相似;
(3)①钙的元素符号为:Ca;根据在原子中,原子序数=质子数=核外电子数,可得:2+x=9,则x=7;②在元素周期表中,最下面的数字为40.08,这就是钙的相对原子质量;
(4)根据粒子结构示意图分析:当质子数=核外电子数,就是原子;当质子数>核外电子数,就是阳离子;当核电荷数(即质子数)相等,即为同种元素.
故答案为:(1)得;金属;(2)8;(3)①Ca;7;②40.08;(4)D;B;BD.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.本题考查学生根据元素的名称写出元素符号和根据质子数与核外电子数的关系,计算最外层电子数的解题能力.1年前查看全部
- 在原子序数1-18号的元素中:(1)与水反应最剧烈的金属是______.(2)与水反应最剧烈的非金属单质是______.
在原子序数1-18号的元素中:
(1)与水反应最剧烈的金属是______.
(2)与水反应最剧烈的非金属单质是______.
(3)原子半径最小的元素______.
(4)气态氢化物水溶液呈碱性的元素是______.
(5)气态氢化物最稳定的化学式是______.
(6)最高价氧化物对应水化物的酸性最强的元素是______.
(7)电子数为10的化合物分子式______、______、______、______. 超强投诉1年前1
超强投诉1年前1 -
 灵魂飘零 共回答了15个问题
灵魂飘零 共回答了15个问题 |采纳率100%解题思路:(1)金属性越强,与水反应越剧烈,结合同周期随原子序数增大金属性减弱、同主族自上而下金属性增强判断;
(2)元素非金属性越强,单质与水反应与剧烈,结合同周期随原子序数增大非金属性增强、同主族自上而下非金属性减弱判断;
(3)周期表中氢原子半径最小;
(4)中学中氢化物只有NH3溶液呈碱性;
(5)非金属性越强,氢化物越稳定;
(6)最高价氧化物对应水化物的酸性最强的是HClO4;
(7)常见电子数为10的化合物分子有:CH4、NH3、H2O、HF.(1)同周期随原子序数增大金属性减弱、同主族自上而下金属性增强,故Na的金属性最强,与水反应最剧烈,故答案为:Na;
(2)同周期随原子序数增大非金属性增强、同主族自上而下非金属性减弱,故F元素非金属性最强,F2与水反应最剧烈,故答案为:F2;
(3)周期表中氢原子半径最小,故答案为:H;
(4)中学中只有N元素的氢化物NH3的溶液呈碱性,故答案为:N;
(5)F元素的非金属性最强,其氢化物HF最稳定,故答案为:HF;
(6)Cl元素的最高价氧化物对应水化物HClO4的酸性最强,故答案为:Cl;
(7)常见电子数为10的化合物分子有:CH4、NH3、H2O、HF,故答案为:CH4;NH3;H2O;HF.点评:
本题考点: 原子结构与元素的性质.
考点点评: 本题考查原子结构与元素周期律,比较基础,注意对元素周期律的理解,注意识记常见10电子、18电子微粒.1年前查看全部
- 1-18号元素中酸性最强的含氧酸是什么
 pepepe1年前1
pepepe1年前1 -
 mousewdk 共回答了18个问题
mousewdk 共回答了18个问题 |采纳率94.4%HClO4.高氯酸,无机化合物,氯的含氧酸.是无色透明的发烟液体.高氯酸在无机酸中酸性最强.可助燃,具强腐蚀性、强刺激性,可致人体灼伤.1年前查看全部
- 1-18号元素在周期表中占了几个周期
 ovpe21年前1
ovpe21年前1 -
 jkzhong 共回答了18个问题
jkzhong 共回答了18个问题 |采纳率94.4%如图所示,每一横行是个周期.1-18元素一起占了3横行,说明占了3个周期、1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图.我对它
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图.我对它进行研究:

(1)原子序数为17的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为13的元素属于______元素(填“金属”或“非金属”).
(2)我发现如下规律:①原子序数与元素原子核电荷数在数值上相等;②______;③______;… 525271年前1
525271年前1 -
 gf3s1gjrt 共回答了14个问题
gf3s1gjrt 共回答了14个问题 |采纳率92.9%解题思路:(1)原子序数为17的元素为Cl,写出名称即可;根据原子结构示意图的特点:金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;
非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;进行解答;
(2)根据元素周期律及图表中的信息进行分析解答.(1)原子序数为17的元素为Cl,名称为氯; 根据原子结构示意图的特点:金属元素的最外层电子数一般少于4;
非金属元素的最外层电子数一般多于4,易得到电子;
故答案为:氯;得;金属;
(2)根据元素周期律及图表中的信息可总结:
电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;
故答案为:同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;(或最右纵行的原子结构均为稳定结构;或同一周期原子的最外层电子数从左到右逐渐增加).点评:
本题考点: 元素周期表的特点及其应用;核外电子在化学反应中的作用;元素的简单分类.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.1年前查看全部
- 1-18号元素最外层比此外层电子数少1的是 少3的是
 倚竹轻叹1年前1
倚竹轻叹1年前1 -
 xhp73056 共回答了16个问题
xhp73056 共回答了16个问题 |采纳率93.8%少1的是Li和Cl
少3的是P1年前查看全部
- (2010•云南)元素周期表是学习化学的重要工具,如图是元素周期表中1-18号元素原子核外电子排布示意图,根据提供的信息
(2010•云南)元素周期表是学习化学的重要工具,如图是元素周期表中1-18号元素原子核外电子排布示意图,根据提供的信息回答:

(1)第11号元素属于______元素(填“金属”或“非金属”),第2号元素的名称为______.
(2)第16号元素的原子最外层电子数为______. traveller1年前1
traveller1年前1 -
 相思紫薇星 共回答了19个问题
相思紫薇星 共回答了19个问题 |采纳率78.9%解题思路:根据元素周期表中原子结构示意图的信息进行分析回答;(1)由11号元素的元素名称是钠元素,属于金属元素;第2号元素的名称为氦;
(2)由原子结构示意图可知第16号元素的原子最外层电子数为6;
答案:(1)金属;氦;(2)6.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生根据元素周期表中所给信息解题的能力,难度较小.1年前查看全部
- 在原子序数1-18号元素中,按要求用合适的化学用语填空:
在原子序数1-18号元素中,按要求用合适的化学用语填空:
(1)与水反应最剧烈的金属是______.
(2)与水反应最剧烈的非金属单质是______.
(3)原子半径最小的元素是______.
(4)最稳定气态氢化物的化学式是______.
(5)最高价氧化物对应水化物的酸性最强的化学式是______.
(6)电子数为10的化合物分子式______、______、______、______. by5161年前1
by5161年前1 -
 Phonixsong 共回答了13个问题
Phonixsong 共回答了13个问题 |采纳率92.3%(1)在原子序数1-18号元素中,与水反应最剧烈的金属是Na,金属性最强,故答案为:Na;
(2)与水反应最剧烈的非金属单质是F 2 ,F元素的非金属性最强,故答案为:F 2 ;
(3)原子半径最小的元素是H,原子核外只有1个电子,故答案为:H;
(4)最稳定气态氢化物对应的元素的非金属性应最强,为HF,故答案为:HF;
(5)最高价氧化物对应水化物的酸性最强的元素为Cl,非金属性仅次于F、O,但F、O无正价,不存在对应的酸,化学式是HClO 4 ,故答案为:HClO 4 ;
(6)电子数为10的化合物分子式有:CH 4 、NH 3 、H 2 O、HF,故答案为:CH 4 ;NH 3 ;H 2 O;HF.1年前查看全部
- 1-18号元素中如果元素气态氢化物为HnR其最高价氧化水化物分子中含m个氧原子则其最高价氧化物水化物化学式
1-18号元素中如果元素气态氢化物为HnR其最高价氧化水化物分子中含m个氧原子则其最高价氧化物水化物化学式
急 kfy0011年前3
kfy0011年前3 -
 汝又奈之何 共回答了26个问题
汝又奈之何 共回答了26个问题 |采纳率92.3%R:8-n 阴离子的价电子.化学式:
电荷:
O:2m (来自-2价)
R:8-n
则:
H:2m-8+n
H2m-8+n R Om1年前查看全部
- 1-18号元素分子,化合物电子式
1-18号元素分子,化合物电子式
我混乱死了 七七年明朗的拂晓1年前2
七七年明朗的拂晓1年前2 -
 星光使者 共回答了18个问题
星光使者 共回答了18个问题 |采纳率88.9%电子式不是写得越多,越记得住
要掌握方法:1年前查看全部
- 1-18号元素的原子结构图,要图啊 谢谢~
 四月1年前2
四月1年前2 -
 yzh000111222 共回答了17个问题
yzh000111222 共回答了17个问题 |采纳率82.4%+1 1
+ 2
+3 2 1
.
+10 2 8
+11 2 8 1
.
+18 2 8 81年前查看全部
- 下面是元素周期表中1-18号元素原子的排列情况,根据此表我对它进行探究:
下面是元素周期表中1-18号元素原子的排列情况,根据此表我对它进行探究:
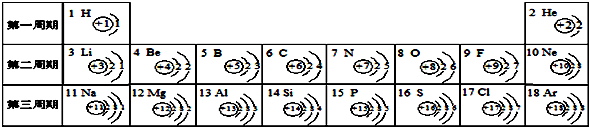
(1)从上表中我探究出以下规律:在原子里,核电荷数=原子序数=______.我通过细致地分析,还可以总结出一些规律:______、______.
(2)第11号元素属于______元素(填“金属”或“非金属”),它的原子在化学反应中容易______电子(填“得”或“失”),变成______(填离子符号).
(3)某元素的原子结构示意图如图 所示:则X=______,它位于元素周期表中的第______周期,该元素的化学性质与上表中的______元素的化学性质相似.(填元素符号)
所示:则X=______,它位于元素周期表中的第______周期,该元素的化学性质与上表中的______元素的化学性质相似.(填元素符号)  ywnyykl1年前1
ywnyykl1年前1 -
 恬静悠远 共回答了20个问题
恬静悠远 共回答了20个问题 |采纳率95%解题思路:(1)根据原子序数表示的意义,利用表中的数字来分析规律;根据提供的周期表,从横行和竖行来分析元素周期表中的规律.
(2)根据原子序数来判断元素,利用原子结构来分析性质并书写离子的符号.
(3)原子中,质子数=核外电子数;决定元素化学性质的是原子的最外层电子数.(1)因原子中,质子数等于核电荷数等于核外电子数,由周期表中的数字观察可发现原子结构中的质子数与原子序数相同;根据周期表可以发现在同一周期的元素的原子结构中的电子层数都是相同的,如第二周期都是2个电子层,在同一竖行的最外层电子数都相同,如第一列,最外层电子数都是1,决定元素种类的是质子数;金属元素原子的最外层电子数一般少于4个;同一周期元素原子的最外层电子数依次递增;同一族元素原子的最外层电子数相等.
(2)因原子序数为11的元素是钠元素,名称的偏旁为“金”,则属于金属元素,因原子结构中最外层电子数为1,则在反应中容易失去1个电子而满足最外层8电子的稳定结构,钠原子变为钠离子,钠离子带1个单位的正电荷,其符号为Na+,
(3)该元素的原子x=2+8+8+2=20,原子中有四个电子层,所以它处在的四周期,元素的化学性质取决于最外层电子数,所以该元素与Mg、Be化学性质相似.
故答案为:(1)质子数(或电子数);决定元素种类的是质子数;原子核外电子层数=周期数;金属元素原子的最外层电子数一般少于4个;同一周期元素原子的最外层电子数依次递增;同一族元素原子的最外层电子数相等.(其它合理答案也可)
(2)金属;失;Na+(3)20;四;Mg.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题难度不大,了解粒子结构示意图的意义,灵活运用元素周期表中元素的信息是正确解答本题的关键.1年前查看全部
- (6分)下表为1-18号元素的原子序数和元素符号
 jiangyunbiao1年前1
jiangyunbiao1年前1 -
 void0411 共回答了16个问题
void0411 共回答了16个问题 |采纳率87.5%(1)17得到 Cl - AlCl 3
(2)B、C(3)A、C、D、F
(1)原子结构示意图中大圆圈内数字表示质子数,最外层电子数为7,易得到一个电子成为离子,离子符号为Cl - 地壳中含量最多的金属元素是铝元素,与氯元素形成的化合物为AlCl 3
(2)镁元素质子数为12,圆圈内数字表示质子数;故选B、C
(3)原子结构意图圆圈内数字表示个数,弧线表示电子层,弧线上的数字表示电子数1年前查看全部
- 下表列出了1-18号元素的原子序数和元素符号:
下表列出了1-18号元素的原子序数和元素符号:
请回答下列问题:原子序数 1 2 3 4 5 6 7 8 9 元素符号 H He Li Be B C N O F 原子序数 10 11 12 13 14 15 16 17 18 元素符号 Ne Na Mg Al Si P S Cl Ar
(1)l~18号元素中属于稀有气体元素的有He、Ne、______(填元素符号).
(2)l~18号元素中最外层有2个电子的原子有______、Be、Mg(填元素符号).
(3)某元素的原子结构示意图为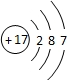 ,它在化学反应中一般易______电子(填“得到”
,它在化学反应中一般易______电子(填“得到”
或“失去”),它与地壳中含量最多的金属元素形成化合物的化学式为______.
(4)某粒子的结构示意图为 ,当x-y=8时,该粒子为______.
,当x-y=8时,该粒子为______.
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的结构和性质.下列各组粒子中属于等电子体的是______(填序号字母).
A、NO和O2B、CO和N2C、SO2和CO2D、PO43-和SO42-. wuhukuding1年前1
wuhukuding1年前1 -
 汶水孤鹏 共回答了20个问题
汶水孤鹏 共回答了20个问题 |采纳率100%解题思路:(1)要会写稀有气体的元素符号,前18号元素中稀有气体元素有:He、Ne、Ar;(2)首先由原子结构示意图判断出是什么元素,再根据原子最外层有8个电子时稳定判断出最外层少于4个时容易失去电子、大于4个时容易得到电子;(3)根据元素的原子结构判断该元素在化学反应中得失电子情况;记忆地壳中元素的含量的顺序;(4)根据粒子结构示意图中的未知数来判断该粒子的写法;(5)理解什么是等电子体,离子团所含电子数等于各离子的电子数之和.(1)此小题只要会写稀有气体元素符号,就可知1-18号元素中稀有气体元素有He、Ne、Ar,故此题答案为Ar;
(2)熟练掌握1-18号元素的原子结构示意图,可知其中最外层电子数为2的原子有He、Be、Mg,故此题答案为He;
(3)据图可知该元素为17号元素氯元素,氯原子最外层有7个电子,最外层电子数>4个,故易得到电子;地壳中含量前4位的是氧、硅、铝、铁,所以地壳中含量最多的金属元素是铝,故氯元素和铝元素形成的化合物的化学式AlCl3;
(4)由该粒子的结构示意图中,x-y=8可得:x=8+y,而y是最外层电子数,取值范围是1-8,通过带入可得y=8,x=16,所以为16号元素硫,但核外有18个电子,不是硫原子而是硫离子.故该粒子是S2-;
(5)理解等电子体是具有相同原子数和电子数的分子或离子.
A、一个NO分子中有2个原子,7+8=15个电子;一个O2分子中有2个原子,8+8=16个电子,所以A中两种分子不是等电子体;
B、一个CO分子中有2个原子,6+8=14个电子;一个N2分子中有2个原子,7+7=14个电子,所以B中两种分子是等电子体;
C、一个SO2分子中有3个原子,16+8×2=32个电子;一个CO2分子中有3个原子,6+8×2=22个电子,所以C中两种分子不是等电子体;
D、一个PO43-离子中有5个原子,15+8×4+3=50个电子;一个SO42-离子中有5个原子,16+8×4+2=50个电子,所以D中两种离子是等电子体.
故选B、D点评:
本题考点: 原子结构示意图与离子结构示意图;原子的定义与构成;原子和离子的相互转化;核外电子在化学反应中的作用;元素的简单分类.
考点点评: A此题考查的是原子结构示意图的意义,稀有气体元素,地壳中元素含量,另外第(5)小题是给出信息题,先给出等电子体的概念,然后再来做出选择.其中前三个小题比较简单,属于基础题;后两个小题较难一点.1年前查看全部
- 已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数:a>c>b>d
B.离子的还原性:Y2->Z-
C.离子半径:Y2->Z->X+>W3+
D.元素电负性大小顺序:Y>Z 娃哈哈a9931年前1
娃哈哈a9931年前1 -
 CLISJERRY 共回答了25个问题
CLISJERRY 共回答了25个问题 |采纳率92%元素周期表前三周期元素的离子aW3+、bX+、cY2-、dZ-具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,Y、Z为非金属,应处于第二周期,故Y为O元素,Z为F元素,W、X为金属应处于第三周期,W为Al元素,X为Na元素,
A.核外电子数相等,所以a-3=b-1=c+2=d+1,则质子数:a>b>d>c,故A错误;
B.非金属性F>O,非金属性越强,对应的单质的氧化性越强,则阴离子的还原性越弱,则离子还原性O2->F-,故B正确;
C.元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数a>b>d>c,则离子半径Y2->Z->X+>W3+,故C正确;
D.电负性F>O,故D错误.
故选BC.1年前查看全部
- 在1-18号元素中属于第一周期的元素有____;属于第ⅢA族的元素有_____.它们____相似.
在1-18号元素中属于第一周期的元素有____;属于第ⅢA族的元素有_____.它们____相似.
另外一题:(1) 在3-18号元素中属于金属元素的是_______;属于非金属元素的是___________;属于稀有元素的是_________.
(2)你发现的规律是__________________________. noformet1年前1
noformet1年前1 -
 lishaohui126 共回答了14个问题
lishaohui126 共回答了14个问题 |采纳率100%氢(H) 氦(He) ;
硼(B) 铝(Al) 化学性质;
另外一题:锂(Li) ,铍(Be),钠(Na),镁(Mg),铝(Al) ;
氢H ,硼B ,碳C ,氮N ,氧O ,氟F ,硅Si ,磷P ,硫S ,氯Cl ;
氦He ,氖Ne ,氩A1年前查看全部
- (2006•崇文区二模)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中1-18号元素原子核外电子排布.
(2006•崇文区二模)元素周期表是我们学习和研究化学的重要工具.下表是元素周期表中1-18号元素原子核外电子排布.

请问:(1)第17号元素的名称是______,它在化学反应中容易______(填“得”或“失”)电子,在18号元素中,与该元素具有相似化学性质的元素是______.
(2)从上表中还可以得出以下规律:原子核外电子数等于原子序数等于______、等于______.
(3)写出第8号元素的单质与第16号元素的单质反应的化学方程式S+O2
SO2点燃 .S+O2.
SO2点燃 . 乐趣老人1年前1
乐趣老人1年前1 -
 cabalalove 共回答了15个问题
cabalalove 共回答了15个问题 |采纳率93.3%解题思路:(1)根据周期表中的原子序数来分析元素,然后利用原子结构中的最外层电子数来分析性质,元素的化学性质跟它的原子的最外层电子数目关系非常密切;
(2)根据原子核外电子数=原子序数=核内质子数=核电荷数分析;
(3)根据周期表中的原子序数来分析元素,根据元素分析元素的单质,从而写出化学反应方程式.(1)第17号元素的名称氯,因其原子结构中最外层电子数为7,所以在反应中容易得到1个电子,从而达到稳定结构;最外层电子数相同,元素的化学性质相似,在18号元素中,与氯元素具有相似化学性质的元素是氟.
故答案为:氯;得;氟;
(2)在原子中,原子核外电子数=原子序数=核内质子数=核电荷数;
故答案为:核内质子数;核电荷数;
(3)第8号元素是氧,氧元素的单质是氧气,第16号元素是硫,硫元素的单质是硫磺,硫磺燃烧的化学方程式是S+O2
点燃
.
SO2;
故答案为:S+O2
点燃
.
SO2.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查学生对周期表的认识,要求学生能利用信息来发现规律,较好的考查了学生的分析归纳能力.1年前查看全部
- 1-18号元素中,原子的核外电子数与电子层数相同的是
 流年的ww1年前2
流年的ww1年前2 -
 不再挣扎 共回答了13个问题
不再挣扎 共回答了13个问题 |采纳率92.3%H,Be,Al.1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图:
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.下表是依据元素周期表画出的1-18号元素的原子结构示意图:

(1)核电荷数为11的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;核电荷数为9的元素属于______ 元素(填“金属”或“非金属”),与该元素化学性质相似的另一元素是______(填元素符号);
(2)表中具有相对稳定结构的元素是______.
(3)在化学反应中,每个铝原子失去______个电子形成______(填“阳”或“阴”)离子. 艾文的BF1年前1
艾文的BF1年前1 -
 sjtm 共回答了19个问题
sjtm 共回答了19个问题 |采纳率100%解题思路:(1)若最外层电子数≥4,则一般为非金属元素,在化学反应中易得电子,若最外层电子数<4,则一般为金属元素,在化学反应中易失去电子;元素原子的最外层电子数相同,化学性质相似.
(2)最外层具有8个电子的原子(氦是2)具有相对稳定结构.
(3)最外层电子数<4,则一般为金属元素,在化学反应中易失去电子,据此进行分析解答.(1)核电荷数为11的元素符号是Na,名称是钠,是金属元素,钠原子最外层电子的数目是1,少于4个,在化学反应中容易失去最外层的一个电子;核电荷数为9的元素是氟元素,属于非金属元素,根据元素原子的最外层电子数相同,化学性质相似可知,与该元素化学性质相似的另一元素是为氯,故答案为:钠;失;非金属;氯(Cl);
(2)最外层具有8个电子的原子(氦是2)具有相对稳定结构,表中具有相对稳定结构的元素是氦元素、氖元素和氩元素,故答案为:氦元素、氖元素和氩元素;
(3)铝原子的最外层电子数为3,在化学反应中,每个铝原子失去3个电子形成阳离子.
故答案为:3;阳.点评:
本题考点: 原子结构示意图与离子结构示意图.
考点点评: 本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.1年前查看全部
- A、B的元素符号分别是?A、B为核电荷数1-18号两种元素的原子,A的原子序数大于B,且B原子最外层电子数是A原子最外层
A、B的元素符号分别是?
A、B为核电荷数1-18号两种元素的原子,A的原子序数大于B,且B原子最外层电子数是A原子最外层电子数的3倍.AB形成的化合物是常见的化合物.该化合物加热熔化时能导电,(1)AB的元素符号分别是——(2)用电子式表示AB形成化合物的过程——和他们之间的化学键—— gorgebush1年前2
gorgebush1年前2 -
 yisonber 共回答了21个问题
yisonber 共回答了21个问题 |采纳率81%(1)MgO (2)Mg(+)[O](2-)Mg(+),[O]中O的周围要加上8个点.他们之间是离子键1年前查看全部
- 决定1-18号元素化合价的主要因素是
决定1-18号元素化合价的主要因素是
A.核内质子数
B.核外电子数
C.核外电子层数
D.最外层电子数 emmaliping71年前1
emmaliping71年前1 -
 迎接光辉 共回答了14个问题
迎接光辉 共回答了14个问题 |采纳率92.9%答案D
对于1-18号元素来说,发生化学反应只与最外层电子有关.1年前查看全部
- 1-18号元素中,失去电子最多的阳离子是?
1-18号元素中,失去电子最多的阳离子是?
RT 梦里可以自由翱翔1年前1
梦里可以自由翱翔1年前1 -
 feitianzixialang 共回答了20个问题
feitianzixialang 共回答了20个问题 |采纳率80%Al3+1年前查看全部
- 已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,下列关系正确的是( )
已知1-18号元素的离子aA3+、bB+、cC2-、dD-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>b
B.离子的还原性C2->D-
C.氢化物的稳定性H2C>HD
D.离子半径A3+>B+ 11点31分1年前1
11点31分1年前1 -
 我爱豺豺 共回答了11个问题
我爱豺豺 共回答了11个问题 |采纳率81.8%解题思路:短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,结合元素周期律解答.短周期元素的离子:aA3+、bB+、cC2-、dD-都具有相同的电子层结构,则核外电子数相等,所以有:a-3=b-1=c+2=d+1,C、D为非金属,应处于第二周期,A、B为金属应处于第三周期,结合离子所带电荷,可知C为O元素,D为F元素,A为Al元素,B为Na元素,
A.B为Na元素,C为O元素,故b=11、c=8,则质子数:b>c,故A错误;
B.同周期随原子序数增大非金属性增强,故非金属性O<F,则离子还原性:O2->F-,故B正确;
C.同周期随原子序数增大非金属性增强,故非金属性O<F,非金属性越强氢化物越稳定,故氢化物稳定性:HF>H2O,故C错误;
D.电子层结构相同,核电荷数越大离子半径越小,故离子半径r(Al3+)<r(Na+),故D错误,
故选B.点评:
本题考点: 元素周期律和元素周期表的综合应用.
考点点评: 本题考查结构与位置关系、元素周期律等,难度中等,注意元素周期律的理解掌握,也可以根据电荷与核外电子排布相同推断元素在周期表中的位置而不需要推断具体的元素.1年前查看全部
- 图表是整理数据、发现其中规律的一种重要工具。1-18号元素原子最外层电子数与原子序数的关系如下图。 试回答:
图表是整理数据、发现其中规律的一种重要工具。1-18号元素原子最外层电子数与原子序数的关系如下图。 
试回答:
(1)第三周期11-18号元素原子最外层电子数变化的趋势是__________。
(2)图中He与Ne、Ar原子最外层电子数不一样,但都处在每周期的结尾处,从原子结构上分析其原因____________________________________________。
(3)原子的核外电子排布,特别是最外层的电子数目,与元素的化学性质有密切关系。在一个化学反应中,如果有元素化合价升高,同时就有元素化合价降低。 →
→ →
→
 瓦名诺1年前1
瓦名诺1年前1 -
 john2121nn 共回答了23个问题
john2121nn 共回答了23个问题 |采纳率95.7%(1)逐渐递增(或从1到8逐渐递增)
(2)最外层都达到相对稳定结构(或最外层电子已填充满)
(3)11;失;NaCl1年前查看全部
- 元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是依据元素周期表画出的1-18号元素的原子结构示意图.请结合
元素周期表是学习和研究化学的重要工具,它的内容十分丰富.如图是依据元素周期表画出的1-18号元素的原子结构示意图.请结合所学知识回答下列问题:
(1)原子序数为12的元素名称是______,在化学反应中,该元素的原子容易______(填“得”或“失”)电子;原子序数为16的元素属于______元素(填“金属”或“非金属”).
(2)______元素与氯元素化学性质相似,该元素与钠元素形成的化合物的化学式为______.
(3)我发现如下规律:①原子序数与元素原子核电荷数在数值上相等;
②______;
③______. 深蓝沫沫1年前1
深蓝沫沫1年前1 -
 后来又 共回答了14个问题
后来又 共回答了14个问题 |采纳率92.9%解题思路:(1)原子序数为17的元素为Cl,写出名称即可;根据原子结构示意图的特点:金属元素的最外层电子数一般少于4,易失去最外层电子形成阳离子;非金属元素的最外层电子数一般多于4,易得到电子,形成阴离子;进行解答;
(2)最外层电子数相同的化学性质相似,氯元素与氟元素的最外层电子数相同,故氯元素与氟元素的化学性质相似,根据化合价代数和为零的原则书写化学式;
(3)根据元素周期律及图表中的信息进行分析解答.(1)原子序数为12的名称为镁; 根据原子结构示意图的特点:金属元素的最外层电子数一般少于4;易失去电子;原子序数为16的元素为氧元素,属于非金属元素;
(2)氯元素与氟元素的最外层电子数相同,故氯元素与氟元素的化学性质相似;根据在化合物中化合价代数和为零的原则,氟的化合价为--1价,钠的化合价为+1价,故形成的化合物的化学式为NaF;
(3)根据元素周期律及图表中的信息可总结:
电子层数等于周期数;同一纵行从上到下电子层数逐渐增加;同一纵行,原子最外层电子数相同;最右纵行的原子结构均为稳定结构;同一周期原子的最外层电子数从左到右逐渐增加;
答案:(1)镁;失; 非金属;(2)F,NaF;
(3)②电子层数与元素所在周期数相等;
③同一周期最外层电子数依次增加.点评:
本题考点: 元素周期表的特点及其应用;原子结构示意图与离子结构示意图.
考点点评: 本题考查学生对元素周期律的理解与掌握,并能灵活应用的能力.1年前查看全部
- 已知1-18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构, 下列
已知1-18号元素的离子 a W 3+ 、 b X + 、 c Y 2- 、 d Z - 都具有相同的电子层结构, 下列关系正确的是 [ ]
A.质子数c>b
B.离子的还原性Y 2- >Z -
C.氢化物的稳定性H 2 Y>HZ
D.原子半径X sukiya10081年前1
sukiya10081年前1 -
 敲错了门的爱 共回答了14个问题
敲错了门的爱 共回答了14个问题 |采纳率85.7%B1年前查看全部
大家在问
- 1概率论里面,随机变量的分布和随机变量函数的分布有什么区别?
- 2下列做法不符合“节能减排”这一要求的是( )
- 3Tom seems ______(have) a problem these days
- 41+3=4=2的平方,1+3+5+7=16=4的平方,1+3+5+7+9=25=5的平方.(1)1+3+5+7+...+
- 5思想品德考试同样是下雨杜甫说同样是下雨,杜甫说“好雨知时节,当春乃发生”,杜牧却说“清明时节雨纷纷,路上行人欲断魂”.这
- 6spring festival evening party in 2012写个作文吧(80个字
- 7(2007•泸州)取某个健康人肾动脉中的血浆、肾小囊中的液体和尿液进行分析比较,所得到的数据如下表(单位:克/100毫升
- 8求写个关于 what do small companies fail more easily than large on
- 9一个分数,分子加4变成七分之一,分子乘4变成七分之三,这个分数?
- 10"这是一支粉笔,掰断了它还是粉笔.
- 11天上为什么没有火星
- 12还是幂级数求和函数问题n=0到无穷∑n分之x的n次方 x属于[-1,1]先求导再积分,为什么最后出来-ln(1-x) 负
- 13等腰三角形两腰为1,顶角为30度,面积怎么求
- 14按数字由小到大的顺序抄写单词。 twelve forty-three t
- 15有人能教我怎么写关于梦想作文的开头吗?

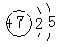

 (1)某元素原子结构示意图为  
(1)某元素原子结构示意图为   

