醇的还原性比醛差吧,但是,醇在有催化剂的条件下,可被O2氧化,应该可以被KMnO4氧化吧?
 kevinia2022-10-04 11:39:541条回答
kevinia2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 邪乎 共回答了20个问题
邪乎 共回答了20个问题 |采纳率100%- 醇是常见的可被酸性KMnO4氧化的物质,只是醇被强氧化剂氧化后,会生成酸或碳链断裂产物,这在有机合成中无什么意义,故一般不讲此类反应.
- 1年前
相关推荐
- 高中氧化性,还原性物质归类最好能标明强弱
 娘亲141年前1
娘亲141年前1 -
 木子美521 共回答了11个问题
木子美521 共回答了11个问题 |采纳率100%非金属单质(F2 ,Cl2 , O2 , S, N2 , P , C , Si)
1, 氧化性:
F2 + H2 === 2HF
F2 +Xe(过量)===XeF2
2F2(过量)+Xe===XeF4
nF2 +2M===2MFn (表示大部分金属)
2F2 +2H2O===4HF+O2
2F2 +2NaOH===2NaF+OF2 +H2O
F2 +2NaCl===2NaF+Cl2
F2 +2NaBr===2NaF+Br2
F2+2NaI ===2NaF+I2
F2 +Cl2 (等体积)===2ClF
3F2 (过量)+Cl2===2ClF3
7F2(过量)+I2 ===2IF7
Cl2 +H2 ===2HCl
3Cl2 +2P===2PCl3
Cl2 +PCl3 ===PCl5
Cl2 +2Na===2NaCl
3Cl2 +2Fe===2FeCl3
Cl2 +2FeCl2 ===2FeCl3
Cl2+Cu===CuCl2
2Cl2+2NaBr===2NaCl+Br2
Cl2 +2NaI ===2NaCl+I2
5Cl2+I2+6H2O===2HIO3+10HCl
Cl2 +Na2S===2NaCl+S
Cl2 +H2S===2HCl+S
Cl2+SO2 +2H2O===H2SO4 +2HCl
Cl2 +H2O2 ===2HCl+O2
2O2 +3Fe===Fe3O4
O2+K===KO2
S+H2===H2S
2S+C===CS2
S+Fe===FeS
S+2Cu===Cu2S
3S+2Al===Al2S3
S+Zn===ZnS
N2+3H2===2NH3
N2+3Mg===Mg3N2
N2+3Ca===Ca3N2
N2+3Ba===Ba3N2
N2+6Na===2Na3N
N2+6K===2K3N
N2+6Rb===2Rb3N
P2+6H2===4PH3
P+3Na===Na3P
2P+3Zn===Zn3P2
2.还原性
S+O2===SO2
S+O2===SO2
S+6HNO3(浓)===H2SO4+6NO2+2H2O
3S+4 HNO3(稀)===3SO2+4NO+2H2O
N2+O2===2NO
4P+5O2===P4O10(常写成P2O5)
2P+3X2===2PX3 (X表示F2,Cl2,Br2)
PX3+X2===PX5
P4+20HNO3(浓)===4H3PO4+20NO2+4H2O
C+2F2===CF4
C+2Cl2===CCl4
2C+O2(少量)===2CO
C+O2(足量)===CO2
C+CO2===2CO
C+H2O===CO+H2(生成水煤气)
2C+SiO2===Si+2CO(制得粗硅)
Si(粗)+2Cl===SiCl4
(SiCl4+2H2===Si(纯)+4HCl)
Si(粉)+O2===SiO2
Si+C===SiC(金刚砂)
Si+2NaOH+H2O===Na2SiO3+2H2
二,金属单质(Na,Mg,Al,Fe)的还原性
2Na+H2===2NaH
4Na+O2===2Na2O
2Na2O+O2===2Na2O2
2Na+O2===Na2O2
2Na+S===Na2S(爆炸)
2Na+2H2O===2NaOH+H2
2Na+2NH3===2NaNH2+H2
4Na+TiCl4(熔融)===4NaCl+Ti
Mg+Cl2===MgCl2
Mg+Br2===MgBr2
2Mg+O2===2MgO
Mg+S===MgS
Mg+2H2O===Mg(OH)2+H2
2Mg+TiCl4(熔融)===Ti+2MgCl2
Mg+2RbCl===MgCl2+2Rb
2Mg+CO2===2MgO+C
2Mg+SiO2===2MgO+Si
Mg+H2S===MgS+H2
Mg+H2SO4===MgSO4+H2
2Al+3Cl2===2AlCl3
4Al+3O2===2Al2O3(钝化)
4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg
4Al+3MnO2===2Al2O3+3Mn
2Al+Cr2O3===Al2O3+2Cr
2Al+Fe2O3===Al2O3+2Fe
2Al+3FeO===Al2O3+3Fe
2Al+6HCl===2AlCl3+3H2
2Al+3H2SO4===Al2(SO4)3+3H2
2Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O
(Al,Fe在冷,浓的H2SO4,HNO3中钝化)
Al+4HNO(稀)===Al(NO3)3+NO+2H2O
2Al+2NaOH+2H2O===2NaAlO2+3H2
2Fe+3Br2===2FeBr3
Fe+I2===FeI2
Fe+S===FeS
3Fe+4H2O(g)===Fe3O4+4H2
Fe+2HCl===FeCl2+H2
Fe+CuCl2===FeCl2+Cu
Fe+SnCl4===FeCl2+SnCl2
(铁在酸性环境下,不能把四氯化锡完全
还原为单质锡 Fe+SnCl2==FeCl2+Sn)
三, 非金属氢化物(HF,HCl,H2O,H2S,NH3)
1,还原性:
4HCl(浓)+MnO2===MnCl2+Cl2+2H2O
4HCl(g)+O2===2Cl2+2H2O
16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O
14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O
2H2O+2F2===4HF+O2
2H2S+3O2(足量)===2SO2+2H2O
2H2S+O2(少量)===2S+2H2O
2H2S+SO2===3S+2H2O
H2S+H2SO4(浓)===S+SO2+2H2O
3H2S+2HNO(稀)===3S+2NO+4H2O
5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O
3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O
H2S+4Na2O2+2H2O===Na2SO4+6NaOH
2NH3+3CuO===3Cu+N2+3H2O
2NH3+3Cl2===N2+6HCl
8NH3+3Cl2===N2+6NH4Cl
4NH3+3O2(纯氧)===2N2+6H2O
4NH3+5O2===4NO+6H2O
4NH3+6NO===5N2+6HO(用氨清除NO)
NaH+H2O===NaOH+H2
4NaH+TiCl4===Ti+4NaCl+2H2
CaH2+2H2O===Ca(OH)2+2H2
四,非金属氧化物
低价态的还原性:
2SO2+O2===2SO3
2SO2+O2+2H2O===2H2SO4
(这是SO2在大气中缓慢发生的环境化学反应)
SO2+Cl2+2H2O===H2SO4+2HCl
SO2+Br2+2H2O===H2SO4+2HBr
SO2+I2+2H2O===H2SO4+2HI
SO2+NO2===SO3+NO
2NO+O2===2NO2
NO+NO2+2NaOH===2NaNO2
(用于制硝酸工业中吸收尾气中的NO和NO2)
2CO+O2===2CO2
CO+CuO===Cu+CO2
3CO+Fe2O3===2Fe+3CO2
CO+H2O===CO2+H2
氧化性:
SO2+2H2S===3S+2H2O
SO3+2KI===K2SO3+I2
NO2+2KI+H2O===NO+I2+2KOH
(不能用淀粉KI溶液鉴别溴蒸气和NO2)
4NO2+H2S===4NO+SO3+H2O
2NO2+Cu===4CuO+N2
CO2+2Mg===2MgO+C
(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)
SiO2+2H2===Si+2H2O
SiO2+2Mg===2MgO+Si
五,金属氧化物
1,低价态的还原性:
6FeO+O2===2Fe3O4
FeO+4HNO3===Fe(NO3)3+NO2+2H2O
2,氧化性:
Na2O2+2Na===2Na2O
(此反应用于制备Na2O)
MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al.
一般通过电解制Mg和Al.
Fe2O3+3H2===2Fe+3H2O (制还原铁粉)
Fe3O4+4H2===3Fe+4H2O
六,含氧酸
1,氧化性:
4HClO3+3H2S===3H2SO4+4HCl
HClO3+HI===HIO3+HCl
3HClO+HI===HIO3+3HCl
HClO+H2SO3===H2SO4+HCl
HClO+H2O2===HCl+H2O+O2
(氧化性:HClO>HClO2>HClO3>HClO4, 但浓,热的HClO4氧化性很强)
2H2SO4(浓)+C===CO2+2SO2+2H2O
2H2SO4(浓)+S===3SO2+2H2O
H2SO4+Fe(Al) 室温下钝化
6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O
2H2SO4(浓)+Cu===CuSO4+SO2+2H2O
H2SO4(浓)+2HBr===SO2+Br2+2H2O
H2SO4(浓)+2HI===SO2+I2+2H2O
H2SO4(稀)+Fe===FeSO4+H2
2H2SO3+2H2S===3S+2H2O
4HNO3(浓)+C===CO2+4NO2+2H2O
6HNO3(浓)+S===H2SO4+6NO2+2H2O
5HNO3(浓)+P===H3PO4+5NO2+H2O
6HNO3+Fe===Fe(NO3)3+3NO2+3H2O
4HNO3+Fe===Fe(NO3)3+NO+2H2O
30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O
36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O
30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O
2,还原性:
H2SO3+X2+H2O===H2SO4+2HX
(X表示Cl2,Br2,I2)
2H2SO3+O2===2H2SO4
H2SO3+H2O2===H2SO4+H2O
5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2O
H2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl
七,碱
低价态的还原性:
4Fe(OH)2+O2+2H2O===4Fe(OH)3
八,盐
1,氧化性:
2FeCl3+Fe===3FeCl2
2FeCl3+Cu===2FeCl2+CuCl2
(用于雕刻铜线路版)
2FeCl3+Zn===2FeCl2+ZnCl2
FeCl3+Ag===FeCl2+AgC
Fe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应)
Fe(NO3)3+Ag 不反应
2FeCl3+H2S===2FeCl2+2HCl+S
2FeCl3+2KI===2FeCl2+2KCl+I2
FeCl2+Mg===Fe+MgCl2
2,还原性:
2FeCl2+Cl2===2FeCl3
3Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O
3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O
2Na2SO3+O2===2Na2SO41年前查看全部
- 氧化性还原性比较 F Cl Br I S.还有那个2价铁3价铁
氧化性还原性比较 F Cl Br I S.还有那个2价铁3价铁
氧化性还原性比较 F Cl Br I S.还有那个2价铁3价铁.是怎么排序的. fltcy1年前1
fltcy1年前1 -
 wenxinwu57 共回答了17个问题
wenxinwu57 共回答了17个问题 |采纳率100%还原性:
对于金属:K > Ba > Ca > Na > Mg > Al > Zn > Fe > Sn > Pb > H > Cu > Hg > Ag > Pt > Au
对于离子:S2- > SO3^2- > I- > Fe2+ > Br- > Cl-
氧化性:
对于金属离子:Ag+ > Hg2+ > Cu2+ > H+ > Pb2+ > Sn2+ > Fe2+ > Zn2+ > Al3+ > Mg2+ > Na+ > Ca2+ > Ba2+ > K+
Fe3+ > Cu2+ > Fe2+
对于氧化剂:F2 > KMnO4 > ClO2 > Cl2 > H2O2 > Br2 > I2 > S1年前查看全部
- 碳还原出比它更强的还原剂举个例哪个还原产物比碳的还原性强
 longkui5201年前2
longkui5201年前2 -
 幽远冰原 共回答了16个问题
幽远冰原 共回答了16个问题 |采纳率100%SiO2+2C=Si+2CO↑
CO的还原性比C强1年前查看全部
- 化学中阴离子只有氧化性,阳离子只有还原性吗?
化学中阴离子只有氧化性,阳离子只有还原性吗?
如题`` 就要生了1年前11
就要生了1年前11 -
 老天打笨小孩 共回答了23个问题
老天打笨小孩 共回答了23个问题 |采纳率91.3%当然不是的啦,因为有的元素有多个化合价的,处于中间价态的离子就有两性了1年前查看全部
- 请问,硫代硫酸铵与硫代硫酸钠,哪一个还原性更强?
 _狮子狗1年前2
_狮子狗1年前2 -
 Midgarding 共回答了20个问题
Midgarding 共回答了20个问题 |采纳率95%硫代硫酸铵 还原性更强.因为两者的硫代硫酸根都有还原性,但是 NH4+ 有还原性,而 Na+ 几乎没有还原性,所以硫代硫酸铵 还原性更强.1年前查看全部
- 铁和碳的还原性,怎么比较?怎么比较两物质还原性大小,只根据化学方程式准确啊?
 徐晨光5201年前3
徐晨光5201年前3 -
 lgw780617 共回答了19个问题
lgw780617 共回答了19个问题 |采纳率94.7%你是否以为碳的还原性比铁强,根据碳可以还原铁的实验吗?该反应的特殊性要注意,反应条件是在加热或高温,才能置换出铁单质.一般可以作为判断的,应该是在常温条件下就可以进行的置换反应,才能对比两种单质的氧化性或还原性.如铁的腐蚀,碳作为正极,而铁作负极形成原电池,所以铁的还原性要更强些.金属的失电子能力应该比非金属强.
要比较两物质还原性大小,根据相互置换要注意反应条件.
其次,两种还原剂跟同一种氧化剂作用,反应条件容易进行或是比较难和反应进行的彻底程度可以作为判断依据.1年前查看全部
- 常温下具有还原性的气体单质是什么?
 smz000000011年前2
smz000000011年前2 -
 zhuyongyuan 共回答了13个问题
zhuyongyuan 共回答了13个问题 |采纳率92.3%氢气1年前查看全部
- 既然Cl-离子还原性极弱,为什么还会被HClO氧化而不被HNO3氧化?
 梦里惊醒全是你1年前1
梦里惊醒全是你1年前1 -
 dingding05 共回答了19个问题
dingding05 共回答了19个问题 |采纳率94.7%氯气和水的反应是个可逆反应
Cl2+H2O=可逆=HCl+HClO
可逆反应有一个平衡移动的问题,比方减小氯气的浓度,反应向逆向进行,
这个不是氧化还原的问题是可逆反应平衡移动问题,高中后面会学到.
其实一个反应是否可以进行主要看电极电势
一般大学学到
Cl2 / Cl- E=1.36v
NO3- /NO2 E=0.84v
氯气被还原为Cl- 需要的电极电势要高于硝酸被还原为NO2的电极电势
这就说明氧化性Cl2大于HNO3,所以HNO3不能把Cl-氧化为Cl2.1年前查看全部
- 还原性是物理性质还是化学性质如题
 春草春1年前6
春草春1年前6 -
 13806505559 共回答了23个问题
13806505559 共回答了23个问题 |采纳率87%是化学性质1年前查看全部
- 硝酸亚铁和水反应么亚铁离子有强还原性,硝酸有强氧化性,和水能生成氢氧化铁,铁离子和no么?如果不能的话请说明下原因,那k
硝酸亚铁和水反应么
亚铁离子有强还原性,硝酸有强氧化性,和水能生成氢氧化铁,铁离子和no么?如果不能的话请说明下原因,
那kmno4为什么没有氢离子也有强还原性 66chen661年前1
66chen661年前1 -
 qq1115201111 共回答了18个问题
qq1115201111 共回答了18个问题 |采纳率88.9%不反应.
这里不是HNO3,只是NO3-.NO3-要有大量H+的条件下才具有强氧化性.
高锰酸钾是高锰酸钾,NO3-是NO3-.拿2种不同的物质来比较,没意思.1年前查看全部
- 是不是还原性越强,越容易被氧化.
 466396971年前3
466396971年前3 -
 sisi1115 共回答了11个问题
sisi1115 共回答了11个问题 |采纳率90.9%是的,因为还原就是失去电子,本身就显正电荷,被氧化.所以越是容易失去电子,就是还原性越强,也就越容易被氧化.1年前查看全部
- 什么的还原性比铯的还原性强?不要说钫.
 莫念苍生1年前3
莫念苍生1年前3 -
 大耳如来 共回答了14个问题
大耳如来 共回答了14个问题 |采纳率92.9%碱化物
负价的碱金属1年前查看全部
- 单糖全部都属于是还原性糖么?单糖不是可以异构生成醛基么~那不就是代表它又具有还原性了么?
 QYJjojo1年前1
QYJjojo1年前1 -
 dao1duo 共回答了13个问题
dao1duo 共回答了13个问题 |采纳率76.9%有醛基的糖都具有还原性 单糖是不能水解的糖 单糖中最重要的就是葡萄糖 因为有醛基所以具有还原性 二糖里的麦芽糖有醛基 也具有还原性 还原糖可以发生银镜反应 和新制的Cu(OH)2反应 生物上还学过 还原糖可以和斐林试剂水浴后生成砖红色沉淀1年前查看全部
- 二氧化硫使品红褪色是利用的他漂白性还是还原性 说具体点.
 牧歌的薄荷糖1年前3
牧歌的薄荷糖1年前3 -
 神鼎周四阿 共回答了22个问题
神鼎周四阿 共回答了22个问题 |采纳率100%漂白性,二氧化硫和色素分子结合成分子间无色化合物,使得品红褪色,所以加热可以恢复品红的红色.1年前查看全部
- SO2稳定吗?做到一个选择题:SO2通常不具有的化学性质是A不稳定性B氧化性C还原性D酸性氧化物通性答案是A诶.难道SO
SO2稳定吗?
做到一个选择题:SO2通常不具有的化学性质是
A不稳定性
B氧化性
C还原性
D酸性氧化物通性
答案是A诶.难道SO2很稳定的吗?通常不具有的不应该是还原性麽 雪泷1年前3
雪泷1年前3 -
 volar12345 共回答了12个问题
volar12345 共回答了12个问题 |采纳率100%A
稳定性是指在平常条件下是不是很容易分解或者变成其他物质
我们看SO2在空气中可以稳定存在的啊1年前查看全部
- fe2o3有氧化性,不是还原性吗?fe3o4为什么既具有氧化性又具有还原性
 花落尘泥1年前2
花落尘泥1年前2 -
 setqwetwqe34 共回答了17个问题
setqwetwqe34 共回答了17个问题 |采纳率82.4%fe2o3 铁处于3价 属于最高价态了 具有氧化性,而fe3o4是由fe2o3和feo组成的,这里面的feo铁处于2价 既具有氧化性 也具有还原性,1年前查看全部
- 处于中间价态的元素既有还原性又有氧化性的物质有哪些?
处于中间价态的元素既有还原性又有氧化性的物质有哪些?
请写出几个化学方程式, ZZEESSTT1年前4
ZZEESSTT1年前4 -
 泪不过两行 共回答了14个问题
泪不过两行 共回答了14个问题 |采纳率92.9%这个有很多,基本集中在非金属元素中.
如N(氮)处于中间价态的有+4价
方程式:3NO2+H2O==NO+2HNO3
还有很多,如含氧根离子.1年前查看全部
- (2007•黄埔区二模)现有混有少量CO2的CO气体,某同学欲用CO还原CuO实验,证明CO具有还原性,请根据下图所示装
(2007•黄埔区二模)现有混有少量CO2的CO气体,某同学欲用CO还原CuO实验,证明CO具有还原性,请根据下图所示装置回答问题.(A处框图表示盛有CO2和CO混合气体的储气瓶)
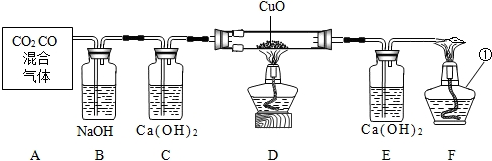
(1)写出图F中有编号的仪器名称.①______:
(2)反应后装置D中观察得到的现象______:写出该装置中发生反应的化学方程式CO+CuO
Cu+CO2△ ..CO+CuO;
Cu+CO2△ ..
(3)装置F的作用是______:写出该反应发生的化学方程式2CO+O2
2CO2点燃 .2CO+O2
2CO2点燃 .
(4)装置C和E都将气体通入澄清石灰水,但其实验目的是不同的,分别写出装置C和E中澄清石灰水的作用是______;______. 风之碟舞1年前1
风之碟舞1年前1 -
 伤痕垒垒 共回答了22个问题
伤痕垒垒 共回答了22个问题 |采纳率95.5%解题思路:根据所学知识可以判断仪器的名称;
氧化铜和一氧化碳在加热条件下能生成红色的铜和二氧化碳气体;
一氧化碳有毒,扩散到空气中会污染环境,一氧化碳燃烧能生成二氧化碳;
二氧化碳能使澄清的石灰水变浑浊.(1)①是酒精灯.故填:酒精灯.
(2)反应后装置D中观察得到的现象是黑色固体变成红色.故填:黑色固体变成红色.
一氧化碳和氧化铜反应的化学方程式为:CO+CuO
△
.
Cu+CO2.
(3)装置F的作用是把一氧化碳转化成二氧化碳,不污染环境.故填:处理尾气.
一氧化碳和氧气反应的化学方程式为:2CO+O2
点燃
.
2CO2.
(4)装置C中石灰水的作用是检验二氧化碳是否除尽.故填:检验二氧化碳是否除尽.
装置E中石灰水的作用是检验产物中是否含有二氧化碳.故填:检验产物中是否含有二氧化碳.点评:
本题考点: 碳、一氧化碳、氢气还原氧化铜实验.
考点点评: 本题主要考查实验现象、物质的性质、化学方程式的书写等方面的知识,书写化学方程式时要遵循质量守恒定律.1年前查看全部
- 氧气具有氧化性还是还原性?
 dww2751年前4
dww2751年前4 -
 瑶台月下逢 共回答了10个问题
瑶台月下逢 共回答了10个问题 |采纳率70%既有氧化性又有还原性,大多情况表现为氧化性表示氧化性.
只有在和非金属行非常强的的物质反应时才表现为还原性1年前查看全部
- Fe ,Fe 2+,Cu,Cl -还原性由强至弱的顺序是 Fe 2+,Fe 3+,Cl 2,Cu
Fe ,Fe 2+,Cu,Cl -还原性由强至弱的顺序是 Fe 2+,Fe 3+,Cl 2,Cu
Fe ,Fe 2+,Cu,Cl -还原性由强至弱的顺序是
Fe 2+,Fe 3+,Cl 2,Cu 2+的氧化性由强至弱是 一个vv鱼1年前2
一个vv鱼1年前2 -
 cjaohui 共回答了26个问题
cjaohui 共回答了26个问题 |采纳率88.5%Fe,Fe2+,Cu,Cl-
CI2,Fe3+,Cu,Fe2+1年前查看全部
- 二硝基甲苯为什么具有还原性,还原机理是什么,具体些
 linglinglin1年前2
linglinglin1年前2 -
 rickydeng 共回答了17个问题
rickydeng 共回答了17个问题 |采纳率82.4%二硝基甲苯可以和高锰酸钾的酸性溶液或者中性溶液反应生成二硝基苯甲酸,高锰酸钾是氧化剂,二硝基甲苯是还原剂1年前查看全部
- 碱性氧化物与氧化性酸,非氧化性酸生成什么?FeS2体现氧化性或还原性吗?
 nini84771年前3
nini84771年前3 -
 乌溜溜007 共回答了20个问题
乌溜溜007 共回答了20个问题 |采纳率95%碱性氧化物与非氧化性酸生成盐与水
例如:CaO+2HCl=CaCl2+H2O;
碱性氧化物与氧化性酸也可以生成盐与水,不过当碱性氧化物中的金属元素为金属低价态的时候,会被氧化性酸氧化为高价态
FeS2主要体现还原性.
希望可以帮得到你~1年前查看全部
- 碘离子为什么不和亚铁离子反应?铁离子和碘离子反应生成物为什么是亚铁离子而不是铁,碘离子的还原性那么强?(这个才是重点)
 四楼米粉1年前5
四楼米粉1年前5 -
 扬谷的天空 共回答了16个问题
扬谷的天空 共回答了16个问题 |采纳率87.5%先假设碘离子和三价铁能生成铁单质和碘单质,肯定那么根据还原剂的还原性大于还原产物的还原性就有还原性碘离子大于铁单质,可事实是金属的还原性肯定大于碘离子,所以假设不成立,产物只能是二价的铁,这就符合还原性的顺序碘离子大于二价铁大于溴离子大于氯离子大于氢氧根,如果是高一和高二学生这是最好的解释1年前查看全部
- 从元素周期律,C的还原性不是比Si强吗?但实际为什么Si更强?
从元素周期律,C的还原性不是比Si强吗?但实际为什么Si更强?
不好意思,搞错了… _^怕死拉 冰川柠檬1年前2
冰川柠檬1年前2 -
 andruw 共回答了19个问题
andruw 共回答了19个问题 |采纳率78.9%对于同主族元素,从上到下,金属性增强,还原性增强.而Si在C的下方,所以Si还原性比C强.
对于反应2C + SiO2 =高温= Si + 2CO,应该这样解释:在高温下,C的还原性比Si强.
所以,在一般情况下Si还原性比C强;在高温条件下C还原性比Si强.1年前查看全部
- 证明一氧化氮还原性强于二氧化硫还原性的方程式是什么
 qz55951年前4
qz55951年前4 -
 sophialam 共回答了14个问题
sophialam 共回答了14个问题 |采纳率92.9%一氧化氮与氧气 常温直接反应
二氧化硫与氧气 加热可逆反应1年前查看全部
- 下列物质中按只有氧化性只有还原性既有氧化性又有还原性的顺序
下列物质中按只有氧化性只有还原性既有氧化性又有还原性的顺序
下列物质中按只有氧化性只有还原性既有氧化性又有还原性的顺序排列的是 A F2 K HCl B Cl2 Al H2 C NO2 Na Br2 D O2 SO2 H2O 我想知道A中HCl里的Cl是-1价,不已经是最低价了么?怎么还能既有氧化性又有还原性? wclightnin1年前3
wclightnin1年前3 -
 一切随风_0917 共回答了18个问题
一切随风_0917 共回答了18个问题 |采纳率72.2%HCl既有氧化性又有还原性氧化性,H是+1价可以得到电子被还原,生成氢气,这样HCl就具有氧化性,还原性就是失去电子Cl是-1价可以失去电子变成氯气,或者别的高价Cl离子,所以HCl就具还原性.1年前查看全部
- 乙烯!我们知道,乙烯能与溴水、高锰酸钾反应,利用了这些物质的强氧化性和乙烯的还原性那么,为什么在乙醇脱水生成乙烯中,浓硫
乙烯!
我们知道,乙烯能与溴水、高锰酸钾反应,利用了这些物质的强氧化性和乙烯的还原性
那么,为什么在乙醇脱水生成乙烯中,浓硫酸不和乙烯反应?而且,有没有可能浓硫酸、乙醇发生了酯化反应?
我要问的是为什么浓硫酸和乙烯不反应,而不是这个结论 灵光稻米1年前3
灵光稻米1年前3 -
 圣御臻轩 共回答了17个问题
圣御臻轩 共回答了17个问题 |采纳率100%不是具有氧化性的物质碰到还原性的物质一定就要反应,乙烯不具有碱性,也不是盐,物质结构决定物质性质,乙烯和溴水和高锰酸钾反应其本质原因是它有双键,还原性是体现出来的而已.
希望我的回答对您有所帮助.1年前查看全部
- 如何在氧化还原反应中判断氧化性还原性的强弱?(高一化学)给我些例题.
 forgxm1年前1
forgxm1年前1 -
 丰富细致 共回答了22个问题
丰富细致 共回答了22个问题 |采纳率95.5%楼下说的怕是不对吧,这个东西只能靠自己一个一个去记 还有就是氧化还原反应中都是强强生成弱弱举个例子
Fe+氢离子===亚铁离子+氢气 铁的还原性比氢气强 氢离子的氧化性比亚铁离子的氧化性强1年前查看全部
- 既有氧化性和还原性的化合物有哪些
既有氧化性和还原性的化合物有哪些
有哪些 HCl 是不为什么 hieiathrun1年前1
hieiathrun1年前1 -
 ap0505127 共回答了17个问题
ap0505127 共回答了17个问题 |采纳率82.4%是的,其中的氢有氧化性,化合价可降低成为单质,氯又可以升高成为氯气,具还原性,既有氧化性又有还原性的物质应是所含的元素化合价即可上升又可降低.1年前查看全部
- 还原性与金属活泼性之间的联系
 静土1年前2
静土1年前2 -
 nyzzk 共回答了23个问题
nyzzk 共回答了23个问题 |采纳率87%金属原子越活泼,表明金属原子越容易失去电子而形成阳离子,即金属单质的还原性越强,而形成的阳离子越稳定.表明该阳离子是越难得到电子而形成原子的.故该阳离子的氧化性越弱.反之,金属阳离子的氧化性(得电子能力)越强,就表明该金属原子越难失去电子,即金属单质的还原性越弱,该金属的活动性越弱.1年前查看全部
- 简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
简单非金属阴离子只有还原性,而金属阳离子不一定只有氧化性?
什么是简单非金属阴离子?S2-是吗那他不既有还原型又有氧化性吗但答案这个选项又是对的 hazaline1年前2
hazaline1年前2 -
 男炎之隐 共回答了23个问题
男炎之隐 共回答了23个问题 |采纳率91.3%S2-化合价为-2已经最低了,所以没有氧化性,只有还原性1年前查看全部
- 锰离子与氯离子还原性的比较
 品浪1年前1
品浪1年前1 -
 MandyFeng06 共回答了18个问题
MandyFeng06 共回答了18个问题 |采纳率77.8%锰离子还原性弱
MnO2+4HCl=MnCl2+Cl2+2H2O
反应中锰离子为还原产物,还原性不如还原剂氯离子1年前查看全部
- Fe的还原性是怎么体现的2Fe+3Cl2 = 2FeCl3 Fe的还原性是将Cl2 变成FeCL3吗?
 ribolee1年前3
ribolee1年前3 -
 雪山飛糊 共回答了19个问题
雪山飛糊 共回答了19个问题 |采纳率78.9%Fe的还原性是通过和氧化剂反应体现
2Fe+3Cl2 =2FeCl3
在这个反应体系中
Fe将Cl2还原为-1价的Cl
而自己被Cl2氧化为Fe3+
满意请采纳
多谢1年前查看全部
- 比如H2S,s最低价,h最高价,我是说这个h2s又还原性还是有氧化性,为什么实际他只有还原性
 bethy10151年前1
bethy10151年前1 -
 飞起来的鱼 共回答了19个问题
飞起来的鱼 共回答了19个问题 |采纳率89.5%硫化氢应该是既有氧化性又有还原性的.
由于-2价的S具有强还原性,所以一般反应中体现它的还原性.
但遇到活泼金属时,金属必然作还原剂,此时体现H的氧化性.1年前查看全部
- 为什么SO2和CO2中S,C都现+4价,而CO2没还原性?
为什么SO2和CO2中S,C都现+4价,而CO2没还原性?
同问题 wyingm1年前2
wyingm1年前2 -
 张三丰001 共回答了16个问题
张三丰001 共回答了16个问题 |采纳率81.3%因为C的最高价是+4
而S可以是+6如H2SO4
所以就只有SO2有还原性1年前查看全部
- 粒子半径:Br->K+>S2->S 还原性:Na+>S2->Br—>Cl—
粒子半径:Br->K+>S2->S 还原性:Na+>S2->Br—>Cl—
粒子半径:Br->K+>S2->S
还原性:Na+>S2->Br—>Cl—
分别应该怎么判断呢? 恨水惊秋1年前1
恨水惊秋1年前1 -
 sanjing888666 共回答了15个问题
sanjing888666 共回答了15个问题 |采纳率93.3%1.Br-在有四个电子层,Br-的半径一定最大.第一个排列有问题啊.应该是Br->S2->S>K+.排列规律是:离子或原子的结构相同的,你看右上角的数字,数字越小,半径越大.
2.这个排列也有问题啊.Na+哪来的还原性啊?规律是:非金属单质氧化性(F>O>N>Cl>Br>I>S>H>C)越强的,其阴离子的还原性就越弱.所以应该是:S2->Br->Cl->Na+1年前查看全部
- 碘离子达到饱和结构为何还会有强还原性
碘离子达到饱和结构为何还会有强还原性
碘离子最外层电子不是已经达到8个了吗,那么为什么还会有强还原性呢,强还原性不就是***很容易失电子吗,
并且氯离子处于最低价负一价时,为什么不具备有强还原性呢,那什么情况下,氯离子会反应变成氯气呢 ypy_01年前1
ypy_01年前1 -
 ynynyn999 共回答了21个问题
ynynyn999 共回答了21个问题 |采纳率95.2%是这样的:Cl和I同位于第七主族,但是Cl的电子层数少,I的电子层数多,可想而知,电子层数多了,原子核对外层电子的吸引能力就下降了,所以易失去电子,所以I-最外层电子已经达到8个了,还会有强还原性;而Cl-电子层数少,核...1年前查看全部
- 如何判断离子的还原性、氧化性?比如氯离子、溴离子、典离子什么的…?
如何判断离子的还原性、氧化性?比如氯离子、溴离子、典离子什么的…?
可是.,,啥叫最高价态最低价态啊? 村姑1号1年前1
村姑1号1年前1 -
 晓园妹妹 共回答了24个问题
晓园妹妹 共回答了24个问题 |采纳率87.5%原子最外层的电子都失去了.这时它就处于最高价态
原子最外层电子达到饱和(这个词可能不是很专业)时 它就处于最低价态
这个是需要记忆的...
看这个!
处于最高价态的离子 只具有氧化性.
处于中间价态的离子 具有氧化性也具有还原性
处于最低价态的离子 只具有还原性.
单质的氧化性:CL2>Br2>I2
相对离子的还原性:CL-1年前查看全部
- 由两种还原性离子构成的化合物
 lxfoye1年前2
lxfoye1年前2 -
 lcl123 共回答了14个问题
lcl123 共回答了14个问题 |采纳率100%有很多.这样分析:首先,化合物肯定是由正化合价的元素和负化合价的元素组成.所以正化合价的元素和负化合价的元素对应的离子都具有还原性.对于负价离子,肯定有还原性;而对于正价离子,要有还原性的话,必须是变价的元素离子,最典型的是Fe2+,Mn2+.
所以由两种还原性离子构成的化合物有FeCl2,FeBr2,FeI2,MnCl2等等.1年前查看全部
- 氯化氢,硫酸,硝酸都是什么性酸,氧化性还是还原性,为什么
 xinliyi1年前1
xinliyi1年前1 -
 天地随风 共回答了23个问题
天地随风 共回答了23个问题 |采纳率91.3%盐酸是非氧化性酸,只是具有酸的通性,但氯化氢气体具有一定的还原性(-1价的氯化合价可升高),但不强
硫酸分两种情况,稀硫酸具有酸的通性,氧化性却很弱(主要是SO4 2-的氧化性弱),所以是非氧化性酸,而浓硫酸除了具有酸的通性外,由于水的含量极少,因此浓硫酸主要以H2SO4分子的形式存在,而H2SO4分子具有很强的氧化性,所以它是强氧化性酸,与强还原性的物质(如硫化氢等)无法共存,它与金属反应生成最高价态的金属盐,并且可与活动性表中排在H后的铜、汞、银等金属反应
硝酸无论稀浓,都同时具有酸的通性强氧化性,它的氧化性主要来自NO3-离子,也属于强氧化性酸1年前查看全部
- 关于钠的说法错误的是A:钠很软,熔点低于100摄氏度 B;钠在焰色反应时,火焰呈黄色 C:Na有强还原性 D:电解熔融氯
关于钠的说法错误的是
A:钠很软,熔点低于100摄氏度
B;钠在焰色反应时,火焰呈黄色
C:Na有强还原性
D:电解熔融氯化钠的过程中,Na+被还原成Na
能把错误指出来吗? 大兴垸村的1年前1
大兴垸村的1年前1 -
 人生如雾 共回答了15个问题
人生如雾 共回答了15个问题 |采纳率100%下列关于钠的说法错误的是(没有错的)
A:钠很软,熔点低于100摄氏度 对
B;钠在焰色反应时,火焰呈黄色 对
C:Na有强还原性 对
D:电解熔融氯化钠的过程中,Na+被还原成Na 对1年前查看全部
- 拜托各位大哥设计一个试验,证明酒精灯外焰具有氧化性,内焰具有还原性.
拜托各位大哥设计一个试验,证明酒精灯外焰具有氧化性,内焰具有还原性.
1.写出实验所需的材料
2.写出实验步骤,预测实验现象, ericshou1年前1
ericshou1年前1 -
 宁明晨 共回答了25个问题
宁明晨 共回答了25个问题 |采纳率80%1.简单的说,用外焰加热一根干净的铜丝,发现变黑了.则说明铜被氧化成了CuO
即可说明.
2.同时会发现,内焰加热的已经变黑的铜丝又变成紫红色了,说明CuO又被还原成了Cu,因为内焰为没有完全燃烧的乙醇,说明乙醇具有还原性.1年前查看全部
- 在氧化还原反应中什么叫氧化性/还原性、被氧化/被还原、氧化产物/还原产物
在氧化还原反应中什么叫氧化性/还原性、被氧化/被还原、氧化产物/还原产物
和其他氧化还原反应的知识点! 散落的记忆1年前5
散落的记忆1年前5 -
 sunle008 共回答了18个问题
sunle008 共回答了18个问题 |采纳率88.9%反应中得到电子的,化合价降低,就是氧化剂;失去电子,化合价升高,就是还原剂(两者都是反应物)
氧化物被还原,生成还原产物;还原物被氧化,生成氧化产物(是不是像绕口令?去年我也这么被搞糊涂的)1年前查看全部
- 关于氢化锂特征A.液态时是电的良导体 B.Hˉ具强还原性,遇 H+ 时可反应放出氢气.C.是非电解质
 thindog1年前1
thindog1年前1 -
 ychoo 共回答了25个问题
ychoo 共回答了25个问题 |采纳率92%氢化锂是类盐氢化物,是离子化合物. A.液态时存在自由移动的H-和Li+离子,能导电,属于电解质. B也正确. C错误1年前查看全部
- 离子共存问题:物质的氧化性和还原性是怎样影响离子的共存的?
 战二十1年前3
战二十1年前3 -
 davenxie 共回答了21个问题
davenxie 共回答了21个问题 |采纳率95.2%总的来说就是具有强氧化性的离子和强还原性的离子不能在一起,否则就反应而不能共存.
那么那些是具有强氧化性的离子呢?MnO4(-)
Cr2O7(2-)
CrO4(2-)
Fe(3+)
O2(2-)过氧根
NO3(-)需配合H+
ClO-不体现氧化性,HClO是强氧化剂,这个记住,配合H+
MnO4- 酸性越强 氧化性越高.
具还原性的离子,
S2- 、Fe2+、I-、SO32- 等这些处于低价态的离子1年前查看全部
- 生物竞赛的几道判断题1单糖具有还原性,所以可以用氧化还原的原理测定其含量2淀粉的还原性大于纤维素3动物油韩不饱和脂肪酸比
生物竞赛的几道判断题
1单糖具有还原性,所以可以用氧化还原的原理测定其含量
2淀粉的还原性大于纤维素
3动物油韩不饱和脂肪酸比植物油多
4固醇类化合物的基本结构是环戊烷多氢菲
5磷脂,糖脂等作为细胞膜成分(或部于细胞表面),在细胞识别,神经传导,组织免疫等多方面发挥作用 板板9131年前2
板板9131年前2 -
 旋律再生 共回答了18个问题
旋律再生 共回答了18个问题 |采纳率88.9%对
错 他们的还原性极弱
错动 物的脂肪酸结构比较简单,多是饱和脂肪酸
对
对1年前查看全部
- 一种氧化剂和多种还原剂发生反应时,为什么是还原性强的先反应
 happy小垭1年前2
happy小垭1年前2 -
 xxx5000 共回答了20个问题
xxx5000 共回答了20个问题 |采纳率75%还原性即失电子能力,还原性越强说明失电子能力越强,那麼当然先反应咯1年前查看全部
- 谁可以和我说下强氧化性,又还原性,氧化剂,还原剂,什么关系?
 心绪万千1年前1
心绪万千1年前1 -
 dd王7 共回答了15个问题
dd王7 共回答了15个问题 |采纳率86.7%升失氧,被氧化,作还原剂显还原性.如金属单质,容易失电子.价态只能从0到正数所以多作为还原剂
相反对应降得还.口诀
还原剂强弱不是影响很大.氧化剂强弱是重点多看看.1年前查看全部
- 三价铁和溴气哪个氧化性更高 最好给我提供一下还原性顺序表
 Well19831年前1
Well19831年前1 -
 jony251 共回答了16个问题
jony251 共回答了16个问题 |采纳率87.5%Cl2>Br2>Fe3+>I2>S
还原性:K>Ca>Na>Mg>Al>Mn>Zn>Cr>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
(2)金属阳离子氧化性的顺序
K+1年前查看全部
大家在问
- 1如何自制氦气.或哪里能购买少量氦气!氦气的化学式是什么?
- 2成功的花, 人们只惊羡她现时的明艳! 然而当初她的芽儿, 浸透了奋
- 3甲、乙两车分别从A、B两地同时出发相向而行,甲每小时行驶80千米,乙每小时行驶全程的10%,当乙行驶到全程的[5/8]时
- 4格列佛是什么原因来到飞岛国?知道的请回答!
- 5英语翻译Why do regulatory bodies need to study the financial sta
- 6作文,我要管住我自己,500字,我知道题目很弱智,但老师要求,
- 7若xy-z=0,且(y+x)/x=(z+x)/y=(y+x)/z,求[(y+z)(z+x)(x+y)]/xyz的值?
- 8下列反应中HNO 3 既表现出酸性又表现出强氧化性的是( ) A.稀硝酸与CuO反应
- 9冬天手冷时,我们经常将两只手相互搓搓使手感到暖和,是利用______的方法使手的内能增加的;用热水袋使身体变暖,是利用_
- 10He prepared well for the job interview,for he could't sick _
- 11一个长3m、宽为2m、深为1.5m的水池灌满了水.如把水全部放空留到与池底同高的地面,水的重力势能减少____J.
- 12种树郭橐驼传 和 病梅馆记 两文的异同
- 13—Do you mind if I play the piano?
- 14汉语拼音o和ou的区别韵母o和ou的区别
- 15硫磺是易燃物品还是自燃物品呢?
