从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如
 pierro2022-10-04 11:39:541条回答
pierro2022-10-04 11:39:541条回答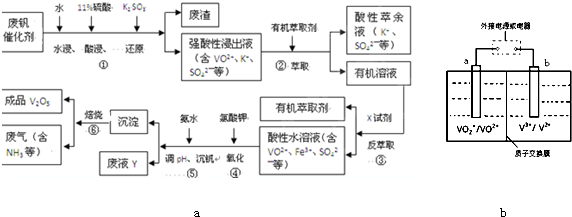
回答下列问题:
(1)①中废渣的主要成分是______.
(2)完成④中反应的离子方程式:
______ClO3-+______VO2++______H+=______VO3++______(______)+______(______)
(3)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(4)全矾液流电池是一种新型电能储存和高效转化装置(如图b所示,a、b均为惰性电极),已知:全矾液流电池的工作原理为:
VO2++V2++2H+
| 放电 |
| 充电 |
V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.则:
①放电过程中,当转移1.0mol电子时共有1.0mol H+从______槽迁移进______槽(填“左”、“右”)
②当充电时,右槽溶液颜色由______色变为______色.

已提交,审核后显示!提交回复
共1条回复
 leiby1019 共回答了20个问题
leiby1019 共回答了20个问题 |采纳率90%- 解题思路:(1)废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅;
(2)依据氧化还原反应元素化合价变化和电子守恒原子守恒分析配平得到离子方程式;
(3)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.6,此时钡沉淀率达到最大,需要调节的pH较小;依据沉淀溶度积计算分析;
(4)①放电时,正极上的反应:VO2++2H++e-═VO2++H2O,负极上发生V2+-e-=V3+的反应;
②充电过程是电解池的工作原理,阳极上发生失电子的氧化反应,右槽中是阴极反应,发生失去电子的氧化反应;(1)废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅,
故答案为:SiO2;
(2)依据氧化还原反应元素化合价变化和电子守恒原子守恒分析配平,ClO3-中氯元素化合价从+5价变化为-1价,得到电子6,VO2+变化为VO3+、元素化合价从+4价变化为+5价失电子1,依据电子守恒、原子守恒配平得到离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O;
故答案为:1;6;6;6;1,Cl-;3;H2O;
(3)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7,此时钡沉淀率达到最大,需要调节的PH较小;若钒沉淀率为90%时不产生Fe(OH)3沉淀,此时PH=2,氢离子浓度=10-2mol/L,c(OH-)=10-12mol/L,则溶液中c(Fe3+)浓度依据溶度积计算,Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.6×10-39,计算得到c(Fe3+)=2.6×10-3mol/L,不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<4.0×10-2mol/L,
故答案为:1.7;2.6×10-3mol/L;
(4)①根据题意,放电时左槽溶液颜色由黄色变为蓝色,即VO2++2H++e-═VO2++H2O,发生得电子的还原反应,所以此电极是正极,质子交换膜是允许氢离子通过的隔膜,放电时,正极上的反应:VO2++2H++e-═VO2++H2O,负极上发生V2+-e-=V3+的反应,当转移1.0mol电子时共有1.0mol H+从右槽移进左槽;
故答案为:右,左;
②充电过程中,a极是电解池的阳极,充电时和电源的正极相接,该极上发生失电子的氧化反应,充电时,右槽是电解池的阴极,该极上发生得电子的还原反应,应该是V3+为绿色变化为V2+为紫色,绿色变为紫色;
故答案为:绿、紫;点评:
本题考点: 金属的回收与环境、资源保护;氧化还原反应方程式的配平;化学电源新型电池;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等. - 1年前
相关推荐
- 废钒催化剂与稀硫酸和亚硫酸钾反应的化学方程式
 ee3691年前3
ee3691年前3 -
 jitake 共回答了15个问题
jitake 共回答了15个问题 |采纳率93.3%HCl少量时:Na2SO3+HCl=NaCl+NaHSO3.
HCl过量时:Na2SO3+HCl=2NaCl+H2O+SO2↑1年前查看全部
- 为回收利用废钒催化剂(含有V 2 O 5 、VOSO 4 及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺
为回收利用废钒催化剂(含有V 2 O 5 、VOSO 4 及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
回答下列问题:
(1)工业上由V 2 O 5 冶炼金属钒常用铝热法,该反应的化学方程式为_______
(2)为了提高钒的浸出率,用酸浸使催化剂中的V 2 O 5 转变成可溶于水的VOSO 4 ,与水浸液合并,再用KClO 3 氧化,使+4价的V氧化成易溶于水的(VO 2 ) 2 SO 4 。反应①的离子方程式为_______;反应②的离子方程式为ClO 3 - +6VO 2 + +3H 2 O=6VO 2 + +6H + +Cl - 。
(3)该工艺中反应③的沉淀率是回收钒的关键之一,该步反应的离子方程式为_______。
(4) 实验室用的原料中V 2 O 5 占6%(原料中的所有钒已换算成V 2 O 5 )。取100g该废钒催化剂按工业生产的步骤进行实验,当加入100 mL 0.1 mol·L -1 的KC1O 3 溶液时,溶液中的钒恰好被完全处理,假设以后各步钒没有损失,则该实验中钒的回收率是_______ (已知V 2 O 5 的相对分子质量为182)。
(5)全钒液储能电池是利用不同价态的离子对之间的氧化还原反应来实现化学能和电能相互转化的装置,其原理如右下图所示。已知电池的总反应式为VO 2 + +V 2 + +2H + VO 2 + +V 3 + +H 2 O
VO 2 + +V 3 + +H 2 O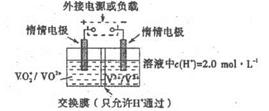
①放电时的正极反应式为______________。
②放电过程中氢离子的作用是______________,充电时若转移的电子为2mol,则左槽溶液中n(H + )的变化量为______________。 一个传说1年前1
一个传说1年前1 -
 芦花大公鸡 共回答了17个问题
芦花大公鸡 共回答了17个问题 |采纳率100%1年前查看全部
- 废钒催化剂的主要成分是V 2 O 5 、VOSO 4 、K 2 SO 4 、SiO 2 和Fe 2 O 3 等,现欲利用
废钒催化剂的主要成分是V 2 O 5 、VOSO 4 、K 2 SO 4 、SiO 2 和Fe 2 O 3 等,现欲利用以下工艺流程回收V 2 O 5 。
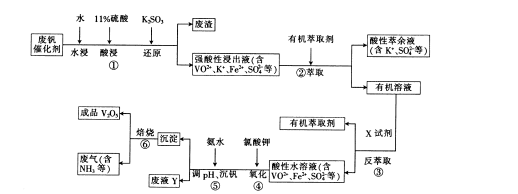
回答下列问题:
(1) VOSO 4 中,V元素的化合价为_______,①中产生的废渣的主要成分是_________。
(2)配平④中反应的离子方程式:
(3)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表:
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为______________。
(4)生产时,将②中的酸性萃余液循环用于①中的水浸。在整个工艺流程中,可循环利用的物质还有________________。
(5)成品V 2 O 5 可通过铝热反应来制取金属钒,写出该反应的化学方程式:______________________________________。 kod51年前1
kod51年前1 -
 cloudran 共回答了13个问题
cloudran 共回答了13个问题 |采纳率92.3%1年前查看全部
- (2013•淮南一模)从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程
(2013•淮南一模)从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程示意图如下,请回答下列问题:

(1)步骤①中废渣的主要成分是SiO2SiO2,③中X试剂为H2SO4H2SO4;(均填化学式)
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中;
(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)⇌2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是加入碱中和硫酸使平衡正移加入碱中和硫酸使平衡正移;
(4)请完成④中反应的离子方程式:
11ClO3-+66VO2++66H-+=66VO3++1Cl-1Cl-+3H2O3H2O
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为1.7-1.81.7-1.8;pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1 钒沉淀率% 88.1 94.8 96.5 98.0 98.8 98.8 96.4 93.1 89.3
(6)该工艺流程中,可以循环利用的物质有氨气 有机萃取剂氨气 有机萃取剂. 小樱不乖1年前1
小樱不乖1年前1 -
 就是喜欢贱 共回答了16个问题
就是喜欢贱 共回答了16个问题 |采纳率93.8%解题思路:(1)依据流程分析,步骤①是加入水溶解,加入酸溶解VOSO4,加入亚硫酸钾还原V2O5;步骤③是有机溶液中加入X试剂得到的离子分析可知X为硫酸;(2)依据分液操作的步骤进行分析回答,注意分液的原则是“上吐下泻”的分离方法;(3)依据平衡移动原理分析判断,正向进行可以提高萃取百分率;(4)依据氧化还原反应电子守恒和原子守恒书写配平离子方程式;(5)分析图表分析,加入氨水是调节溶液PH到钒沉淀率最高时最佳;(6)分析流程,过程中加入的物质在反应流程中有重新生成的物质可以循环利用.(1)步骤①是加入水溶解,加入酸溶解VOSO4,加入亚硫酸钾还原V2O5;步骤③是有机溶液中加入X试剂得到的离子是H+,VO2+,SO42-,可知酸性溶液中发生氧化还原反应,X为硫酸,故答案为:SiO2 ;H2SO4;
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中;
故答案为:打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中;
(3)R2(SO4)n(水层)+2nHA(有机层)⇌2RAn(有机层)+nH2SO4(水层),加入碱中和酸可以促进平衡正向进行,提高萃取百分率,
故答案为:加入碱中和硫酸使平衡正移;
(4)分析元素化合价,钒元素化合价从+4价变化为+5价,说明钒元素被氧化,氯元素化合价降低做氧化剂被还原为氯离子,结合氧化还原反应电子守恒和原子守恒判断缺项和配平离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案为:1,6,6,6,1 Cl-,3H2O;
(5)钒沉淀率最高时最佳,依据图表分析可知溶液的PH需要调节到1.7-1.8,钒的沉淀率最大,故答案为:1.7-1.8;
(6)过程中加入的物质在反应流程中有重新生成的物质可以循环利用,依据流程图可知,氨气和有机萃取剂是可以循环利用的物质,
故答案为:氨气;有机萃取剂.点评:
本题考点: 制备实验方案的设计;物质分离和提纯的方法和基本操作综合应用.1年前查看全部
- (2013•淮南一模)从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程
(2013•淮南一模)从废钒催化剂(主要成分有V2O5,VOSO4,K2SO4,SiO2等)中回收V2O5的一种生产流程示意图如下,请回答下列问题:
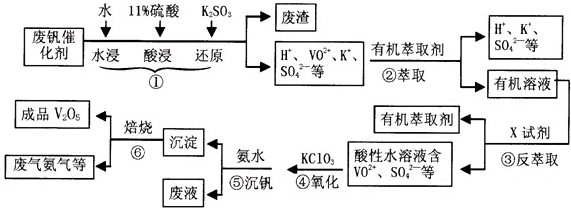
(1)步骤①中废渣的主要成分是______,③中X试剂为______;(均填化学式)
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,接下来的操作是______;
(3)②③的变化过程可简化为(下式R表示VO 2+,HA表示有机萃取剂)
R2(SO4)n(水层)+2nHA(有机层)⇌2RAn(有机层)+nH2SO4(水层)
为提高②中萃取百分率,应采取的措施是______;
(4)请完成④中反应的离子方程式:
______ClO3-+______VO2++______H-+=______VO3++______+______
(5)25°C时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如表
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH值为______;pH 1.3 1.4 1.5 1.6 1.7 1.8 1.9 2.0 2.1 钒沉淀率% 88.1 94.8 96.5 98.0 98.8 98.8 96.4 93.1 89.3
(6)该工艺流程中,可以循环利用的物质有______. liajili1年前1
liajili1年前1 -
 喜欢的技巧 共回答了14个问题
喜欢的技巧 共回答了14个问题 |采纳率92.9%(1)步骤①是加入水溶解,加入酸溶解VOSO4,加入亚硫酸钾还原V2O5;步骤③是有机溶液中加入X试剂得到的离子是H+,VO2+,SO42-,可知酸性溶液中发生氧化还原反应,X为硫酸,故答案为:SiO2 ;H2SO4;
(2)实验室中进行萃取分液操作时,注入萃取剂,充分振荡,将分液漏斗于铁圈上静置,当液体分层后,打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中;
故答案为:打开分液漏斗瓶塞(或瓶塞凹槽对准瓶口小孔);当分液面接近(或略超过)活塞处时关闭活塞;上层液体从分液漏斗上口倒入另一烧杯中;
(3)R2(SO4)n(水层)+2nHA(有机层)⇌2RAn(有机层)+nH2SO4(水层),加入碱中和酸可以促进平衡正向进行,提高萃取百分率,
故答案为:加入碱中和硫酸使平衡正移;
(4)分析元素化合价,钒元素化合价从+4价变化为+5价,说明钒元素被氧化,氯元素化合价降低做氧化剂被还原为氯离子,结合氧化还原反应电子守恒和原子守恒判断缺项和配平离子方程式为:ClO3-+6VO2++6H+=6VO3++Cl-+3H2O,
故答案为:1,6,6,6,1 Cl-,3H2O;
(5)钒沉淀率最高时最佳,依据图表分析可知溶液的PH需要调节到1.7-1.8,钒的沉淀率最大,故答案为:1.7-1.8;
(6)过程中加入的物质在反应流程中有重新生成的物质可以循环利用,依据流程图可知,氨气和有机萃取剂是可以循环利用的物质,
故答案为:氨气;有机萃取剂.1年前查看全部
大家在问
- 1做事不慌不忙 成功的事例
- 2已知:如图,正方形ABCD中,对角线AC、BD交于点O,E、F分别为OA、OD中点.求证:
- 3形容燕子飞的快的成语
- 4如图:点D是线段BC上的一点,角B=角C=角ADE=60度,AD=DE,求:CE=BD
- 5草履虫聚集在水上面,说明草履虫需要(阳光)(氧气)(养料)
- 6一定量的Na Mg Al 分别与足量的盐酸反应 放出的氯气质量比为1:2:4 则Na Mg Al 三种金属的物质的量比为
- 7有两只灯泡a和b,a灯标有“110V100W”,b灯标有“110V40W”,另有一个可变电阻R,为了能使两只灯泡在接入2
- 8关于功和能的关系,下列说法中不正确的是( )
- 9从中午到黄昏,前进,前进,终于翻过了第一座大雪山—夹金山.问;最后一句中的破折号的作用是什么?
- 10已知a与(b-1)互为相反数,求多项式4-【5(a-2b)-3(a+b)+15b】
- 11如图,从内到外,边长依次为2,4,6,8,…的所有正六边形的中心均在坐标原点,且一组对边与x轴平行,它们的顶点依次用A
- 12几比五分之二等于五分之二1
- 13DFI() ADG() A()G
- 14A的平方B的四次方减1/16因式分解
- 15一段的英语翻译,关于一个职位的since 2007 i am active as a business account


