甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:
 只爱白的2022-10-04 11:39:541条回答
只爱白的2022-10-04 11:39:541条回答(1)高炉冶铁过程中,甲烷在催化反应室中产生水煤气(CO和H2)还原氧化铁,有关反应为:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+260kJ•mol-1
已知:2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1则CH4与O2反应生成CO和H2的热化学方程式为______;
(2)将一定量的CO(g)与H2(g)通入定容的聚焦太阳能反应器,发生反应:
CO(g)+3H2(g)⇌CH4(g)+H2O(g).该反应△H=-206kJ•mol-1.
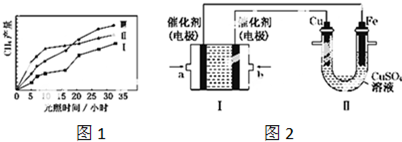
①在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图1所示.在0~30 小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为______.
②能说明该反应达到平衡状态的是______.
A.容器内压强保持不变B.气体平均相对分子质量保持不变
C.v正(CH4)=v逆(H2)D.CO的浓度保持不变
(3)如图2所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
①a处应通入______(填“CH4”或“O2”),b处电极上发生的电极反应式是______.
②电镀结束后,装置Ⅰ中溶液的pH______(填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度______.
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有
| O | 2 3 |
| O | 2 3 |
④在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷______L(标准状况下).

已提交,审核后显示!提交回复
共1条回复
 dbb519 共回答了15个问题
dbb519 共回答了15个问题 |采纳率100%- 解题思路:(1)根据盖斯定律书写热化学反应方程式;
(2)①相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
②平衡标志是正逆反应速率相同,各成分含量保持不变;
(3)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂;甲烷失电子和氢氧根离子反应生成碳酸根离子和水;
②根据I中氢氧根离子浓度变化确定溶液pH变化;II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量;
③I中还有碳酸根离子生成;
④根据转移电子相等计算消失甲烷的体积.(1)CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=260kJ•mol-1①
2CO(g)+O2(g)═2CO2(g)△H=-566kJ•mol-1②,
将方程式2×①+②得 2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ,
故答案为:2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-46kJ•mol-1 ;
(2)①由图2可知,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
故答案为:VⅢ>VⅡ>VⅠ;
②CO(g)+3H2(g)⇌CH4(g)+H2O(g).该反应△H=-206kJ•mol-1 ,反应是气体体积减小的放热反应,结合平衡标志是正逆反应速率相同,各成分含量保持不变;
A.反应前后气体压强发生变化,容器内压强保持不变,说明反应达到平衡状态,故A正确;
B.反应前后气体质量不变,物质的量减小,气体平均相对分子质量保持不变,说明反应达到平衡状态,故B正确;
C.3v正(CH4)=v逆(H2)说明反应达到平衡状态,v正(CH4)=v逆(H2),不能说明正逆反应速率相同,故C错误;
D.CO的浓度保持不变是破坏标志,故D正确;
故答案为:ABD;
(3)①II中首先镀铜,则Cu作阳极、Fe作阴极,I中a处电极为负极、b处电极为正极,负极上通入燃料、正极上通入氧化剂,所以a处通入的气体是甲烷;甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应为CH4+10OH--8e-=CO32-+7H2O,b处通的是氧气,电极上发生的电极反应式是:O2+2H2O+4e=4OH-;
故答案为:甲烷;O2+2H2O+4e=4OH-;
②根据I中电池反应为CH4+2O2+2KOH=K2CO3+3H2O,KOH参加反应导致溶液中KOH浓度降低,则溶液的pH减小;
II中发生电镀,阳极上溶解的铜质量等于阴极上析出铜的质量,则溶液中铜离子浓度不变,
故答案为:变小;不变;
③I中负极反应为CH4+10OH--8e-=CO32-+7H2O,所以还有碳酸根离子生成,故答案为:CO32-;
④串联电路中转移电子相等,所以消耗甲烷的体积=
12.8g
64g/mol×2
8×22.4L/mol=1.12L;
故答案为:1.12.点评:
本题考点: 热化学方程式;化学电源新型电池;化学平衡状态的判断.
考点点评: 本题考查了盖斯定律、原电池和电解池原理,平衡标志和判断,图象分析方法,根据电解池中Cu、Fe电极上发生的反应确定燃料电池中正负极及电极上通入的气体,再结合转移电子相等计算,难点是电极反应式的书写,题目难度中等. - 1年前
相关推荐
- (2009•天河区一模)现有 ①四氧化三铁,②甲烷,③铜粉,④氯酸钾,⑤氧气,⑥水,⑦
(2009•天河区一模)现有①四氧化三铁,②甲烷,③铜粉,④氯酸钾,⑤氧气,⑥水,⑦乙醇,⑧碳酸钠等物质,
(1)属于有机化合物的是(填编号,下同) ______;
(2)属于单质的是 ______;
(3)属于氧化物的是 ______;属于盐的是 ______. 狐媚天香1年前1
狐媚天香1年前1 -
 木而风 共回答了17个问题
木而风 共回答了17个问题 |采纳率100%解题思路:利用纯净物、有机物及化合物的分类可以解决此题,有机物是含碳的化合物;单质是含一种元素的纯净物;氧化物是由两种元素组成,其中一种是氧元素;盐是电离时生成金属离子与酸根离子的化合物.(1)有机物是含碳的化合物,故答案为:②⑦
(2)单质是纯净物,只含一种元素.故答案为:③⑤
(3)氧化物是含氧元素的化合物,且只有两种元素;盐是电离时生成金属离子与酸根离子的化合物.
故答案为:①⑥;④⑧点评:
本题考点: 有机物与无机物的区别;物质的简单分类;单质和化合物的判别;常见的氧化物、酸、碱和盐的判别.
考点点评: 此题是对物质分类知识的考查,通过对有机物、单质、氧化物、盐的选择,加深了对物质分类知识的理解.1年前查看全部
- 甲烷是一种清洁燃料.某密闭的容器有甲烷(CH4)、氧气、二氧化碳三种物质,在一定条件下,它们充分发生化学反应.测得反应前
甲烷是一种清洁燃料.某密闭的容器有甲烷(CH4)、氧气、二氧化碳三种物质,在一定条件下,它们充分发生化学反应.测得反应前后各物质的质量如下表:
请根据表中的信息,判断下列说法正确的是( )物质 甲烷 氧气 二氧化碳 水 反应前物质的质量(g) 16 70 1 0 反应后物质的质量(g) 0 x 45 36
A.甲烷燃烧不会产生温室气体
B.表中“x”的值为6
C.该反应为分解反应
D.10g甲烷在50g氧气中燃烧生成60g生成物 Just-a-Joke1年前1
Just-a-Joke1年前1 -
 bb269 共回答了15个问题
bb269 共回答了15个问题 |采纳率80%解题思路:根据质量守恒定律得出x的值,由物质质量的增减量可确定反应物和生成物的质量,反应后质量增加属于生成物,质量增加了多少,就是生成了多少,反应后质量减小,说明是反应物,减少的质量就是参加反应的质量,再根据反应物和生成物的种类判断反应类型.A、甲烷燃烧生成二氧化碳和水,二氧化碳属于温室效应的主要气体,故A说法错误;
B、根据质量守恒定律可以知道,X=16+70+1+0-0-45-36=6,故B说法正确;
C、甲烷反应后质量减少属于反应物,反应后氧气质量减少,属于反应物,二氧化碳反应后质量增加,属于生成物,开始没有水,最后有水了,说明水是生成物,反应物是两种,生成物是两种,所以该反应不是分解反应,故C说法错误;
D、设10g甲烷完全燃烧需要氧气的质量为x,则
CH4+2O2
点燃
.
CO2+2H20
1664
10g x
[16/64]=[10g/x],解得x=40g,因此10g甲烷在50g氧气中燃烧,氧气有剩余,所以不会生成60g生成物,故D说法错误.
故选:B.点评:
本题考点: 质量守恒定律及其应用;反应类型的判定.
考点点评: 掌握质量守恒定律的内容:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和,能够根据反应前后质量的变化来判断反应物和生成物,并能够根据反应特点来判断反应类型.1年前查看全部
- 完全燃烧2mol两种气态烃组成的混合气体后所得到3.2molCO2和4molH2O混合烃中乙烯__甲烷__丙烷__乙烷_
完全燃烧2mol两种气态烃组成的混合气体后所得到3.2molCO2和4molH2O混合烃中乙烯__甲烷__丙烷__乙烷__乙炔__(填“一定有”“一定无”“可能有”)
 刺_儿1年前1
刺_儿1年前1 -
 我不是新来的啊 共回答了18个问题
我不是新来的啊 共回答了18个问题 |采纳率94.4%设平均分子式为CxHy,则由燃烧方程式
CxHy+(x+y/4)O2→点燃→xCO2+y/2H2O
1 x y/2
2mol 3.2mol 4mol
X=1.6mol
y=4mol
因为混合气体是由两种气态烃组成,根据计算可知:碳原子的平均物质的量为1.6mol,所以含碳原子的物质的量一定有小于1.6、一定有大于1.6,而小于1.6的只有甲烷中碳原子数小于1.6,所以一定含有甲烷;
而甲烷分子中氢原子数是4,与平均相同,所以另一气态烃的氢原子数也应为4,因此另一气态烃为乙烯.
乙烯 一定有_甲烷_一定有_丙烷_一定无_乙烷_一定无_乙炔_一定无_1年前查看全部
- (2分)为了减少“温室效应”带来的负面影响。法国化学家Paul Sabatier提出CO2生成甲烷的反应。该反应是使CO
(2分)
为了减少“温室效应”带来的负面影响。法国化学家Paul Sabatier提出CO2生成甲烷的反应。该反应是使CO2和H2在催化剂作用下生成CH4和H2O,试写出该反应的化学方程式: qyd1101年前0
qyd1101年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 分子中所有原子不可能共面的是A甲烷 B乙烯 C乙醇 B苯
 hatelove4211年前1
hatelove4211年前1 -
 SYF我的爱 共回答了22个问题
SYF我的爱 共回答了22个问题 |采纳率86.4%A和C1年前查看全部
- (2004•泸州)有①氧气、②氢气、③水、④二氧化碳、⑤一氧化碳、⑥甲烷等6种我们熟悉的物质,请用这些物质的序号填写下列
(2004•泸州)有①氧气、②氢气、③水、④二氧化碳、⑤一氧化碳、⑥甲烷等6种我们熟悉的物质,请用这些物质的序号填写下列空白:属于氧化物的是______,能使带火星的木条复燃的气体是______,能使澄清石灰水变浑浊的气体是______,能与血红蛋白结合,有剧毒的气体是______,最常用的溶剂是______,燃烧后生成物是两种的是______.
 一个vv的时刻1年前1
一个vv的时刻1年前1 -
 jinbiao_zh 共回答了18个问题
jinbiao_zh 共回答了18个问题 |采纳率77.8%解题思路:根据氧化物的定义、氧气、二氧化碳、一氧化碳的性质、水的用途、甲烷的组成和燃烧产物回答.氧化物是指由两种元素组成的且其中一种是氧元素的化合物,水是由氢、氧两种元素组成的化合物,二氧化碳和一氧化碳是由由碳、氧两种元素组成的化合物,所以都是氧化物;氧气有助燃性,能使带火星的木条复燃;澄清石灰水的主要成分是氢氧化钙,二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水,故能能使澄清石灰水变浑浊;CO易与血液中的血红蛋白结合,且一旦结合就难以分离,使血红蛋白携氧能力降低,造成中毒;水是最常用的溶剂;甲烷是由碳、氢两种元素组成的,燃烧时生成二氧化碳和水.
故答案为:③④⑤;①;④;⑤;③;⑥.点评:
本题考点: 甲烷、乙醇等常见有机物的性质和用途;氧气的化学性质;二氧化碳的检验和验满;一氧化碳的毒性;从组成上识别氧化物.
考点点评: 本题主要考查对化学基本概念和物质性质、用途等基本知识,体现化学学科考查以教材为根本的原则,符合中考方向.1年前查看全部
- 甲烷与氯气在光照条件下发生取代反应,我做的一套湖南的理综卷子上的,说这句话不对
甲烷与氯气在光照条件下发生取代反应,我做的一套湖南的理综卷子上的,说这句话不对
正确答案是CH4与氯气在光照条件下发生取代反应,我勒个去,这有区别吗, 七键琴魔1年前1
七键琴魔1年前1 -
 雁度千山过 共回答了21个问题
雁度千山过 共回答了21个问题 |采纳率95.2%没有区别,不过最好是写化学结构式或分子式1年前查看全部
- 1mol甲烷在一定条件下和氯气发生取代反应,在此条件下完全反应后,只得到了一氯代物和二氯代物两种有机物,其中一氯代物的物
1mol甲烷在一定条件下和氯气发生取代反应,在此条件下完全反应后,只得到了一氯代物和二氯代物两种有机物,其中一氯代物的物质的量为0.7mol,求此时消耗的氧气的物质的量?
 百事乐3331年前1
百事乐3331年前1 -
 鸿翎急使 共回答了21个问题
鸿翎急使 共回答了21个问题 |采纳率85.7%一氯代物是0.7mol,那么二氯代物0.3mol,消耗Cl2=0.7+0.3X2=1.3mol1年前查看全部
- 汽油里含有多少比例的甲烷请问汽油里是不是含有甲烷,那比例大概是多少呢?
 775886881年前0
775886881年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 甲烷的四种氯代物均不溶于水,期中空间结构和甲烷完全相同的是()
甲烷的四种氯代物均不溶于水,期中空间结构和甲烷完全相同的是()
常温下,只有一氯甲烷是气体,其他三种是液体.CHCL3俗称()CCL4叫()是重要的有机溶剂, dodo_jun1年前2
dodo_jun1年前2 -
 grend 共回答了12个问题
grend 共回答了12个问题 |采纳率91.7%CCl4;氯仿;四氯化碳,大1年前查看全部
- 已知天然气的主要成分甲烷是一种会产生温室效应的气体,等物质的量的CH 4 和CO 2 产生的温室效应,前者大.下面是有关
已知天然气的主要成分甲烷是一种会产生温室效应的气体,等物质的量的CH 4 和CO 2 产生的温室效应,前者大.下面是有关天然气的几种叙述:①天然气与煤、石油相比是比较清洁的能源;②等质量的CH 4 和CO 2 产生的温室效应也是前者大;③燃烧天然气也是酸雨的成因之一.其中正确的是( ) A.①②③ B.只有① C.①和② D.只有③  把快乐留给明天1年前1
把快乐留给明天1年前1 -
 罩饼 共回答了16个问题
罩饼 共回答了16个问题 |采纳率93.8%根据题意可知天然气燃烧生成的二氧化碳气体是形成温室效应的主要原因,和化石燃料燃烧相比属于清洁能源,等质量为mg的甲烷和二氧化碳物质的量为:甲烷为
1
16 ×m,二氧化碳含碳量
1
44 ×m,所以,甲烷物质的量大于二氧化碳,所以甲烷产生的温室效应大;
故选C.1年前查看全部
- 物质的量1.0.2mol甲烷中,有____mol原子,共有几个原子.2.2mol酒精有____mol分子,氧原子的物质的
物质的量
1.0.2mol甲烷中,有____mol原子,共有几个原子.
2.2mol酒精有____mol分子,氧原子的物质的量为____mol,即____个,含氢原子____个,含碳原子____mol.
3.0.5mol乙烯分子中含有分子数____个.2mol乙烯中,有____个的乙烯分子,有____mol的碳原子和____个氢原子. governance1年前2
governance1年前2 -
 xiazf5988 共回答了21个问题
xiazf5988 共回答了21个问题 |采纳率95.2%1.
1mol;共有1NA=6.02×10^23个原子;
2.
2mol分子;氧原子2×2=4mol,即4NA=2.408×10^24个; 含氢原子2×4NA=4.816×10^24个,含碳原子2×2=4mol
3.
0.5×6NA=1.806×10^24个;
2NA=1.204×10^24个; 4mol的碳原子和8NA=4.816×10^24个氢原子1年前查看全部
- 标况下,5.60L的甲烷和乙烯的混合气体通过足量的溴水,溴水质量增加了4.20g.试求混合气体中乙烯的质量分数.
 幸福雪儿21年前1
幸福雪儿21年前1 -
 weier50 共回答了22个问题
weier50 共回答了22个问题 |采纳率90.9%溴水吸收乙烯
所以乙烯的质量是4.2g
则乙烯的的物质的量为4.20g/(28g/mol)等于0.15mol
因为混合气体的物质的量为5.60L/22.4L/mol等于0.25mol
所以甲烷的物质的量为0.25mol减去0.15mol等于0.10mol
则甲烷的质量为0.10mol乘以16g/mol等于1.6g
最后乙烯在混合气体中的质量分数为4.20/(4.20+1.60)乘以100%=72.41%1年前查看全部
- 下列关于甲烷结构的说法错误的是( ) A.甲烷分子中的化学键都是共价键 B.甲烷分子为正四面体结构 C.甲烷分子为正四
下列关于甲烷结构的说法错误的是( ) A.甲烷分子中的化学键都是共价键 B.甲烷分子为正四面体结构 C.甲烷分子为正四边形结构 D.CH 2 C1 2 不存在同分异构体  制作ll1年前1
制作ll1年前1 -
 万里独行007 共回答了16个问题
万里独行007 共回答了16个问题 |采纳率93.8%A、甲烷中存在的化学键是碳氢单键,均是共价键,故A正确;
B、甲烷的空间结构为正四面体结构,故B正确;
C、甲烷的空间结构为正四面体结构,故C错误;
D、甲烷分子中,碳原子采取sp 3 杂化,4个碳氢键完全相同,CH 2 C1 2 不存在同分异构体,故D正确.
故选C.1年前查看全部
- 异戊烷 丙烷 乙烯 甲烷 氮气得沸点是如何随压力变化的 比如每升高一个大气压 沸点升高多少度?
 吃不到葡萄1年前1
吃不到葡萄1年前1 -
 胭脂粉猪 共回答了19个问题
胭脂粉猪 共回答了19个问题 |采纳率94.7%压力增大沸点升高1年前查看全部
- 氧气 氢气 二氧化碳 一氧化碳 甲烷 这些气体仅能用排水法收集的是?(话说我觉得这些都不仅能用排水法收集) 麻烦化学达人
氧气 氢气 二氧化碳 一氧化碳 甲烷 这些气体仅能用排水法收集的是?(话说我觉得这些都不仅能用排水法收集) 麻烦化学达人回答下我这个问题 最好能简单的讲解下
 m99101年前15
m99101年前15 -
 cfcvgy 共回答了19个问题
cfcvgy 共回答了19个问题 |采纳率100%CO不用排空气法收集的原因,是因为CO的相对分子质量是28,而空气一般取29.
两者过于接近,所以不用向下排空气法收集
用排水法收集的原因,是CO难溶于水.1年前查看全部
- 一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol一1.
下列选项正确的是( )
A.CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-867 kJ•mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.1molCH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8 mol kl5da1年前1
kl5da1年前1 -
 sugelade 共回答了9个问题
sugelade 共回答了9个问题 |采纳率100%解题思路:A、根据盖斯定律由已知热化学方程式①+②可得2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ•mol-1,由于气态水的能量比液态水的能量高,相同物质的量的甲烷反应生成液态水放出的热量较多.
B、根据盖斯定律由已知热化学方程式①+②可得目标热化学方程式,然后根据热化学方程式计算放出的热量.
C、碳元素化合价由CH4中-4价升高为CO2中+4价,据此计算.
D、标准状况下2.24L CH4的物质的量为0.1mol,碳元素化合价由CH4中-4价升高为CO2中+4价,据此计算.A、已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
由盖斯定律①+②可得:2CH4(g)+4NO2(g)=2N2(g)+2CO2(g)+4H2O(g)△H=-1734 kJ•mol-1,即:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1,由于气态水的能量比液态水的能量高,所以1mol甲烷与2mol二氧化氮反应生成1mol氮气、1mol二氧化碳、2mol液态水放出的热量大于867kJ,故A错误;
B、由A可知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867 kJ•mol-1,所以0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为0.2mol×867 kJ•mol-1=173.4 kJ,故B正确;
C、反应中碳元素化合价由CH4中-4价升高为CO2中+4价,1molCH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为1mol×[4-(-4)]=8mol,故C错误;
D、标准状况下2.24L CH4的物质的量为0.1mol,用0.1molCH4还原NO2至N2,反应中碳元素化合价由CH4中-4价升高为CO2中+4价,转移的电子为0.1mol×[4-(-4)]=0.8mol,故D正确.
故选:BD.点评:
本题考点: 用盖斯定律进行有关反应热的计算;氧化还原反应的电子转移数目计算;有关反应热的计算.
考点点评: 考查反应热的计算、盖斯定律、氧化还原反应等,难度中等,注意A中物质的量状态与能量关系,掌握利用盖斯定律构造目标热化学方程式.1年前查看全部
- 9克水中所含氧原子数与多少克甲烷中所含氧原子数相同?
 qiu02101年前2
qiu02101年前2 -
 woshizhu514 共回答了20个问题
woshizhu514 共回答了20个问题 |采纳率85%应该是氢原子吧
9g水为0.5mol,含有1mol氢原子,
而1mol甲烷含有4mol氢原子
这样可以求出甲烷的质量了吧1年前查看全部
- (2014•天桥区三模)已确定某可燃性气体含有甲烷(CH4)和乙炔(C2H2),为进一步确定其组成,现取5.8g混合气体
(2014•天桥区三模)已确定某可燃性气体含有甲烷(CH4)和乙炔(C2H2),为进一步确定其组成,现取5.8g混合气体充分燃烧,测得生成CO2为17.6g,H2O为9g,则混合气体中CH4和乙炔C2H2的质量比为( )
A. 13:23
B. 16:13
C. 3:8
D. 13:8 笨鱼泡泡1年前1
笨鱼泡泡1年前1 -
 玲雅馨君 共回答了14个问题
玲雅馨君 共回答了14个问题 |采纳率78.6%解题思路:根据质量守恒定律,化学反应前后元素的种类和原子的质量不变,将甲烷的化学式改写成CH•H3进行解答即可.将甲烷的化学式改写成CH•H3,则混合气体中甲烷和乙炔碳元素和氢元素的原子个数比是1:1;
生成二氧化碳的质量是17.6g,则碳元素的质量是17.6g×[12/44]=4.8g,设和碳元素结合的氢元素的质量为x
C--H
12 1
4.8g x
[12/4.8g=
1
x] x=0.4g
故混合气体中CH的质量和是:4.8g+0.4g=5.2g,故甲烷中H3的质量是5.8g-5.2g=0.6g,设甲烷中CH的质量是y
CH--H3
13 3
y 0.6g
[13/y=
3
0.6g] y=2.6g
故甲烷的质量是2.6g+0.6g=3.2g,故乙炔的质量是5.8g-3.2g=2.6g
故甲烷和乙炔的质量比是3.2g:2.6g=16:13,观察选项,故选B.点评:
本题考点: 有关化学式的计算和推断;化合物中某元素的质量计算.
考点点评: 本题考查了混合物成分的推断,完成此题,可以巧妙的将化学式进行转化,然后进行计算即可.1年前查看全部
- 科学家发现海底埋藏着大量的“可燃冰”,其中主要含有甲烷水合物.甲烷中各元素的质量比是______,甲烷燃烧的化学方程式为
科学家发现海底埋藏着大量的“可燃冰”,其中主要含有甲烷水合物.甲烷中各元素的质量比是______,甲烷燃烧的化学方程式为CH4+2O2
CO2+2H2O点燃 .CH4+2O2.
CO2+2H2O点燃 .
“可燃冰”将成为未来新能源,但目前在开采技术上还存在困难.开采中甲烷气体一旦泄露可能导致的后果是______. jacy25531年前1
jacy25531年前1 -
 jiaxiaolin 共回答了13个问题
jiaxiaolin 共回答了13个问题 |采纳率84.6%解题思路:根据化合物中各元素的质量比等于各原子的相对原子质量之和的比;甲烷完全燃烧生成二氧化碳和水以及甲烷属于可燃性气体,遇明火会发生爆炸进行解答.甲烷中碳、氢元素的质量比=12:(1×4)=3:1;甲烷完全燃烧生成二氧化碳和水,化学方程式为CH4+2O2
点燃
.
CO2+H2O,甲烷属于可燃性气体,遇明火会发生爆炸,所以开采中甲烷气体一旦泄露可能导致的后果是会发生爆炸.
故填:碳氢元素的质量比为3:1(或C:H=3:1);CH4+2O2
点燃
.
CO2+2H2O;会发生爆炸.点评:
本题考点: 常用燃料的使用与其对环境的影响;元素质量比的计算;资源综合利用和新能源开发.
考点点评: 本题难度不大,新能源的开发与利用是中考考查的热点,掌握常见物质的元素组成、利用化学反应前后原子守恒来确定物质化学式的方法等是正确解题的关键.1年前查看全部
- 将一定量的甲烷燃烧后得到CO、CO2和水蒸气,混和气体的质量是49.6g通过无水氯化钙时,无水氯化钙增重25.2g,则C
将一定量的甲烷燃烧后得到CO、CO2和水蒸气,混和气体的质量是49.6g通过无水氯化钙时,无水氯化钙增重25.2g,则CO2的质量是( )
A. 12.5g
B. 13.2g
C. 19.7g
D. 24.4g wangloveu1年前3
wangloveu1年前3 -
 飘OV微 共回答了21个问题
飘OV微 共回答了21个问题 |采纳率85.7%解题思路:CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根根据C原子守恒可计算CO和CO2的总的物质的量,根据二者质量可计算CO2的物质的量,进而计算CO2质量.产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,
所以n(H2O)=[25.2g/18g/mol]=1.4mol,
根据H原子守恒,可知:n(CH4)=[1/2]n(H2O)=[1/2]×1.4mol=0.7mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,
所以m(CO)+m(CO2)=49.6g-25.2g=24.4g,
所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,
解之:n(CO2)=0.3mol,
所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g.
故选:B.点评:
本题考点: 化学方程式的有关计算.
考点点评: 本题考查混合物的计算,难度中等,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量.1年前查看全部
- 将氯气用光照射后在黑暗中放置一段时间再与甲烷混合,会发生氯代反应吗
将氯气用光照射后在黑暗中放置一段时间再与甲烷混合,会发生氯代反应吗
rt wenni55551年前1
wenni55551年前1 -
 wangzbs1688 共回答了15个问题
wangzbs1688 共回答了15个问题 |采纳率86.7%这是不可以的…这种取代反应的发生是有条件的…条件光照非常重要.这个取代反应的微观本质是氯气和甲烷发生有效碰撞.氯氯键和碳氢键会撞开,这里需要有一定的能量才能发生有效碰撞…这种碰撞必须要结合了光子的氯气才能达到效果.然后氯原子和氢原子生成氯化氢,另一个氯原子与失去一个氢原子的甲烷生成一氯甲烷.如果在黑暗状态下,氯气分子虽然会和甲烷分子碰撞.但不能使共价键断裂1年前查看全部
- “可燃冰“是深藏在海底的新能源,它的储量很大,具有开发应用前景,其主要成分是甲烷.甲烷的分子式为( )
“可燃冰“是深藏在海底的新能源,它的储量很大,具有开发应用前景,其主要成分是甲烷.甲烷的分子式为( )
A.CH4
B.C2H4
C.C2H2
D.C02 anran_liu1年前1
anran_liu1年前1 -
 亚马孙天使 共回答了16个问题
亚马孙天使 共回答了16个问题 |采纳率87.5%解题思路:甲烷是由碳氢两种元素构成的最简单的有机物.甲烷属于烷烃,是由碳氢两种元素构成的最简单的有机物,其分子式为CH4;
故选A.点评:
本题考点: 化石燃料与基本化工原料.
考点点评: 本题考查了甲烷的分子式的书写,属于基础知识的考查,题目较简单.1年前查看全部
- (2011•丹阳市模拟)从二氧化碳、甲烷、生石灰、氧化铝、一氧化碳中选出相应物质用化学式填空.
(2011•丹阳市模拟)从二氧化碳、甲烷、生石灰、氧化铝、一氧化碳中选出相应物质用化学式填空.
①可用作干燥剂的是______;
②可用作灭火剂的是______;
③具有毒性,用于冶炼金属的化合物是______;
④天然气的主要成分是______;
⑤铝制品表面失去金属光泽,是因为生成了______. 英俊的格格巫1年前1
英俊的格格巫1年前1 -
 headragon 共回答了23个问题
headragon 共回答了23个问题 |采纳率91.3%解题思路:本题解题关键是根据相关元素组成物质的性质判断出物质名称,然后根据物质化学式的书写规则正确写出表示物质的化学式.
①可做干燥剂的物质应具有可吸水性;
②可用作灭火剂的物质应该具有不燃烧,不支持燃烧的性质;
③一氧化碳具有毒性;
④天然气的主要成分是甲烷;
⑤铝在空气中会氧化.①氧化钙具有吸水性,故答案为CaO;
②二氧化碳不燃烧,也不支持燃烧,且密度比空气大,可用作灭火剂,故填:CO2;
③具有毒性,用于冶炼金属的化合物是一氧化碳,故填:CO;
④天然气的主要成分是甲烷,故答案为:CH4;
⑤铝制品表面失去金属光泽,是因为铝和氧气反应生成了氧化铝,故答案为:Al2O3.点评:
本题考点: 酸碱盐的应用;常见气体的用途.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计结合物质的性质,既考查了对物质性质的了解,又考查了学生对化学式等化学符号的书写,考查全面,注重基础,不错的题目.1年前查看全部
- 要使32千克甲烷在空气中完全燃烧需要消耗氧气多少升?要消耗这些氧气需要空气多少升.
 秦灯灯1年前4
秦灯灯1年前4 -
 xwdmeng 共回答了11个问题
xwdmeng 共回答了11个问题 |采纳率90.9%设,消耗氧气xg
CH4+2O2===点燃===CO2+2H2O
16 64
32g x
16/64=32/x
x=128g
消耗氧气128/22.4=5.71升
要空气5.71/21%=27.2升.1年前查看全部
- 以下关于甲烷的说法中错误的是 ( ) A.甲烷分子是由极性键构成的分子 B.甲烷分子具有正四面体结构 C.甲烷分子中四
以下关于甲烷的说法中错误的是 ( )
A.甲烷分子是由极性键构成的分子 B.甲烷分子具有正四面体结构 C.甲烷分子中四个C—H键是完全等价的键 D.甲烷分子中具有非极性键  ncspider1年前1
ncspider1年前1 -
 喜欢樱桃的女巫 共回答了23个问题
喜欢樱桃的女巫 共回答了23个问题 |采纳率95.7%D
甲烷是极性键构成的非极性分子,正四面体结构,四个C—H键是完全等价的键,D错误。1年前查看全部
- 相同质量的氢气,一氧化碳,甲烷分别燃烧,则消耗氧气的质量比为
相同质量的氢气,一氧化碳,甲烷分别燃烧,则消耗氧气的质量比为
需要理由 xiaosigeren1年前1
xiaosigeren1年前1 -
 湖人垄上行 共回答了18个问题
湖人垄上行 共回答了18个问题 |采纳率88.9%2H2 + O2 -----> 2H2O
2CO + O2 -----> 2CO2
CH4 + 2O2 -----> CO2 + 2H2O
m/4:m/56:m/8=1:1/14:1/2=14:1:71年前查看全部
- 甲烷与氯气反应的生成物1有油状液滴 和少量白雾 都是什么啊 2还有 什么情况下 取代反应完全啊 3甲烷只能和卤素元素反应
甲烷与氯气反应的生成物
1有油状液滴 和少量白雾 都是什么啊
2还有 什么情况下 取代反应完全啊
3甲烷只能和卤素元素反应么 kscience1年前3
kscience1年前3 -
 yyes2008 共回答了23个问题
yyes2008 共回答了23个问题 |采纳率87%1,三氯甲烷和四氯甲烷都是油状物,白雾应该是盐酸~
2,就是多通氯气啦,不过总是会有点杂质的了~
3,卤素取代,后面有些虚题应该会有催化氧化变成有氧的东东,甲醇甲醛甲酸之类的~不过那些你都不用管它是怎么做到的,题目告诉你可以反应就是可以~还有就是燃烧么~氧气跟甲烷反应.1年前查看全部
- 甲烷,NH4,SIH4,H2S这几种气态H化物最不稳定的是哪个?为什么?
 离子蓝1年前1
离子蓝1年前1 -
 wjhxf604 共回答了11个问题
wjhxf604 共回答了11个问题 |采纳率100%根据元素周期表,主族非金属元素从上到下,氢化物稳定性依次降低,同周期主族元素由左到右,氢化物稳定性依次升高,所以为SIH41年前查看全部
- 甲烷与丙烷 A.互为同位素 B.互为同素异形体 C.互为同分异构体 D.互为同系物
甲烷与丙烷 A.互为同位素 B.互为同素异形体 C.互为同分异构体 D.互为同系物
16上8下 O 与 17上8下 O 互为? z51791年前4
z51791年前4 -
 lship 共回答了19个问题
lship 共回答了19个问题 |采纳率100%D
A
如还有疑问~欢迎追问1年前查看全部
- 苯加甲醇是生成甲苯加水,还是苯酚加甲烷?反应条件是什么?
 lwx200520061年前1
lwx200520061年前1 -
 犹豫当中 共回答了24个问题
犹豫当中 共回答了24个问题 |采纳率91.7%在AlCl3催化下,苯也可以和醇反应,苯环上的氢原子被烷基取代生成烷基苯1年前查看全部
- 以下是甲烷(CH4)在空气中燃烧生成水和二氧化碳的微观过程模拟图,符合该反应微观过程先后顺序的选项是( )
以下是甲烷(CH4)在空气中燃烧生成水和二氧化碳的微观过程模拟图,符合该反应微观过程先后顺序的选项是( )

A.②③①
B.①③②
C.③②①
D.②①③ 五湖1年前1
五湖1年前1 -
 赛车手 共回答了19个问题
赛车手 共回答了19个问题 |采纳率89.5%甲烷燃烧是甲烷与空气中的氧气的反应,甲烷是由甲烷分子构成的,氧气是由氧分子构成的,故②在最前,甲烷分子分成碳原子和氢原子,氧分子分成氧原子,故①在中间,然后氢原子和氧原子结合成水分子,碳原子和氧原子结合成二氧化碳分子,故③在最后,故正确的顺序是②①③,观察选项,故选D.1年前查看全部
- 甲烷和氯气生成一氯代物化学方程式
 天越_dd1年前0
天越_dd1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 2009年12月7日世界气候大会在丹麦首都哥本哈根举行,旨在控制大气中二氧化碳、甲烷和其他造成“温室效应”的气体的排放,
2009年12月7日世界气候大会在丹麦首都哥本哈根举行,旨在控制大气中二氧化碳、甲烷和其他造成“温室效应”的气体的排放,将温室气体的浓度稳定在使气候系统免遭破坏的水平上。控制二氧化碳排放,更需要从人人做起,“低碳生活”有望成为新的时尚流行全球。“低碳生活”是指生活作息时所耗用能量要减少,从而减低碳特别是二氧化碳的排放。下列不属于“低碳生活”方式的是 [ ]A.多用电邮、QQ等即时通讯工具,少用传真打印机
B.乘地铁上下班
C.将呼吸产生的二氧化碳用石灰水吸收
D.吃天然食品、穿棉质服装 永不岛的小披风1年前1
永不岛的小披风1年前1 -
 秋也远 共回答了24个问题
秋也远 共回答了24个问题 |采纳率83.3%C1年前查看全部
- 下列说法正确的是( )A.用点燃的方法鉴别甲烷和乙烯B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等C.实验室常
 下列说法正确的是( )
下列说法正确的是( )
A.用点燃的方法鉴别甲烷和乙烯
B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等
C.实验室常用如图所示的装置制取少量的乙酸乙酯
D.糖类、蛋白质、油脂属于天然高分子化合物 caodefeng1年前1
caodefeng1年前1 -
 polopolo2223 共回答了21个问题
polopolo2223 共回答了21个问题 |采纳率95.2%A.乙烯中含碳量高,燃烧有黑烟,甲烷燃烧有淡蓝色的火焰,现象不同,能鉴别,故A正确;
B.1mol乙醇消耗3mol氧气,1mol乙酸消耗2mol氧气,消耗的氧气的质量不等,故B错误;
C.装置制取少量的乙酸乙酯,导管不能深入碳酸钠溶液中,易倒吸,故C错误;
D.糖类中的多糖为高分子化合物,油脂、单糖、二糖均不属于高分子化合物,故D错误;
故选A.1年前查看全部
- 能鉴别甲烷和乙烯的试剂是溴的四氯化碳溶液还是稀硫酸?
 lanlianhua_1231年前1
lanlianhua_1231年前1 -
 伽萘僧伽 共回答了11个问题
伽萘僧伽 共回答了11个问题 |采纳率100%溴的四氯化碳溶液.甲烷与溴的四氯化碳溶液不反应.溴的四氯化碳溶液加入乙烯颜色褪去.1年前查看全部
- 现提供以下几种物质:A.武德合金 B.甲烷 C.石灰石 D.一氧化碳
现提供以下几种物质:a.武德合金 b.甲烷 c.石灰石 d.一氧化碳
请根据它们的用途,用字母代号填写(每种物质限选一次):
(1) _______ 是“西气东输”中的气体主要成分;
(2) _______ 可用于生产水泥;
(3) _______ 是一种***气体燃料的主要成分;
(4) _______ 是制作保险丝的材料; 苏广雷同学1年前1
苏广雷同学1年前1 -
 vv的vv 共回答了21个问题
vv的vv 共回答了21个问题 |采纳率95.2%(1)B
(2)C
(3)D
(4)A1年前查看全部
- 老师说可以用电解醋酸钠来制取甲烷,我想问怎么制取,写出电极反应式?
 njtantan1年前1
njtantan1年前1 -
 2007nowhereman 共回答了24个问题
2007nowhereman 共回答了24个问题 |采纳率83.3%以前的课本有醋酸钠与氢氢化钠(固体)在加热下生成CH4,机理是脱羧反应.电解好象看到过.但具体怎么反应想不起来.C2H6好象也可以电解出来 .1年前查看全部
- 为什么甲烷气球瘪得比氧气气球/氮气气球快?
为什么甲烷气球瘪得比氧气气球/氮气气球快?
瘪得快/慢和气体分子大小有关么?那甲烷气体分子体积最小么?
(等温等压 气球体积相同) a-jean1年前4
a-jean1年前4 -
 饼干公主 共回答了15个问题
饼干公主 共回答了15个问题 |采纳率80%甲烷相对质量是16
氧气相对质量是32
氮气相对质量是28
甲烷气体分子比氧气/氮气小
气体分子体最小的是氢气,氢气相对质量是21年前查看全部
- 甲烷和丙烷混合气体VL,完全燃烧时所需氧气体积
 悠然苦涩1年前1
悠然苦涩1年前1 -
 pp6066 共回答了17个问题
pp6066 共回答了17个问题 |采纳率100%CH4 + 2O2 -----CO2 + 2H2O
1 2
V 2V
C3H8 + 5O2 ------3CO2 + 4H2O
1 5
V 5V
所需氧气体积 2V1年前查看全部
- 甲烷、氨气、溴化氢、碘化氢、硝酸、碳酸、磷酸、亚硫酸的化学式是什么?
 断刀流水11151年前1
断刀流水11151年前1 -
 烁远 共回答了17个问题
烁远 共回答了17个问题 |采纳率100%CH4,NH3,BrH,IH,HNO3,H2CO3,H3PO4,H2SO31年前查看全部
- 1木炭不充分燃烧2 一氧化碳燃烧 3甲烷燃烧4 酒精燃烧5碳和二氧化碳反应6碳还原氧化铜7碳还原氧化铁8氢气还原氧化铜9
1木炭不充分燃烧2 一氧化碳燃烧 3甲烷燃烧4 酒精燃烧5碳和二氧化碳反应6碳还原氧化铜7碳还原氧化铁8氢气还原氧化铜9工业煅烧石灰石10一氧化碳还原氧化铜 11加热铜粉 最好发图片谢谢
 qwteryeru1年前1
qwteryeru1年前1 -
 cqitic-solow 共回答了14个问题
cqitic-solow 共回答了14个问题 |采纳率92.9%1、2C+O2=2CO
2、2CO+O2=2CO2
3、CH4+2O2=CO2+2H2O
4、C2H5OH+3O2=2CO2+3H20
5、C+CO2=2CO
6、C+CUO=CO+CU;C+2CUO=CO2+2CU
7、3C+Fe2O3=3CO+2Fe;3C+2Fe2O3=2CO2+4Fe
8、H2+CUO=CU+H2O
9、CaCO3=CaO+CO2
10、CO+CUO=CU+CO2
11、2CU+O2=2CUO
我的答题到此结束,谢谢
希望我的答案对你有帮助1年前查看全部
- 化学反应中的热量变化问题甲烷燃烧放出热量,水的分解要吸收热量,试从化学键变化的角度分析其原因.
 蜡笔小哈1年前1
蜡笔小哈1年前1 -
 gwjawj 共回答了18个问题
gwjawj 共回答了18个问题 |采纳率94.4%甲烷燃烧断裂化学键所要的能量小于形成新化学键放出的能量所以放出热量
水的分解断裂化学键所要的能量大于形成新化学键放出的能量所以吸收热量1年前查看全部
- 16g甲烷完全燃烧需要多少克氧气,同时生成多少克二氧化碳
 偶尔忧郁1年前2
偶尔忧郁1年前2 -
 一别是千年 共回答了18个问题
一别是千年 共回答了18个问题 |采纳率88.9%CH4+2O2=CO2+2H2O
16 64 44
m氧=64×16÷16=64(g)
m二氧化碳=44×16÷16=44(g)1年前查看全部
- 为什么甲烷不易被氧化为甲酸,而甲基易被氧化为羧基呢
 xjy031年前2
xjy031年前2 -
 huahua365 共回答了20个问题
huahua365 共回答了20个问题 |采纳率90%甲烷是SP3轨道杂化,体系稳定,而甲基就因为这种体系被破坏了,不稳定.所以甲基不仅可以被氧化还可以被取代.有一种甲基化试剂就是这个原理,像麻黄碱和冰毒就一个甲基之差,国家才对麻黄碱严格控制.1年前查看全部
- 下列物质能使溴水因反应而褪色的是() A.甲烷 B.乙烯 C.苯 D.乙酸
 我爱书生1年前3
我爱书生1年前3 -
 长学 共回答了12个问题
长学 共回答了12个问题 |采纳率83.3%B.CH2=CH2+Br2==CH2Br-CH2B1年前查看全部
- 在标准状况下,6.72L的甲烷和CO的混合气体的质量为6g,求混合气体中有甲烷的物资的量,CO的质量
 shanghaicw1年前1
shanghaicw1年前1 -
 flowaters 共回答了19个问题
flowaters 共回答了19个问题 |采纳率94.7%n(CH4)=6.72/22.4=0.3mol,m(CH4)=0.3 x 16=4.8g m(CO)=6-4.8=1.2g,n(CO)=1.2/28=3/70 mol1年前查看全部
- 在甲烷与氯气取代反应的实验中,反应现象是瓶内(),瓶壁()瓶中()
 成都阿散1年前2
成都阿散1年前2 -
 白小白catt 共回答了19个问题
白小白catt 共回答了19个问题 |采纳率78.9%在甲烷与氯气取代反应的实验中,反应现象是瓶内(液面上升),瓶壁(有油状物生成),瓶中(气体颜色变浅或消失)1年前查看全部
- 什么是原子在一个平面内比如甲烷一个C,两个H,在同一个平面内,是因为如果再加上第三个H,两个键角加起来大于180度吗?如
什么是原子在一个平面内
比如甲烷一个C,两个H,在同一个平面内,是因为如果再加上第三个H,两个键角加起来大于180度吗?如果不是,是怎么用键角判断的? we12327091年前1
we12327091年前1 -
 bigalex88 共回答了22个问题
bigalex88 共回答了22个问题 |采纳率86.4%回到数学问题:三点成一平面.
以一个原子为一点.有三个以上原子组成的分子,如果都在一个平面内就是了.水分子有三个原子必在同一平面内,与键角无关.
但甲烷有五个原子,它们不在同一平面内.
乙烯分子有六个原子,若以所有原子的核为中心质点,则这些质点正好在同一平面内.平面形有机分子的碳原子都取sp2杂化,键角是120度.相同例还有苯.1年前查看全部
大家在问
- 1污染物在水体中的迁移转化过程按形态特征如何划分类型?
- 2用一根50厘米的铁丝围城一个长、宽比为3:2的长方形,围城的这个长方形面积是多少厘米
- 3用be honest with,be honest in,to be honest或honest填空
- 4一道直线与圆锥曲线关系O为坐标原点,M(1,-3),N(5,1),C满足OC=tOM+(1-t)ON(向量),C的轨迹与
- 5如图,∠1=90°+n°,∠2=90°-n°,∠3=m°,那么∠4的度数是( )
- 6六年级上册英语第七单元四会句子 外研社
- 7雨后,天空中出现了一条彩虹(改为比喻句)
- 8英语翻译妮妮来自天空,是一只自由自在地在天空飞翔着的小燕子,其造型创意来自北京传统的沙燕风筝.“燕”还代表燕京,妮妮把春
- 9Greeting the teacher
- 10(2014•赤峰)读某品牌汽车说明书,我们能感觉到当今世界是( )
- 11M20的螺栓用多粗的铁丝防松
- 12I live near a( ) ,I often go swimming there in summer A.rive
- 13在我国北方的冬天,下雪时人们不会感觉到很冷,而在化雪时却非常的寒冷,这就是俗话所说“下雪不冷,化雪冷”.试用所学知识解释
- 14用o f l e r w 组成一个单词,并说出中文.
- 150.1mol/L 醋酸钠溶液离子浓度最大的是,为什么,讲理由
