(2014•德庆县一模)下列反应的离子方程式正确的是( )
 只能做看客2022-10-04 11:39:541条回答
只能做看客2022-10-04 11:39:541条回答A.向Ba(OH)2溶液中滴加稀盐酸:2H++2Cl-+Ba2++2OH-═2H2O+BaCl2
B.向FeCl3溶液中加铁粉:2Fe3++Fe═3Fe2+
C.向澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O
D.向FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+

已提交,审核后显示!提交回复
共1条回复
 lanqilin 共回答了21个问题
lanqilin 共回答了21个问题 |采纳率90.5%- 解题思路:A.反应生成氯化钡和水,氢氧化钡为溶于水的强碱;
B.反应生成氯化亚铁、电子、电荷均守恒;
C.过量二氧化碳,反应生成碳酸氢钙;
D.电子、电荷不守恒.A.向Ba(OH)2溶液中滴加稀盐酸的离子反应为H++OH-═H2O,故A错误;
B.向FeCl3溶液中加铁粉的离子反应为2Fe3++Fe═3Fe2+,故B正确;
C.向澄清石灰水中通入过量二氧化碳的离子反应为OH-+CO2═HCO3-,故C错误;
D.向FeCl3溶液中加入Cu粉的离子反应为2Fe3++Cu═2Fe2++Cu2+,故D错误;
故选B.点评:
本题考点: 离子方程式的书写.
考点点评: 本题考查离子反应方程式的书写,明确发生的化学反应为解答的关键,注意把握氧化还原反应中电子、电荷守恒即可解答,题目难度不大. - 1年前
相关推荐
- (2014•德庆县一模)如图是利用某农作物品种①和品种②培育作物新品种的几种方法,叙述正确的是( )
(2014•德庆县一模)如图是利用某农作物品种①和品种②培育作物新品种的几种方法,叙述正确的是( )

A.⑥与③相比,茎秆粗壮,果实、种子大,营养物质丰富,结实率高
B.过程Ⅴ使用的药剂作用于有丝分裂的前期
C.过程Ⅵ需要限制酶和DNA聚合酶两种工具酶
D.过程Ⅶ产生的变异具有不定向性 风雨无心花满地1年前1
风雨无心花满地1年前1 -
 sunny_hit 共回答了20个问题
sunny_hit 共回答了20个问题 |采纳率80%解题思路:根据题意和图示分析可知:ⅠⅡ为杂交育种,ⅠⅢⅤ为单倍体育种,ⅠⅣ为多倍体育种,Ⅵ为基因工程育种,Ⅶ为诱变育种.A、③是二倍体生物,⑥是四倍体生物,⑥与③相比,茎秆粗壮,果实、种子大,营养物质丰富,但结实率低,A错误;
B、过程Ⅴ使用的药剂为秋水仙素,作用于有丝分裂的前期,抑制纺锤体的形成,B正确;
C、过程Ⅵ需要限制性核酸内切酶和DNA连接酶两种工具酶,C错误;
D、过程Ⅶ表示发生了基因突变,基因突变是不定向的,所以过程Ⅶ产生的变异具有不定向性,D正确.
故选:BD.点评:
本题考点: 生物变异的应用.
考点点评: 本题考查育种的相关知识,意在考查学生的识图能力和判断能力,运用所学知识综合分析问题和解决问题的能力.1年前查看全部
- (2012•德庆县一模)如图,已知直线y=12x与双曲线y=kx(k>0)交于A、B两点,且点A的横坐标为4.
 (2012•德庆县一模)如图,已知直线y=
(2012•德庆县一模)如图,已知直线y=
x与双曲线y=1 2
(k>0)交于A、B两点,且点A的横坐标为4.k x
(1)求k的值;
(2)判断点(-2,-4)是否在双曲线上,并说明理由. 蒙娜豆沙1年前1
蒙娜豆沙1年前1 -
 dolly-su6 共回答了18个问题
dolly-su6 共回答了18个问题 |采纳率83.3%解题思路:(1)将交点A的横坐标代入直线解析式中求出对应y的值,即为A的纵坐标,确定出A的坐标,将A的坐标代入反比例函数解析式中,即可求出k的值;
(2)由第一问求出的k值,确定出反比例解析式,将x=-2代入反比例解析式中求出对应y的值,判断y的值是否为-4,即可判断出点(-2,-4)是否在双曲线上.(1)∵直线y=[1/2]x与双曲线y=[k/x](k>0)交于A、B两点,且点A的横坐标为4,
∴将x=4代入直线解析式得:y=[1/2]×4=2,
∴A点的坐标为(4,2),
将x=4,y=2代入反比例解析式得:2=[k/4],
解得:k=8;
(2)∵k=8,
∴反比例函数的表达式为y=[8/x],
当x=-2时,y=[8/−2]=-4,
则点(-2,-4)在双曲线上.点评:
本题考点: 反比例函数与一次函数的交点问题.
考点点评: 此题考查了一次函数与反比例函数的交点问题,以及判断点是否在函数图象上的方法,熟练运用待定系数法是解本题的关键.1年前查看全部
- (2013•德庆县二模)如图,AB是⊙O的直径,若AB=10,BC=6,则cos∠CAB的值为( )
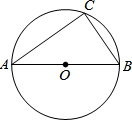 (2013•德庆县二模)如图,AB是⊙O的直径,若AB=10,BC=6,则cos∠CAB的值为( )
(2013•德庆县二模)如图,AB是⊙O的直径,若AB=10,BC=6,则cos∠CAB的值为( )
A.[3/4]
B.[4/3]
C.[3/5]
D.[4/5] 冰海飞鱼1年前1
冰海飞鱼1年前1 -
 z626622174 共回答了17个问题
z626622174 共回答了17个问题 |采纳率94.1%解题思路:AB是⊙O的直径,则△ABC是直角三角形,利用勾股定理求得AC的长,则利用三角函数的定义求解.∵AB是⊙O的直径,
∴∠ACB=90°,
在直角△ABC中,AC=
AB2−BC2=
102−62=8,
则cos∠CAB=[AC/AB]=[8/10]=[4/5].
故选D.点评:
本题考点: 圆周角定理;勾股定理;锐角三角函数的定义.
考点点评: 本题考查了圆周角定理,以及勾股定理、三角函数,正确理解定理是关键.1年前查看全部
- (2012•德庆县一模)某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质.限选以下试
(2012•德庆县一模)某同学设计了以下流程来检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质.限选以下试剂:氯化钡溶液、硝酸钡溶液、酚酞试液、稀硝酸、稀盐酸、稀硫酸、硝酸银溶液.回答下列问题:
(1)甲同学首先进行了粗略的检验,判断是否有氢氧化钠:用______(填仪器)取少量的固体于试管中,加蒸馏水,______(填操作)溶解,再滴加1-2酚酞溶液,结果溶液变红,甲同学说一定有氢氧化钠,请判断是否合理______(填是或否),并说明原因______
乙同学按下面的操作进行了详细的检验
(2)对检验碳酸钠粉末中可能含有的杂质提出合理假设:
假设1:只含有氯化钠假设2:只含有______
假设3:氯化钠和氢氧化钠都含有
(3)设计实验方案,进行试验
①加入过量试剂A的名称是______.
②填写下表:(按上面的步骤过程在下表中填写步骤4和步骤5加入的试剂和现象,结论)
实验步骤 预期现象和结论 步骤4:取少量滤液于试管,往其中滴加2~3滴酚酞试液 ______ 步骤5:另取少量滤液于另一试管,往其中滴加足量的______至溶液呈酸性,再滴加少量______. ______  泪汪汪哭1年前1
泪汪汪哭1年前1 -
 fxf19414 共回答了20个问题
fxf19414 共回答了20个问题 |采纳率80%解题思路:(1)利用药匙取用固体,溶解于水,振荡可加速溶解,滴加1-2酚酞溶液,结果溶液变红,溶液显碱性;
(2)由检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质进行假设;
(3)步骤1为溶解,步骤2中加硝酸钡将碳酸根离子转化为沉淀,步骤3为过滤,步骤4中检验溶液是否为碱性,步骤5中检验是否存在氯离子,以此来解答.(1)利用药匙取用固体,溶解于水,振荡可加速溶解,滴加1-2酚酞溶液,结果溶液变红,溶液显碱性,溶液中不一定含NaOH,因碳酸钠水溶液也呈碱性,也能使酚酞变红,故答案为:药匙;振荡; 否;因为碳酸钠水溶液也呈碱性,也能使酚酞变红;
(2)由检验碳酸钠粉末中可能含有少量氯化钠和氢氧化钠中的一种或两种杂质可知,假设2为只含氢氧化钠,故答案为:氢氧化钠;
(3)由实验流程可知,步骤1为溶解,步骤2中加硝酸钡将碳酸根离子转化为沉淀,步骤3为过滤,步骤4中检验溶液是否为碱性,步骤5中检验是否存在氯离子,
①由上述分析可知,试剂A为硝酸钡溶液,故答案为:硝酸钡溶液;
②由流程可知,步骤4为取少量滤液于试管,往其中滴加2~3滴酚酞试液,现象与结论为若变红则假设2或假设3成立,若不变红,假设1成立;
步骤5为另取少量滤液于试管,往其中滴加足量的稀硝酸至溶液呈酸性,再滴加少量的硝酸银溶液,现象和结论为①若没有白色沉淀生成,结合步骤4中溶液变红则说明假设2成立;②若有白色沉淀生成,结合步骤4中变红则说明假设3成立;结合步骤4中溶液没有变红则假设1成立,
故答案为:
实验步骤 预期现象和结论
步骤4:取少量滤液于试管,往其中滴加2~3滴酚酞试液 (1)如果酚酞变红,假设2或假设3成立.
(2)如果酚酞不变红,假设1可能成立.
步骤5:另取少量滤液于试管,往其中滴加足量的稀硝酸至溶液呈酸性,再滴加少量的硝酸银溶液. ①若没有白色沉淀生成,结合步骤4中溶液变红则说明假设2成立;②若有白色沉淀生成,结合步骤4中变红则说明假设3成立;结合步骤4中溶液没有变红则假设1成立.点评:
本题考点: 物质的检验和鉴别的实验方案设计.
考点点评: 本题考查物质成分的探究实验,侧重实验方案的设计和离子检验的考查,把握盐类水解规律及离子之间的反应为解答的关键,(3)为解答的难点,题目难度中等.1年前查看全部
- (2008•德庆县二模)特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图回答:
 (2008•德庆县二模)特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图回答:
(2008•德庆县二模)特快电热壶由于快捷方便,被许多家庭、宾馆使用.请据图回答:
(1)电热壶的制作材料中属于金属或合金的是______(填序号).
(2)用铜质材料制作电源插头的插脚是利用铜具有______性.
(3)这种水壶具有水沸自动断电保护功能,即水沸后因气压增大使电源开关自动断电.请从分子的角度解释水沸后气压增大的原因:______. wdy09221年前1
wdy09221年前1 -
 polo12 共回答了19个问题
polo12 共回答了19个问题 |采纳率84.2%解题思路:可以根据合金的概念、金属的物理性质和微观粒子的特征等方面进行分析、判断,从而得出正确的结论..(1)不锈钢属于合金.故填:①
(2)铜具有良好的导电性.故填:导电.
(3)分子之间的间隔随着温度的升高而增大.故填:受热时水分子运动加快,分子间的间隔增大.点评:
本题考点: 合金与合金的性质;金属的物理性质及用途;微粒观点及模型图的应用.
考点点评: 解答本题时要把图中的信息和所学知识有机地结合起来,只有这样才能得到合理的答案.1年前查看全部
- (2014•德庆县一模)如图,在光滑的水平桌面上有一物体A,通过绳子与物体B相连,不计一切摩擦,绳子不可伸长.如果mB=
 (2014•德庆县一模)如图,在光滑的水平桌面上有一物体A,通过绳子与物体B相连,不计一切摩擦,绳子不可伸长.如果mB=3mA,则物体A的加速度大小等于( )
(2014•德庆县一模)如图,在光滑的水平桌面上有一物体A,通过绳子与物体B相连,不计一切摩擦,绳子不可伸长.如果mB=3mA,则物体A的加速度大小等于( )
A.3g
B.[3g/4]
C.g
D.[g/2] 最美是爱你1年前1
最美是爱你1年前1 -
 celeste1985 共回答了20个问题
celeste1985 共回答了20个问题 |采纳率90%根据牛顿第二定律,得:
对A:F=mAa…①
对B:mBg-F=mBa…②
由①+②得:a=
mBg
mA+mB=
3mAg
mA+3mA=
3g
4
故ACD错误,B正确;
故选:B.1年前查看全部
- (2014•德庆县二模)一个正五边形绕它的中心至少要旋转______度,才能和原来五边形重合.
 道我的1年前1
道我的1年前1 -
 lin_86 共回答了16个问题
lin_86 共回答了16个问题 |采纳率100%解题思路:要与原来的五边形重合.可用一个圆周角的度数(即360度)除以5,便可知道至少要旋转多少度才能和原来的五边形重合.要与原来五边形重合,故为360÷5=72°.故一个正五边形绕它的中心至少旋转72°才能和原来的五边形重合.
点评:
本题考点: 旋转对称图形.
考点点评: 本题主要考查旋转对称图形的性质以及几何体度数的计算方法,难度一般.1年前查看全部
- (2011•德庆县二模)生产、生活中处处有化学.
(2011•德庆县二模)生产、生活中处处有化学.
(1)在KNO3、NH4HCO3、KAl(SO4)2•12H2O三种物质中,可用作复合肥的是______;碳酸氢铵溶液滴入氢氧化钠溶液,可闻到______气味的气体.
(2)使煤在空气中燃烧的条件是______.熄灭酒精灯利用的灭火原理是______.
(3)自行车的链条常采用______的方法防锈;用盐酸除去铁锈的化学方程式为______. 红Apple1年前1
红Apple1年前1 -
 AndreGuan 共回答了21个问题
AndreGuan 共回答了21个问题 |采纳率95.2%解题思路:同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥;铵盐遇碱会放出有刺激性气味的气体氨气;由燃烧的条件可以回答煤在空气中燃烧的条件.由铁生锈的条件和防护措施以及铁锈的主要成分,写出化学方程式即可.(1)硝酸钾中含有钾元素和氮元素,属于复合肥.碳酸氢铵属于铵盐,能与碱性物质反应产生刺激性气味的气体氨气;故答案为:硝酸钾;由刺激性;
(2)煤是可燃物,在空气中能与氧气接触,故达到燃烧所需的最低温度(或温度达到着火点)煤就能在空气中燃烧的条件;熄灭酒精灯利用的灭火原理是 隔绝氧气;故答案为:达到燃烧所需的最低温度(或温度达到着火点);隔绝氧气(或隔绝空气);
(3)自行车的链条是铁制的,容易生锈,所以给链条涂油,阻止了链条与氧气和水接触,可以防锈,还可以起到润滑作用;故答案为:涂油;
②铁锈的主要成分是Fe2O3,和盐酸反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O.点评:
本题考点: 常见化肥的种类和作用;金属锈蚀的条件及其防护;酸的化学性质;燃烧与燃烧的条件;灭火的原理和方法.
考点点评: 本题难度不大,主要考查学生对常见的化肥、可燃物燃烧的条件和灭火的原理和铁生锈的条件和防护措施以及铁锈的主要成分和除锈的方法等知识点的掌握情况.1年前查看全部
- (2014•德庆县二模)下列四个几何体中,俯视图为四边形的是( )
(2014•德庆县二模)下列四个几何体中,俯视图为四边形的是( )
A.
B.
C.
D.
 临风小子1年前1
临风小子1年前1 -
 gao_925 共回答了17个问题
gao_925 共回答了17个问题 |采纳率94.1%1年前查看全部
- (2014•德庆县一模)煤和石油都是重要的化工资源.下列过程不涉及化学变化的是( )
(2014•德庆县一模)煤和石油都是重要的化工资源.下列过程不涉及化学变化的是( )
A.石油的裂解
B.煤的干馏
C.石油的分馏
D.煤的气化 Batista1年前1
Batista1年前1 -
 失去的才最珍贵 共回答了24个问题
失去的才最珍贵 共回答了24个问题 |采纳率91.7%解题思路:化学变化的特征是:在原子核不变的情况下,有新物质生成.判断物理变化和化学变化的依据是:是否有新物质生成.A.石油的裂解是大分子生成小分子,有新物质生成,属于化学变化,故A错误; B.煤的干馏是煤加强热分解的过程有新物质生成,属于化学变化,故B错误;C.石油的分馏是利用物质沸点的不同进行分离,没有新物质生成,物...
点评:
本题考点: 物理变化与化学变化的区别与联系.
考点点评: 本考点考查了物理变化和化学变化的区别,基础性比较强,只要抓住关键点:是否有新物质生成,问题就很容易解决,本考点主要出现在选择题和填空题中.1年前查看全部
- (2014•德庆县二模)如图,已知矩形ABCD中,CE⊥BD于E,CF平分∠DCE与DB交于点F,FG∥DA与AB交于点
 (2014•德庆县二模)如图,已知矩形ABCD中,CE⊥BD于E,CF平分∠DCE与DB交于点F,FG∥DA与AB交于点G.
(2014•德庆县二模)如图,已知矩形ABCD中,CE⊥BD于E,CF平分∠DCE与DB交于点F,FG∥DA与AB交于点G.
(1)求证:BC=BF;
(2)若AB=4,AD=3,求CF;
(3)求证:GB•DC=DE•BC. dengda6661年前1
dengda6661年前1 -
 skula 共回答了18个问题
skula 共回答了18个问题 |采纳率100%解题思路:(1)要求证:BF=BC只要证明∠CFB=∠FCB就可以,从而转化为证明∠BCE=∠BDC就可以;
(2)已知AB=4,AD=3,就是已知BC=BF=3,CD=4,在直角△BCD中,根据三角形的面积等于[1/2]BD•CE=[1/2]BC•DC,就可以求出CE的长.要求CF的长,可以在直角△CEF中用勾股定理求得.其中EF=BF-BE,BE在直角△BCE中根据勾股定理,就可以求出;
(3)欲证GB•DC=DE•BC,由BC=BF,即证GB:DE=BF:DC,即证△GBF∽△EDC即可.(1)证明:∵四边形ABCD是矩形,∴∠CDB+∠DBC=90°.∵CE⊥BD,∴∠DBC+∠ECB=90°.∴∠ECB=∠CDB.又∵∠DCF=∠ECF,∴∠CFB=∠CDB+∠DCF=∠ECB+∠ECF=∠BCF.∴BF=BC;(2)在Rt△ABD中,由勾股定理得BD=AB2+AD...
点评:
本题考点: 相似三角形的判定与性质;勾股定理;矩形的性质.
考点点评: 本题主要考查矩形的性质及相似三角形的判定和性质,同时考查了等腰三角形边角之间的关系.1年前查看全部
- (uv14•德庆县一模)如图,半径为R的光滑圆形轨道安置在一竖直平面上,左侧连接一个光滑的弧形轨道,右侧连接动摩擦因数为
 (uv14•德庆县一模)如图,半径为R的光滑圆形轨道安置在一竖直平面上,左侧连接一个光滑的弧形轨道,右侧连接动摩擦因数为μ的水平轨道C手.小球A自弧形轨道上端由静止释放,恰好通过最高点我.通过圆轨道后,再滑上C手轨道,在C点与相同质量的另一小球C发生弹性碰撞,小球C到达手点时的速度为
(uv14•德庆县一模)如图,半径为R的光滑圆形轨道安置在一竖直平面上,左侧连接一个光滑的弧形轨道,右侧连接动摩擦因数为μ的水平轨道C手.小球A自弧形轨道上端由静止释放,恰好通过最高点我.通过圆轨道后,再滑上C手轨道,在C点与相同质量的另一小球C发生弹性碰撞,小球C到达手点时的速度为
.求:3gR
(1)小球A经过我点时速度的大小.
(u)小球释放时的高度h.
(3)水平轨道C手段的长度s. hzuh791年前1
hzuh791年前1 -
 兔兔王 共回答了15个问题
兔兔王 共回答了15个问题 |采纳率86.7%解题思路:(1)小球滚到两圆轨道最高点时对轨道无压力,仅受重力,运用向心力公式可求出在其位置的速度.(2)从释放点到轨道最高点过程只有重力做功,由机械能守恒定律可解高度h(3)由动能定理求出CD的长度(2)小球在3处对轨道压力为零,
由牛顿第二定律得:mg=m
vz3
R①
解得:v3=
gR;②
(z)取轨道最低点为零势能点,从释放小球到到达3的过程中,
由机械能守恒定律得:mgh=mg•zR+[2/z]mv3z,③
解得:h=z.3R;
(h)对小球从最高点到D点全过程,
应用动能定理得:mgh-μmgs=[2/z]mv2z-0,
解得:s=[R/μ];
答:(2)小球A经过3点时速度的大小为
gR.
(z)小球释放时的高度为z.3R.
(h)水平轨道2D段的长度为[R/μ].点评:
本题考点: 向心力;机械能守恒定律.
考点点评: 掌握向心力公式外,还熟悉了牛顿第二定律,最后比较了机械能守恒定律与动能定理的优缺点.本题中小球在轨道最高点压力为零是解题的切入点.1年前查看全部
- (2014•德庆县二模)“送人玫瑰,手留余香”,广东有一批无私奉献的志愿者,目前注册志愿者已达274万人,274万用科学
(2014•德庆县二模)“送人玫瑰,手留余香”,广东有一批无私奉献的志愿者,目前注册志愿者已达274万人,274万用科学记数法表示为( )
A.2.74×104
B.2.74×105
C.2.74×106
D.2.74×107 翃虹1年前1
翃虹1年前1 -
 温柔不是罪过 共回答了25个问题
温柔不是罪过 共回答了25个问题 |采纳率92%解题思路:科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数.确定n的值时,要看把原数变成a时,小数点移动了多少位,n的绝对值与小数点移动的位数相同.当原数绝对值>1时,n是正数;当原数的绝对值<1时,n是负数.274万=274 0000=2.74×106,
故选:C.点评:
本题考点: 科学记数法—表示较大的数.
考点点评: 此题考查科学记数法的表示方法.科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数,表示时关键要正确确定a的值以及n的值.1年前查看全部
- (2011•德庆县二模)表中列出几种物质的熔点,据此判断以下说法正确的是( )
(2011•德庆县二模)表中列出几种物质的熔点,据此判断以下说法正确的是( )
物质名称 汞 金 铜 铁 钨 氧 熔点/℃ -38.8 1064 1083 1535 3410 -218
A.铜球掉入铁水中不会熔化
B.在-220℃时,氧呈液态
C.水银温度计可测量-40℃的温度
D.用钨制成的灯丝不易熔化 sonya-faye1年前1
sonya-faye1年前1 -
 kk乐章 共回答了18个问题
kk乐章 共回答了18个问题 |采纳率83.3%解题思路:A、铜的熔点比铁的熔点低,铜球掉入铁水中会熔化;
B、氧气的熔点是-218℃,在-220℃时,氧呈固态;
C、水银的熔点是-38.8℃,不能测量-40℃的温度;
D、钨的熔点很高,不易熔化.A、铜球掉入铁水中会熔化.故选项错误;
B、在-220℃时,氧呈固态.故选项错误;
C、水银温度计不能测量-40℃的温度.故选项错误;
D、用钨制成的灯丝不易熔化.故选项正确.
故选D.点评:
本题考点: 金属的物理性质及用途.
考点点评: 解答本题要根据表中数据进行分析、判断,从而得出正确的结论.1年前查看全部
- (2011•德庆县二模)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为20%
 (2011•德庆县二模)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为20%的氢氧化钠溶液进行中和,如右图所示.
(2011•德庆县二模)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用质量分数为20%的氢氧化钠溶液进行中和,如右图所示.
(1)完全中和50g废水中盐酸需要氢氧化钠溶液的质量是______g.
(2)请你计算废水中盐酸的溶质质量分数.(写出具体的计算过程)
(3)在测定时,有同学发现在氢氧化钠溶液与盐酸反应过程中,溶液有温度的变化.某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:______. 倾听心灵的呼唤1年前1
倾听心灵的呼唤1年前1 -
 老五l 共回答了17个问题
老五l 共回答了17个问题 |采纳率94.1%解题思路:(1)因为NaOH和HCl完全反应后生成的NaCl溶液呈中性,故从图中分析可知当纵轴数值等于7时,对应的横轴值就是消耗氢氧化钠溶液的质量;
(2)根据NaOH和HCl反应的化学方程式,用氢氧化钠溶液中溶质NaOH的量可求出废液中溶质HCl的量,进而求出废液中HCl的质量分数;
(3)探究中和反应是否放热不能用氢氧化钠固体和盐酸反应,因为固体氢氧化钠溶于水也要放热,应该用氢氧化钠溶液和盐酸反应.(1)NaOH和HCl完全反应后的溶液呈中性,即PH=7,有图可知此时消耗的氢氧化钠溶液为20g.
(2)设废水中HCl的质量为x
20g氢氧化钠溶液中含溶质NaOH的质量为20×20%=4g
NaOH+HCl=NaCl+H2O
4036.5
4gx
[40/36.5=
4g
x]
x=3.65g
废水中盐酸的溶质质量分数=[3.65g/50g]×100%=7.3%
(3)由氢氧化钠的物理性质可知所设计的实验不合理,因为固体氢氧化钠溶于水也要放热,因而不能确定变化过程中的热效应是反应中产生的,还是溶解时产生的.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;常见碱的特性和用途.
考点点评: 此题是有关溶液的计算题,主要是第2问计算质量分数,一定要牢记溶质质量分数的公式,另外计算数据要认真准确.1年前查看全部
- (2008•德庆县二模)某化学兴趣小组在实验室利用如下装置制取气体.
(2008•德庆县二模)某化学兴趣小组在实验室利用如下装置制取气体.
(1)写出编号为①、②的仪器名称:①______; ②______.
(2)利用过氧化氢和二氧化锰来制取并收集氧气,所选用的装置为______(填字母)和______;从选择的收集装置看,你能得出氧气的性质有:______.用红砖粉末代替二氧化锰加入过氧化氢溶液中,也能够立即产生气泡,红砖粉末起______作用.该反应的化学方程式为2h2o2
2h2o+o2↑mno2 .2h2o2.
2h2o+o2↑mno2 .
(3)a装置检查气密性的方法______.
(4)若用b装置制取一瓶氢气,用排空气法进行收集,请画出收集装置图.
(5)硫化氢(h2s)是一种无色***气体,其水溶液呈酸性,实验后剩余的硫化氢气体应选用
______溶液作吸收剂,且选用下图中的(填序号)______装置吸收较为理想. waterair141年前1
waterair141年前1 -
 yanminl 共回答了13个问题
yanminl 共回答了13个问题 |采纳率84.6%(1)熟悉常见化学仪器,了解它们的名称.图中①试管;②水槽;故答案为:试管、水槽;
(2)用过氧化氢和二氧化锰反应制取氧气,是不需加热的反应装置,所以可以B;氧气的密度大于空气的密度,并不易溶于水,我们可用C向上排空气法和D排水法收集;因为红砖粉末代替二氧化锰加入过氧化氢溶液中,也能够立即产生气泡,所以红砖粉末的作用是催化;反应化学方程式是:2H2O2
MnO2
.
2H2O+O2↑.故答案为:B、C或D、不易溶于水,密度比空气大、催化、2H2O2
MnO2
.
2H2O+O2↑;
(3)根据课本所学方法,将导气管一端插入水中,手握试管,如产生气泡,则气密性良好.
(4)根据排空气法收集气体的注意事项画图即可,排空气法收集氢气图如下:
导管要伸到接近瓶的底部否则扣分;
(5)根据硫化氢溶液成酸性的特点,我们要用碱性溶液去处理剩余的气体.也就是说可用氢氧化钠或氢氧化钾;可选用图中的B装置.故答案为:氢氧化钠或氢氧化钾、B.1年前查看全部
- (2011•德庆县二模)下图是某实验中各物质间的变化关系,请回答:
(2011•德庆县二模)下图是某实验中各物质间的变化关系,请回答:
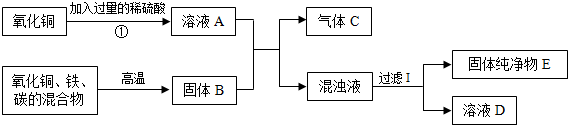
(1)操作Ⅰ的名称是______,操作Ⅰ中所用的铁制仪器是______.
(2)若氧化铜、铁、碳的混合物恰好完全反应,则气体C是______(填化学式,下同),固体纯净物E是______.
(3)写出①反应的化学方程式______.写出制得气体C的反应方程式______. mgls1231年前1
mgls1231年前1 -
 zaixiu1 共回答了22个问题
zaixiu1 共回答了22个问题 |采纳率90.9%解题思路:(1)分离不溶性固体和液体常用过滤的方法;过滤操作中用到的仪器有烧杯、玻璃棒、铁架台、漏斗,其中铁制仪器是铁架台;
(2)根据题意反应①是CuO+H2SO4=CuSO4+H2O,而且由于反应前加入了过量的稀硫酸,所以溶液A是硫酸铜溶液和稀硫酸的混合液;若氧化铜、铁、碳的混合物恰好完全反应后,生成的固体B为铁和铜的混合物;溶液A和固体B反应时,实质发生了Fe+CuSO4=FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑气体是H2;混浊液至少是FeSO4和Cu的混合物,过滤后E是Cu
(3)根据题意反应①是CuO与稀H2SO4反应生成CuSO4和H2O;铁与剩余的稀硫酸发生置换反应生成氢气.(1)分离不溶性固体和液体常用过滤的方法;过滤操作中用到的仪器有烧杯、玻璃棒、铁架台、漏斗,其中铁制仪器是铁架台,故答案为:过滤;铁架台;
(2)根据题意反应①是CuO+H2SO4=CuSO4+H2O,而且由于反应前加入了过量的稀硫酸,所以溶液A是硫酸铜溶液和稀硫酸的混合液;若氧化铜、铁、碳的混合物恰好完全反应后,生成的固体B为铁和铜的混合物;溶液A和固体B反应时,实质发生了Fe+CuSO4=FeSO4+Cu;Fe+H2SO4=FeSO4+H2↑气体是H2;混浊液至少是FeSO4和Cu的混合物,过滤后E是Cu,故答案为:H2;Cu
(3)根据题意反应①是氧化铜与稀硫酸反应生成硫酸铜和水;铁与剩余的稀硫酸发生置换反应生成氢气,故答案为:CuO+H2SO4=CuSO4+H2O;Fe+H2SO4=FeSO4+H2↑点评:
本题考点: 物质的相互转化和制备;酸的化学性质;碳的化学性质;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题考查了金属与酸及金属氧化物与酸的反应,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备,以便灵活应用.1年前查看全部
- (2013•德庆县一模)如果方程x2+px+q=0(p2-4q≥0)的两个根是x1,x2,
(2013•德庆县一模)如果方程x2+px+q=0(p2-4q≥0)的两个根是x1,x2,
(1)求证:x1+x2=-p,x1•x2=q;
(2)已知关于x的方程x2+mx+n=0,(n≠0)求出一个一元二次方程,使它的两个根分别是已知方程两根的倒数;
(3)已知a,b满足a2-15a-5=0,b2-15b-5=0,求[a/b+b a]的值. 可能相似的问题-
1年前1个回答
-
1年前1个回答
-
1年前1个回答
-
(2014•德庆县一模)在水溶液中能量共存的一组离子是( )
1年前1个回答
-
1年前1个回答
你能帮帮他们吗
Copyright © 2022 YULUCN.COM - 雨露学习互助 - 17 q. 0.048 s. - webmaster@yulucn.com 池中莲1101年前1
池中莲1101年前1 -
 longkaxin 共回答了23个问题
longkaxin 共回答了23个问题 |采纳率95.7%(1)证法1:∵x2+px+q=0,
∴x1=
p2−4q−p
2,x2=
−
p2−4q−p
2.
∴x1+x2=
p2−4q−p
2+
−
p2−4q−p
2=−p,
∴x1x2=
p2−4q−p
2×
−
p2−4q−p
2=q.
证法2:∵x2+px+q=0的两根为x1,x2.
∴(x−x1)(x−x2)=x2+px+q,
即x1年前查看全部
- (2014•德庆县二模)下列式子中正确的是( )
(2014•德庆县二模)下列式子中正确的是( )
A.([1/3])-2=-9
B.(-2)3=-6
C.
=-2(−2)2
D.(-3)0=1 jmyj5201年前1
jmyj5201年前1 -
 zxc1124zxc 共回答了19个问题
zxc1124zxc 共回答了19个问题 |采纳率100%A、(
1
3)−2=
1
(
1
3)2=9,故本项错误;
B、(-2)3=-8,故本项错误;
C、
(−2)2=2,故本项错误;
D、(-3)0=1,故本项正确,
故选:D.1年前查看全部
- (2012•德庆县一模)下列说法正确的是( )
(2012•德庆县一模)下列说法正确的是( )
A.甲酸乙酯和食用植物油均可水解
B.蛋白质、乙酸和糖类均属电解质
C.溴乙烷与NaOH水溶液共热生成乙烯
D.乙醇和乙醛都可以发生加成反应 yuzede1年前1
yuzede1年前1 -
 共回答了22个问题
共回答了22个问题 |采纳率100%解题思路:A、根据甲酸乙酯和植物油都属于酯类分析;
B、蛋白质和乙酸为电解质,而糖类属于非电解质;
C、根据卤代烃与氢氧化钠的水溶液发生取代反应分析;
D、乙醛含有不饱和键,能够发生加成反应,而乙醇不能够发生加成反应.A、由于食用植物油和乙酸乙酯都属于酯类,一定条件下都能够发生水解生成酸和醇,故A正确;
B、乙酸和蛋白质都能够电离出离子,属于电解质,而糖类不能够电离出离子,不属于电解质,故B错误;
C、溴乙烷在氢氧化钠的水溶液中加热发生取代反应,在氢氧化钠的醇溶液加热发生消去反应,故C错误;
D、乙醇分子中不含有不饱和键,不能够发生加成反应,故D错误;
故选:A.点评:
本题考点: 酯的性质;卤代烃简介;乙醇的化学性质;氨基酸、蛋白质的结构和性质特点.
考点点评: 本题考查了卤代烃的水解、酯的性质、电解质与非电解质的判断等知识,题目难度中等,涉及的知识点较多,注意掌握据此有机物的性质、电解质与非电解质的判断方法,试题有利于培养学生的分析理解能力及灵活应用所学知识的能力.1年前查看全部
- (2012•德庆县一模)短周期元素A、B、C、D的核电荷数依次增大,A位于第ⅠA族,B最外层电子数为5,A和C同主族,D
(2012•德庆县一模)短周期元素A、B、C、D的核电荷数依次增大,A位于第ⅠA族,B最外层电子数为5,A和C同主族,D的最外层电子数为3,则( )
A.原子半径:C>D>B
B.单质的金属性:D>C
C.A、B、C的氧化物均为共价化合物
D.D的氧化物是两性氧化物 needforlove1年前1
needforlove1年前1 -
 kk323637 共回答了37个问题
kk323637 共回答了37个问题 |采纳率78.4%解题思路:短周期元素A、B、C、D的核电荷数依次增大,A位于第ⅠA族,B最外层电子数为5,A和C同主族,C原子序数大于B,则B位于第二周期、C位于第三周期,则B为N元素、C为Na元素,A为Li或H,D的最外层电子数为3,处于ⅢA族,原子序数大于Na,则D为Al,据此解答.短周期元素A、B、C、D的核电荷数依次增大,A位于第ⅠA族,B最外层电子数为5,A和C同主族,C原子序数大于B,则B位于第二周期、C位于第三周期,则B为N元素、C为Na元素,A为Li或H,D的最外层电子数为3,处于ⅢA族,原子序数大于Na,则D为Al,
A.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>Al>N,故A正确;
B.同周期自左而右金属性减弱,故金属性Na>Al,故B错误;
C.A为Li时,其氧化物为离子化合物,C为Na元素,其氧化物为离子化合物,故C错误;
D.Al的氧化物为氧化铝,氧化铝是两性氧化物,故D正确,
故选AD.点评:
本题考点: 原子结构与元素周期律的关系.
考点点评: 本题考查结构位置性质关系应用,难度不大,注意A元素的不确定性,掌握结构与位置关系是解题关键.1年前查看全部
- (2014•德庆县一模)如图,T代表“天宫一号”飞行器,S代表“神舟八号”飞船,它们都绕地球做匀速圆周运动,其轨道如图中
 (2014•德庆县一模)如图,T代表“天宫一号”飞行器,S代表“神舟八号”飞船,它们都绕地球做匀速圆周运动,其轨道如图中所示,则( )
(2014•德庆县一模)如图,T代表“天宫一号”飞行器,S代表“神舟八号”飞船,它们都绕地球做匀速圆周运动,其轨道如图中所示,则( )
A.T的周期大于S的周期
B.T的线速度大于S的线速度
C.T的向心加速度大于S的向心加速度
D.S和T的速度都小于环绕速度7.9km/s ranling1年前1
ranling1年前1 -
 superwjt 共回答了16个问题
superwjt 共回答了16个问题 |采纳率68.8%解题思路:由图可知两飞行器的转动半径,由万有引力公式可得出两者的周期、速率、向心加速度等的大小关系;根据变轨需要的条件及卫星的运动可知如何对接.由图可知,T的转动半径大于S的转动半径
A、由G[Mm
r2=
4π2mr
T2可知,T=2π
r3/GM],故T的周期大于S的周期;故A正确;
B、由G[Mm
r2=
mv2/r]可知,v=
GM
r,故T的速度小于S的速率,故B错误;
C、由G[Mm
r2=ma可知,a=
GM
r2,故T的加速度小于S的加速度,故C错误;
D、由G
Mm
r2=
mv2/r]可知,v=
GM
r,环绕速度7.9km/s,半径最小,所以S和T的速度都小于7.9km/s,故D正确;
故选AD.点评:
本题考点: 人造卫星的加速度、周期和轨道的关系;线速度、角速度和周期、转速.
考点点评: 天体的运动主要依靠万有引力定律充当向心力,故分析天体的运动时一定要先从这一点进行分析,再结合所学过的运动学知识解决问题.1年前查看全部
- (2013•德庆县一模)下列运算正确的是 ( )
(2013•德庆县一模)下列运算正确的是 ( )
A.2a2+3a3=5a5
B.(a2)3=a8
C.a3÷a2=a
D.(a-b)2=a2-b2 wang13yu101年前1
wang13yu101年前1 -
 一笑而过难 共回答了17个问题
一笑而过难 共回答了17个问题 |采纳率88.2%解题思路:利用合并同类项、幂的乘方、同底数幂的除法以及完全平方公式的知识求解即可求得答案,注意排除法在解选择题中的应用.A、2a2+3a3≠5a5,故本选项错误;
B、(a2)3=a6,故本选项错误;
C、a3÷a2=a,故本选项正确;
D、(a-b)2=a2-2ab+b2,故本选项错误.
故选C.点评:
本题考点: 同底数幂的除法;合并同类项;幂的乘方与积的乘方;完全平方公式.
考点点评: 此题考查了合并同类项、幂的乘方、同底数幂的除法以及完全平方公式.此题比较简单,注意掌握指数的变化是解此题的关键.1年前查看全部
- (2014•德庆县一模)在真空中,电量为q1的点电荷产生的电场中有一点P,P点与q1的距离为 r,把一个电量为
(2014•德庆县一模)在真空中,电量为q1的点电荷产生的电场中有一点P,P点与q1的距离为 r,把一个电量为q2的实验电荷放在P点,它受的静电力为F,则P点电场强度的大小等于( )
A.[Fq1  rainy_wind1年前1
rainy_wind1年前1 -
 天粘衰草 共回答了15个问题
天粘衰草 共回答了15个问题 |采纳率80%解题思路:电量为q1的点电荷场源电荷,在P点产生的电场强度的大小根据公式E=k
可以确定.电量为q2的实验电荷在P点所受的电静电力为F,根据电场强度的定义式E=q1 r2
也可以确定P点电场强度的大小.F q2 A、B电量为q2的实验电荷在P点所受的电静电力为F,根据电场强度的定义式得到:P点电场强度的大小E=
F
q2.故A错误,B正确.
C、D电量为q1的点电荷场源电荷,在P点产生的电场强度的大小为E=k
q1
r2.故C正确,D错误.
故选BC点评:
本题考点: 电场强度.
考点点评: 本题考查了电场强度的两个公式:E=F/q],E=kQr2,q是试探电荷,Q是场源电荷.1年前查看全部
- (2011•德庆县二模)右表是一种救治伤员常用瓶装药品说明书的一部分,请仔细阅读并回答问题.
(2011•德庆县二模)右表是一种救治伤员常用瓶装药品说明书的一部分,请仔细阅读并回答问题.
(1)已知葡萄糖的化学式为C6H12O6,则葡萄糖的相对分子质量为______,葡萄糖中碳氢氧原子个数比为______,18g葡萄糖中含有______g碳元素.品名:葡萄糖氯化钠内注射液
【类别】体液补充药
【规格】(1)l00mL:葡萄糖5g,氯化钠0.9g
(2)250mL:葡萄糖25g,氯化钠2.25g
【适应症】补充热能和体液
(2)某伤员补充l00mL注射液和250mL注射液各l瓶,相当于补充了______g葡萄糖.
(3)不同规格的该药品(注射液的密度均为1g/mL)中氯化钠的质量分数______(选填“相同”、“不同”). ztuu8441年前1
ztuu8441年前1 -
 zdsppp 共回答了7个问题
zdsppp 共回答了7个问题 |采纳率71.4%(1)根据相对分子的质量为组成分子的各原子的相对原子质量之和,可得葡萄糖C6H12O6的相对分子质量为:12×6+12+16×6=180;根据标在元素符号右下角的数字表示一个分子中所含原子的个数;可得葡萄糖中碳氢氧原子个数...1年前查看全部
- (2012•德庆县二模)在Rt△ABC中,∠C=90°,BC=6,AB=8,sinA=[3/4][3/4].
 两只小乌龟走了1年前1
两只小乌龟走了1年前1 -
 baby820731 共回答了19个问题
baby820731 共回答了19个问题 |采纳率100%解题思路:根据锐角三角函数的定义知sinA=[对边/斜边]=[CB/AB],将相关线段的长度代入计算即可.∵Rt△ABC中,∠C=90°,BC=6,AB=8,
∴sinA=[CB/AB]=[6/8]=[3/4].
故答案为:[3/4].点评:
本题考点: 锐角三角函数的定义.
考点点评: 本题主要考查锐角三角函数的定义及运用:在直角三角形中,锐角的正弦为对边比斜边,余弦为邻边比斜边,正切为对边比邻边.1年前查看全部
- (2012•德庆县一模)能在水溶液中大量共存的一组离子是( )
(2012•德庆县一模)能在水溶液中大量共存的一组离子是( )
A.H+、Fe3+、NO3-、ClO-
B.Ag+、Cu2+、Cl-、SO2−4
C.K+、SO
、Na+、NO2−4−3
D.NH4+、OH-、Cl-、HCO−3 任洪强1年前1
任洪强1年前1 -
 楚一丹 共回答了18个问题
楚一丹 共回答了18个问题 |采纳率94.4%解题思路:离子之间不发生任何反应生成沉淀、气体或弱电解质,或不发生氧化还原反应、互促水解等反应,则可大量共存,以此解答.A.H+与ClO-反应生成HClO,不能大量共存,故A错误;
B.Ag+与Cl-、SO42-反应生成沉淀而不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.OH-与NH4+、HCO3-反应不能大量共存,故D错误.
故选:C.点评:
本题考点: 离子共存问题.
考点点评: 本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握常见离子的性质以及反应类型,为解答该题的关键,难度不大.1年前查看全部
- (2011•德庆县二模)同学们在学习碱的化学性质时,进行如图所示的实验.
(2011•德庆县二模)同学们在学习碱的化学性质时,进行如图所示的实验.

(1)A实验注入氢氧化钠溶液后,可观察到的现象是______;
(2)C实验中观察到试管内有白色沉淀产生,写出该反应的化学方程式:______.
(3)实验结束后,同学们将A、B、C三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
【提出问题】废液中含有哪些物质?
【交流讨论】①小明通过实验观察,认为废液中一定含有的物质是水、氯化钠、指示剂和______(写物质名称);一定不含有的物质是______(写物质名称).
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?
同学们有如下猜想:
小明认为:只有碳酸钠
小东认为:只有氢氧化钠
小刚认为:是氢氧化钠和碳酸钠
你认为还有可能是______(写一种猜想).
【实验设计】小聪想用氯化钙溶液来验证小明、小东、小刚的猜想.通过查阅资料获悉氯化钙溶液呈中性,并设计如下实验.
若溶液呈红色,则______的猜想正确;若溶液呈无色,则______的猜想正确.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需要考虑______. woniu15141年前1
woniu15141年前1 -
 szyl88 共回答了18个问题
szyl88 共回答了18个问题 |采纳率83.3%解题思路:(1)氢氧化钠溶液与二氧化碳反应,压强变小,大气压吧气球吹大;
(2)氢氧化钙溶液与碳酸钠反应,生成碳酸钙沉淀和氢氧化钠溶液;
(3)因为“滴由酚酞的溶液显碱性”,则可知该溶液呈碱性;故碱性物质由:碳酸钠、氢氧化钠、氢氧化钙、或它们的混合物等组合;根据实验设计,验证实验的猜想.(1)A实验注入氢氧化钠溶液后,可观察到的现象是气球变大;
(2)C实验中观察到试管内有白色沉淀产生,由题意可写出该反应化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(3)实验结束后,同学们将A、B、C三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
【交流讨论】①小明通过实验观察,认为废液中一定含有的物质是水、氯化钠、指示剂和碳酸钙;一定不含有的物质是盐酸.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?可能是氢氧化钙或氢氧化钠和氢氧化钙;碳酸钠、氢氧化钠、碳酸钠与氢氧化钠等(写一种猜想).
【实验设计】小聪想用氯化钙溶液来验证小明、小东、小刚的猜想.通过查阅资料获悉氯化钙溶液呈中性,并设计实验.若溶液呈红色,则小刚的猜想正确;若溶液呈无色,则小明的猜想正确.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需要考虑反应物是否有剩余.
故答为:(1)气球变大;
(2)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(3)【交流讨论】①碳酸钙;盐酸;②氢氧化钙(或氢氧化钠和氢氧化钙)(写化学式也可给分)(其它合理答案均可)【实验设计】小刚;小明【反思拓展】反应物是否有剩余(其它合理答案均可)点评:
本题考点: 碱的化学性质;实验探究物质的组成成分以及含量;盐的化学性质.
考点点评: 掌握碱的性质及其应用;了解物质的除杂和净化方法;了解酸碱盐的溶解性和在空气中的储存方法.1年前查看全部
- 英语翻译我的家乡是德庆县,位于广东省中部偏西西江中游北岸的从属于肇庆市的一个山区县.那里的交通便利,资源丰富,在1996
英语翻译
我的家乡是德庆县,位于广东省中部偏西西江中游北岸的从属于肇庆市的一个山区县.
那里的交通便利,资源丰富,在1996年被定为广东省历史文化名城. MICHELLE-QIU1年前1
MICHELLE-QIU1年前1 -
 hyfx 共回答了12个问题
hyfx 共回答了12个问题 |采纳率91.7%I come from Deqing Town , a mountian town lying on the nothern shore of the midstream of the Westren River, which runs in the west -central part of Guangdong Province , is under the jurisdiction of Zhaoqing City. My hometown enjoys a very convenient transportation system, with abundant resources and a long history ,which has renowned it as a famous historical cultural city by the govrnment of Guangdong Province in 1996.1年前查看全部
- (2014•德庆县二模)已知x=2是方程x2+mx+2=0的一个根,则m的值是______.
 sumelyc1年前1
sumelyc1年前1 -
 ff大亨no1 共回答了20个问题
ff大亨no1 共回答了20个问题 |采纳率90%解题思路:将x=2代入方程即可得到一个关于m的方程,解方程即可求出m值.把x=2代入方程可得:4+2m+2=0,
解得m=-3.
故答案为-3.点评:
本题考点: 一元二次方程的解.
考点点评: 本题主要考查了方程的解的定义,把求未知系数的问题转化为方程求解的问题.1年前查看全部
- (2014•德庆县一模)四种短周期元素的性质或结构信息如下表.下列推断正确的是( )
(2014•德庆县一模)四种短周期元素的性质或结构信息如下表.下列推断正确的是( )
元素编号 元素性质或结构 T M层上有6个电子 X 元素最高正价是+7价 Y 第三周期元素的金属阳离子中半径最小 Z Z在第三周期,最外层电子数只有一个
A.非金属性:T>X;还原性:Y>Z
B.X的最高价氧化物对应的水化物是无机含氧酸中的最强酸
C.离子半径从大到小的顺序:T>X>Z>Y
D.X、Z形成化合物的化学键类型与X、T形成化合物的化学键类型相同 无我无天1年前1
无我无天1年前1 -
 red12 共回答了20个问题
red12 共回答了20个问题 |采纳率95%解题思路:T原子M层上有6个电子,则T是S元素;
X元素最高正价是+7价且为短周期元素,则X是Cl元素;
Y是第三周期元素的金属阳离子中半径最小的元素,第三周期离子半径最小的金属阳离子是铝离子,所以Y是Al元素;
Z在第三周期,最外层电子数只有一个,则Z是Na元素;
A.同一周期元素中,元素的金属性随着原子序数的增大而减弱,非金属性随着原子序数的增大而增强,元素的金属性越强,其还原性越强;
B.Cl元素的最高价氧化物的水化物是无机含氧酸中酸性最强的酸;
C.离子的电子层数越多,其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小;
D.活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键.T原子M层上有6个电子,则T是S元素;
X元素最高正价是+7价且为短周期元素,则X是Cl元素;
Y是第三周期元素的金属阳离子中半径最小的元素,第三周期离子半径最小的金属阳离子是铝离子,所以Y是Al元素;
Z在第三周期,最外层电子数只有一个,则Z是Na元素;
A.同一周期元素中,元素的金属性随着原子序数的增大而减弱,非金属性随着原子序数的增大而增强,元素的金属性越强,其还原性越强,所以非金属性:T<X;还原性:Y<Z,故A错误;
B.Cl元素的最高价氧化物的水化物HClO4是无机含氧酸中酸性最强的酸,故B正确;
C.离子的电子层数越多,其离子半径越大,电子层结构相同的离子,其离子半径随着原子序数的增大而减小,离子半径大小顺序是T>X>Z>Y,故C正确;
D.X、Z形成化合物的化学键是离子键,X、T形成化合物的化学键是共价键,离子键和共价键类型不同,故D错误;
故选BC.点评:
本题考点: 位置结构性质的相互关系应用.
考点点评: 本题考查了元素位置结构性质的相互关系及应用,根据原子结构确定元素,再结合元素周期律来分析解答,知道离子半径大小的比较方法,题目难度不大.1年前查看全部
- (2012•德庆县一模)我市去年参加中考人数约为50 000人,用科学记数法表示为( )
(2012•德庆县一模)我市去年参加中考人数约为50 000人,用科学记数法表示为( )
A.50×103
B.5×103
C.5×104
D.5×105 handaoping1年前1
handaoping1年前1 -
 queenyli 共回答了23个问题
queenyli 共回答了23个问题 |采纳率87%解题思路:科学记数法的表示形式为a×10n的形式,其中1≤|a|<10,n为整数.确定n的值是易错点,由于50 000有5位,所以可以确定n=5-1=4.50 000=5×104.
故选C.点评:
本题考点: 科学记数法—表示较大的数.
考点点评: 此题考查科学记数法表示较大的数的方法,准确确定a与n值是关键.1年前查看全部
- (2008•德庆县二模)在植物生长过程中,氮肥能使枝叶繁茂,磷肥能使果实饱满,钾肥能使茎杆健壮.小明同学回家发现自家田里
(2008•德庆县二模)在植物生长过程中,氮肥能使枝叶繁茂,磷肥能使果实饱满,钾肥能使茎杆健壮.小明同学回家发现自家田里的小麦出现大面积倒伏现象,就向其父母提出了一条合理化建议:明年应在小麦生长期增施抗倒伏的化肥,你认为应多施用的化肥是( )
A.Ca(H2PO4)2
B.KCl
C.NH4NO3
D.微量元素肥料 yanran1985011年前1
yanran1985011年前1 -
 sisiyalangley 共回答了16个问题
sisiyalangley 共回答了16个问题 |采纳率93.8%解题思路:含有氮元素的肥料称为氮肥.含有磷元素的肥料称为磷肥.含有钾元素的肥料称为钾肥.同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥.钾肥能使茎杆健壮,抗倒伏.
A、磷酸二氢钙中含有磷元素,属于磷肥.错误;
B、氯化钾中含有钾元素,属于钾肥.正确;
C、硝酸铵中含有氮元素,属于氮肥.错误;
D、微量元素肥料不能使茎杆健壮,抗倒伏.错误.
故选B.点评:
本题考点: 常见化肥的种类和作用.
考点点评: 本题主要考查化肥的分类方面的知识,解答时要分析化肥中含有哪种或哪几种营养元素,然后再根据化肥的分类方法确定化肥的种类.1年前查看全部
- (2013•德庆县二模)已知△ABC的三边长分别为3cm,4cm,5cm,D,E,F分别为△ABC各边的中点,则△DEF
(2013•德庆县二模)已知△ABC的三边长分别为3cm,4cm,5cm,D,E,F分别为△ABC各边的中点,则△DEF的周长为( )
A.3cm
B.6cm
C.12cm
D.24cm 雪芦萤火1年前1
雪芦萤火1年前1 -
 山坡牧羊 共回答了19个问题
山坡牧羊 共回答了19个问题 |采纳率89.5%解题思路:利用三角形中位线定理可知,中点三角形的周长等于原三角形周长的一半,即可求.∵△ABC的三边长分别为3cm,4cm,5cm,
∵D,E,F分别为△ABC各边的中点,
∴△DEF的各边长分别为△ABC的三边长的一半,
∴△DEF的周长为[1/2](3+4+5)=6cm.
故选B.点评:
本题考点: 三角形中位线定理.
考点点评: 本题比较简单,考查的是三角形中位线定理的性质,属简单题目.1年前查看全部
- (2图15•德庆县一模)有关生物膜结构与功能的叙述,正确的是( )
(2图15•德庆县一模)有关生物膜结构与功能的叙述,正确的是( )
A.生物膜的功能主要由膜蛋白实现的,它的合成不需要ATP
B.线粒体外膜与内膜的主要功能不同,丙酮酸的分解是在线粒体内膜上进行的
C.细胞中的囊泡都是由高尔基体形成的
D.变形虫和草履虫的细胞膜基本组成成分相同 8块钱1年前1
8块钱1年前1 -
 mixia1980 共回答了15个问题
mixia1980 共回答了15个问题 |采纳率86.7%解题思路:生物膜的主要组成成分是蛋白质和磷脂,不同生物膜的功能的复杂程度是由生物膜的蛋白质的种类和数量决定的,生物膜系统由细胞膜、细胞器膜和核膜组成,生物膜系统在组成成分上相似、在结构和功能上联系.多、生物膜蛋白的合成过程是耗能过程,需要多TP提供能量,多错误;
7、丙酮酸分解的场所是线粒体基质,7错误;
C、细胞膜中囊泡不一定是由高尔基体形成,细胞进行胞吞时形成的吞噬泡由细胞膜形成,C错误;
e、变形虫和草履虫的细胞膜基本组成成分相同,都是磷脂和蛋白质,e正确.
故选:e.点评:
本题考点: 细胞膜系统的结构和功能.
考点点评: 本题的知识点是生物膜的组成成分和功能,生物膜系统在组成成分、结构上、功能上联系,有氧呼吸的具体过程和发生的场所,对于相关知识点的理解并把握知识点间的内在联系是解题的关键.1年前查看全部
- (2012•德庆县二模)下列图形中,既是轴对称图形又是中心对称图形的是( )
(2012•德庆县二模)下列图形中,既是轴对称图形又是中心对称图形的是( )
A.
B.
C.
D.
 52qq20051年前1
52qq20051年前1 -
 毛钱个人 共回答了18个问题
毛钱个人 共回答了18个问题 |采纳率100%解题思路:根据轴对称图形与中心对称图形的概念对各选项分析判断后利用排除法求解.A、既是轴对称图形又是中心对称图形,故本选项正确;
B、是轴对称图形,但不是中心对称图形,故本选项错误;
C、不是轴对称图形,是中心对称图形,故本选项错误;
D、是轴对称图形,但不是中心对称图形,故本选项错误.
故选A.点评:
本题考点: 中心对称图形;轴对称图形.
考点点评: 本题考查了中心对称图形与轴对称图形,一定要掌握好中心对称图形与轴对称图形的概念:轴对称图形的关键是寻找对称轴,图形两部分折叠后可重合,中心对称图形是要寻找对称中心,旋转180度后两部分重合.1年前查看全部
- (2014•德庆县二模)如图,菱形ABCD的边长为2cm,∠ADC=120°,弧BD是以A为圆心AB长为半径的弧,弧CD
 (2014•德庆县二模)如图,菱形ABCD的边长为2cm,∠ADC=120°,弧BD是以A为圆心AB长为半径的弧,弧CD是以点B为圆心BC长为半径的弧.则图中阴影部分的面积为[2π/3][2π/3]cm2.
(2014•德庆县二模)如图,菱形ABCD的边长为2cm,∠ADC=120°,弧BD是以A为圆心AB长为半径的弧,弧CD是以点B为圆心BC长为半径的弧.则图中阴影部分的面积为[2π/3][2π/3]cm2. lyzz1001年前1
lyzz1001年前1 -
 慧云脑袋简单 共回答了25个问题
慧云脑袋简单 共回答了25个问题 |采纳率80%解题思路:根据菱形的对角线平分每一组对角,进而得出∠BDC=∠DBC=60°,即可得出△DBC是等边三角形,进而利用扇形面积求出即可.∵菱形ABCD的边长为2cm,∠ADC=120°,
∴∠BDC=∠DBC=60°,
∴△DBC是等边三角形,
∴BD=BC=2cm,
∴图中阴影部分的面积为:
60π×22
360=[2π/3](cm2).
故答案为:[2π/3].点评:
本题考点: 菱形的性质;扇形面积的计算.
考点点评: 此题主要考查了菱形的性质以及等边三角形判定和扇形的面积公式的应用,根据已知得出△DBC是等边三角形是解题关键.1年前查看全部
- (2012•德庆县一模)将1.00mol二氧化硫和1.00mol氧气通入1.00L的密闭容器中,分别在500K、600K
(2012•德庆县一模)将1.00mol二氧化硫和1.00mol氧气通入1.00L的密闭容器中,分别在500K、600K、700K三个不同的温度下进行2SO2+O2⇌2SO3反应,反应过程中SO3浓度随时间的变化如下面表格所示:
表一:500K
表二:600K时间(min) 0 5 10 15 20 25 30 35 40 45 50 55 SO3
浓度(mol/L)0 0.1 0.15 0.20 0.25 0.30 0.35 0.40 0.50 0.55 0.60 0.60
表三:700K时间(min) 0 5 10 15 20 25 SO3浓度(mol/L) 0 0.2 0.30 0.40 0.50 0.50
(1)从上面三个表的数据可以判断该反应是______反应(填吸热或放热),利用表一计算0-40min内用时间(min) 0 5 10 15 20 25 SO3浓度(mol/L) 0 0.25 0.35 0.35 0.35 0.35
SO2表示该反应的化学反应速率v(SO2)=______mol/L•min;
(2)对该反应,下面的说法正确的是______;(双选)
A.当容器中的压强不再变化时,该反应就达到平衡
B.达到平衡时v正(SO2)=v逆(SO3)
C.平衡时c(SO2)=c(SO3)
D.当由500K平衡状态时升高温度至600K时,重新达到平衡状态时,容器的压强减少
(3)从上面三个表的数据,温度对应该反应的反应速率和平衡移动的影响是______;
(4)计算在600K时的平衡常数(写出计算过程,最后结果取两位有效数字)依题意得 2SO2+O2⇌2SO3
开始浓度(mol/L) 1 1 0
转化浓度(mol/L) 0.50 0.25 0.50
平衡浓度(mol/L) 0.50 0.75 0.50
K=
=[0.50mol/L×0.50mol/Lc2(SO3) c2(SO2)c(O2) (0.50mol/L)2×0.75mol/L  alizeexu1年前0
alizeexu1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2008•德庆县二模)从 C、H、O、S、Na中选择合适的元素,写出符合下列要求的物质的化学式:
(2008•德庆县二模)从 C、H、O、S、Na中选择合适的元素,写出符合下列要求的物质的化学式:
(1)可形成酸雨的氧化物______.
(2)其水溶液能使无色酚酞溶液变成红色的碱______.
(3)可用来除锈的酸______.
(4)占人体体重最多的物质______. heming_011年前1
heming_011年前1 -
 sky20009 共回答了18个问题
sky20009 共回答了18个问题 |采纳率66.7%解题思路:由C、H、O、S、Na中选择合适的元素,组成合适的物质:
(1)可形成酸雨的氧化物为二氧化硫或三氧化硫;
(2)其水溶液能使无色酚酞溶液变成红色的碱为氢氧化钠;
(3)可用来除锈的酸为硫酸;
(4)占人体体重最多的物质水.(1)二氧化硫或三氧化硫的化学式,其书写方法为:根据读法,从右向左,故SO2(或SO3);
(2)氢氧化钠:已知钠元素的化合价为+1价,氢氧根的化合价为-1价,先标注化合价
+1
Na
−1
OH,再利用化合价数值交叉法书写化学式NaOH;
(3)硫酸:已知氢元素的化合价为+1价,硫酸根的化合价为-2价,先标注化合价
+1
H
−2
SO 4,再利用化合价数值交叉法书写化学式H2SO4;
(4)水的化学式,其书写“氢二氧一”,故化学式为:H2O.
故答为:(1)SO2(或SO3);(2)NaOH;(3)H2SO4;(4)H2O.点评:
本题考点: 化学式的书写及意义;酸雨的产生、危害及防治;氧化物、酸、碱和盐的概念;生命活动与六大营养素.
考点点评: 本题主要考查学生对化学用语的书写和理解能力,题目设计既包含对化学符号意义的了解,又考查了学生对化学符号的书写.1年前查看全部
- (2014•德庆县一模)甲、乙两车从同一地点沿同一方向出发,如图是甲、乙两车的速度图象,由图可知( )
 (2014•德庆县一模)甲、乙两车从同一地点沿同一方向出发,如图是甲、乙两车的速度图象,由图可知( )
(2014•德庆县一模)甲、乙两车从同一地点沿同一方向出发,如图是甲、乙两车的速度图象,由图可知( )
A.甲车的加速度大于乙车的加速度
B.t1时刻甲、乙两车的加速度相同
C.t1时刻甲、乙两车相遇
D.t1时刻甲、乙两车速度相等 cqahui1年前1
cqahui1年前1 -
 宝宝得哇 共回答了23个问题
宝宝得哇 共回答了23个问题 |采纳率95.7%解题思路:根据斜率的大小判断加速度的大小.由图得知t1时刻甲、乙两车的速度相同.t1时刻甲、乙两车位移不等,没有相遇.A、甲车图线的斜率小于乙车图线的斜率,则甲车的加速度小于乙车的加速度.故A错误.
B、D由图可知:t1时刻甲车的加速度小于乙车的加速度,两车速度相等.故B错误,D正确.
C、t1时刻甲的位移大于乙的位移,它们从同一地点出发,则甲在乙的前方,没有相遇.故C错误.
故选D点评:
本题考点: 匀变速直线运动的图像.
考点点评: 本题速度图象问题,由图象能直接读出速度、加速度和位移,要抓住数学意义来理解物理意义.1年前查看全部
- (2012•德庆县一模)某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的是( )
(2012•德庆县一模)某同学通过系列实验探究铝及其化合物的性质,操作正确且能达到目的是( )
A.将Al(OH)3沉淀转入坩埚中,加强热,得氧化铝固体
B.将Ba(OH)2溶液缓慢滴入Al2(SO4)3溶液中,观察Al(OH)3沉淀的生成
C.将Al(OH)3浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀
D.将铝加入浓硫酸中探究铝和硫酸反应是否产生氢气 bear56781年前1
bear56781年前1 -
 cara5185 共回答了20个问题
cara5185 共回答了20个问题 |采纳率90%解题思路:Al(OH)3的性质,Al(OH)3的分解时的温度为300℃左右,因此不需要用坩,用蒸发皿,不用坩埚;
3Ba(OH)2+Al2(SO4)3=3BaSO4↓+2Al(OH)3↓,除生成Al(OH)3沉淀外,还有BaSO4沉淀,对观察Al(OH)3沉淀,造成干扰,过滤操作步骤,不能将浊液直接倒入,要通过玻璃棒引流.根据Al和浓硫酸的性质解决.常温下Al和浓硫酸相遇会发生钝化.A• 2Al(OH)3
加热
.
Al2O3+3H2O,将Al(OH)3放入蒸发皿中加热分解即可,不用放入干锅中,故A错误;
B• 3Ba(OH)2+Al2(SO4)3=3BaSO4↓+2Al(OH)3↓,除生成Al(OH)3沉淀外,还生成BaSO4沉淀,因此,观察Al(OH)3沉淀受到影响,故B错误;
C• 过操作时,要将液体沿玻璃棒倒入过滤器中,不能直接导入,故C错误;
D• 常温下,铝遇到浓硫酸钝化,即使加热条件下,反应时生成SO2气体,也不能生成H2,根据产生气体的性质,SO2气体是一种有刺激性气味的气体,H2是一种无色无味的气体,故D正确.
故选D.点评:
本题考点: 镁、铝的重要化合物.
考点点评: 本题主要考查元素化合物的知识,化学实验的基本操作,实验仪器的使用,解决这类问题,需要熟记基本知识,需要细心认真.1年前查看全部
- (2014•德庆县一模)飞机的起飞过程是从静止出发,在直跑道上加速前进,当达到一定速度时离地升空.已知飞机加速前进的路程
(2014•德庆县一模)飞机的起飞过程是从静止出发,在直跑道上加速前进,当达到一定速度时离地升空.已知飞机加速前进的路程为1600m,所用的时间为40s.假设这段运动为匀加速运动,则飞机的加速度和离地时的速度分别是( )
A.2m/s2,80m/s
B.1m/s2,40m/s
C.80m/s2,40m/s
D.1m/s2,80m/s 走路只用手1年前1
走路只用手1年前1 -
 淡淡然之 共回答了18个问题
淡淡然之 共回答了18个问题 |采纳率100%解题思路:由题意可知这段运动为匀加速运动,又已知飞机加速前进的路程为1600m,所用时间为40s,可根据匀变速直线运动的基本公式解题.根据匀加速直线运动位移时间公式得:
x=vt+[1/2]at2
a=
2x
t2=
2×1600
402m/s2=2m/s2
根据速度时间公式得:
v=v0+at=80m/s
故选:A.点评:
本题考点: 匀变速直线运动的速度与时间的关系;匀变速直线运动的位移与时间的关系.
考点点评: 该题是匀变速直线运动基本公式的直接应用,难度不大,属于基础题.1年前查看全部
- (2013•德庆县一模)学校教职工一般由管理人员、后勤人员和专任教师三部分组成,如图所示的扇形统计图表示某校教职工人数的
 (2013•德庆县一模)学校教职工一般由管理人员、后勤人员和专任教师三部分组成,如图所示的扇形统计图表示某校教职工人数的分布情况.已知该校有14位后勤人员,则该校教职工总人数是( )
(2013•德庆县一模)学校教职工一般由管理人员、后勤人员和专任教师三部分组成,如图所示的扇形统计图表示某校教职工人数的分布情况.已知该校有14位后勤人员,则该校教职工总人数是( )
A.49人
B.70人
C.140人
D.280人 hexiaju8510251年前1
hexiaju8510251年前1 -
 alangsun 共回答了11个问题
alangsun 共回答了11个问题 |采纳率81.8%解题思路:根据该校有14位后勤人员,且通过扇形图可知后勤人员所占比例为:20%,根据14÷总人数=20%,直接可以求出全校总人数.∵该校有14位后勤人员,且通过扇形图可知后勤人员所占比例为:20%,
∴该校教职工总人数是:14÷20%=70人.
故选B.点评:
本题考点: 扇形统计图.
考点点评: 此题主要考查了扇形统计图及相关计算.在扇形统计图中,每部分占总部分的百分比等于实际人数之间的比.1年前查看全部
- (2011•德庆县二模)水是生命之源,也是人类宝贵的自然资源,我们应珍惜和保护水资源.
(2011•德庆县二模)水是生命之源,也是人类宝贵的自然资源,我们应珍惜和保护水资源.
(1)下图表示了化学式H2O的两种意义,请发挥你的想象力,告诉我们你还从水的化学式中获得哪些信息:
c.表示______
(2)水体污染的来源主要有工业污染、农业污染和______.
(3)饮用酸碱度过大或硬度大的地下水不利于人体健康.可用______测定地下水的酸碱度.检验某地下水是硬水还是软水,可用来鉴别的物质是______.
(4)生产自来水的过程中,可用______方法除去水中不溶性杂质.
(5)实验室用电解水的方法探究水的组成,写出电解水的化学方程式:2H2O
2H2↑+O2↑通电 .2H2O.
2H2↑+O2↑通电 .
(6)淡化海水可采用膜分离技术(如图所示).水分子可以透过膜(海水中其它离子不能透过)进入左侧的池子,从而得到淡水.以下分析中正确的是______.
A.这种膜可用滤纸代替
B.右侧池中海水的密度不变
C.右侧池中溶剂的质量减少
D.海水淡化的过程无需外界提供能量. lq222581年前1
lq222581年前1 -
 如意神功 共回答了14个问题
如意神功 共回答了14个问题 |采纳率100%解题思路:(1)化学式可以表示一种物质;表示该物质的组成元素;表示一个分子;表示一个分子由几个原子构成等.
(2)生活污染也是水体污染的一个重要方面.
(3)用PH试纸可以测定溶液的酸碱度,用肥皂水可以鉴别水的软硬.
(4)过滤可以把不溶于水的物质除去.
(5)电解水能生成氢气和氧气.
(6)离子能够通过滤纸,右侧池中海水的密度应该变大,右侧池中溶剂的质量减少,海水淡化的过程中需要外界提供能量.(1)水由氢元素和氧元素组成,1个水分子由2个氢原子和1个氧原子构成.故填:表示水由氢元素、氧元素组成,表示1个水分子中含有2个氢原子、1个氧原子.
(2)生活污染也是水体污染的一个重要方面.故填:生活污染.
(3)可用pH试纸测定地下水的酸碱度.检验某地下水是硬水还是软水,可用来鉴别的物质是肥皂水.故填:pH试纸; 肥皂水.
(4)生产自来水的过程中,可用过滤方法除去水中不溶性杂质故填:过滤.
(5)电解水的化学方程式为:2H2O
通电
.
2H2↑+O2↑.
(6)离子能够通过滤纸,右侧池中海水的密度应该变大,右侧池中溶剂的质量减少,海水淡化的过程中需要外界提供能量.故填:C.点评:
本题考点: 化学式的书写及意义;过滤的原理、方法及其应用;溶液的酸碱度测定;电解水实验;硬水与软水;水资源的污染与防治.
考点点评: 本题主要考查化学式的含义、化学方程式的书写、淡化水的方法等方面的知识,书写化学方程式时要注意遵循质量守恒定律.1年前查看全部
- (2012•德庆县二模)如图,已知⊙O的两条弦AC,BD相交于点E,∠A=75°,∠D=______.
 发围素围1年前0
发围素围1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- (2012•德庆县一模)如图,已知在矩形ABCD中,E是AD上的一点,连接EC,BC=CE,BF⊥EC于点F.
 (2012•德庆县一模)如图,已知在矩形ABCD中,E是AD上的一点,连接EC,BC=CE,BF⊥EC于点F.
(2012•德庆县一模)如图,已知在矩形ABCD中,E是AD上的一点,连接EC,BC=CE,BF⊥EC于点F.
求证:△ABE≌△FBE. 我爱豆包1年前1
我爱豆包1年前1 -
 sxqxzxp 共回答了25个问题
sxqxzxp 共回答了25个问题 |采纳率92%解题思路:根据矩形性质得出AD∥BC,∠A=90°,根据平行线性质和等腰三角形性质得出∠AEB=∠EBC=∠CEB,根据AAS证明两三角形全等即可.证明:在矩形ABCD中,AD∥BC,∠A=90°,
∵AD∥BC,
∴∠AEB=∠EBC,
∵BC=CE,
∴∠EBC=∠BEC,
∴∠AEB=∠BEC,
∵BF⊥CE,
∴∠A=∠BFE=90°,
在△ABE和△FBE中
∵
∠A=∠BFE
∠AEB=∠FEB
BE=BE,
∴△ABE≌△FBE(AAS).点评:
本题考点: 矩形的性质;全等三角形的判定与性质.
考点点评: 本题考查了矩形性质、等腰三角形性质、平行线的性质、全等三角形的判定等知识点,主要考查学生的推理能力,题目比较典型,难度适中.1年前查看全部
- (2014•德庆县一模)如图所示,带箭头的线段表示某一电场的电场线,在电场力作用下一带电粒子(不计重力)经过A点飞向B点
 (2014•德庆县一模)如图所示,带箭头的线段表示某一电场的电场线,在电场力作用下一带电粒子(不计重力)经过A点飞向B点,径迹如图中虚线所示,则( )
(2014•德庆县一模)如图所示,带箭头的线段表示某一电场的电场线,在电场力作用下一带电粒子(不计重力)经过A点飞向B点,径迹如图中虚线所示,则( )
A.粒子带正电
B.粒子在B点加速度较大
C.粒子在B点动能较大
D.A、B两点相比较,B点电势高 ben86ben1年前1
ben86ben1年前1 -
 大雪飘飘322 共回答了21个问题
大雪飘飘322 共回答了21个问题 |采纳率100%解题思路:电场线的疏密表示电场强度的强弱,电场线某点的切线方向表示电场强度的方向.不计重力的粒子在电场力作用下从A到B,运动与力关系可知,电场力方向与速度方向分居在运动轨迹两边,且电场力偏向轨迹的内侧.A、粒子从A到B,电场力对粒子运动做负功,因此粒子带负电.故A错误;
B、由于B点的电场线密,所以B点的电场力大,则B点的加速度较大.故B正确;
C、粒子从A到B,电场力对粒子运动做负功,电势能增加,导致动能减少,故C错误;
D、沿着电场线电势降低,所以A点的电势高,故D错误;
故选:B点评:
本题考点: 电场线;电势;电势能.
考点点评: 电场线虽然不存在,但可形象来描述电场的分布.对于本题关键是根据运动轨迹来判定电场力方向,由曲线运动条件可知合力偏向曲线内侧.1年前查看全部
- (2012•德庆县一模)已知二次函数y1的图象的顶点是A(2,-3),且经过点(1,0).
(2012•德庆县一模)已知二次函数y1的图象的顶点是A(2,-3),且经过点(1,0).
(1)求二次函数y1的解析式;
(2)说出二次函数y1与二次函数y2=-(x-1)(x-3)的三个相同点与三个不同点;
(3)设抛物线y2的顶点为B、若线段AB的垂直平分线交抛物线y1于点C,交抛物线y2于点D,求CD的长. jianghuyiye1年前1
jianghuyiye1年前1 -
 曹华淳 共回答了12个问题
曹华淳 共回答了12个问题 |采纳率100%解题思路:(1)由顶点坐标设出函数解析式y1=a(x-2)2-3,将(1,0)代入求得a的值即可;
(2)根据二次函数的性质从对称轴、顶点坐标、开口方向等去作比较;
(3)先求出B点坐标,由线段AB的垂直平分线交抛物线y1于点C,交抛物线y2于点D求出C、D两点坐标,由两点坐标公式求出CD的长.(1)设y1=a(x-2)2-3,∵抛物线过点(1,0),
∴a(1-2)2-3=0,∴a=3.
∴二次函数y1的解析式y1=3(x-2)2-3;
(2)相同点:①对称轴相同;②与x轴的2个交点坐标相同;③都经过一,四象限.
不同点:①开口方向不同;②顶点坐标不同;③图象所在的象限不同;
(3)∵B(2,1),∴AB的中垂线为直线y=-1.
∴3(x-2)2-3=-1,
∴x=2±
6
3,
∴C(2±
6
3,-1);
同理,D(2±
2,-1);
∴CD=
2-
6
3或
2+
6
3.点评:
本题考点: 待定系数法求二次函数解析式.
考点点评: 本题考查了二次函数解析式的求法,性质以及由两点坐标求线段的方法.1年前查看全部
- (2014•德庆县一模)设NA为阿伏加德罗常数的值.下列说法正确的是(C-12 H-1 N-14 O-16)( )
(2014•德庆县一模)设NA为阿伏加德罗常数的值.下列说法正确的是(C-12 H-1 N-14 O-16)( )
A.1L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA
B.12g碳含有的电子数为4NA
C.常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA viki0081年前1
viki0081年前1 -
 -宫- 共回答了16个问题
-宫- 共回答了16个问题 |采纳率81.3%解题思路:A.次氯酸钠溶液中,次氯酸根离子部分水解,溶液中次氯酸根离子减少;
B.12gC的物质的量为1mol,1molC原子中含有6mol电子;
C.氮气和一氧化碳的摩尔质量都是28g/mol,14g二者的混合物的物质的量为0.5mol,含有1mol原子;
D.标况下6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸,转移了0.2mol电子.A.次氯酸钠溶液中,次氯酸根离子发生水解,无法计算溶液中次氯酸根离子的物质的量及数目,故A错误;
B.12gC的物质的量为1mol,含有6mol碳原子,含有的电子数为6NA,故B错误;
C.14gN2与CO组成的混合气体的物质的量为0.5mol,0.5mol混合气体中含有1mol原子,含有的原子数目为NA,故C正确;
D.标准状况下,6.72L NO2的物质的量为0.3mol,0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮,转移了0.2mol电子,故D错误;
故选C.点评:
本题考点: 阿伏加德罗常数.
考点点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.1年前查看全部
大家在问
- 1想一想,算一算.799999+79999+7999+799+7922×43+22×32+75×18.
- 2Every night in my dreams在英语中是什么句式结构
- 3求,花开有时落,人生容易老,
- 4为什么电磁波电场强度和磁场强度是错的
- 5下列各句中,没有语病的一句是 [ ] A.八一男篮不仅是一支球队,也是中
- 6Plants grow in Tom's garden all through the______and they ar
- 7振幅和频率相同的两个声音一定有相同的音色
- 8翻译,将下面中文翻译为英文,要求速度准确.不能是在线翻译的,要求准确度.如果合格,会追加分数.
- 9除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
- 10(2013•沙河口区一模)如图,在平面直角坐标系中,坐标是(0,-3)的点是( )
- 11There are different __of books in the bookshop.
- 12It's amazing how much this helped.
- 13如图,在矩形ABCD中,AB=6米,BC=8米,动点P以2米/秒的速度从点A出发,沿AC向点C移动,同时动点Q以1米/秒
- 14规定运算⊕,a⊕b=ab+1,求:(1)(-2)⊕3;(2)[(-1)⊕2]⊕(-3).
- 15两种原子结合是不是都要先成为离子,再结合成化合物分子?





