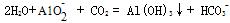污废水,好氧、厌氧微生物污废水中的好氧微生物处理与厌氧微生物处理过程的比较?(从分解有机物速率、能量耗用、污泥产量、主要
 娃哈哈dlc7232022-10-04 11:39:541条回答
娃哈哈dlc7232022-10-04 11:39:541条回答污废水中的好氧微生物处理与厌氧微生物处理过程的比较?(从分解有机物速率、能量耗用、污泥产量、主要最终产物、微生物种类及应用范围等方面分析)

已提交,审核后显示!提交回复
共1条回复
 啥GP世道 共回答了21个问题
啥GP世道 共回答了21个问题 |采纳率90.5%- 这个是污水处理吧?污水一般先经过厌氧生物池处理 厌氧生物处理的污水去除COD,BOD数值量大于经过好养菌处理的.主要将高分子难降解的有机物转变为低分子易被降解的有机物,
进过厌氧生物池后虽然COD去除量很高,但是其实这时候的污水还不能直接排放,这时的水COD还不符合国标,需要进行好氧处理,主要进行的是反硝化
厌氧处理中污水的有机物分解量是远远大于好氧的,之所以在好氧前加厌氧池一般考虑到是为了降低好氧池的压力,因为如果进入好氧池水中的COD含量过高,容易引起好氧池中微生物中毒.污泥产量好氧池很多,厌氧池很少,往往在一沉上需要大量排泥. - 1年前
相关推荐
- 废水悬浮固体和浊度的测定实验中,滤纸,滤膜分别适用于什么情况下
 emmach111年前1
emmach111年前1 -
 宝儿baby 共回答了26个问题
宝儿baby 共回答了26个问题 |采纳率92.3%我在环保通上看到关于滤纸和滤膜知识上说:滤纸用于测定废水SS,用中速滤纸就可以了.浊度的检测只能用浊度仪,滤纸或者滤膜都不能英语浊度的检测.1年前查看全部
- 地表水污染的主要来源是什么A.未经处理而排放的工业废水B.未经处理的生活废水C.大量使用化肥,农药,除草剂的农田污水D.
地表水污染的主要来源是什么
A.未经处理而排放的工业废水
B.未经处理的生活废水
C.大量使用化肥,农药,除草剂的农田污水
D.堆放在河边的工业废弃物生活垃圾
E.开矿污水等 dengw_23361年前1
dengw_23361年前1 -
 dnps 共回答了15个问题
dnps 共回答了15个问题 |采纳率80%按照受污染的水体划分,有地表水(河流、湖泊、海洋)污染、地下水污染及降水污染.地表水污染主要由污水排放引起,地下水污染则主要由污水入渗引起.降水污染主要由废气排放引起,如大量排放含硫废气就可能造成酸雨.1年前查看全部
- 高一化学铁部分内容(两个填空)为除去废水中的亚铁离子,常先将废水中的( ),再调节溶液的铁离子转化为( )析出
 desheng161年前1
desheng161年前1 -
 90_09_99 共回答了16个问题
90_09_99 共回答了16个问题 |采纳率81.3%亚铁离子转换为铁离子、FE(OH)31年前查看全部
- 有一种工业废水,其中含有大量的硫酸亚铁、少量的银离子以及污泥.某同学设计了一个既经济又合理的方法回
有一种工业废水,其中含有大量的硫酸亚铁、少量的银离子以及污泥.某同学设计了一个既经济又合理的方法回
⑴步骤②中:需加入的物质是(铁粉),分离所得混合物的方法是(过滤)
⑵步骤③中,需加入的物质是(硫酸),发生反应的化学方程式是(Fe+H2SO4=FeSO4+H2↑)
⑶某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理(不合理),理由是(铁粉过量,和银混在一起)
⑷步骤④的溶液2和溶液3为什么要混合(更充分回收硫酸亚铁晶体)
答案我都知道,但能给我解释一下(1)中为什么要加铁粉?发生了什么反应?
讲详细点,谢谢
 迫于果腹撒1年前1
迫于果腹撒1年前1 -
 羽丕花圣 共回答了20个问题
羽丕花圣 共回答了20个问题 |采纳率100%加入过量的铁粉目的是把溶液的的Ag+全部置换出来生成单质的银.
反应的化学方程式为:Fe+Ag2SO4=FeSO4+2Ag1年前查看全部
- (2008•杭州)某化工厂排出的废水中含有硝酸银,硝酸钡,为了不污染环境并充分利用资源,需要从废水中回收金属银并制得碳酸
(2008•杭州)某化工厂排出的废水中含有硝酸银,硝酸钡,为了不污染环境并充分利用资源,需要从废水中回收金属银并制得碳酸钡,操作步骤和实验结果如下表,请填出表中未完成部分(写化学式)
操作步骤 实验结果 (1)向废水中加入适量______后过滤 分离出滤液A和滤出物______ (2)向滤液A中加入______溶液后过滤 滤出物是蓝色沉淀,滤液B中只含一种溶质 (3)向滤液B中加入______溶液后过滤 得到碳酸钡晶体  xiaonn8208211年前1
xiaonn8208211年前1 -
 oo是Id 共回答了12个问题
oo是Id 共回答了12个问题 |采纳率83.3%解题思路:根据题意:要从废水中回收金属银,可向废水中加入适量的排在银前的金属,由(2)滤出物是蓝色沉淀,说明该沉淀是氢氧化铜,可知(1)中加入的金属是铜,与硝酸银反应生成硝酸铜和银;(2)向滤液A中加入溶液过滤得到氢氧化铜沉淀,说明加入的是一种碱,又滤液B中只含一种溶质,说明该碱溶液与硝酸铜反应生成氢氧化铜和硝酸钡,据复分解反应原理可知加入的是氢氧化钡溶液;硝酸钡溶液可与碳酸钠、碳酸钾溶液反应生成碳酸钡沉淀.要从废水中回收金属银,可向废水中加入适量的排在银前的金属,由(2)滤出物是蓝色沉淀,说明该沉淀是氢氧化铜,由此说明(1)中加入的金属是铜,与硝酸银反应生成硝酸铜和银;(2)向滤液A中加入溶液过滤得到氢氧化...
点评:
本题考点: 金属的化学性质;盐的化学性质.
考点点评: 了解顺序表中前面的金属可将后面的金属从其盐溶液中置换出来,氢氧化铜是蓝色沉淀,及复分解反应的原理,才能结合题意正确分析解答,本题能很好考查学生依据所学分析、解决问题的能力.1年前查看全部
- 用石灰中和含铁含氟含硫酸根的酸性废水时,产生的污泥经板框压滤后的脱水污泥含水率有多高?其密度是多少
 木空间1年前1
木空间1年前1 -
 csy3388 共回答了26个问题
csy3388 共回答了26个问题 |采纳率92.3%50%.21年前查看全部
- 电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr 3 +,同时还含有少量的Cu 2+ 、Fe 2+ Fe 3
电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr 3 +,同时还含有少量的Cu 2+ 、Fe 2+ Fe 3+ 和Al 3+ 等,且酸性较强。为回收利用铬元索,此工业废水通常采用如下流程处理:
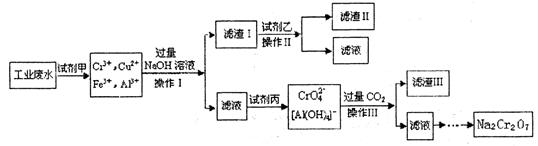
已知: (1)铬元素有以下循环过程: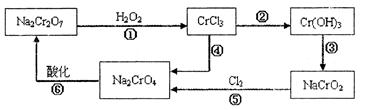
(2)Cu(OH) 2 能溶于氨水: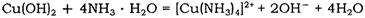
请回答下列问题:
(1) 加入试剂甲的目的:________________
(2) 试剂乙的名称:________ ,试剂丙的化学式:________________
(3) 上述操作I、II、III相同,则进行该实验操作所需要的主要玻璃仪器有________________
(4) 滤渣I的主要成分为________________(写化学式)。
(5) 在铬元素循环过程的反应①中每反应掉1 mol H 2 O 2 同时消耗H + 数目为:______________
(6) 铬元素循环过程的反应⑥的离子方程式:_____________________________;
废水处理流程中生成滤渣III的离子方程式 : _______________________ 有乐的的1年前1
有乐的的1年前1 -
 zjwzssbzt 共回答了13个问题
zjwzssbzt 共回答了13个问题 |采纳率84.6%1年前查看全部
- 含磷洗涤剂含有Na5P3O10,其洗涤废水任意排放会造成水资源污染.Na5P3O10中磷的化合价为( )
含磷洗涤剂含有Na5P3O10,其洗涤废水任意排放会造成水资源污染.Na5P3O10中磷的化合价为( )
A.+2
B.+3
C.+4
D.+5 rgnjwxsh1年前1
rgnjwxsh1年前1 -
 mmm701016 共回答了18个问题
mmm701016 共回答了18个问题 |采纳率100%解题思路:根据在化合物中正负化合价代数和为零进行解答本题.根据在化合物中正负化合价代数和为零,Na5P3O10中磷元素的化合价为:(+1)×5+x×3+(-2)×10=0,
解得 x=+5,故选D.点评:
本题考点: 有关元素化合价的计算.
考点点评: 本题考查学生根据在化合物中正负化合价代数和为零计算指定元素化合价的能力.1年前查看全部
- 某中学化学课外活动小组对某工厂排放的含少量硫酸的废水进行抽样检测.取一定量的废水,用质量分数为1%的氢氧化钡溶液中和(其
某中学化学课外活动小组对某工厂排放的含少量硫酸的废水进行抽样检测.取一定量的废水,用质量分数为1%的氢氧化钡溶液中和(其它物质不与氢氧化钡反应),当恰好中和时,消耗氢氧化钡溶液的质量为171g,过滤后,测得滤液的质量为268.67g.(不考虑过滤时滤液质量损失)(计算结果保留二位小数)
求:①反应中生成沉淀的质量为多少?
②该工厂排放的废水中所含硫酸的质量分数为多少?
 zny861年前1
zny861年前1 -
 HomeKit 共回答了19个问题
HomeKit 共回答了19个问题 |采纳率94.7%171g*1%=1.71g
Ba(OH)2+H2SO4==BaSO4↓+2H2O
171 98 233
1.71g x y
171/1.71g=98/x=233/y
x=0.98g
y=2.33g
①反应中生成沉淀的质量为 2.33g
②该工厂排放的废水中所含硫酸的质量分数为 0.98g/(268.67g+2.33g-171g)*100%=0.98%1年前查看全部
- 2012年世界水日主题是“水与粮食安全”,下列做法符合该主题的是( ) A.用工业废水灌溉农田 B.农业生产大量使用
2012年世界水日主题是“水与粮食安全”,下列做法符合该主题的是()
A.用工业废水灌溉农田 B.农业生产大量使用化肥和农药 C.农业和园林改漫灌为喷灌、滴灌 D.大力开采地下水来灌溉  生于七零年代的我1年前1
生于七零年代的我1年前1 -
 storm81 共回答了16个问题
storm81 共回答了16个问题 |采纳率93.8%C
1年前查看全部
- 测工业废水中镍的的含量已知在氨溶液中,碘存在条件下,镍与丁二酮肟作用.形成组成比例为1:4的旧红色的可溶性络合物.测定式
测工业废水中镍的的含量
已知在氨溶液中,碘存在条件下,镍与丁二酮肟作用.形成组成比例为1:4的旧红色的可溶性络合物.测定式样(体积为10ml)中镍的含量.其上限为10mg/L下限为0.25mg/L测定时,铁.钴.铜离子是主要干扰物.消除方法是加入适量的Na2_EDTA溶液.利用上述已知条件,设计一个测定工业废水中镍的含量的方案(含条件实验.消除干扰.计算定量) 苏醒的夏天1年前1
苏醒的夏天1年前1 -
 心随我动 共回答了17个问题
心随我动 共回答了17个问题 |采纳率94.1%水质 镍的测定火焰原子吸收分光光度法 GB 11912-89
1 主题内容与适用范围
本标准规定了用火焰原子吸收分光光度法直接测定工业废水中镍.
本标准适用于工业废水及受到污染的环境水样,最低检出浓度为0.05mg/L,校准曲线的浓度范围0.2~5.0mg/L.
2 原理
将试液喷入空气-乙炔贫燃火焰中.在高温下,镍化合物离解为基态原子,其原子蒸气对锐线光源(镍空心阴极灯)发射的特征谱线232.0nm产生选择性吸收.在一定条件下,吸光度与试液中镍的浓度成正比.
3 试剂
本标准所用试剂除另有说明外,均使用符合国家标准或专业标准的分析纯试剂和去离子水或同等纯度的水.
3.1 硝酸(HNO3),=1.42g/mL,优级纯.
3.2 硝酸(HNO3),=1.42g/mL.
3.3 硝酸溶液,1+99:用硝酸(3.1)配制.
3.4 硝酸溶液,1+1:用硝酸(3.2)配制.
3.5 高氯酸(HClO4),=1.54g/mL,优级纯.
3.6 镍标准贮备液:称取光谱纯金属镍1.0000g,准确到0.0001g,加硝酸(3.1)10mL,待完全溶解后,用去离子水稀释至1000mL,每毫升溶液含1.00mg镍.
3.7 标准工作溶液:移取镍贮备液(3.6)10.0mL于100mL容量瓶中,用硝酸溶液(3.4)稀释至标线,摇匀.此溶液中镍的浓度为100mg/L.
4 仪器
4.1 原子吸收分光光度计.
4.2 镍空心阴极灯.
4.3 乙炔钢瓶或乙炔发生器.
4.4 空气压缩机,应备有除水、除油、除尘装置.
4.5 仪器参数:不同型号仪器的最佳测试条件不同,可根据仪器说明书自行选择.
5 样品
5.1 采样前,所用聚乙烯瓶用洗涤剂洗净,再用硝酸(3.4)浸泡24h以上,然后用水冲洗干净.
5.2 若需测定镍总量,样品采集后立即加入硝酸(3.1),使样品pH为1~2.
5.3 测定可滤态镍时,采样后尽快通过0.45m滤膜过滤,并立即按(5.2)酸化.
6 步骤
6.1 试料
测定镍总量时,一般要进行消解处理.取适量水样(使含镍在10~250g)加5mL硝酸(3.1),置于电热板上在近沸状态下将样品蒸发近干.冷却后再加入硝酸(3.1)5mL,重复上述操作一次,必要时再加入硝酸(3.1)或高氯酸,直到消解完全.等蒸至近干,加硝酸(3.3)溶解残渣,若有不溶沉淀应通过定量滤纸过滤至50mL容量瓶中,加硝酸(3.3)至标线,摇匀.
6.2 空白试验
用水代替试料,采用相同的步骤,且与采样和测定中所用的试剂用量相同做空白试验.
6.3 干扰
6.3.1 本标准测镍基体干扰不显著,但当无机盐浓度较高时则产生背景干扰,采用背景校正器校正;在测量浓度许可时,也可采用稀释法.
6.3.2 使用232.0nm作吸收线,存在波长相距很近的镍三线,选用较窄的光谱通带可以克服邻近谱线的光谱干扰.
6.4 校准曲线的绘制
用硝酸溶液(3.3)稀释标准工作溶液(3.7)配制至少5个标准溶液,且试料的浓度应落在0.2~5.0mg/L范围内.按所选择的仪器工作参数调好仪器,用硝酸溶液(3.3)调零后,测量每份溶液的吸光度,绘制校准曲线.
6.5 测量
在测量标准溶液的同时,测量空白和试料.根据扣除空白后试料的吸光度,从校准曲线查出试料中的含量.
注:①测定可滤态镍时,用(5.3)制备的试料直接喷入测定.
②测定镍总量时,一般进行消解前处理,用试料(6.1)进行测定.
7 结果的表示
实验室样品中镍的浓度C(mg/L)按下式计算:
式中:C——实验室样品中镍浓度,mg/L.
m——试料中镍的含量,g.
V——分取水样的体积,mL.
8 精密度和准确度
13个实验室分析含镍1.02mg/L的统一样品,重复性相对标准偏差为1.65%,再现性相对标准偏差为3.29%,回收率在95%~105%之间.
本标准还用于含镍0.07~5.45mg/L的矿山、冶炼、电镀、机械等行业41种废水样品分析,其相对标准偏差为0.2%~10%,加标回收率为92%~109%.1年前查看全部
- COD约500,含NaOH,异丙醇,pH约14,含盐约10%的电子废水,如何处理经济效率?
 qq知已1年前2
qq知已1年前2 -
 g1121 共回答了23个问题
g1121 共回答了23个问题 |采纳率100%微电解
深度的双氧水加硫酸亚铁1年前查看全部
- 双氧水可以将废水中的氰化物转化为无毒物同时生成NH3的离子方程式
 yingzi3131年前1
yingzi3131年前1 -
 tintin5555 共回答了18个问题
tintin5555 共回答了18个问题 |采纳率88.9%CN- + H2O2 + H2O = HCO3- +NH3↑ (数字都是下标)1年前查看全部
- 某化工厂排放的废水中只含有盐酸和MgCl2两种物质.小明同学向采集来的62.8g废水样品中,慢慢加入20%的NaOH溶液
某化工厂排放的废水中只含有盐酸和MgCl2两种物质.小明同学向采集来的62.8g废水样品中,慢慢加入20%的NaOH溶液至恰好完全反应时,消耗NaOH溶液60g.将生成的沉淀物过滤出,经水洗、干燥后称重为5.8g.
(1)写出向废水中加入NaOH溶液发生反应的化学方程式:______;
(2)请求出上述废水样品完全反应后的溶液里溶质的质量分数(要有计算过程)
【相对分子质量:MgCl2-95、NaOH-40、HCl-36.5、NaCl-58.5、Mg(OH)2-58、H2O-18.】 hyf1987101年前1
hyf1987101年前1 -
 弹散 共回答了14个问题
弹散 共回答了14个问题 |采纳率100%解题思路:废水中的盐酸和MgCl2两种物质都可与加入的氢氧化钠溶液发生反应,盐酸与氢氧化钠发生中和反应,生成氯化钠和水,而只有MgCl2与氢氧化钠溶液反应生成氢氧化镁沉淀,同时生成氯化钠;因此恰好完全反应时所得溶液为氯化钠溶液,其中溶质氯化钠质量为两个反应生成氯化钠的质量和,利用质量守恒计算出所得溶液的质量,最后使用溶液中溶质质量分数公式,计算废水样品完全反应后的溶液里溶质的质量分数.(1)废水中盐酸与氢氧化钠可以发生中和反应,方程式为HCl+NaOH═NaCl+H2O;氯化镁与氢氧化钠发生复分解反应,方程式为MgCl2+2NaOH═2NaCl+Mg(OH)2↓;
故答案为:HCl+NaOH═NaCl+H2O,MgCl2+2NaOH═2NaCl+Mg(OH)2↓;
(2)设生成5.8g沉淀氢氧化镁沉淀时,消耗氢氧化钠溶液的质量为x,生成氯化钠的质量为y
MgCl2+2NaOH═2NaCl+Mg(OH)2↓
80 117 58
x×20% y5.8g
[80/x×20%]=[58/5.8g] x=40g
[117/y]=[58/5.8g] y=11.7g
则与盐酸反应的氢氧化钠溶液的质量=60g-40g=20g,设生成氯化钠的质量为z
HCl+NaOH═NaCl+H2O
4058.5
20g×20% z
[40/20g×20%]=[58.5/z] z=5.85g
废水样品完全反应后的溶液里溶质的质量分数=[11.7g+5.85g/62.8g+60g−5.8g]×100%=15%
答:废水样品完全反应后的溶液里溶质的质量分数为15%.点评:
本题考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算;碱的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 根据质量守恒定律,废水样品完全反应后的溶液里溶质的质量=所取废水的质量+所加入氢氧化钠溶液的质量-生成沉淀的质量.1年前查看全部
- 硫酸铝可除去碱性废水中的悬浮颗粒,不能除去酸性废水中的悬浮颗粒,是因为酸抑制水解吗?为什么?为什么碱性废水中的就可以除去
硫酸铝可除去碱性废水中的悬浮颗粒,不能除去酸性废水中的悬浮颗粒,是因为酸抑制水解吗?为什么?为什么碱性废水中的就可以除去?碱会促进水解吗?
 太阳日眼1年前1
太阳日眼1年前1 -
 bocog1876 共回答了22个问题
bocog1876 共回答了22个问题 |采纳率72.7%是因为酸抑制水解.
硫酸铝可除去碱性废水中的悬浮颗粒是利用铝水解生成的Al(OH)3,如果水中含酸,铝的水解被抑制,自然就不起作用了.
碱可以促进铝的水解.有利于除去碱性废水中的悬浮颗粒.1年前查看全部
- 某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.为了减少污染,变废为宝,工程师们设计了如下流程,以回收铜和硫
某工厂排出的废水中含有大量的Fe2+、Cu2+和SO42-.为了减少污染,变废为宝,工程师们设计了如下流程,以回收铜和硫酸亚铁.请回答:
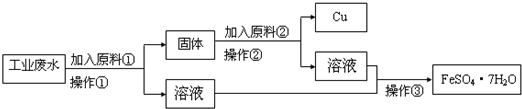
(1)原料①为______(填化学式).
(2)写出加入原料②后反应的离子方程式:______.
(3)若在实验室中完成该流程,操作②需要用到的玻璃仪器的名称是______、
______、______;整个实验操作过程中不可能用到的装置是______(填字母).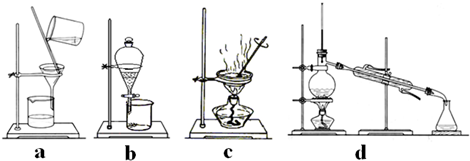
 青天大人1年前1
青天大人1年前1 -
 william蟑螂 共回答了18个问题
william蟑螂 共回答了18个问题 |采纳率83.3%解题思路:(1)根据该题要求:回收铜且不引进新的杂质判断原料①;
(2)先判断操作①后的固体成分,再根据流程图知:操作①后的溶液中的溶质与操作②后的溶液中的溶质相同写离子方程式;
(3)根据混合物的状态确定实验操作,根据实验操作确定实验仪器;根据各装置用途确定选项;(1)根据题意知,该物质能和铜离子反应且不引进新的杂质离子,所以只能是铁,故答案为:Fe.
(2)操作①中加入过量的铁才能使铜离子完全反应,所以所得固体的成分是铁和铜;分离铁和铜且回收铜,所以加入某物质与铁反应,与铜不反应,且与铁反应后的物质与操作①所得溶液中溶质的成分一样,加入的物质只能是稀硫酸,所以发生的离子反应为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
(3)操作②的分离是固体、液体分离,所以应用过滤的方法,故用到的玻璃仪器有玻璃棒、漏斗、烧杯;
操作①、②的分离是固体、液体分离,所以应用过滤的方法;操作③是蒸发掉水分,使溶质从溶液中析出,所以应用蒸发结晶的方法;
a、该装置是过滤装置,分离固体和液体;
b、该装置是萃取装置,根据溶解度的不同分离;
c、该装置是蒸发结晶装置,分离溶剂和溶质;
d、该装置是蒸馏装置,根据沸点的不同分离液体和液体;
所以选bd
故答案为:玻璃棒、漏斗、烧杯;bd.点评:
本题考点: 金属的回收与环境、资源保护;常见金属元素的单质及其化合物的综合应用;物质的分离、提纯的基本方法选择与应用.
考点点评: 本题考查了学生对高中化学实验装置图的理解和掌握程度.1年前查看全部
- 初中化学,为什么NAOH也会处理硫酸厂的废水?不是要生成沉淀或气体才可将硫去掉吗..
 月阙了1年前3
月阙了1年前3 -
 irish咖啡 共回答了15个问题
irish咖啡 共回答了15个问题 |采纳率86.7%因为硫酸和氢氧化钠发生中和反应生成硫酸钠没有腐蚀性在经过脱盐、水就没有污染了
2NAOH+H2SO4=NA2SO4+2H2O1年前查看全部
- 有一工厂的废水,含有 有一工厂的废水,含有硝酸银,为净化废水,防止环境污染,变废为宝,某初中的化学兴趣小组设计了两种净化
有一工厂的废水,含有
有一工厂的废水,含有硝酸银,为净化废水,防止环境污染,变废为宝,某初中的化学兴趣小组设计了两种净化废水的方案.
方案一:在废水中加入足量的稀盐酸.
方案二:在废水中加入足量的铁粉. 请你评价一下,哪一种方案更好,然后将实验方案设计完整. ktuktr1年前1
ktuktr1年前1 -
 闲云自在 共回答了13个问题
闲云自在 共回答了13个问题 |采纳率92.3%方案二好,方案一生成氯化银,初中学生无法继续处理;
步骤:
(1)放入足量铁粉,
(2)过滤,
(3)固体中加入稀硫酸,
(4)过滤、洗涤、干燥,得到银.1年前查看全部
- 为测定工厂废水中硫酸的含量,取100g废水于烧杯中,加入120g质量分数为10%的氢氧化钠溶液,恰好完全反映(废水中无不
为测定工厂废水中硫酸的含量,取100g废水于烧杯中,加入120g质量分数为10%的氢氧化钠溶液,恰好完全反映(废水中无不溶物,其他成分不与氢氧化钠反应.)请计算:1)废水中硫酸的质量分数(要有具体步骤) 2)该工厂每天用含氢氧化钠75%的熟石灰样品处理150t这种废水,需要这种熟石灰样品的质量是多少吨?(要有具体步骤)
 lgzpp1年前1
lgzpp1年前1 -
 cvcv2 共回答了19个问题
cvcv2 共回答了19个问题 |采纳率84.2%(1)NaOH的质量为120g×10%=12g 设H2SO4的质量为x H2SO4+2NaOH==Na2SO4+2H2O 98 80 x 12g x=14.7g 所以,废水中硫酸的质量为14.7g 14.7g/100g=14.7% 硫酸的质量分数为14.7% 150t这种沸水可求出H2SO4质量为22.05t H2SO4+Ca(OH)2=CaSO4+2H20 98 74 22.05t xt 得x=16.65t 16.65/75%=22.2t 答:要熟石灰22.2t,1年前查看全部
- 某化学兴趣小组为了测定一工厂废水中硫酸的含量,取100g废水于烧杯中,加入40g质量分数为10%的氢氧化钠溶液,恰好完全
某化学兴趣小组为了测定一工厂废水中硫酸的含量,取100g废水于烧杯中,加入40g质量分数为10%的氢氧化钠溶液,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应).请计算:
(1)废水中硫酸的质量分数;
(2)该工厂每天用含氢氧化钙74%的熟石灰处理200t这种废水,需要熟石灰多少t? 赠远虚盈手1年前1
赠远虚盈手1年前1 -
 tiancai 共回答了14个问题
tiancai 共回答了14个问题 |采纳率100%解题思路:(1)由废水质量、氢氧化钠溶液的质量和氢氧化钠溶液的质量分数,根据硫酸与氢氧化钠反应的化学方程式可以计算出废水中硫酸的质量分数;
(2)由废水质量、废水中硫酸的质量分数和熟石灰中氢氧化钙的质量分数,根据硫酸与氢氧化钙反应的化学方程式可以计算出所需熟石灰的质量.(1)设废水中硫酸的质量分数为x.
2NaOH+H2SO4=Na2SO4+2H2O
8098
40g×10% 100g×x
[80/98]=[40g×10%/100g×x],x=4.9%
(2)设需要熟石灰的质量为y.
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
y×74%200t×4.9%
[74/98]=[y×74%/200t×4.9%],y=10t
答:(1)废水中硫酸的质量分数为4.9%.
(2)需要熟石灰10t.点评:
本题考点: 含杂质物质的化学反应的有关计算;有关溶质质量分数的简单计算.
考点点评: 本题主要考查含杂质物质的化学方程式的计算和溶质质量分数的计算,难度较大.1年前查看全部
- 怎样检测排放的废水中是否含有少量硫酸
怎样检测排放的废水中是否含有少量硫酸
实验操作:
现象和结论
若该厂排放的废水中含有少量硫酸,为了除去硫酸,降低对水的污染,有同学建议,应该将该厂的废水和含有少量氢氧化钠的废水按一定比例混合.之一建议依据的原理是什么?该建议如何保证在除去废水中硫酸的同时,又不会对水造成二次污染? 8bb1sjb1年前1
8bb1sjb1年前1 -
 hjyangshuo007 共回答了18个问题
hjyangshuo007 共回答了18个问题 |采纳率94.4%之一原理是硫酸与氢氧化钠发应生成硫酸钠和水
最好添加石灰即氧化钙,氧化钙与水反应生成氢氧化钙,氢氧化钙与硫酸反应生成硫酸钙沉淀和水.经济实惠.1年前查看全部
- 家里的净水机刚安装时,好水和废水的比例差不多是1:3,最近接一壶水竟然出的废水把家里7公斤的洗衣机装满不说,还要装满两个
家里的净水机刚安装时,好水和废水的比例差不多是1:3,最近接一壶水竟然出的废水把家里7公斤的洗衣机装满不说,还要装满两个10升的水桶,这样的废水量太可怕了,是不是机器坏了啊
 wgr19821年前1
wgr19821年前1 -
 lube77 共回答了20个问题
lube77 共回答了20个问题 |采纳率90%净水机的过滤部分是需要定期更换的,因为杂质堵塞过滤器表面会是通过过滤器的水减少很多,废水随即增加,建议更换滤芯1年前查看全部
- 某同学对某地工业废水(含有硫酸和盐酸)中的H2SO4进行测定.
某同学对某地工业废水(含有硫酸和盐酸)中的H2SO4进行测定.
取50g该废水于烧杯中,加入足量的BaCl2溶液,充分反应中,过滤、洗涤、干燥得到BaSO4固体11.65g.通过计算回答下列问题:
(2)若改用KOH溶液来测定50g该废水中H2SO4的含量,结果会______(填偏大、偏低、不变),理由是___________________________.
我知道答案是不变 我只要理由
我们老师说是不变 他让我们自己想啊、、、、、、、
___________________________________________________
额 他竟然耍我
偏大 原因是盐酸与氢氧化钾反应- - 弟弟要aa1年前1
弟弟要aa1年前1 -
 逆天明 共回答了17个问题
逆天明 共回答了17个问题 |采纳率76.5%偏大吧...1年前查看全部
- 噪音像一个来无影去无踪的“隐身人”,不像烟尘和废水那样可以集中起来处理.尽管这位“隐身人”难以对付,人们还是想出了许多制
噪音像一个来无影去无踪的“隐身人”,不像烟尘和废水那样可以集中起来处理.尽管这位“隐身人”难以对付,人们还是想出了许多制服他的办法.“隔音玻璃”就是消除噪音的能收临街的窗子如果装上这种玻璃,街上的声音为40分贝时,传到房间里只剩下12分贝了.
(1)从文中找出下列词语的反义词.
解除( )
压制( )
(3)“噪音像一个来无影去无踪的“隐身人”,不像烟尘和废水那样可以集中起来处理”说明了“隔音玻璃”的( ) 1988211年前1
1988211年前1 -
 春wcx 共回答了16个问题
春wcx 共回答了16个问题 |采纳率93.8%(1)从文中找出下列词语的反义词.
解除( 装上 )
压制( 提高 )
(3)“噪音像一个来无影去无踪的“隐身人”,不像烟尘和废水那样可以集中起来处理”说明了“隔音玻璃”的( 对人们的重要性 )1年前查看全部
- 常用LAS阴离子废水处理方法有哪些?
 nanrem1年前1
nanrem1年前1 -
 籽籽的天空 共回答了20个问题
籽籽的天空 共回答了20个问题 |采纳率95%常用LAS阴离子废水处理方法有:
1、膜分离法
是利用膜的高渗透选择性来分离溶液中的溶剂和溶质.可用膜分离中的超滤和纳滤技术来处理LAS废水.
2混凝处理法
常用于表面活性剂废水处理的混凝剂有铁盐、铝盐及有机聚合物类.混凝反应不仅能去除废水中胶体颗粒和吸附在胶体表面上的LAS,还可与溶解在水相中的LAS形成难溶性的沉淀.
3、催化氧化法
催化氧化法是对传统化学氧化法的改进与强化.常用的Fenton试剂氧化即为催化氧化法的一种,属均相氧化法.处理时,如果铁盐浓度较高,LAS的去除主要靠絮凝作用;浓度低时,则主要靠氧化作用.近年来,催化氧化法又出现了多相催化氧化法和光催化氧化法.
4、泡沫分离法
是向废水中通入空气,生成气泡,使废水中的LAS吸附于气泡表面,升至水面富集形成泡沫层,除去泡沫层,将LAS从废水中浓缩分离出来的过程.
5、吸附分离法
常用的吸附剂包括活性炭、吸附树脂、硅藻土及高岭土等各种固体物料.对LAS废水用活性炭法处理效果较好,常温下对LAS的吸附容量可达到55.8mg/g.但活性炭再生能耗大,且再生后吸附能力亦有不同程度降低,因而其应用受到限制.
6、生物氧化法
生物法是LAS废水的主要处理方法,包括活性污泥法、生物膜及UASB等.可降解LAS的菌种包括邻单胞菌属的革兰氏阴性杆菌、黄单胞菌属的革兰氏阴性短杆菌等生物氧化法可直接处理偏碱性的LAS废水,设备简单,处理能力大,出水的pH值符合排放要求.
7、微电解法
复极性固定床电解法是一种较新型的水处理方法,它是在电解反应器中填充粒子,外加直流电场,使其中的导电粒子复极化而形成无数微小的电解单位,污染物被吸附到粒子表面发生电化学反应而被氧化除去的过程.
8、吸附法
常用的吸附剂主要包括活性炭、吸附树脂、硅藻土、高岭土等.常温下对表面活性剂废水用活性炭法处理效果较好,活性炭对LAS废水的吸附容量可达到55.8mg/g,活性炭吸附符合Freundlich公式.活性炭再生能耗大,且再生后吸附能力亦有不同程度的降低,因而限制了其应用.用吸附树脂处理表面活性剂废水,其优点是吸附速度快、稳定性好、再生容易,主要缺点是预处理较繁琐,一次性投资大.1年前查看全部
- 有一种工业废水,已知其中含有大量的FeSO4,少量的Ag+和Na+,以及部分污泥.试设计一个既经济又合理的方法以回收金属
有一种工业废水,已知其中含有大量的FeSO4,少量的Ag+和Na+,以及部分污泥.试设计一个既经济又合理的方法以回收金属银、硫酸亚铁.分步列出实验步骤,并说明每一步骤的目的(不必写化学方程式).
 ea357zx1年前1
ea357zx1年前1 -
 apple是天使 共回答了11个问题
apple是天使 共回答了11个问题 |采纳率81.8%解题思路:在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.Ag+:加入过量的铁粉,使Ag+还原为Ag,将混有Fe粉的Ag用稀H2SO4处理,使Fe溶解,过滤,分离出银,据此分析解答.要从工业废水中回收金属银和硫酸亚铁,首先需要将其中的污泥通过过滤除去,然后根据铁能将银离子置换出来的性质,加入过量的铁粉,使银全部被置换出来,过滤得到银和铁的混合物,然后根据铁可以和酸发生置换反应而银不与酸发生置换反应的性质,将得到的固体混合物加入稀硫酸,使铁反应,过滤得到银,最后将溶液混合,根据物质溶解度的不同,加热得到饱和溶液,然后降温使硫酸亚铁晶体析出,然后加热使硫酸亚铁晶体失去结晶水从而得到硫酸亚铁,
答:①过滤除去污泥,②向滤液中加入过量的铁粉,使Ag+还原为Ag,③过滤,将Ag和过量的铁粉从溶液中分离出来,④将混有Fe粉的Ag用稀H2SO4处理,使Fe溶解,⑤过滤,分离出银,⑥将③、⑤两步的滤液合并,蒸发浓缩,冷却结晶,⑦趁热过滤,除去其中的Na+得硫酸亚铁晶体,加热晶体使其失去结晶水得到FeSO4.点评:
本题考点: 金属的回收与环境、资源保护.
考点点评: 本题考查了混合物的分离和提纯的实验方案的设计,完成此题,可以依据金属活动性顺序及其意义进行,题目难度不大.1年前查看全部
- 我国淡水资源非常短缺,在生产和生活中应该 A.减少饮水量,以节约用水 B.将生活用水、工厂废水直接排放到湖泊或海洋中 C
我国淡水资源非常短缺,在生产和生活中应该
A.减少饮水量,以节约用水 B.将生活用水、工厂废水直接排放到湖泊或海洋中 C.既要节约用水,又要防止和消除水体污染 D.减少植树造林面积,因为植物生长需要大量的水  复仇快1年前1
复仇快1年前1 -
 shenjun888 共回答了22个问题
shenjun888 共回答了22个问题 |采纳率77.3%C
1年前查看全部
- 工业废水大都是含有有害物质的( ) 酸雨是( )性降水
 李玫儿1年前1
李玫儿1年前1 -
 luosongtj 共回答了23个问题
luosongtj 共回答了23个问题 |采纳率82.6%有害物质:(重金属);酸雨是(酸)性降水.1年前查看全部
- 厌氧罐最近PH值升高,挥发酸也升高是什么原因,我们的水尾化工废水,进水COD为2200左右,PH值7.5,现在厌氧罐出水
厌氧罐最近PH值升高,挥发酸也升高是什么原因,我们的水尾化工废水,进水COD为2200左右,PH值7.5,现在厌氧罐出水COD2500,PH值8.9,碱度1000,挥发酸650,关于挥发酸和PH值的升高是这两天的事,
 丢失的岁月1年前1
丢失的岁月1年前1 -
 juanbeibei 共回答了18个问题
juanbeibei 共回答了18个问题 |采纳率100%PH:厌氧水解酸化工艺,对PH要求范围较松,即产酸菌的PH应控制4-7范围内;完全厌氧反应则应严格控制PH,即产甲烷反应控制范围6.5-8.0,最佳范围为6.8-7.2,PH低于6.3或高于7.8,甲烷化速降低.1年前查看全部
- 化肥厂有害废水以脱硫废水污染最为严重对吗?
 我的大熊猫1年前1
我的大熊猫1年前1 -
 qo_el_f_bdnp6ea6 共回答了17个问题
qo_el_f_bdnp6ea6 共回答了17个问题 |采纳率82.4%不是,化肥厂污染不是很大!化工厂最严重1年前查看全部
- 你家中的废水有没有被再利用?是怎么利用的?
 qq游子___1年前1
qq游子___1年前1 -
 4713821 共回答了9个问题
4713821 共回答了9个问题 |采纳率77.8%洗菜的水可以顺便浇花,洗衣服等等的废水一般找个大桶或者几个盆装着,然后用来冲厕所.1年前查看全部
- (2008•镇江)某厂拟选用下列物质处理含硫酸的废水.现花最少的钱中和等量的废水应选择( )
(2008•镇江)某厂拟选用下列物质处理含硫酸的废水.现花最少的钱中和等量的废水应选择( )
A.NaCl
B.CaCO3
C.Ca(OH)2
D.NaOH 良良18901年前1
良良18901年前1 -
 flyingtree 共回答了15个问题
flyingtree 共回答了15个问题 |采纳率100%解题思路:花最少的钱中和等量的废水,需选用碱类物质来进行处理,通过计算求得所需物质的质量及花费.要中和含硫酸的废水,选用的物质为碱类物质,故AB不符合题意,只需比较氢氧化钙与氢氧化钠的花费即可.
Ca(OH)2+H2SO4=CaSO4+2H2O
74 98
处理98Kg硫酸需要氢氧化钙的花费为:2.0元/Kg×74Kg=148元,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
处理98Kg硫酸需要氢氧化钠的花费为:11.5元/Kg×80Kg=920元,
比较可以发现,氢氧化钙的花费少.
故选C.点评:
本题考点: 中和反应及其应用;酸、碱性废水的处理.1年前查看全部
- 在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的氮气和二氧化碳,从而消除对环境的污染,有关的反应为:6NH3+5C
在细菌作用下,用氨处理含甲醇的工业废水,使其变为无毒的氮气和二氧化碳,从而消除对环境的污染,有关的反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;上述反应中B物质的化学式为( )
A. H2
B. O2
C. NO
D. CO 朝晖路打更的1年前1
朝晖路打更的1年前1 -
 半点微笑005 共回答了19个问题
半点微笑005 共回答了19个问题 |采纳率84.2%解题思路:由反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;根据质量守恒定律的元素守恒可知:反应前后的元素种类、原子个数,则可推测B物质的化学式.由反应为:6NH3+5CH3OH+12B═3N2+5CO2+19H2O;根据质量守恒定律的元素守恒可知:反应前后的元素种类、原子个数,则反应前的原子个数为:氮原子为6个,氢原子为38个,碳原子5个,氧原子5个;而反应后的原子个数为:氮原子为6个,氢原子为38个,碳原子5个,氧原子29个,故可知12B中含有24个氧原子.故为:O2.
故选B.点评:
本题考点: 质量守恒定律及其应用;有关化学式的计算和推断.
考点点评: 本题主要考查学生运用质量守恒定律进行推断的能力,学会利用质量守恒定律的元素守恒处理问题.1年前查看全部
- 关于化学的题一道题,某工厂的工业废水中含有大量的FeSo4、较多的Cu2+和Na+。为了减少污染,工厂计划从废水中回收硫
关于化学的题
一道题,某工厂的工业废水中含有大量的FeSo4、较多的Cu2+和Na+。为了减少污染,工厂计划从废水中回收硫酸亚铁和金属铜。请说明操作方法,完成回收硫酸亚铁和铜的简单实验方案。谢了!尽量说仔细一点!
各位高手,我赶时间!我先谢谢了! 当午妹锄禾哥又要1年前1
当午妹锄禾哥又要1年前1 -
 yukiwa 共回答了15个问题
yukiwa 共回答了15个问题 |采纳率93.3%用铁屑将Cu置换出来,再用硫酸洗涤过量的铁粉,过滤可以得到纯净的铜单质,然后对滤液进行加热浓缩,冷却结晶,可以得到含有结晶水的硫酸亚铁,最后烘干晶体。1年前查看全部
- 某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀
某含铬Cr2O2-7废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到nmol FeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(3x+l)mol
B.处理废水中Cr2O72-的物质的量为[nx/2]mo1
C.反应中发生转移的电子的物质的量为6nx mol
D.在FeO•FeyCrxO3中3x=y 丝巾1年前1
丝巾1年前1 -
 sll6886 共回答了17个问题
sll6886 共回答了17个问题 |采纳率82.4%解题思路:A.由铁元素守恒,求出消耗硫酸亚铁的物质的量,结合电子转移守恒或FeO•FeyCrxO3电中性找出x与y,代入硫酸亚铁的物质的量计算;
B.反应的铬元素完全转化为沉淀,根据铬原子守恒计算;
C.Cr2O72-中Cr为+6价,被还原为+3价Cr,每个Cr原子得3个电子,计算出Cr原子物质的量,转移电子为Cr原子物质的量3倍;
D.根据失电子守恒计算.A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO•FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,故A正确;
B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为[nx/2]mol,故B正确;
C.得到nmolFeO•FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,故C错误;
D、FeO•FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,故D正确.
故选C.点评:
本题考点: 氧化还原反应的计算;氧化还原反应.
考点点评: 本题考查氧化还原反应,题目难度中等,注意原子守恒、电子守恒在计算中的应用,使计算简单化.1年前查看全部
- 高浓度有机废水的COD去除率比较低是什么原因?
高浓度有机废水的COD去除率比较低是什么原因?
我们单位是化工单位,生产废水COD一般可以达到10000左右,可溶性还算可以,经过与生活污水混合进行预处理,能降低到5000-8000左右,预处理后污水进入处理系统采用的是调节池-水解酸化1段2段-接触氧化1段2段-二沉池-生物活性炭池-清水池,其中二沉池污泥进入污泥池然后回流调节池,工艺大概是这样,水解酸化与接触氧化都是内部填料其中接触氧化为生物挂膜.水解酸化与接触氧化为底部微孔曝气我想问的是从进水到出水COD去除率仅有10%,那么按照当初的设计期望是可以达到出水在200左右的,如果COD去除率那么低,那么是在哪个环节出错了,或者说是应该注意哪些方面的调整才能把COD降下来.所有池体水力停留时间均在8-12H,设计时是按照30立方每天设计的.现在生产扩大,每天大概可以产生不到50方的水,那么应该如何去在现有的基础上进行调整能让COD降下来?有些问题可能说的不是特别的准提供的资料也不是很全,总的来说就是现有工艺,如果不扩建能否让COD去除率提高一些,如果扩建应该有什么样的方法去提高COD去除率
我今天取了点样,水解酸化COD去除率是进水的14% 接触氧化是60%不到,但是到后面的沉淀池和清水池里面COD突然升高,到总排口居然比接触氧化池的出水COD要高1000..
这是什么原因呢?有没有可能是沉淀池里的污泥时间过长而导致的呢? eric0000001年前1
eric0000001年前1 -
 chenjin2008 共回答了21个问题
chenjin2008 共回答了21个问题 |采纳率85.7%据我接触的化工废水来看,化工废水的可生化性是很差的.光靠厌氧和接触氧化根本降解不了.我建议你做做芬顿实验.将水解之后的废水做芬顿实验,然后将芬顿的产水用接触氧化池的污泥曝启.你看能否降到设计值.
我之前也碰到过精细化工的一个废水,和你的工艺差不多.一点也降解不下来,而且你水力停留很久也没有用.估计你们公司接项目的时候就是拍脑袋接的吧!特别是如果里面有苯环类东西,就你这个工艺,你想都不要想了!
不给采纳,谁理你.
还直接修改自己的问题,鄙视.1年前查看全部
- 英语翻译水可以用来灌溉农田,这样才有我们卓上的食物!水还可以用来洗衣服!既然水那么重要!所以我们要节约!我们可以用废水来
英语翻译
水可以用来灌溉农田,这样才有我们卓上的食物!水还可以用来洗衣服!既然水那么重要!所以我们要节约!我们可以用废水来浇灌树木!还需要养成随手关水的习惯,我们还应该把水循环利用(大体意思一样就可以了) headpoint1年前3
headpoint1年前3 -
 pipanzhe 共回答了27个问题
pipanzhe 共回答了27个问题 |采纳率81.5%Water can be used to irrigate farmland so that we have delicious food on the dinner table.Water can also be used to wash clothes and so on.Since water is so important it can be used more economically such as to water trees and plants.What's more,we should have the habit to turn off the tap and recycle water whenever it's possible.1年前查看全部
- 某废水处理站用甲醇处理含氨34mg/L的废水,其反应原理如下:
某废水处理站用甲醇处理含氨34mg/L的废水,其反应原理如下:
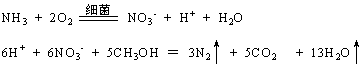
问:在处理过程中,氨转化为氮气可达98%,如果每天处理500立方米的废水,计算每天需要甲醇多少kg?每天有多少kg 氮气放出?
 新好男人20051年前2
新好男人20051年前2 -
 qiaojs 共回答了20个问题
qiaojs 共回答了20个问题 |采纳率90%V(需处理的废水)=500m3×1000(l/m3)=500000L ;
m(氨的总量)=0.034g/L ×500000L =17000g ;
n(氨的总量)=m(氨的总量)/(17g/mol)
=17000g/(17g/mol)=1000mol ;
n(处理氨的总量)=n(氨的总量)×98%=1000mol ×98%=980mol ;
有反应原理得出以下反应关系:
5CH3OH------3N2-------6硝酸根------6NH3
5 3 6
n(CH3OH) n(N2) 980mol
n(CH3OH) = (980mol×5)/ 6 ;
m(CH3OH) =【 (980mol×5)/ 6】×(32g/mol)=26133.3g≈26.1kg ;
n(N2) = (980mol×3)/ 6 =490mol ;
m(N2) =(490mol)×(28g/mol)=13720g≈13.7kg ;
答:每天需甲醇约26.1kg ,放出氮气约13.7kg.1年前查看全部
- 废水中的COD和氨氮有何计算方法?
 aa矿工1年前1
aa矿工1年前1 -
 shyf66 共回答了17个问题
shyf66 共回答了17个问题 |采纳率94.1%废水中污染物浓度一般靠测定,而不是靠计算...如果说预测的话另说.
COD用重铬酸盐法测定,氨氮可用蒸馏和滴定法测定,也可直接用仪表检测.1年前查看全部
- 为检验废水是否含有Ag为检验废水中是否含有Ag,可采用什么试剂?现象是什么?离子反应方程式是什么?
 冰清雨荷1年前2
冰清雨荷1年前2 -
 若谷心怀 共回答了21个问题
若谷心怀 共回答了21个问题 |采纳率95.2%加入NaCl
有白色沉淀
Ag+ + Cl- -----> AgCl1年前查看全部
- 某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气
某化工厂排出的废水中含有AgNO3、Ba(NO3)2、Cu(NO3)2重金属盐,已知白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,某同学设计了一个除去废水中重金属离子的实验方案如下:

(1)固体A中一定含有的物质为______(写化学式).
(2)B溶液中的溶质一定含有______(写化学式).
(3)请写出③、④的化学方程式:______、______. 水ww泉1年前1
水ww泉1年前1 -
 yetta2008 共回答了25个问题
yetta2008 共回答了25个问题 |采纳率84%解题思路:由题中的框图可知:已知红褐色固体是氢氧化铁,可知X是金属铁,铁把银、铜置换出来,故固体A为Ag、Cu、Fe;又由于加入过量的铁和出现的白色沉淀,所以B溶液中一定有Fe(NO3)2和Ba(NO3)2.书写化学方程式时要注意配平和沉淀符号.(1)由题中的图知:废水加过量固体X,然后向滤液中加氢氧化钠,产生白色沉淀又变成红褐色沉淀,由题中信息知白色沉淀是氢氧化亚铁,红褐色沉淀是氢氧化铁;可知金属X是铁,废水中含有银离子、钡离子和铜离子,铁可将银离子和铜离子置换出来,还有过量的铁,所以固体A中一定含有Fe、Ag和Cu;
(2)溶液中含有没参加反应的硝酸钡和生成的硝酸亚铁,硝酸铜和硝酸银完全被过量的铁置换出来,所以B溶液中的溶质一定含有Fe(NO3)2、Ba(NO3)2;
(3)反应③是白色的Fe(OH)2固体在潮湿的空气中的水、氧气反应可生成红褐色的Fe(OH)3,因此反应的方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
溶液C为Ba(NO3)2,加入硫酸钠发生反应的方程式为:Ba(NO3)2+Na2SO4=BaSO4↓+2NaNO3.
故答案为:(1)Fe、Cu、Ag;(2)Ba(NO3)2、Fe(NO3)2;(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3;Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3 .点评:
本题考点: 物质的鉴别、推断;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
考点点评: 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论.1年前查看全部
- 工业废水处理达标后能作为溶剂,石灰,等药品吗,增加水处理压力吗
 lovelydragon1年前1
lovelydragon1年前1 -
 qiuxinzeng 共回答了24个问题
qiuxinzeng 共回答了24个问题 |采纳率100%如果是处理废物,这样做成本就高了,可以考虑综合处理,如果你说的是中水回用,就要达到回用标准.1年前查看全部
- 为了对某工厂的废水水质进行检测,某化学实验室取500mL水样进行检测.当加入KSCN溶液是,水样变红,再向水样
为了对某工厂的废水水质进行检测,某化学实验室取500mL水样进行检测.当加入KSCN溶液是,水样变红,再向水样
中加入1.12g铁粉,红色恰好褪去,
1,水样中一定存在的金属离子是
2,加入铁粉后发生反应的离子方程式为
3,加入铁粉前,水样中该金属离子的物质的量浓度为 aajiuzhai1年前1
aajiuzhai1年前1 -
 梦亦如昨 共回答了11个问题
梦亦如昨 共回答了11个问题 |采纳率90.9%1,水样中一定存在的金属离子是: Fe3+ (3价铁离子)
2,加入铁粉后发生反应的离子方程式为:Fe + 2Fe3 + = 3 Fe3+
3, 加入铁粉前,水样中该金属离子的物质的量浓度为:2.24/56 /0.5 = 0.08 mol/L1年前查看全部
- 水滑石在废水废气应用中存在的问题及展望
水滑石在废水废气应用中存在的问题及展望
存在问题即没有研究的领域及实际应用中存在的缺点,展望即未来研究的焦点,分成条叙述 真爱无悔5201年前1
真爱无悔5201年前1 -
 爱我修罗704 共回答了16个问题
爱我修罗704 共回答了16个问题 |采纳率81.3%这个真没用!1年前查看全部
- 陶瓷废水的絮凝沉淀,预调pH至8 9 脱色率和浊度去除率都没什么变化,但是到10就有很大的变化,为什么?
陶瓷废水的絮凝沉淀,预调pH至8 9 脱色率和浊度去除率都没什么变化,但是到10就有很大的变化,为什么?
答得好有加分,老师催着交论文

 yoyojeams1年前1
yoyojeams1年前1 -
 mmq1984 共回答了29个问题
mmq1984 共回答了29个问题 |采纳率82.8%可能是钙镁的影响,钙离子形成碳酸钙才能沉淀,需要在pH10以上,镁离子需要pH12以上形成氢氧化镁才能沉淀;从你的试验数据,说明此废水中钙镁含量高,其他离子如铁、锌、铝的含量不高,所以在pH8、pH9时浊度没有太大变化.为证实,你可以测一下沉淀物中钙镁的含量.1年前查看全部
- 降低溶液的电导率的方法我是做污水处理的,但是我所用的方法不适合高电导率的废水的处理,我想问下有没有什么方法可以降低溶液电
降低溶液的电导率的方法
我是做污水处理的,但是我所用的方法不适合高电导率的废水的处理,我想问下有没有什么方法可以降低溶液电导率,我查了文献,一般都是用生物方法,我想问下有没有什么吸附法之类的 xia01011年前1
xia01011年前1 -
 li2ke 共回答了13个问题
li2ke 共回答了13个问题 |采纳率92.3%问题是吸附之后如何再生呢?所以,这种方法用在污水处理上不是好办法.1年前查看全部
- 某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气
某化工厂排出的澄清废水中,加入BaCl2溶液产生白色沉淀,再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体,下列说法正确的是:
1.废液中一定有CO3(2-) 2.废液中有H2SO4
3.废液中一定有Ag+ 4.废液中一定有SO4(2-)
答案是1和4,可是我不明白为什么说1和3不行呢? lyyong12341年前1
lyyong12341年前1 -
 doudoufly 共回答了22个问题
doudoufly 共回答了22个问题 |采纳率90.9%“俊狼猎英”团队为您解答.
分析:通过“再加入足量稀硝酸,沉淀部分溶解,并放出能使澄清石灰水变浑浊的气体”可知,溶液中一定含有CO3(2-),那么如果有CO3(2-)的话,就一定没有H2SO4和Ag+,因为CO3(2-)和酸是不能共存的(反应会产生二氧化碳),CO3(2-)和Ag+结合会变成碳酸银沉淀,如果没有Ag+的话,那么再加入足量稀硝酸,沉淀部分溶解,说明有不溶于硝酸的沉淀,就不是氯化银,而是硫酸钡沉淀了,所以溶液中一定含有SO4(2-),明白么?不明白可以追问!1年前查看全部
- 电镀废水斜管沉淀池出水黄绿色电镀废水斜管沉淀池出刚开始水黄绿色,现在颜色正常了,可是沉淀池给人的感觉是不够清澈,不是污泥
电镀废水斜管沉淀池出水黄绿色
电镀废水斜管沉淀池出刚开始水黄绿色,现在颜色正常了,可是沉淀池给人的感觉是不够清澈,不是污泥上泛的那种,沉淀正常,就是不清澈. mmsaraqi1年前1
mmsaraqi1年前1 -
 tazj 共回答了19个问题
tazj 共回答了19个问题 |采纳率94.7%你反应的这种情况是水的浊度高,主要是微小悬浮物没法沉淀,环.保通论坛有人就建议你挑选比较理想的聚丙烯酰胺来做絮凝剂,聚丙是有很多型号的,根据离子度的不同,其对微小悬浮物的絮凝作用有强弱.
还有你可以通过调整pH值来观察其沉淀性;通过实验选择比较理想的pH值后通过加药泵来调节.1年前查看全部
- 工业废水含氢氧化钠低于5%以下,普通槽罐车运输可以运输吗?(没有危险品运输证的)
工业废水含氢氧化钠低于5%以下,普通槽罐车运输可以运输吗?(没有危险品运输证的)
要运输的话,要有什么条件! 好好恋爱1年前1
好好恋爱1年前1 -
 我土容易吗 共回答了23个问题
我土容易吗 共回答了23个问题 |采纳率91.3%不可以,运输会产生反应1年前查看全部
大家在问
- 1有一铁球质量是237克,体积80立方是厘米,问这铁球是实心还是空心的,如果是空心的,空心的部分的体积是多少,
- 2国际单位制选定的三个力学基本物理量是:m,kg,s是不是?????……
- 3this is the way he will do it麻烦准确翻译,
- 4甲乙两人相向而行,甲每分种走60米,乙每分钟走80米,两个人在距中点80米处相遇,问两地相距多少米?
- 5最好有4部文学作品的主要内容.什么文学作品都行.20 到 30字左右
- 6语文高手来!!!《父亲在拐角处等我》阅读答案 原文麻烦你们自己上网查一下
- 7.(本小题满分l0分)选修4—5:不等式选讲
- 8A,B两地相距48㎞,小武骑车从A地到B地后再返回A地,在回来的路上,他用去时的速度行2小时,后停留30分钟,接着用比原
- 9海水提溴时氯气的作用是什么?怎样制得粗溴?为什么制得粗溴猴,要鼓入热空气或水蒸气把溴吹出来?
- 10灰心失望的意思快——快大哥大姐们
- 11读图,回答问题.(1)图1、图2中字母和序号表示的都是地形单元,其中,A对应的是数码______,C对应的是数码____
- 12用英语描述一个人我不知道该怎么描述,也没有描述的对象http://bbsimg.qq.com/2004/11/05/00
- 13求比值 5分之2∶2.4 7.2∶36 9分之8∶12分之7 1.2
- 14资本主义世界体系的形成对于近代中国商业带来了什么样的影响?商人群体的处境在这个过程中发生了怎样的变化?(提示:可以结合近
- 15关于轿车的载重量一、一般轿车最大载重量怎样计算?二、车里坐满四人后(平均150斤).背箱还能放多少东西呢?三、如果超载对