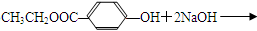
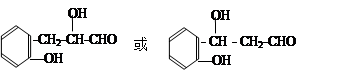
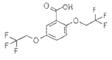
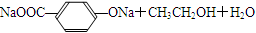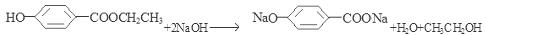广谱高效低毒杀虫剂(农药)有哪些?之前用的甲胺磷 觉得毒性太大了!
 bluechos2022-10-04 11:39:541条回答
bluechos2022-10-04 11:39:541条回答
已提交,审核后显示!提交回复
共1条回复
 yhrzhjh 共回答了21个问题
yhrzhjh 共回答了21个问题 |采纳率100%- 一、有机磷杀虫剂 (一)敌百虫 属低毒广谱杀虫剂,具有很强的胃毒作用和较高的触杀作用,具有渗透性,但元内吸传导作用,适宜于水稻、麦类、蔬菜、果树、棉花等作物害虫的防治. 【剂型】25%、6%粉剂,80%、85...
- 1年前
相关推荐
- 普罗帕酮为广谱高效抗心律失常药.下列说法正确的是( )
普罗帕酮为广谱高效抗心律失常药.下列说法正确的是( )
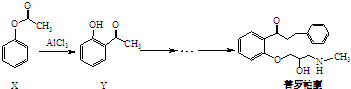
A.反应物X与中间体Y互为同分异构体
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应 蔓竹1年前1
蔓竹1年前1 -
 Beyge 共回答了21个问题
Beyge 共回答了21个问题 |采纳率90.5%解题思路:A.反应物X与中间体Y分子式相同,结构不同;
B.Y含有酚羟基,可与溴水发生取代反应;
C.根据手性碳原子的定义分析;
D.根据有机物含有的官能团的性质进行判断.A.反应物X与中间体Y分子式相同,结构不同,属于同分异构体,故A正确;
B.Y含有酚羟基,可与溴水发生取代反应,与氯化铁发生颜色反应,则可用溴水或FeCl3溶液鉴别X和Y,故B正确;
C.手性碳原子是碳原子上连接4个不同的原子或原子团,普罗帕酮分子中有1个手性碳原子,故C错误;
D.X、Y不能发生消去反应,Y和普罗帕酮不能发生水解反应,故D错误.
故选AB.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构和性质,题目难度不大,注意把握有机物的官能团的性质,比较有机物的结构特点.1年前查看全部
- 二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用.以下是某校化学研究小组设计实验室制
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用.以下是某校化学研究小组设计实验室制取ClO2的工艺流程图.下列有关说法正确的是( )
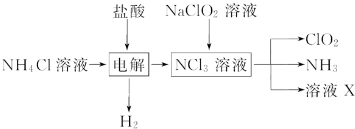
A.电解时发生反应的化学方程式为:2HCl
Cl2↑+H2↑电解 .
B.由NaClO2溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3
C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的 NH3
D.溶液X的成分为NaClO3和NaOH 没有毛毛的小猪子1年前1
没有毛毛的小猪子1年前1 -
 415856 共回答了25个问题
415856 共回答了25个问题 |采纳率88%解题思路:A、由工艺流程转化关系可知,电解氯化铵与盐酸混合溶液,生成NCl3与H2;
B、结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,NCl3+3H2O+6ClO-2=6ClO2↑+3Cl-+3OH-+NH3↑,依据离子方程式定量关系计算;
C、氨气为碱性气体,碱石灰不能吸收氨气;
D、NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH.A、电解氯化铵和盐酸混合溶液时,根据流程图知生成氢气和NCl3,其电解反应方程式为:NH4Cl+2HCl
通电
.
3H2↑+NCl3,故A错误;
B、NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,结合电子守恒可知,Cl元素的化合价升高,则N元素化合价降低,还生成氨气,NCl3+3H2O+6ClO2-=6ClO2↑+3Cl-+3OH-+NH3↑,由NaClO2溶液制取0.6mol ClO2时,至少消耗0.1mol NCl3,故B正确;
C、氨气为碱性气体,碱石灰不能吸收氨气,可以用浓硫酸干燥氨气,故C错误;
D、结合电子守恒计算分析,NCl3与NaClO2按物质的量之比为1:6恰好反应生成ClO2,还生成氯化钠、NaOH,故D错误;
故选B.点评:
本题考点: 氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查了元素化合物性质和转化关系的分析判断,主要是氧化还原反应的分析应用,产物判断是解题关键,题目难度中等.1年前查看全部
- 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
 二氧化氯(clo2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(clo2)是一种高效、广谱、安全的杀菌、消毒剂.
(1)氯化钠电解法是一种可靠的工业生产clo2方法.
①用于电解的食盐水需先除去其中的ca2+、mg2+、so42-等杂质.在进行除杂操作时,先往粗盐水中加入过量的______(填化学式),至沉淀不再产生后,再加入过量的na2co3和naoh,充分反应后将沉淀一并滤去;最后再用适量的稀盐酸中和至p h=7.
②该法工艺原理如右图所示.其过程是将食盐水在特定条件下电解得到的氯酸钠(naclo3)与盐酸反
应生成clo2.该工艺中可以利用的单质有______(填化学式),发生器中生成clo2的化学方程式为:
______.
(2)纤维素还原法制clo2是一种新方法,其原理是:纤维素水解得到的最终产物d与naclo3反应生成clo2.完成并配***应的化学方程式:____________+24naclo3+12h2so4=______clo2↑+______co2↑+18h2o+____________.
(3)clo2和cl2均能将电镀废水中的cn-氧化为无毒的物质,自身被还原为cl-.处理含cn-相同量的电镀废水,所需cl2的物质的量是clo2的______倍. meixinlei1年前1
meixinlei1年前1 -
 cactus458 共回答了22个问题
cactus458 共回答了22个问题 |采纳率95.5%解题思路:(1)①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去;
②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl,根据流程图可知加入物质为NaClO3和HCl,生成ClO2;可以写出方程式,并用化合价升降法配平得到;
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,然后配平得到;
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,故为2.5倍.(1)①加入过量的Na2CO3和NaOH,可分别除去Ca2+、Mg2+,在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl2,除去硫酸根,过量的钡离子,加入Na2CO3除去,故答案为:BaCl2;
②电解饱和食盐水生成H2、Cl2和NaOH;故可以利用的单质为H2、Cl2,合成HCl,根据流程图可知加入物质为NaClO3和HCl,生成ClO2;发生氧化还原反应,NaClO3被还原生成ClO2,HCl被氧化生成Cl2,同时生成水,反应的化学方程式为2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,
故答案为:H2、Cl2;2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O;
(2)纤维素为多糖,水解最终产物为葡萄糖(C6H12O6),具有还原性,可将NaClO3还原得到ClO2.Cl从+5到+4价,降低1价,葡萄糖(C6H12O6)C均价为0,到+4价,升高4价,则配平后的化学方程式为1 C6H12O6+24 NaClO3+12H2SO4=24 ClO2↑+6 CO2↑+18H2O+12 Na2SO4,
故答案为:1;C6H12O6;24;6;12;Na2SO4;
(3)每摩尔Cl2得到2mol电子,而每摩尔ClO2得到5mol电子,则所需Cl2的物质的量是ClO2的2.5倍,故答案为:2.5.点评:
本题考点: 电解原理;氧化还原反应方程式的配平.
考点点评: 本题考查化学工艺流程,涉及氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂)等相关知识,题目难度中等,注意把握物质的分离、提纯操作方法.1年前查看全部
- 图中所示化合物A(fumimycin)是:从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是
 图中所示化合物A(fumimycin)是:从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
图中所示化合物A(fumimycin)是:从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
A.该化合物A的分子式为:C15H15O6N
B.化合物A不与NaHCO3反应
C.化合物A与足量的NaOH反应,1mol A可以消耗4mol NaOH
D.化合物A可以水解得到2种有机物 江北佬1年前1
江北佬1年前1 -
 sea2004 共回答了15个问题
sea2004 共回答了15个问题 |采纳率86.7%解题思路:由有机物的结构简式可确定有机物的分子式,该有机物中含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有肽键和酯基,可发生水解反应,含有羧基,具有酸性,可发生中和和酯化反应,以此解答该题.解;A.由结构简式该有机物的分子式为C16H15O7N,故A错误;
B.分子中含有羧基,可与NaHCO3反应生成气体,故B错误;
C.分子中含有2个酚羟基、1个羧基和1个酯基,且酯基水解生成酚羟基和羧基,则1mol A至少消耗5mol NaOH,故C错误;
D.由结构简式可知,分子中含有酯环和肽键,水解生成两种有机物,故D正确.
故选D.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查学生有关官能团决定性质的知识与空间结构等,要求学生熟记官能团具有的性质,本题易错点为D,注意把握官能团的性质,根据官能团判断有机物的性质,难度不大.1年前查看全部
- 有机物A是一种广谱高效食品防腐剂,如图1所示是A分子的球棍模型.回答问题:
有机物A是一种广谱高效食品防腐剂,如图1所示是A分子的球棍模型.回答问题:

(1)写出A的分子式:______;
(2)A能够发生反应的类型有(填序号):______;
①氧化反应 ②加成反应③取代反应 ④消去反应
(3)写出A与足量烧碱溶液反应的化学方程式:______
(4)如图2是一些中草药中所含的有机物:其中互为同分异构体的是(填序号):______;能与溴水发生加成反应的是(填序号):______;
(5)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,写出B的结构简式:______;
(6)A的另一种同分异构体C遇FeCl3溶液显紫色;1mol C可与 1mol NaOH 反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,E经取代、消去两步反应可得香豆素.写出符合上述要求的一种C的结构简式:______. bambo321年前1
bambo321年前1 -
 aoxiangwinning 共回答了28个问题
aoxiangwinning 共回答了28个问题 |采纳率92.9%解题思路:由球棍模型可知结构简式为HO-C6H4-COOCH2CH3,分子中含有酚羟基,可发生取代、氧化反应,含有酯基,可发生水解反应,
(1)根据有机物的结构简式判断分子式;
(2)由结构模型可知A为苯甲酸乙酯,根据苯环和酯基的性质判断;
(3)A含有酯基可在碱性条件下水解;
(4)根据同分异构体的定义判断,根据有机物含有的官能团的性质判断可能具有的性质;
(5)B为 ,可发生消去、酯化反应;
,可发生消去、酯化反应;
(6)A的另一种同分异构体C遇FeCl3溶液显紫色,说明分子中含有酚羟基;1molC可与1mol NaOH反应生成有机物,说明只有一个酚羟基;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,说明D中含有醛基,E经酯化、消去两步反应可得香豆素.(1)由球棍模型可知结构简式为HO-C6H4-COOCH2CH3,分子式为C9H10O3,故答案为:C9H10O3;
(2)含有酚羟基,可发生取代、氧化反应,含有酯基,可发生水解反应,水解反应属于取代反应,但不能发生消去反应,故答案为:①②③;
(3)该有机物中含有酚羟基、酯基,可以和氢氧化钠发生中和反应、水解反应,即 ,
,
故答案为: ;
;
(4)根据同分异构体的概念:②④分子式相同,但是结构不同,属于同分异构体,①②④中均含双键,与溴水发生加成反应,故答案为:②④;①②④;
(5)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,应为 ,故答案为:
,故答案为: ;
;
(6)A的另一种同分异构体C遇FeCl3溶液显紫色,则其中含有酚羟基;1mol C可与 1mol NaOH 反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E即为羧酸,D中含有醛基,E经取代、消去两步反应可得香豆素,符合条件的A的同分异构体为: ,
,
故答案为: 或
或 .
.点评:
本题考点: 有机物的结构和性质;有机物分子中的官能团及其结构.
考点点评: 本题考查较为综合,侧重于有机物的结构和性质的考查,为高考常见题型,难度不大,注意把握有机物的官能团的性质,结合题给信息判断有机物的结构简式.1年前查看全部
- 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.

(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是______(填序号).
A.只有还原性B.还原性和酸性C.只有氧化性D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为______mol.
(2)目前已开发出用电解法制取ClO2的工艺.
①如图1示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:______
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为______mol;用平衡移动原理解释阴极区pH增大的原因______.
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为______;处理100m3这种污水,至少需要ClO2[50a/13][50a/13]mol. 肚皮刘1年前1
肚皮刘1年前1 -
 威尔斯 共回答了18个问题
威尔斯 共回答了18个问题 |采纳率94.4%解题思路:(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl中,生成NaCl与酸性有关,生成氯气与HCl的还原性有关;
②NaClO3中Cl元素的化合价由+5价降低为+4价;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=[V/Vm]计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;根据方程式计算需要ClO2的物质的量.(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl起还原剂作用,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,故答案为:B;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量为0.1mol×(5-4)=0.1mol,
故答案为:0.1;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为[0.112L/22.4L/mol]=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为[100ag/26g/mol]=[50a/13]mol,由方程式可知,至少需要ClO2的物质的量=[50a/13]mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;[50a/13].点评:
本题考点: 制备实验方案的设计;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查制备实验方案的设计,为高频考点,设计氧化还原反应、常用化学用语、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.1年前查看全部
- 抗真菌药,广谱抗真菌药有什么区别?
 6vr31年前1
6vr31年前1 -
 老刀不宝 共回答了21个问题
老刀不宝 共回答了21个问题 |采纳率95.2%二者的抗菌谱不同,有的抗真菌药只能针对某一部分真菌,而广谱抗真菌药物的抗菌谱更广泛一些,对很多真菌都有抑制和杀灭作用.1年前查看全部
- 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对
二氧化氯(clo2)是一种高效、广谱、安全的杀菌、消毒剂.与cl2相比,clo2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(1)clo2的制备方法比较实用的有数十种,下列方法是常见方法之一.
方法一:2naclo3+4hcl=2clo2↑+cl2↑+2nacl+2h2o
方法二:2naclo3+h2o2+h2so4=2clo2↑+na2so4+o2↑+2h2o
方法三:实验室常用氯酸钠(naclo3)、亚硫酸钠(na2so3)和硫酸共热制备二氧化氯
①方法一:当有0.4mol电子发生转移时,得到的还原产物为______ mol.
②方法二:该反应中h2o2______(填序号).
a.发生氧化反应b.仅做氧化剂
c.既被氧化又被还原d.既未被氧化也未被还原
③方法三的化学反应方程式为:______.
(2)纤维素还原法制clo2是一种新方法,其原理是:纤维素水解得到的最终产物葡萄糖(c6h12o6)与naclo3在稀硫酸存在的条件下,反应生成clo2和co2等产物.写出该反应的化学方程式:______.
(3)clo2和cl2均能将电镀废水中的cn-氧化为无毒的物质,自身被还原为cl-.处理含cn-相同量的电镀废水,所需cl2的物质的量是clo2的______倍.
(4)clo2在杀菌消毒的同时,可将剧毒***化物氧化成无毒气体而除去,写出用clo2氧化除去cn-的离子方程式______.某工厂污水中含cn- a mg/l,处理100m3这种污水,至少需要clo2[50a/13][50a/13]mol. chris1986851年前1
chris1986851年前1 -
 白剑锋 共回答了19个问题
白剑锋 共回答了19个问题 |采纳率100%解题思路:(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5价降低为+4价,被还原,有2mol电子转移生产2mol还原产物ClO2;
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水;
(3)由化合价变化计算转移等电子时的物质的量;
(4)ClO2氧化除去CN-,生成氮气、二氧化碳和氯离子;结合氧化还原反应方程式计算.(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5价降低为+4价,被还原,有2mol电子转移生产2mol还原产物ClO2,则当有0.4mol电子发生转移时,得到的还原产物为0.4mol,故答案为:0.4;
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高,作还原剂,发生氧化反应,故答案为:a;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水,反应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水,反应为24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O,
故答案为:24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O;
(3)处理含CN-相同量的电镀废水,转移电子相同,所需Cl2的物质的量是ClO2的
4−(−1)
2×[0−(−1)]=2.5倍,故答案为:2.5;
(4)ClO2氧化除去CN-的离子方程式为2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
含CN-a mg/L,处理100m3这种污水,n(CN-)=
100×103L×a×10−3g
26g/mol=[50a/13]mol,由2ClO2+2CN-=2CO2↑+N2↑+2Cl-可知,至少需要ClO2[50a/13]mol,
故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;[50a/13].点评:
本题考点: 氧化还原反应;氧化还原反应的计算.
考点点评: 本题考查氧化还原反应及计算,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、分析能力和计算能力的考查,题目难度中等.1年前查看全部
- 工业上常用NaClO3和Na2SO3溶液混合,并加H2SO4酸化后反应制取一种广谱消毒剂,在该反应中NaClO3和Na2
工业上常用NaClO3和Na2SO3溶液混合,并加H2SO4酸化后反应制取一种广谱消毒剂,在该反应中NaClO3和Na2SO3的物质的量之比为2:1,该广谱消毒剂的化学式为( )
A.Cl2O7
B.ClO2
C.Cl2O3
D.Cl2O 叶落知多少1年前1
叶落知多少1年前1 -
 悬崖与风 共回答了17个问题
悬崖与风 共回答了17个问题 |采纳率100%解题思路:根据题意“工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得”,由此可知,NaClO3中氯元素的化合价由+5价降低,反应中NaClO3为氧化剂,则Na2SO3为还原剂,被氧化为Na2SO4,根据电子转移守恒计算Cl元素在还原产物中的化合价,据此判断.根据题意“工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得”,由此可知,NaClO3中氯元素的化合价由+5价降低,反应中NaClO3为氧化剂,则Na2SO3为还原剂,则Na2SO3被氧化生成+6价S,生成Na2SO4,令Cl元素在还原产物中的化合价为a,则:2×(5-a)=1×(6-4),解得a=4,故该广谱消毒剂的化学式为ClO2,故选B.
点评:
本题考点: 氧化还原反应的计算.
考点点评: 本题考查氧化还原反应的有关计算,难度不大,注意从化合价变化判断氧化剂、还原剂、氧化产物、还原产物等概念,利用电子转移守恒计算.1年前查看全部
- 二氧化氯(ClO 2 )为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
二氧化氯(ClO 2 )为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO 2 的反应原理为2NaClO 3 +4HCl=2ClO 2 ↑+Cl 2 ↑+2H 2 O+2NaCl。
①浓盐酸在反应中显示出来的性质是________。
②若上述反应中产生0.1 mol ClO 2 ,则转移电子的物质的量为________mol。A.只有还原性 B.还原性和酸性 C.只有氧化性 D.氧化性和酸性
(2)目前已开发出用电解法制取ClO 2 的新工艺。
①上图是用石墨作电极,一定条件下电解饱和食盐水制取ClO 2 的示意图。则阳极产生ClO 2 的电极反应式为_____________________________________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为________mol,用平衡移动原理解释阴极区pH增大的原因:______________________________________。
(3)ClO 2 对污水中Fe 2 + 、Mn 2 + 、S 2 - 和CN - 等有明显的去除效果。某工厂污水中含CN - a mg/L,现用ClO 2 将CN - 氧化,产物中有两种气体生成,其离子反应方程式为________________;处理100 m 3 这种污水,至少需要ClO 2 ________mol。 1758590781年前1
1758590781年前1 -
 baobao2046 共回答了27个问题
baobao2046 共回答了27个问题 |采纳率88.9%(1)①B ②0.1 (2)①Cl - -5e - +2H 2 O=ClO 2 ↑+4H +
②0.01 在阴极上发生反应2H + +2e - =H 2 ↑,H + 浓度减小,使得H 2 O
OH - +H + 的平衡向右移动,OH - 浓度增大,pH增大
(3)2ClO 2 +2CN - =N 2 ↑+2CO 2 ↑+2Cl -
①电解饱和食盐水制取ClO 2 ,ClO 2 为氧化产物,故应在阳极产生,Cl - 失去5个电子生成ClO 2 ,而ClO 2 中含有氧元素,故还有H 2 O参加反应,再根据质量守恒配平电极反应式即可。②阴极产生标准状况下112 mL H 2 ,转移电子0.01 mol,消耗的n(H + )=0.01 mol,为保持溶液呈电中性,故有相同物质的量的Na + 通过阳离子交换膜移向阴极。阴极上H 2 O电离出的H + 放电,导致H 2 O的电离平衡向右移动,OH - 浓度增大,溶液pH增大。(3)处理污水时生成的两种气体不能具有污染性,应为CO 2 和N 2 ,再根据得失电子守恒和原子守恒配平即可。由离子反应方程式可知消耗的ClO 2 的物质的量等于污水中CN - 的物质的量,即n(ClO 2 )=n(CN - )= =
=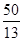 amol。
1年前查看全部
amol。
1年前查看全部
- 有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答问题:
有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答问题:
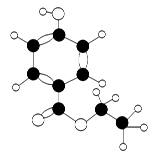
(1)写出A的分子式:________;
(2)A能够发生反应的类型有(填序号):________;
①氧化反应②加成反应③取代反应④消去反应
(3)写出A与足量烧碱溶液反应的化学方程式:________;
(4)下列是一些中草药中所含的有机物: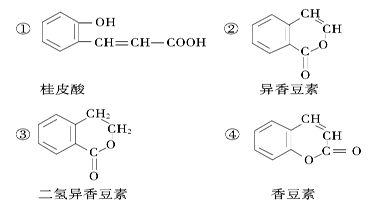
其中互为同分异构体的是(填序号):______;能与溴水发生加成反应的是(填序号):_______;
(5)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,写出该反应的化学方程式:______________________________;
(6)A的另一种同分异构体C遇FeCl 3 溶液显紫色;1 mol C可与 1 mol NaOH 反应生成有机物D;D被Ag(NH 3 ) 2 OH溶液氧化后经酸化得有机物E,E经取代、消去两步反应可得香豆素。写出符合上述要求的一种C的结构简式:____________。 bfti41年前1
bfti41年前1 -
 天下_zz 共回答了18个问题
天下_zz 共回答了18个问题 |采纳率94.4%1年前查看全部
- 被医学界誉为“天然广谱抗菌素”的大蒜,它的辛辣味正是其中的有效成分--大蒜辣素产生的,已知大蒜辣素的化学式为C6H10S
被医学界誉为“天然广谱抗菌素”的大蒜,它的辛辣味正是其中的有效成分--大蒜辣素产生的,已知大蒜辣素的化学式为C6H10S2O,则该物质由______种元素组成,其中碳元素与氧元素的质量比是______,硫元素的质量分数为______.
 带血的泪1年前0
带血的泪1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 过氧乙酸是一种高效广谱杀菌剂.为预防春季传染病的传播,我校拟用0.2%的过氧乙酸溶液对教室、宿舍、公共场所进行环境的表面
过氧乙酸是一种高效广谱杀菌剂.为预防春季传染病的传播,我校拟用0.2%的过氧乙酸溶液对教室、宿舍、公共场所进行环境的表面消毒.市面上常出售每瓶质量为2kg、质量分数为20%的过氧乙酸溶液,其中含溶质过氧乙酸______kg;每瓶可稀释成0.2%的稀溶液______kg.
 张松梅1年前1
张松梅1年前1 -
 朋友222 共回答了17个问题
朋友222 共回答了17个问题 |采纳率70.6%解题思路:利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算配制溶液所需要的溶质的质量;根据溶液稀释前后,溶质的质量不变,结合题意进行分析解答.现有20%的过氧乙酸溶液2kg,该溶液含溶质过氧乙酸的质量为:2kg×20%=0.4kg.
溶液稀释前后,溶质的质量不变,则可稀释成0.2%的过氧乙酸溶为:0.4kg÷0.2%=20kg.
故答案为:0.4;20.点评:
本题考点: 有关溶质质量分数的简单计算;用水稀释改变浓度的方法.
考点点评: 本题难度不大,掌握溶质质量分数的有关计算、溶液稀释前后溶质的质量不变是正确解答本题的关键所在.1年前查看全部
- 二氧化氯是一种广泛使用的安全、高效、广谱消毒剂,世界卫生组织(WHO)将其定为1A级安全消毒剂,常用于饮用水消毒、医疗仪
二氧化氯是一种广泛使用的安全、高效、广谱消毒剂,世界卫生组织(WHO)将其定为1A级安全消毒剂,常用于饮用水消毒、医疗仪器设备和食品工业设备的消毒等.二氧化氯的化学式为ClO 2 ,则该物质中氯元素的化合价是( ) A.+2 B.+3 C.+4 D.+6  sjgpcf4tw72021年前1
sjgpcf4tw72021年前1 -
 ll吧你丫美日 共回答了17个问题
ll吧你丫美日 共回答了17个问题 |采纳率100%根据在化合物中,正负化合价的代数和为零,氧元素的化合价为-2,可得二氧化氯ClO 2 ,中氯元素的化合价为:
x+(-2)×2=0,解答 x=+4;故选C.1年前查看全部
- 二氧化氯(ClO 2 )是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验
二氧化氯(ClO 2 )是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO 2 的工艺流程图。下列有关说法正确的是()

A.电解时发生反应的化学方程式为2HCl  Cl 2 ↑+H 2 ↑
Cl 2 ↑+H 2 ↑B.由NaClO 2 溶液制取0.6 mol ClO 2 时,至少消耗0.1 mol NCl 3 C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO 2 中的NH 3 D.溶液X的主要成分为NaClO 2 和NaOH  bmweos1年前1
bmweos1年前1 -
 venus1122 共回答了24个问题
venus1122 共回答了24个问题 |采纳率91.7%1年前查看全部
- 二溴海因(C5H6O2N2Br2)是一种广谱高效、低残留的新型环境友好消毒剂,下列说法正确的是( )
二溴海因(C5H6O2N2Br2)是一种广谱高效、低残留的新型环境友好消毒剂,下列说法正确的是( )
A. 二溴海因的相对分子质量为286g
B. 二溴海因中氧元素的质量分数小于氮元素的质量分数
C. 二溴海因中含有O2,N2,Br2,C5H6
D. 二溴海因分子中C,H,O,N,Br原子个数比为5:6:2:2:2 春香与梦龙1年前1
春香与梦龙1年前1 -
 散落的幸福 共回答了13个问题
散落的幸福 共回答了13个问题 |采纳率76.9%解题思路:根据相对分子质量是一个不带单位的量判断
根据物质中某元素的质量分数=[该元素的相对分子质量×该元素的原子个数/该物质的相对分子质量]×100%求出二溴海因中氧元素的质量分数和氮元素的质量分数,比较即可;
根据纯净物的概念可以判断C说法错误;
根据化学式的意义判断 D 说法正误.二溴海因(C5H6O2N2Br2)
A、相对分子质量是一个比值,单位为1,通常不写,故A错
B、二溴海因(C5H6O2N2Br2)的、相对分子质量是:12×5+1×6+16×2+14×2+80×2=286
[16×2/286]×100%=10.8% [14×2/286]×100%=10.2%
二溴海因中氧元素的质量分数大于氮元素的质量分数;故B错
C、二溴海因是一种纯净物,其中不会再含有其他物质,故C错
D、由化学式可以知道二溴海因分子中C,H,O,N,Br原子个数比为5:6:2:2:2;故D对
故选D点评:
本题考点: 相对分子质量的概念及其计算;分子和原子的区别和联系;元素的质量分数计算.
考点点评: 熟悉化学式的意义,掌握化学式的计算是解此题的关键.1年前查看全部
- 有机物A是一种广谱高效食品防腐剂,图甲是A 分子的球棍模型.回答问题:
有机物A是一种广谱高效食品防腐剂,图甲是A 分子的球棍模型.回答问题:

(1)写出A的分子式:______;
(2)A不能够发生反应的类型有(填写序号):______;
①水解反应②加成反应
③取代反应④消去反应
(3)写出A与烧碱溶液反应的化学方程式:______;
(4)图乙中是一些中草药中所含的有机物:其中互为同分异构体的是(填写序号):______;不能与Br2水反应的是(填写序号):______;
(5)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,B的结构简式为______,B能否发生消去反应______(填“能”或“不能”);
(6)A的另一种同分异构体C遇FeCl3溶液显紫色;1molC可与1mol NaOH反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,E经酯化、消去两步反应可得香豆素.写出符合上述要求的一种C的结构简式:______. logxiao1年前1
logxiao1年前1 -
 叫醒你的耳朵 共回答了25个问题
叫醒你的耳朵 共回答了25个问题 |采纳率88%解题思路:(1)根据有机物的结构简式判断分子式;
(2)由结构模型可知A为苯甲酸乙酯,根据苯环和酯基的性质判断;
(3)A含有酯基可在碱性条件下水解;
(4)根据同分异构体的定义判断,根据有机物含有的官能团的性质判断可能具有的性质;
(5)B为 ,可发生消去、酯化反应;
,可发生消去、酯化反应;
(6)A的另一种同分异构体C遇FeCl3溶液显紫色,说明分子中含有酚羟基;1molC可与1mol NaOH反应生成有机物,说明只有一个酚羟基;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,说明D中含有醛基,E经酯化、消去两步反应可得香豆素.(1)由A的结构模型可知A为
 ,分子式为C9H10O3,故答案为:C9H10O3;
,分子式为C9H10O3,故答案为:C9H10O3;
(2) 中含有苯环,可发生加成反应,含有酯基,可发生取代、水解反应,含有酚羟基,可发生取代、氧化和显色反应,不能发生消去反应,
中含有苯环,可发生加成反应,含有酯基,可发生取代、水解反应,含有酚羟基,可发生取代、氧化和显色反应,不能发生消去反应,
故答案为:④;
(3)A含有酯基可在碱性条件下水解,反应的方程式为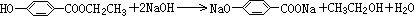 ,
,
故答案为: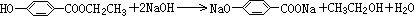 ;
;
(4)互为同分异构体的是②④其中①②④都含有碳碳双键,可与溴水发生加成反应,③不能与溴水发生加成反应,故答案为:②④;③;
(5)A的一种同分异构体B在一定条件下可转化为二氢异香豆素,应为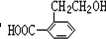 ,因羟基邻位碳原子含有H原子,可发生消去反应,
,因羟基邻位碳原子含有H原子,可发生消去反应,
故答案为: ;能;
;能;
(6)A的另一种同分异构体C遇FeCl3溶液显紫色,说明分子中含有酚羟基;1molC可与1mol NaOH反应生成有机物,说明只有一个酚羟基;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,说明D中含有醛基,E经酯化、消去两步反应可得香豆素,则C为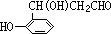 ,
,
故答案为: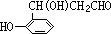 .
.点评:
本题考点: 有机物的推断.
考点点评: 本题考查较为综合,侧重于有机物的结构和性质的考查,为高考常见题型,难度不大,注意把握有机物的官能团的性质,结合题给信息判断有机物的结构简式.1年前查看全部
- 二氧化氯(ClO2)是联合国世界卫生组织确认的一种安全、高效、广谱、强力杀菌剂.二氧化氯常温下是橘红色气体,有窒息性臭味
二氧化氯(ClO2)是联合国世界卫生组织确认的一种安全、高效、广谱、强力杀菌剂.二氧化氯常温下是橘红色气体,有窒息性臭味,二氧化氯气体易溶于水,形成黄绿色的溶液,一般采用向上排空气法来收集二氧化氯.它是一种有强氧化性的物质,其杀菌能力是氯气的5倍,能与很多物质能发生剧烈反应,如能与镁反应生成亚氯酸镁【Mg(Cl02)2】.根据上述信息,请回答:
(1)二氧化氯的物理性质有______;
(2)二氧化氯的化学性质有______;
(3)写出镁与二氧化氯反应的化学方程式______,生成物中氯元素的化合价为______. 和公开1年前1
和公开1年前1 -
 carolinewll 共回答了27个问题
carolinewll 共回答了27个问题 |采纳率96.3%解题思路:物质的化学性质是指在化学变化中表现出来的性质.化学性质主要有:可燃性、毒性、氧化性、还原性、稳定性等.物质的物理性质是指不需要通过化学变化表现出来的性质.物理性质主要有:颜色、状态、气味、密度、硬度、熔点、沸点等.根据化合价规则可以求得化合物中某元素的化合价.(1)二氧化氯的物理性质有:常温下二氧化氯是橘红色气体,有窒息性臭味,易溶于水,密度比空气大.
(2)二氧化氯的化学性质有:有强氧化性,能与镁发生化学反应.
(3)镁与二氧化氯反应的化学方程式为:Mg+2ClO2=Mg(ClO2)2
在Mg(ClO2)2中,镁元素的化合价是+2价,氧元素的化合价是-2价,
设氯元素的化合价为X,根据化合物中元素化合价代数和为零有:
(+2)+2X+(-2)×4=0.
解得:X=+3.
氯元素的化合价是+3价.点评:
本题考点: 化学性质与物理性质的差别及应用;有关元素化合价的计算;书写化学方程式、文字表达式、电离方程式.
考点点评: 本题主要考查了物质的两种性质、化合价的求法及其化学方程式的书写等方面的内容,可以依据已有的知识进行.1年前查看全部
- 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对
二氧化氯(clo2)是一种高效、广谱、安全的杀菌、消毒剂.与cl2相比,clo2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(1)clo2的制备方法比较实用的有数十种,下列方法是常见方法之一.
方法一:2naclo3+4hcl=2clo2↑+cl2↑+2nacl+2h2o
方法二:2naclo3+h2o2+h2so4=2clo2↑+na2so4+o2↑+2h2o
方法三:实验室常用氯酸钠(naclo3)、亚硫酸钠(na2so3)和硫酸共热制备二氧化氯
①方法一:当有0.4mol电子发生转移时,得到的还原产物为______ mol.
②方法二:该反应中h2o2______(填序号).
a.发生氧化反应b.仅做氧化剂
c.既被氧化又被还原d.既未被氧化也未被还原
③方法三的化学反应方程式为:______.
(2)纤维素还原法制clo2是一种新方法,其原理是:纤维素水解得到的最终产物葡萄糖(c6h12o6)与naclo3在稀硫酸存在的条件下,反应生成clo2和co2等产物.写出该反应的化学方程式:______.
(3)clo2和cl2均能将电镀废水中的cn-氧化为无毒的物质,自身被还原为cl-.处理含cn-相同量的电镀废水,所需cl2的物质的量是clo2的______倍.
(4)clo2在杀菌消毒的同时,可将剧毒***化物氧化成无毒气体而除去,写出用clo2氧化除去cn-的离子方程式______.
(5)某工厂污水中含cn-a mg/l,处理100m3这种污水,至少需要clo2[50a/13][50a/13]mol. sirmepc1年前1
sirmepc1年前1 -
 totalgao 共回答了25个问题
totalgao 共回答了25个问题 |采纳率92%解题思路:(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5价降低为+4价,被还原,有2mol电子转移生产2mol还原产物ClO2;
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水;
(3)由化合价变化计算转移等电子时的物质的量;
(4)ClO2氧化除去CN-,生成氮气、二氧化碳和氯离子;
(5)结合氧化还原反应方程式计算.(1)①2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O中,Cl元素的化合价由+5价降低为+4价,被还原,有2mol电子转移生产2mol还原产物ClO2,则当有0.4mol电子发生转移时,得到的还原产物为0.4mol,故答案为:0.4;
②2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O中,H2O2中的O元素化合价升高,作还原剂,发生氧化反应,故答案为:a;
③氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,还生成硫酸钠和水,反应为2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;
(2)葡萄糖(C6H12O6)与NaClO3在稀硫酸存在的条件下,反应生成ClO2和CO2等产物,还生成硫酸钠和水,反应为24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O,故答案为:24NaClO3+C6H12O6+12H2SO4=24ClO2↑+6CO2↑+12Na2SO4+18H2O;
(3)处理含CN-相同量的电镀废水,转移电子相同,所需Cl2的物质的量是ClO2的
4−(−1)
2×[0−(−1)]=2.5倍,故答案为:2.5;
(4)ClO2氧化除去CN-的离子方程式为2ClO2+2CN-=2CO2↑+N2↑+2Cl-,故答案为:2ClO2+2CN-=2CO2↑+N2↑+2Cl-;
(5)含CN-a mg/L,处理100m3这种污水,n(CN-)=
100×103L×a×10−3g
26g/mol=[50a/13]mol,由2ClO2+2CN-=2CO2↑+N2↑+2Cl-可知,至少需要ClO2[50a/13]mol,故答案为:[50a/13].点评:
本题考点: 氧化还原反应的计算;氧化还原反应;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氧化还原反应及计算,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念、分析能力和计算能力的考查,题目难度不大.1年前查看全部
- 普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
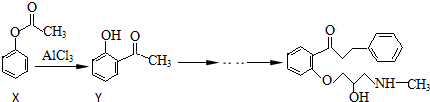
下列有关说法正确的是( )
A.在有机物X的1H核磁共振谱图中,有4组特征峰
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应 不说话的青蛙1年前1
不说话的青蛙1年前1 -
 百合格格 共回答了16个问题
百合格格 共回答了16个问题 |采纳率100%解题思路:A.由结构的对称性可知,苯环上含3种H,甲基上1种H;
B.Y中含酚-OH,而X中不含;
C.连4个不同基团的碳原子为手性碳原子;
D.X不能发生消去反应,Y不能发生水解和消去反应.A.由X的结构对称性可知,苯环上含3种H,甲基上1种H,则在有机物X的1H核磁共振谱图中,有4组特征峰,故A正确;
B.Y中含酚-OH,而X中不含,则可用溴水或FeCl3溶液鉴别X和Y,故B正确;
C.连4个不同基团的碳原子为手性碳原子,所以普罗帕酮中只有与-OH相连的C为手性碳,故C错误;
D.X不能发生消去反应,Y不能发生水解和消去反应,而普罗帕酮能发生加成、氧化、消去反应,不发生水解,故D错误;
故选AB.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重合成步骤中官能团变化、物质鉴别的考查,注意手性碳的判断,题目难度不大.1年前查看全部
- (2014•南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电
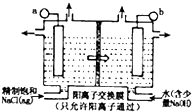 (2014•南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
(2014•南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极ClO2产生的电极方程式:______;图中b电极为______;(填“阳极”或“阴极”)
(2)电解一段时间,当阴极产生标准状况下气体112ml时,停止电解,则通过阳离子交换膜的阳离子物质的量为______mol,阴极区pH______(填“变大”、“变小”或“不变”)
(3)ClO2对污水中Fe2+,Mn2+,S2-,CN-等有明显去除效果,某工厂中污水含CN-(a mg/L),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:______. oic31年前1
oic31年前1 -
 yimin823 共回答了15个问题
yimin823 共回答了15个问题 |采纳率100%解题思路:(1)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;阳离子移向阴极;
(2)在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动;V Vm
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子.(1)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
从图上可见,阳离子移向阴极,所以b为阴极,故答案为:Cl--5e-+2H2O=ClO2↑+4H+;阴极;
(2)在阴极发生2H++2e-=H2↑,氢气的物质的量为[V
Vm=
0.112L/22.4L/mol]=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;pH变大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-.点评:
本题考点: 原电池和电解池的工作原理.
考点点评: 本题考查氧化还原反应、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.1年前查看全部
- 使用Cl 2 对自来水消毒时,会产生对人体有害的有机氯化物,而二氧化氯(ClO 2 )是一种高效、广谱、安全的杀菌、消毒
使用Cl 2 对自来水消毒时,会产生对人体有害的有机氯化物,而二氧化氯(ClO 2 )是一种高效、广谱、安全的杀菌、消毒剂.
(1)Cl 2 可以通过氯碱工业获得.氯碱工业中电解饱和食盐水的化学方程式为______,电解一段时间后,欲使溶液恢复到电解前的浓度和体积,可向电解后的溶液中加入(或通入)______.用于电解的食盐水需先除去其中的Ca 2+ 、Mg 2+ 、SO 4 2- 等杂质.除杂操作时,往粗盐水中先加入过量的______(填化学式),至沉淀不再产生后,再加入过量的Na 2 CO 3 和NaOH,充分反应后将沉淀一并滤去.
(2)氯化钠电解法是一种可靠的工业生产ClO 2 的方法.该法工艺原理示意如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO 3 )与盐酸反应生成ClO 2 .氯化钠电解槽中发生反应的化学方程式为______,发生器中生成ClO 2 的化学方程式为______.
 lit1234561年前1
lit1234561年前1 -
 窜云白玉虎 共回答了23个问题
窜云白玉虎 共回答了23个问题 |采纳率95.7%(1)氯碱工业中电解饱和食盐水的化学方程式为:2NaCl+2H 2 O
电解
.
2NaOH+H 2 ↑+Cl 2 ↑,故答案为:2NaCl+2H 2 O
电解
.
2NaOH+H 2 ↑+Cl 2 ↑;
电解饱和食盐水出来的物质为氢气和氯气,按照出啥加啥的原则,要想恢复到原溶液,应该加入HCl气体,故答案为:HCl;
要除去粗盐中的Ca 2+ 、Mg 2+ 、SO 4 2- 等杂质,每步加入的试剂必须是过量的,使离子除尽,过量的离子在下一步中必须出去,故先加入BaCl 2 ,除去硫酸根,过量的钡离子,加入Na 2 CO 3 除去,故答案为:BaCl 2 ;
电解饱和食盐水出来的物质为氢气和氯气,按照出啥加啥的原则,要想恢复到原溶液,应该加入HCl气体,故答案为:HCl;
(2)电解食盐水得到氯酸钠(NaClO 3 )和H 2 ,电解方程式为:NaCl+3H 2 O
电解
.
NaClO 3 +3H 2 ↑,故答案为:NaCl+3H 2 O
电解
.
NaClO 3 +3H 2 ↑;
2NaClO 3 +和盐酸发生歧化反应,生成NaCl、2ClO 2 、Cl 2 、H 2 O,化学方程式为:2NaClO 3 +4HCl=2NaCl+2ClO 2 ↑+Cl 2 ↑+2H 2 O,故答案为:2NaClO 3 +4HCl=2NaCl+2ClO 2 ↑+Cl 2 ↑+2H 2 O.1年前查看全部
- (2005•宜昌)“三氯生”是一种高效广谱抗菌剂,广泛应用于牙膏、药皂、洗面奶、空气清新剂等.下面关于三氯生(C12H7
(2005•宜昌)“三氯生”是一种高效广谱抗菌剂,广泛应用于牙膏、药皂、洗面奶、空气清新剂等.下面关于三氯生(C12H7Cl3O2)的说法中错误的是( )
A.三氯生中含有氧气分子
B.三氯生由碳、氢、氯、氧四种元素组成
C.三氯生是一种有机物
D.一个三氯生分子共含有24个原子 混乱的世界1年前1
混乱的世界1年前1 -
 积云如渊 共回答了25个问题
积云如渊 共回答了25个问题 |采纳率84%解题思路:A、三氯生中不含有氧分子,它是一种纯净物;
B、三氯生由碳、氢、氧、氯四种元素组成的;
C、三氯生中含有碳元素,属于有机物;
D、每个三氯生分子中含有24个原子.A、三氯生分子中含有氧原子,不含有氧分子.故选项错误;
B、三氯生由碳、氢、氧、氯四种元素组成.说法正确;
C、三氯生中含有碳元素,属于有机物;说法正确;
D、每个三氯生分子中含有24个原子.说法正确;.
故选A.点评:
本题考点: 分子、原子、离子、元素与物质之间的关系;有机物与无机物的区别;化学式的书写及意义;有关化学式的计算和推断.
考点点评: 本题主要考查化学式的含义,解答时要注意理解宏观组成和微观构成的区别.1年前查看全部
- 图中所示化合物A(fumimycin)是:从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是
图中所示化合物A(fumimycin)是:从微生物中分离得到的,它显示出广谱抗菌活性.下列关于化合物A的说法中,正确的是( )
 A. 该化合物A的分子式为:C15H15O6N
A. 该化合物A的分子式为:C15H15O6N
B. 化合物A不与NaHCO3反应
C. 化合物A与足量的NaOH反应,1mol A可以消耗4mol NaOH
D. 化合物A可以水解得到2种有机物 毛怪的阿布1年前1
毛怪的阿布1年前1 -
 vvvbvv 共回答了28个问题
vvvbvv 共回答了28个问题 |采纳率96.4%解题思路:由有机物的结构简式可确定有机物的分子式,该有机物中含有酚羟基,可发生取代、氧化和显色反应,含有碳碳双键,可发生加成、加聚和氧化反应,含有肽键和酯基,可发生水解反应,含有羧基,具有酸性,可发生中和和酯化反应,以此解答该题.解;A.由结构简式该有机物的分子式为C16H15O7N,故A错误;
B.分子中含有羧基,可与NaHCO3反应生成气体,故B错误;
C.分子中含有2个酚羟基、1个羧基和1个酯基,且酯基水解生成酚羟基和羧基,则1mol A至少消耗5mol NaOH,故C错误;
D.由结构简式可知,分子中含有酯环和肽键,水解生成两种有机物,故D正确.
故选D.点评:
本题考点: 有机物的结构和性质.
考点点评: 本题考查学生有关官能团决定性质的知识与空间结构等,要求学生熟记官能团具有的性质,本题易错点为D,注意把握官能团的性质,根据官能团判断有机物的性质,难度不大.1年前查看全部
- 有机物A是一种广谱高效食品防腐剂,如图1所示是A分子的球棍模型.回答下列问题:
有机物A是一种广谱高效食品防腐剂,如图1所示是A分子的球棍模型.回答下列问题:

(1)写出A的分子式:______;
(2)A能够发生反应的类型有(填序号):______;
①氧化反应 ②加成反应 ③取代反应 ④消去反应
(3)如图2所示一些中草药中所含的有机物:
其中互为同分异构体的是(填序号)______;能与溴水反应的是(填序号)______. 王狮虎1年前1
王狮虎1年前1 -
 lightningx 共回答了18个问题
lightningx 共回答了18个问题 |采纳率94.4%解题思路:由球棍模型可知结构简式为HO-C6H4-COOCH2CH3,分子中含有酚羟基,可发生取代、氧化反应,含有酯基,可发生水解反应,以此解答.(1)由球棍模型可知结构简式为HO-C6H4-COOCH2CH3,分子式为C9H10O3,故答案为:C9H10O3;
(2)含有酚羟基,可发生取代、氧化反应,含有酯基,可发生水解反应,水解反应属于取代反应,但不能发生消去反应,故答案为:①②③;
(3)由图可知,②④的分子式相同,但结构不同,二者互为同分异构体,①②④中含碳碳双键,能与溴水发生加成反应,故答案为:②④;①②④.点评:
本题考点: 有机物的结构和性质;有机物分子中的官能团及其结构.
考点点评: 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力及烯烃、酚、酯性质的考查,注意把握有机物的官能团的性质和有机物的结构特点,为解答该题的关键,难度不大.1年前查看全部
- 二氧化氯是—种高效,广谱,安全的杀菌、消毒剂
 jilimi1231年前1
jilimi1231年前1 -
 yybbhh888 共回答了9个问题
yybbhh888 共回答了9个问题 |采纳率33.3%对没错1年前查看全部
- (2013•上海模拟)用Cl2消毒饮用水已有百年历史,近年发现这种方法可能对人体有害.世界环保联盟推荐采用广谱高效消毒剂
(2013•上海模拟)用Cl2消毒饮用水已有百年历史,近年发现这种方法可能对人体有害.世界环保联盟推荐采用广谱高效消毒剂
ClO2.ClO2是黄绿色易爆物,沸点9.90℃.制备ClO2的方法之一表述为:
[______]KClO3+[______]HCl(浓)→[______]KCl+[______]ClO2↑+[______]Cl2↑+______
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)
(2)盐酸在反应中显示出来的性质是______(填写编号,多选倒扣).
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子的物质的量为______mol.
(4)与传统消毒剂Cl2比较,ClO2消毒的效率(以单位质量得到的电子数表示)是Cl2的______倍. 荆州鱼糕1年前1
荆州鱼糕1年前1 -
 爱上红酒的妩媚 共回答了15个问题
爱上红酒的妩媚 共回答了15个问题 |采纳率93.3%解题思路:(1)Cl元素的化合价由+5价降低为+4价,Cl元素由-1价升高为0,结合电子守恒和原子守恒分析;
(2)生成KCl体现酸性,生成氯气时Cl元素的化合价升高;
(3)由反应可知,1个Cl得到电子与1个Cl失去电子数目相同,结合Cl元素的化合价升高计算转移电子数;
(4)ClO2消毒的效率(以单位质量得到的电子数表示)是Cl2的
=2.63倍.
×5m 67.5
×2×1m 71 (1)Cl元素的化合价由+5价降低为+4价,Cl元素由-1价升高为0,由电子守恒和原子守恒可知,反应为2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O,
故答案为:2;4;2;2;1;2;H2O;
(2)生成KCl体现酸性,生成氯气时Cl元素的化合价升高体现其还原性,则体现盐酸的酸性和还原性,故答案为:B;
(3)由Cl元素的化合价升高可知产生0.1mol Cl2,则转移的电子的物质的量为0.1mol×2×(1-0)=0.2mol,故答案为:0.2;
(4)ClO2消毒的效率(以单位质量得到的电子数表示)是Cl2的
m
67.5×5
m
71×2×1=2.63倍,故答案为:2.63.点评:
本题考点: 氧化还原反应的电子转移数目计算;氧化还原反应;氧化还原反应方程式的配平.
考点点评: 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意分析习题中的信息及知识迁移应用,题目难度不大.1年前查看全部
- 二氧化氯(ClO 2 )是一种高效、广谱、安全的杀菌、消毒剂。
二氧化氯(ClO 2 )是一种高效、广谱、安全的杀菌、消毒剂。
(1)氯化钠电解法是一种可靠的工业生产ClO 2 方法。
①用于电解的食盐水需先除去其中的Ca 2+ 、Mg 2+ 、SO 4 2- 等杂质。其次除杂操作时,往粗盐水中先加入过量的________(填化学式),至沉淀不再产生后,再加入过量的Na 2 CO 3 和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO 4 2- ,其原因是___________【已知:Ksp(BaSO 4 )= 1.1 ×10 -10 Ksp(BaCO 3 )= 5.1 ×10 -9 】
②该法工艺原理如右。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO 3 )与盐酸反应生成ClO 2 。
工艺中可以利用的单质有____________(填化学式),发生器中生成ClO 2 的化学方程式为___________。
(2)纤维素还原法制ClO 2 是一种新方法,其原理是:纤维素水解得到的最终产物D与NaClO 3 反应生成ClO 2 。完成反应的化学方程式:
□ (D) +24NaClO 3 +12H 2 SO 4 =□ClO 2 ↑+□CO 2 ↑+18H 2 O+□_________
(3)ClO 2 和Cl 2 均能将电镀废水中的CN - 氧化为无毒的物质,自身被还原为Cl - 。处理含CN - 相同量得电镀废水,所需Cl 2 的物质的量是ClO 2 的_______倍 ykdict1年前1
ykdict1年前1 -
 zgl0117 共回答了17个问题
zgl0117 共回答了17个问题 |采纳率100%(1)①BaCl 2
BaSO 4 和BaCO 3 的 K sp 相差不大,当溶液中存在大量CO 3 2 - 时,BaSO 4 (s)会部分转化为BaCO 3 (s)(或其它合理答案)
②H 2 、Cl 2
2NaClO 3 + 4HCl 2ClO 2 ↑ + Cl 2 ↑ + 2NaCl + 2H 2 O
2ClO 2 ↑ + Cl 2 ↑ + 2NaCl + 2H 2 O
(2)1 C 6 H 12 O 6 + 24 NaClO 3 + 12H 2 SO 4 24 ClO 2 ↑ + 6 CO 2 ↑ + 18H 2 O + 12 Na 2 SO 4
24 ClO 2 ↑ + 6 CO 2 ↑ + 18H 2 O + 12 Na 2 SO 4
(3)2.5
(1)①在除杂的过程中每步加入的试剂必须是过量的,使离子除尽;过量的离子在下一步中必须出去,故先加入BaCl 2 ,除去硫酸根,过量的钡离子,加入Na 2 CO 3 除去。根据提供的Ksp数据,在后面加入碳酸钠时,发生BaSO 4 (s)+ CO 3 2- (aq)= BaCO 3 (s)+SO 4 2- (aq)。②电解饱和食盐水生成H 2 、Cl 2 和NaOH;故可以利用的单质为H 2 、Cl 2 ,合成HCl。根据流程图可知加入物质为NaClO 3 和HCl,生成ClO 2 ;可以写出方程式,并用化合价升降法配平得到。
(2)纤维素为多糖,水解最终产物为葡萄糖(C 6 H 12 O 6 ),具有还原性,可将NaClO 3 还原得到ClO 2 。Cl从+5到+4价,降低1价,葡萄糖(C 6 H 12 O 6 )C均价为0,到+4价,升高4价,然后配平得到。
(3)每摩尔Cl 2 得到2mol电子,而没摩尔ClO 2 得到5mol电子,故为2.5倍。
【考点定位】考查化学工艺流程,涉及氧化还原反应相关概念、配平及计算,化学实验基本方法(除杂)等相关知识。1年前查看全部
- 氟卡尼是新型、广谱、高效抗心律失常药,用于多种心律失常的防治。结构为: ,它可由龙胆酸( ,为原料合成,合成的方法如下图
氟卡尼是新型、广谱、高效抗心律失常药,用于多种心律失常的防治。结构为:
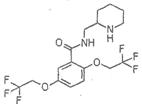 ,它可由龙胆酸(
,它可由龙胆酸( ,为原料合成,合成的方法如下图:
,为原料合成,合成的方法如下图: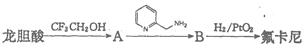
回答以下向题:
(1)写出一种龙胆酸中含有的含氧官能团名称______________;
(2)A的结构简式是____________________________________;
(3)A→B的反应类型是______________;
(4)龙胆酸与甲醇反应生成龙胆酸甲酯,其化学方程式是______________;
(5)满足下列条件的龙胆酸甲酯的同分异构体共有_______种:
①苯环上有3个取代基,其中2个为羟基;②苯环上只有两类氢;③属于酯类。 帘掩映1年前1
帘掩映1年前1 -
 永远完治03 共回答了20个问题
永远完治03 共回答了20个问题 |采纳率90%1年前查看全部
- (2014?南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的
(2014?南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的
 (2014?南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
(2014?南昌模拟)ClO2为一种黄绿色气体,是目前国际上公认的高效,广谱,快速安全的杀菌剂.制备ClO2的新工艺是电解法.
(1)如图表示用石墨作电极,在一定条件下电解饱和食盐水制取ClO2,写出阳极ClO2产生的电极方程式:______;图中b电极为______;(填“阳极”或“阴极”)
(2)电解一段时间,当阴极产生标准状况下气体112ml时,停止电解,则通过阳离子交换膜的阳离子物质的量为______mol,阴极区pH______(填“变大”、“变小”或“不变”)
(3)ClO2对污水中Fe2+,Mn2+,S2-,CN-等有明显去除效果,某工厂中污水含CN-(a mg/L),现将ClO2把CN-氧化成两种无毒气体,写出该反应的离子方程式:______.
 海蓝蓝ok1年前1
海蓝蓝ok1年前1 -
 梅花之恋 共回答了18个问题
梅花之恋 共回答了18个问题 |采纳率88.9%(1)由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
从图上可见,阳离子移向阴极,所以b为阴极,故答案为:Cl--5e-+2H2O=ClO2↑+4H+;阴极;
(2)在阴极发生2H++2e-=H2↑,氢气的物质的量为[V
Vm=
0.112L/22.4L/mol]=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O?OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;pH变大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-.1年前查看全部
- (2010•江苏一模)开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势.
 (2010•江苏一模)开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势.
(2010•江苏一模)开发具有广谱、高效、低毒的杀菌、消毒剂是今后发展的趋势.
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为 1mol O2和1mol H2O)等物质常被用作消毒剂.等物质的量的上述物质消毒效率最高的是______.(填序号)
A.Cl2 B.H2O2 C.ClO2 D.O3
(2)氯氨(NH2Cl)可作为杀菌剂,请用化学方程式表示氯氨在水中的杀菌机理:______.
(3)氯溴海因(C5H6BrClN2O2)是一种比较安全的氯气和氯制剂的替代产品,其结构式如右图所示:
氯溴海因在水中的水解过程比较复杂,主要是水解生成次卤酸和海因,请画出海因的结构式:______.
(4)以铂(Pt)和铁为电极,以KOH溶液为电解液,用电解法可制备高铁酸钾(K2FeO4).
写出阳极的电极反应式:______. 风已沉默1年前1
风已沉默1年前1 -
 歇锄 共回答了23个问题
歇锄 共回答了23个问题 |采纳率95.7%解题思路:(1)等物质的量时,获得电子越多,消毒效率越高;
(2)NH2Cl与水反应生成的HClO和NH3,HClO有强氧化性,具备杀菌作用;
(3)氯溴海因在水中水解主要生成次卤酸和海因,即氯溴海因分子中的卤素原子(Cl、Br)被水中的氢原子取代,然后卤素原子与水中的羟基(-OH)结合为HXO;
(4)电解时阳极发生氧化反应,Fe在碱性条件下被氧化为FeO42-.(1)物质的量都为1mol时,Cl2获得2mol电子,H2O2获得2mol电子,ClO2获得5mol电子,O3获得2mol电子,ClO2得到的电子最多,消毒效率最高,
故答案为:C;
(2)NH2Cl与水反应生成的HClO和NH3,反应方程式为NH2Cl+H2O=NH3+HClO,HClO有强氧化性,具备杀菌作用,
故答案为:NH2Cl+H2O=NH3+HClO;
(3)氯溴海因在水中水解主要生成次卤酸和海因,即氯溴海因分子中的卤素原子(Cl、Br)被水中的氢原子取代,然后卤素原子与水中的羟基(-OH)结合为HXO,故海因的结构式为 ,故答案为:
,故答案为: ;
;
(4)电解时阳极发生氧化反应,Fe在碱性条件下被氧化为FeO42-,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O.点评:
本题考点: 氧化还原反应的计算;电解原理;有机物分子中的官能团及其结构.
考点点评: 本题考查氧化还原反应、有机物的性质、电化学的知识等,难度中等,(2)为易错点,注意结合氯氨(NH2Cl)可作为杀菌剂,确定发生水解反应有HClO生成.1年前查看全部
- 二氧化氯(ClO 2 )已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂,二氧化氯的制取可通过下列反应完成:2Na
二氧化氯(ClO 2 )已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂,二氧化氯的制取可通过下列反应完成:2NaClO 3 +4HCl(浓)  Cl 2 ↑+2ClO 2 ↑+2NaCl+2X。则X的化学式为
Cl 2 ↑+2ClO 2 ↑+2NaCl+2X。则X的化学式为[ ]
A.O 2
B.H 2 O
C.H 2
D.NaClO 桑宜9991年前1
桑宜9991年前1 -
 sxzycxxcxq 共回答了12个问题
sxzycxxcxq 共回答了12个问题 |采纳率100%B1年前查看全部
- (2010•徐汇区二模)二溴海因(化学式为:C5H6O2N2Br2)是一种广谱高效、低残留的新型环境消毒剂,关于
(2010•徐汇区二模)二溴海因(化学式为:C5H6O2N2Br2)是一种广谱高效、低残留的新型环境消毒剂,关于 二溴海因说法正确的是( )
A.二溴海因的摩尔质量为286g
B.1摩尔二溴海因中含6.02×1023个N2分子
C.二溴海因中氧元素1摩尔二溴海因中含的质量分数小于氮元素的质量分数
D.1摩尔二溴海因中C、H、O、N、Br原子个数比为5:6:2:2:2 跳舞小鱼儿1年前1
跳舞小鱼儿1年前1 -
 张一丹 共回答了19个问题
张一丹 共回答了19个问题 |采纳率89.5%解题思路:A、根据摩尔质量的概念和单位分析;
B、科学上把含有6.02×10^23个微粒的集体作为一个单位,叫摩尔;
C、根据元素的质量分数的计算方法结合化学式进行分析;
D、根据元素的个数比(原子右下角的数字表示分子中该原子的数目)的计算方法分析.A、摩尔质量的单位为g/mol,不是g,故A不适合;
B、1摩尔二溴海因中含6.02×1023个二溴海因分子,含有2×6.02×1023个N2原子.故B不适合;
C、因为氧原子的相对原子质量大于氮原子的相对原子质量,在一个二溴海因中都是2个,故1摩尔二溴海因中含氧元素的质量分数大于氮元素的质量分数.故C不适合;
D、1摩尔二溴海因中C、H、O、N、Br原子个数比为5:6:2:2:2.故D适合.
故选D.点评:
本题考点: 元素的质量分数计算;化学式的书写及意义.
考点点评: 本题涉及到摩尔质量的概念和计算,有一定难度.学生需了解和掌握摩尔质量的概念和有关计算方法,才能正确解答.1年前查看全部
- 有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答问题:
有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答问题:

(1)①A的分子式: 。
②A不能够发生反应的类型有____ __。(选填编号)
(2)写出A与足量烧碱溶液反应的化学方程式:________。A.氧化反应 B.加成反应 C.取代反应 D.消去反应
(3)下列是一些中草药中所含的有机物:
其中互为同分异构体的是(选填编号)___ ___;桂皮酸的一种同分异构体为 ,它与HBr气体1:1加成的产物可能有_________种。
,它与HBr气体1:1加成的产物可能有_________种。
(4)A的另一种同分异构体C遇FeCl 3 溶液显紫色;1 mol C可与 1 mol NaOH 反应生成有机物D;D被Ag(NH 3 ) 2 OH溶液氧化后经酸化得有机物E,E经取代、消去两步反应可得香豆素。写出符合上述要求的二种C的结构简式:____________、 。 爱的划痕1年前1
爱的划痕1年前1 -
 wswyxs 共回答了18个问题
wswyxs 共回答了18个问题 |采纳率83.3%1年前查看全部
- (2011•徐州模拟)用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物.
(2011•徐州模拟)用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物.
(1)工业上,ClO2常用NaClO3和Na2SO3溶液混合并加硫酸酸化后反应制得,在该反应中NaClO3和Na2SO3的物质的量之比为______.
(2)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示.则ClO2的有效氯含量是______.
(3)化学小组的同学欲对用ClO2消毒过的自来水进行氯元素含量的测定(假定ClO2全部转化为Cl-),他们进行了如下实验:向30.00mL水样中加几滴K2CrO4溶液作指示剂,用0.001000mol•L-1 AgNO3溶液滴定,当有砖红色Ag2CrO4沉淀出现时,达滴定终点,此时用去AgNO3溶液12.12mL.
①水样中Cl-的物质的量浓度是______.
②已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12.如在滴定终点时,测得溶液中CrO42-的浓度是5.000×10-3mol•L-1.试计算此时溶液中Cl-的浓度是多少. vincen_211年前1
vincen_211年前1 -
 DW任我行 共回答了19个问题
DW任我行 共回答了19个问题 |采纳率100%解题思路:(1)发生2NaClO3+Na2SO3+H2SO4═2ClO2↑+2Na2SO4+H2O;
(2)由Cl2 +2HI=I2+2HCl、2ClO2+10HI=2HCl+5I2+4H2O,结合从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比计算;
(3)①由利用Ag++Cl-=AgCl↓计算水样中Cl-的物质的量及其浓度;
②当有砖红色Ag2CrO4沉淀出现时,达滴定终点,利用Ksp(Ag2CrO4)计算c(Ag+),再利用Ksp(AgCl)计算此时溶液中Cl-的浓度.(1)由信息可知,发生2NaClO3+Na2SO3+H2SO4═2ClO2↑+2Na2SO4+H2O,则反应中NaClO3和Na2SO3的物质的量之比为2:1,故答案为:2:1;
(2)由Cl2 +2HI=I2+2HCl、2ClO2+10HI=2HCl+5I2+4H2O可知,均生成5molI2时需要氯气、二氧化氯的物质的量比为5:2,所以ClO2的有效氯含量为[5×71/2×67.5]×100%=263%(或2.63),故答案为:263%(或2.63);
(3)①由Ag++Cl-=AgCl↓可知,n(Cl-)=12.12×0.001L×0.001000mol•L-1=12.12×10-6mol,所以水样中c(Cl-)=
12.12×10−6mol
30×10−3L=4.04×10-4 mol•L-1,
故答案为:4.04×10-4 mol•L-1;
②当c(CrO42-)=5.00×10-3 mol•L-1出现砖红色沉淀时,由Ksp(Ag2CrO4)和 c(CrO42-)=5.00×10-3,得c(Ag+)=
2.00×10−12
5.000×10−3=2.00×10-5 mol•L-1,
所以c(Cl-)=
1.79×10−10
2.00×10−5=8.90×10-6 mol•L-1,答:此时溶液中Cl-的浓度是8.90×10-6 mol•L-1.点评:
本题考点: 氯、溴、碘及其化合物的综合应用;难溶电解质的溶解平衡及沉淀转化的本质.
考点点评: 本题考查氧化还原反应及溶度积的计算,把握习题中的信息及发生的氧化还原反应、Ksp的计算为解答的关键,(2)为解答的难点,侧重学生分析能力及计算能力的考查,题目难度中等.1年前查看全部
- 作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处
作为世界卫生组织(WHO)推荐的A1级广谱、安全、高效消毒剂,二氧化氯(ClO2)在水处
理领域有着广泛应用.与氯气相比,它不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物.
(1)反应时,ClO2生成ClO2—、Cl—的转化率与溶液的pH的关系如图所示.则pH= 8时,ClO2被还原为_____________.
那ph=8时不是也没有ClO2-吗?
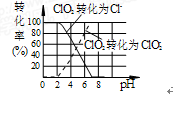
 米米04231年前1
米米04231年前1 -
 mackenzo 共回答了19个问题
mackenzo 共回答了19个问题 |采纳率100%CLO2- 转化率图像显示pH= 8时溶液中无CL- 只转出CLO2-1年前查看全部
- 预防非典型肺炎要经常杀菌消毒.过氧乙酸(化学学式为CH3COOOH)是一种广谱、高效杀菌消毒剂,对预防非典型肺炎有很好作
预防非典型肺炎要经常杀菌消毒.过氧乙酸(化学学式为CH3COOOH)是一种广谱、高效杀菌消毒剂,对预防非典型肺炎有很好作用.下列说法不正确的是( )
A.过氧乙酸分子是碳、氢、氧三种原子构成
B.过氧乙酸的相对分子质量为76
C.过氧乙酸中碳氢氧元素的质量比是6:1:12
D.过氧乙酸是由2个碳元素,4个氢元素和3个氧元素组成的 djswxq1年前1
djswxq1年前1 -
 跌倒了 共回答了20个问题
跌倒了 共回答了20个问题 |采纳率75%解题思路:A.根据物质的分子结构来分析;B.根据相对分子质量的计算方法来分析;C.根据化合物中各元素质量比的计算方法来分析;D.根据元素的规定来分析.A.由过氧乙酸的化学式CH3COOOH可知,过氧乙酸分子是由碳、氢、氧原子构成的,故正确;
B.过氧乙酸的相对分子质量为12×2+1×4+16×3=76,故正确;
C.过氧乙酸中碳、氢、氧三种元素的质量比(12×2):(1×4):(16×3)=6:1:12,故正确;
D.元素是个宏观概念,只讲种类,不讲个数,故错误.
故选D.点评:
本题考点: 化学式的书写及意义;相对分子质量的概念及其计算;元素质量比的计算.
考点点评: 本题难度不大,考查同学们结合新信息、灵活运用化学式的有关计算进行分析问题、解决问题的能力.1年前查看全部
- (2014•宿迁模拟)草甘膦是一种广谱除草剂,其除草机制是抑制植物体内EPSPS酶的合成,最终导致植物死亡.但是,它的使
(2014•宿迁模拟)草甘膦是一种广谱除草剂,其除草机制是抑制植物体内EPSPS酶的合成,最终导致植物死亡.但是,它的使用有时也会影响到植物的正常生长.目前,已发现可以从一种抗草甘膦的大肠杆菌突变株中分离出EPSPS基因,若将该基因转入植物细胞内,从而获得的转基因植物就能耐受高浓度的草甘膦.
取6株植物,其中,植物A和D对草甘膦敏感,B和E对草甘膦天然具有抗性,C和F则经过了转基因处理,但是否成功还未知.表为4种限制酶的识别序列和酶切位点,图1为含有目的基因的DNA片段及其具有的限制酶切点.据图回答下列问题:
(1)若A-C浇清水,D-F浇的水中含有草甘膦,上述植物中,肯定能健康成长的是______.限制酶 MspⅠ BamHⅠ MboⅠ SmaⅠ 酶切
位点C↓CGG
GGC↑CG↓GATCC
CCTAG↑G↓GATC
CTAG↑CCC↓GGG
GGG↑CCC
(2)一个完整的基因表达载体除了目的基因、复制原点、启动子和终止子外,还应包括______.若需利用酶切法获得目的基因,最应选择的限制酶是______和______.
(3)假设EPSPS基因已被成功转移到植物F中,但植物F仍没有表现出抗性,分析可能的原因______.
(4)图2甲是某目的基因(4.0kb,1kb=1000对碱基)与大肠杆菌pUC18质粒(2.7kb)重组的示意图.图2中Ap′是抗氨苄青霉素基因,lacZ是显色基因,其上的EcoRI识别位点位于目的基因插入位点的右侧,其控制合成的物质能使菌落呈现蓝色.(图2乙中深色圆点即为蓝色菌落)
①图乙的培养基中含有氨苄青霉素,请判断图乙中所出现的白色和蓝色两种菌落中,何种会含有重组质粒.
______.
②现用EcoRI酶切重组成功的质粒(重组质粒上目的基因的插入位点与EcoRI的识别位点之间的碱基对忽略不计),酶切后进行电泳观察,会出现长度为______kb的片段. 我只tt自己1年前1
我只tt自己1年前1 -
 szjt 共回答了23个问题
szjt 共回答了23个问题 |采纳率82.6%解题思路:根据题意分析可知:植物A和D对草甘膦敏感,B和E对草甘膦天然具有抗性,C和F则经过了转基因处理,所以A-C浇清水,都能健康成长.F虽经过了转基因处理,但是否成功还未知,所以D-F浇的水中含有草甘膦,D肯定不能健康成长,E肯定能健康成长,F未知.
一种限制酶能够识别双链DNA分子的某种特定核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断裂.(1)根据题意分析可知:植物A和D对草甘膦敏感,B和E对草甘膦天然具有抗性,C和F则经过了转基因处理,所以A-C浇清水,都能健康成长.F虽经过了转基因处理,但是否成功还未知,所以D-F浇的水中含有草甘膦,D肯定不能健康成长,E肯定能健康成长,F未知.因此肯定能健康成长的是ABCE.
(2)一个完整的基因表达载体包括目的基因、复制原点、启动子、终止子和标记基因;根据图1可知,如果用MboⅠ酶进行切割,将会将BamHⅠ酶处的片段进行切割,因此只能选择限制酶MspⅠ和SmaⅠ切割目的基因.
(3)假设EPSPS基因已被成功转移到植物F中,说明F中已含有EPSPS基因,如果仍没有表现出抗性,则说明EPSPS基因在受体细胞中没有表达或表达的酶没有活性.
(4)①白色,因为EcoRI将lacZ显色基因破坏了.
②目的基因被酶切后形成两个片段:1.0kb和3.0kb;质粒被酶切后长度不变:2.7kb.故质粒只能和目的基因片段之一发生重组,如果成功的话将会出现两种情况:3kb和3.7kb或1.0kb和5.7kb.
故答案为:
(1)ABCE
(2)标记基因 MspⅠSmaⅠ
(3)目的基因没有成功表达或表达的产物失活
(4)①白色菌落②3、3.7或1、5.7点评:
本题考点: 基因工程的原理及技术.
考点点评: 本题重点考查基因工程的有关知识,要求掌握基因工程的操作步骤及在生产实践中的运用;能够对基因工程中DNA片段的长短进行简单的计算,难度适中.1年前查看全部
- (2012•泉州模拟)过氧乙酸是一种高效广谱杀菌剂.水灾过后,为预防灾区发生瘟疫,常用0.2%的过氧乙酸溶液进行环境的表
(2012•泉州模拟)过氧乙酸是一种高效广谱杀菌剂.水灾过后,为预防灾区发生瘟疫,常用0.2%的过氧乙酸溶液进行环境的表面消毒.对于20%的过氧乙酸溶液8Kg,请计算:
(1)含溶质过氧乙酸多少千克?
(2)可稀释成0.2%的过氧乙酸溶液多少千克? 乐乐永远1年前1
乐乐永远1年前1 -
 kaiven909 共回答了19个问题
kaiven909 共回答了19个问题 |采纳率84.2%解题思路:(1)根据溶质的质量分数不变进行计算
(2)运用稀释前后溶液中溶质的质量不变再结合溶质质量分数的公式解答(1)溶质过氧乙酸的质量为:8kg×20%=1.6kg
(2)稀释前后溶液中溶质的质量不变,所以在此基础上列等式解答.
设可稀释成0.2%的过氧乙酸溶液的质量为x
0.2%x=1.6kg
x=800kg
答:(1)含溶质过氧乙酸1.6kg
(2)可稀释成0.2%的过氧乙酸溶液800kg点评:
本题考点: 有关溶质质量分数的简单计算;用水稀释改变浓度的方法.
考点点评: 溶液中溶质的质量分数的计算题目,是计算性的题型,计算能力要求比较高.1年前查看全部
- 大蒜有增味、杀菌等作用,被誉为“天然广谱抗菌素.”大蒜中的两种有效成分大蒜辣素和蒜氨酸的相关资料如下表所示:
大蒜有增味、杀菌等作用,被誉为“天然广谱抗菌素.”大蒜中的两种有效成分大蒜辣素和蒜氨酸的相关资料如下表所示:
成 分 性 质
大蒜辣素 C6HloS20 无色油状液体,有臭味,难溶于水
蒜氮酸 C6HloNOaS 无色针状晶体,元气味,易溶于水
(1)大蒜辣素的相对分子质量为————,蒜氨酸中碳、氢元素的质量比为————.
(2)表格中提供的是大蒜辣素和蒜氨酸的 ———— 性质(填“物理”或“化学”),从宏观和微观角度分析它们属于不同物质的原因 ——————. wa4979450521年前1
wa4979450521年前1 -
 flying2488 共回答了15个问题
flying2488 共回答了15个问题 |采纳率86.7%大蒜辣素的相对分子质量为162.27
蒜氨酸中碳、氢元素的质量比为72:10
物理性质 属于不同物质的原因:元素种类不同 原子个数不同1年前查看全部
- 1工业上用NACLO3和NA2SO3溶液混合H2SO4酸化后制得广谱消毒剂,NACLO3和NA2SO3物质的量比为2:1
1工业上用NACLO3和NA2SO3溶液混合H2SO4酸化后制得广谱消毒剂,NACLO3和NA2SO3物质的量比为2:1,该消毒剂化学式为( ) (怎么用得失电子看啊?)
2向1L 0.5mol/L H2SO4 中加10.1gKNO3和12.8gCu ,充分反应后气体在标况下体积为( )
3 .Cl2在70摄氏度的NAOH水溶液里,能同时发生两个自身氧化还原反应,反应完全后测得溶液中NACLO与NACLO3的物质的量比为4:1,则溶液中NACL与NACLO的物质的量比为( )
A 11:2 B 1:1 C 9:4 D 5:1
4.已知在热的碱性溶液中,NACLO发生如下反应,3NACLO===2NaCl +NaClO3,在相同条件下NaClO2也能发生类似反应,其最终产物为
A NaCl NaClO B NACL NACLO3
C NaCLO NAClO3 D NACLO3 NACLO 446719701年前1
446719701年前1 -
 ayaya1001 共回答了14个问题
ayaya1001 共回答了14个问题 |采纳率85.7%1、氯酸钠和亚硫酸钠的物质的量之比为2:1,亚硫酸钠一般发挥还原性,1mol得2mol电子,那么每摩尔的氯酸钠得1mol电子,也就是说氯变为+4价,应该是ClO2
2、相当于0.1mol硝酸和0.2mol铜,44.8ml
3、C由于4mol次氯酸钠和1mol氯酸钠失电子一共是9mol.所以氯化钠得电子也应该是9mol
4、B生成的+1价的产物还会按照给的那个反应继续向下反应,直到最高和最低价态1年前查看全部
- 春季是传染病菌繁衍流行的季节,必须做好预防.二氧化氯(C1O2)已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂.
春季是传染病菌繁衍流行的季节,必须做好预防.二氧化氯(C1O2)已被世界卫生组织确认为一种安全、高效、广谱的强力杀菌剂.制取二氧化氯的反应是:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2C1O2+2X
(1)X的化学式是______.
(2)Cl2和二氧化氯两种分子中所含氯原子的个数比为______.
(3)135g二氧化氯中含氧元素的质量是______g. roadrunner5211年前1
roadrunner5211年前1 -
 柴火煮饭 共回答了25个问题
柴火煮饭 共回答了25个问题 |采纳率88%解题思路:(1)根据质量守恒定律反应前后原子的种类及数目不变,由2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2C1O2+2X,推断X的化学式;
(2)根据化学式的意义分析计算;
(3)根据化学式进行计算135g二氧化氯中含氧元素的质量.(1)由反应的化学方程式2NaClO3+4HCl═2ClO2↑+Cl2↑+2X+2NaCl可知:反应前有钠、氯、氧、氢原子的数目分别是:2、6、6、4.反应后有钠、氯、氧原子2、6、4.由质量守恒定律化学变化前后原子的种类、数目不变,生成物X的2个分子中含有2个O原子和4个H原子,则每个X分子由2个H原子和1个O原子构成,则物质X的化学式为H2O;
(2)由化学式的意义可知,Cl2和二氧化氯两种分子中所含氯原子的个数比为2:1;
(3)135g二氧化氯中含氧元素的质量是:135g×[32/67.5]×100%=64g
故答为:(1)H2O;(2)2:1;(3)64.点评:
本题考点: 质量守恒定律及其应用;化合物中某元素的质量计算.
考点点评: 本题主要考查了根据质量守恒定律推断物质的化学式及根据化学式的计算,难度不大.会根据化学式的意义机型有关的分析、计算等.1年前查看全部
- 二氧化氯(ClO 2 )是联合国世界卫生组织确认的一种安全、高效、广谱、强力杀菌剂.二氧化氯常温下是橘红色气体,有窒息性
二氧化氯(ClO 2 )是联合国世界卫生组织确认的一种安全、高效、广谱、强力杀菌剂.二氧化氯常温下是橘红色气体,有窒息性臭味,二氧化氯气体易溶于水,形成黄绿色的溶液,一般采用向上排空气法来收集二氧化氯.它是一种有强氧化性的物质,其杀菌能力是氯气的5倍,能与很多物质能发生剧烈反应,如能与镁反应生成亚氯酸镁【Mg(C10 2 ) 2 】.根据上述信息,请回答:
(1)二氧化氯的物理性质有______;
(2)二氧化氯的化学性质有______;
(3)写出镁与二氧化氯反应的化学方程式______,生成物中氯元素的化合价为______. 竟陵王子1年前1
竟陵王子1年前1 -
 lmokch 共回答了18个问题
lmokch 共回答了18个问题 |采纳率88.9%(1)二氧化氯的物理性质有:常温下二氧化氯是橘红色气体,有窒息性臭味,易溶于水,密度比空气大.
(2)二氧化氯的化学性质有:有强氧化性,能与镁发生化学反应.
(3)镁与二氧化氯反应的化学方程式为:Mg+2ClO 2 =Mg(ClO 2 ) 2
在Mg(ClO 2 ) 2 中,镁元素的化合价是+2价,氧元素的化合价是-2价,
设氯元素的化合价为X,根据化合物中元素化合价代数和为零有:
(+2)+2X+(-2)×4=0.
解得:X=+3.
氯元素的化合价是+3价.1年前查看全部
- 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl.
①浓盐酸在反应中显示出来的性质是______(填序号).
A.只有还原性B.还原性和酸性C.只有氧化性D.氧化性和酸性
②若上述反应中产生0.1mol ClO2,则转移电子的物质的量为______mol.
(2)目前已开发出用电解法制取ClO2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2.写出阳极产生ClO2的电极反应式:______.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为______mol;用平衡移动原理解释阴极区pH增大的原因______.
(3)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为______;处理100m3这种污水,至少需要ClO2[50a/13][50a/13]mol. kakaup1年前1
kakaup1年前1 -
 ajiu555 共回答了13个问题
ajiu555 共回答了13个问题 |采纳率92.3%解题思路:(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,存在NaCl中氯元素的化合价未变化,据此解答;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量等于ClO2的物质的量;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子;
②在阴极发生2H++2e-=H2↑,通过阳离子交换膜的阳离子为+1价离子,根据n=
计算氢气的物质的量,根据电子转移守恒计算阳离子的物质的量,电解中H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动;V Vm
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;
根据方程式计算需要ClO2的物质的量.(1)①HCl中的氯元素在产物存在于Cl2,氯元素的化合价升高,氯元素被氧化,HCl起还原剂注意,同时存在NaCl中氯元素的化合价未变化,故HCl还起酸的作用,故答案为:B;
②ClO2是还原产物,氯元素的化合价由+5价降低为+4价,转移电子物质的量为0.1mol×(5-4)=0.1mol,
故答案为:0.1mol;
(2)①由题意可知,氯离子放电生成ClO2,由元素守恒可知,有水参加反应,同时生成氢离子,电极反应式为:Cl--5e-+2H2O=ClO2↑+4H+,
故答案为:Cl--5e-+2H2O=ClO2↑+4H+;
②在阴极发生2H++2e-=H2↑,氢气的物质的量为[0.112L/22.4L/mol]=0.005mol,通过阳离子交换膜的阳离子为+1价离子,故交换膜的阳离子的物质的量为0.005mol×2=0.01mol,电解中阴极H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,溶液的pH增大,
故答案为:0.01;在阴极发生2H++2e-=H2↑,H+浓度减小,使得H2O⇌OH-+H+的平衡向右移动,OH-浓度增大,pH增大;
(3)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为[100ag/26g/mol]=[50a/13]mol,由方程式可知,至少需要ClO2的物质的量=[50a/13]mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;[50a/13]mol.点评:
本题考点: 电解原理;氯、溴、碘及其化合物的综合应用.
考点点评: 本题考查氧化还原反应、常用化学用语、电解原理、化学计算等,题目难度中等,电解反应是难点、易错点,是对学生综合能力的考查,需要学生具有扎实的基础与分析解决问题的能力.1年前查看全部
- 蛋白质和糖蛋白有什么区别?百度百科中有这么一段“干扰素(IFN)是一种广谱抗病毒剂,并不直接杀伤或抑制病毒,而主要是通过
蛋白质和糖蛋白有什么区别?
百度百科中有这么一段“干扰素(IFN)是一种广谱抗病毒剂,并不直接杀伤或抑制病毒,而主要是通过细胞表面受体作用使细胞产生抗病毒蛋白,从而抑制乙肝病毒的复制;同时还可增强自然杀伤细胞(NK细胞)、巨噬细胞和T淋巴细胞的活力,从而起到免疫调节作用,并增强抗病毒能力. 干扰素是一组具有多种功能的活性蛋白质(主要是糖蛋白) ,是一种由单核细胞和淋巴细胞产生的细胞因子.它们在同种细胞上具有广谱的抗病毒、影响细胞生长,以及分化、调节免疫功能等多种生物活性.” 既然是蛋白质,又为什么是糖蛋白? cainiao8号1年前1
cainiao8号1年前1 -
 王星钢 共回答了23个问题
王星钢 共回答了23个问题 |采纳率87%就是蛋白质上有多糖 就像细胞表面就有 有识别作用 生物书上说糖蛋白是细胞间交流用的1年前查看全部
- (2013•奉贤区二模)1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效、无刺激性、
(2013•奉贤区二模)1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效、无刺激性、无腐蚀等特点,对禽流感、猪流感等疾病有良好的防治作用.根据上述信息,判断下列说法正确的是( )
A.戊二醛分子式是C5H10O2,符合此分子式的二元醛有4种
B.戊二醛不能在加热条件下和新制的氢氧化铜悬浊液反应
C.戊二醛不能使酸性高锰酸钾溶液褪色
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用 wangtian88481年前1
wangtian88481年前1 -
 zzhh008 共回答了15个问题
zzhh008 共回答了15个问题 |采纳率86.7%解题思路:A、根据结构简式写出其分子式,根据碳链异构确定其含有二元醛的同分异构体个数.
B、一定条件下,醛基和新制氢氧化铜能反应生成砖红色氧化亚铜.
C、醛基能被酸性高锰酸钾溶液氧化.
D、GA溶液有杀菌消毒作用.A、戊二醛分子式为C5H8O2,符合此分子式的二元醛有2种,故A错误.
B、戊二醛含有醛基,所以在加热条件下,戊二醛能和新制氢氧化铜反应生成砖红色沉淀氧化亚铜,故B错误.
C、戊二醛含有醛基,性质较活泼,能被酸性高锰酸钾溶液氧化,所以戊二醛能使酸性高锰酸钾溶液褪色,故C错误.
D、根据题意知,2%的GA溶液具有广谱、高效、无刺激、无腐蚀等特点,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用,所以2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用,故D正确.
故选D.点评:
本题考点: 醛类简介.
考点点评: 本题以戊二醛为载体考查了醛的性质,难度不大,注意醛能被弱氧化剂银氨溶液氧化,所以更能被强氧化剂酸性高锰酸钾氧化.1年前查看全部
- (2012•诏安县质检)被医学界誉为“天然广谱抗菌素”的大蒜,它的辛辣味正是其中的有效成分--大蒜辣素产生的,已知大蒜辣
(2012•诏安县质检)被医学界誉为“天然广谱抗菌素”的大蒜,它的辛辣味正是其中的有效成分--大蒜辣素产生的,已知大蒜辣素的化学式为C6H10S2O,则该物质由______种元素组成,其中碳元素与氧元素的质量比是______,硫元素的质量分数为______.
 只看一二1年前0
只看一二1年前0 -
 共回答了个问题
共回答了个问题 |采纳率
- 有机物A是一种广谱高效食品防腐剂,如图1所示是A分子的球棍模型.
有机物A是一种广谱高效食品防腐剂,如图1所示是A分子的球棍模型.
回答问题:
(1)①A的分子式:______.
②A不能够发生反应的类型有______.(选填编号)
a.氧化反应b.加成反应c.取代反应d.消去反应
(2)写出A与足量烧碱溶液反应的化学方程式:______.
(3)下列是一些中草药中所含的有机物如图2:
其中互为同分异构体的是(选填编号)______;桂皮酸的一种同分异构体为 ,它与HBr气体1:1加成的产物可能有______种.
,它与HBr气体1:1加成的产物可能有______种.
(4)A的另一种同分异构体C遇FeCl3溶液显紫色;1mol C可与 1mol NaOH 反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,E经取代、消去两步反应可得香豆素.写出符合上述要求的二种C的结构简式:______、______. superman1681年前1
superman1681年前1 -
 oo咪21 共回答了16个问题
oo咪21 共回答了16个问题 |采纳率93.8%解题思路:(1)①根据球棍模型和成键情况来确定分子式;
②根据官能团决定性质确定有机物具有的性质;
(2)含有酚羟基、酯基的有机物,可以和氢氧化钠发生中和反应、水解反应,根据实质书写方程式;
(3)根据同分异构体的概念以及有机物和HBr加成的方式以及产物来回答;
(4)C遇FeCl3溶液显紫色,则C中含有酚羟基;1mol C可与1molNaOH 反应生成有机物D,D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,E中有羧基,D中有醛基,C中必然还含有酚羟基,据此性质和结构来回答.(1)①根据物质的球棍模型,知道黑球代表碳原子,大白球代表氧原子,小白球代表氢原子,根据成键情况得到分子式为:C9H10O3,故答案为:C9H10O3;
②该有机物中含有酚羟基、酯基、苯环,能发生氧化反应、取代反应、加成反应,不能发生消去反应,故答案为:d;
(2)该有机物中含有酚羟基、酯基,可以和氢氧化钠发生中和反应、水解反应,即 ,
,
故答案为: ;
;
(3)根据同分异构体的概念:②④分子式相同,但是结构不同,属于同分异构体,桂皮酸的同分异构体 ,和HBr气体1:1加成时,环上的加成存在1、2加成(2种产物)1、4加成(2种产物)3、4加成(2种产物),碳碳三键存在两种加成产物,它的加成的产物共8种,故答案为:②④;8;
,和HBr气体1:1加成时,环上的加成存在1、2加成(2种产物)1、4加成(2种产物)3、4加成(2种产物),碳碳三键存在两种加成产物,它的加成的产物共8种,故答案为:②④;8;
(4)A的另一种同分异构体C遇FeCl3溶液显紫色,则其中含有酚羟基;1mol C可与 1mol NaOH 反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E即为羧酸,D中含有醛基,E经取代、消去两步反应可得香豆素,符合条件的A的同分异构体为:
,故答案为: ;
; .
.点评:
本题考点: 有机物分子中的官能团及其结构;同分异构现象和同分异构体.
考点点评: 本题综合考查学生有机物的结构、性质、基本概念等知识,注意知识的整合和梳理是关键,难度中等.1年前查看全部
- 回答下列关于基因工程的问题.草甘膦是一种广谱除草剂,其除草机制是抑制植物体内EPSPS酶的合成,最终导致植物死亡.但是,
回答下列关于基因工程的问题.
草甘膦是一种广谱除草剂,其除草机制是抑制植物体内EPSPS酶的合成,最终导致植物死亡.但是,它的使用有时也会影响到植物的正常生长.目前,已发现可以从一种抗草甘膦的大肠杆菌突变株中分离出EPSPS基因,若将该基因转入植物细胞内,从而获得的转基因植物就能耐受高浓度的草甘膦.
下图A-F表示6株植物,其中,植物A和D对草甘膦敏感,B和E对草甘膦天然具有抗性,C和F则经过了转基因处理,但是否成功还未知.图1和2分别表示两段DNA序列.表格中1-4分别表示4种限制性核酸内切酶的酶切位点.据图回答下列问题: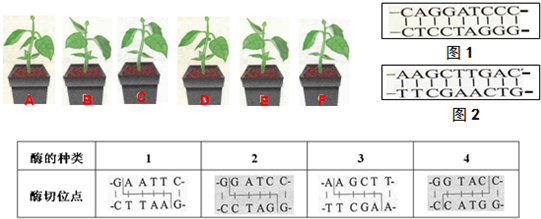
(1)若A-C浇清水,D-F浇的水中含有草甘膦,上述植物中,肯定能健康成长的是______.
(2)若要从大肠杆菌中筛选出含EPSPS基因的突变菌株甲,在大肠杆菌培养基中还必须加入______.
(3)假设位于EPSPS基因两侧的DNA序列均如图I所示,则应选择表中酶______进行酶切;若位于EPSPS基因两侧的DNA序列分别如图I和II所示,则应选择表中酶______进行酶切.
(4)假设大肠杆菌突变菌株甲中EPSPS基因的右侧序列如图II所示,请在方框内画出经酶切后产生的两个末端的碱基序列.
(5)假设EPSPS基因已被成功转移到植物F中,但植物F仍没有表现出抗性,分析可能的原因______.
下图甲是某目的基因(4.0kb,1kb=1000对碱基)与大肠杆菌pUC18质粒(2.7kb)重组的示意图.图中Ap′是抗氨苄青霉素基因,lacZ是显色基因,其上的EcoRI识别位点位于目的基因插入位点的右侧,其控制合成的物质能使菌落呈现蓝色.(图乙中深色圆点即为蓝色菌落)
(6)图乙的培养基中含有氨苄青霉素,请判断图乙中所出现的白色和蓝色两种菌落中,何种会含有重组质粒.______.
(7)现用EcoRI酶切质粒,酶切后进行电泳观察,若出现长度为______kb和______kb的片段,则可以判断该质粒已与目的基因重组成功.(重组质粒上目的基因的插入位点与EcoRI的识别位点之间的碱基对忽略不计) 玉笛yudi1年前1
玉笛yudi1年前1 -
 吾日三省吾身 共回答了23个问题
吾日三省吾身 共回答了23个问题 |采纳率100%解题思路:根据题意分析可知:植物A和D对草甘膦敏感,B和E对草甘膦天然具有抗性,C和F则经过了转基因处理,所以A-C浇清水,都能健康成长.F虽经过了转基因处理,但是否成功还未知,所以D-F浇的水中含有草甘膦,D肯定不能健康成长,E肯定能健康成长,F未知.
一种限制酶能够识别双链DNA分子的某种特定核苷酸序列,并且使每一条链中特定部位的两个核苷酸之间的磷酸二酯键断裂.(1)根据题意分析可知:植物A和D对草甘膦敏感,B和E对草甘膦天然具有抗性,C和F则经过了转基因处理,所以A-C浇清水,都能健康成长.F虽经过了转基因处理,但是否成功还未知,所以D-F浇的水中含有草甘膦,D肯定不能...
点评:
本题考点: 基因工程的应用.
考点点评: 本题重点考查基因工程的有关知识,要求掌握基因工程的操作步骤及在生产实践中的运用,意在考查考生理解所学知识的要点,并学会运用生物学知识分析具体问题的能力.1年前查看全部
大家在问
- 1“那个把戏好极了”英语怎么说
- 2氧化铜和水和硫酸铜的离子方程式
- 3the strange old man often( )the street with his hands ( )on
- 4质量相同的物体,为什么密度大的物体所受到的浮力大
- 5徐渭的题墨葡萄诗赏析:古人写诗讲究炼字,你认为第四句诗中最精彩的一个字是什么?请简述理由.
- 61------5填空,感谢你的帮助,英语
- 7下列鸟类属国家一级保护动物的是(
- 8已知AB是圆O的的直径,M、N分别是AO、BO的中点,CM垂直于AB于M,DN垂直于AB于N,求证,弧AC=弧CD=弧B
- 9用因式分解(1-2²/1)(1-3²/1)(1-4²/1)…(1-9²/1)(1
- 10两个城市相距330千米。一辆汽车从一个城市驶向另一个城市,去时用了6小时,返回时少用了一小时。
- 11英语翻译1.The store sells clothes.(改否定句)The store ________ _____
- 12英语翻译师:亲爱的小朋友们!幼:亲爱的爸爸妈妈、叔叔阿姨们!师:六月,是撒满阳光的:六月,是鲜花盛开的;幼:六月,是我们
- 13英语翻译翻译成中文!
- 14三十九减十六分之十三
- 15“发展体育运动 增强人民体质” 后面加两句口号