活化分子的碰撞也不一定都能发生有效碰撞.这里的原因是不是 取向?
 柳如洁2022-10-04 11:39:543条回答
柳如洁2022-10-04 11:39:543条回答
已提交,审核后显示!提交回复
共3条回复
 lubo713 共回答了11个问题
lubo713 共回答了11个问题 |采纳率81.8%- 活化分子的碰撞也不一定都能发生有效碰撞.有的活化分子的碰撞是有方向性的,即从某一方向碰撞才能反应,尤其是有机物之间的反应,取向性更强.
- 1年前
 49632004 共回答了24个问题
49632004 共回答了24个问题 |采纳率- 是动力学里的相关概念吧,这个原因很多啊,取向是最为主要的一个原因,当然,是不是对心碰撞等的原因也十分重要。
从动力学的角度来说,就是相对碰撞时的相对速度够不够大,活化分子的能量一般已经很大了,但是相对碰撞时的中间损失的,或者说用来发生断键等反应的能量并不一定大。... - 1年前
 jx129 共回答了2个问题
jx129 共回答了2个问题 |采纳率- 比如两个NOBr反应
BrNO+ONBr=不反应
Br Br Br2
N + N = +
O O 2NO - 1年前
相关推荐
- 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫
 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图1,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol-1表示.请认真观察图1,然后回答问题.
(1)如图中反应是______(填“吸热”或“放热”)反应,该反应的△H=______kJ•mol-1(用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能______(填“升高”或“降低”),因此反应速率______(填“加快”或“减慢”),你认为最可能的原因是:______. 冬眠的猴子1年前1
冬眠的猴子1年前1 -
 yangxin0171 共回答了19个问题
yangxin0171 共回答了19个问题 |采纳率94.7%解题思路:(1)从图上分析,反应物能量高于生成物,反应放热;反应热等于生成物与反应物的能量差;
(2)图象分析虚线是降低反应的活化能,化学平衡不变化,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂.(1)图示反应是放热反应,反应热等于生成物与反应物的能量差,即E1-E2,
故答案为:放热;E1-E2;
(2)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂;
故答案为:降低;加快;使用催化剂.点评:
本题考点: 化学反应的能量变化规律.
考点点评: 本题考查了化学反应能量变化分析,活化能概念的理解应用,化学平衡影响因素的分析判断,掌握基础是关键,题目难度不大.1年前查看全部
- 升高温度,活化分子百分数增大吗?
升高温度,活化分子百分数增大吗?
为什么不能说活化分子数增多?
 521雅莉1年前1
521雅莉1年前1 -
 yangmmh 共回答了21个问题
yangmmh 共回答了21个问题 |采纳率90.5%活化分子数=分子总数*活化分子百分数
温度升高,活化分子百分数增加,但如果体系的分子总数减小(如抽取一部分气体),则总的活化分子数还是有可能减小的1年前查看全部
- 压强增大,活化分子的百分数为什么不变啊?
 sam2008A1年前1
sam2008A1年前1 -
 liqian99 共回答了19个问题
liqian99 共回答了19个问题 |采纳率89.5%活化分子的能量与其所处的温度环境有关,如果温度高,分子吸收的能量就多,活化分子百分数增多,反之则小.在温度不变时,活化分子百分数是不变的.压强变化,不会导致分子从体系中吸收或释放能量,所以压强增大,仅仅是单位体积内分子数多了,活化分子绝对数增加了,而活化分子百分数不会改变.1年前查看全部
- 为什么增加反应物浓度 活化分子百分数不变
为什么增加反应物浓度 活化分子百分数不变
我百度了很多, ican_19851年前1
ican_19851年前1 -
 零-征 共回答了22个问题
零-征 共回答了22个问题 |采纳率95.5%能提高活化分子百分数的只有升高温度和使用正催化剂这两种措施.
打个比方,活化分子百分数相当于高考升学率.
原来一个班级40人,升学率是50%,那么会有20人升学.
增大浓度,即向班里加学生,一个班到60人,这时候会有30人升学,升学率是不变的.
提高升学率的措施有教学上抓紧(升温)和降低分数线(使用催化剂,降低反应活化能)1年前查看全部
- 工业合成氨反应为3H2(g)+N2(g)⇋2NH3(g)△H<0,下列措施能使反应物中活化分子百分数增大的方法是( )
工业合成氨反应为3H2(g)+N2(g)⇋2NH3(g)△H<0,下列措施能使反应物中活化分子百分数增大的方法是( )
①增大N2的浓度;
②升高温度;
③增大压强;
④移去NH3;
⑤加入催化剂.
A.①②③
B.①②③⑤
C.①②③④⑤
D.②⑤ 时间旁观者1年前1
时间旁观者1年前1 -
 yangming5119 共回答了26个问题
yangming5119 共回答了26个问题 |采纳率92.3%解题思路:升高温度、增加压强、使用催化剂、增大接触面积均能加快反应速率,注意只有催化剂和温度能使活化分子百分数增大,以此来解答.①增大N2的浓度,单位体积内活化分子数目增大,反应速率加快,故不选;
②升高温度可以增大活化分子百分数,有效碰撞的次数增加,则加快反应速率,故选;
③增大压强,可增大单位体积活化分子数目,则加快反应速率,故不选;
④移去NH3,浓度减小,反应速率减小,故不选;
⑤加入催化剂,降低反应的活化能,增大活化分子百分数,加快反应速率,故选;
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响化学反应速率的因素,为高频考点,把握影响反应速率的因素为解答的关键,侧重活化分子对反应速率影响的考查,注意活化理论的理解,题目难度不大.1年前查看全部
- (2009•镇江一模)在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量
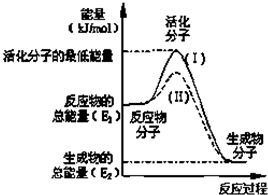 (2009•镇江一模)在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ•mol-1表示.请观察如图,回答下列问题:
(2009•镇江一模)在化学反应中,只有活化分子才能发生有效碰撞而发生化学反应.使普通分子变成活化分子所需提供的平均能量叫活化能,其单位通常用kJ•mol-1表示.请观察如图,回答下列问题:
(1)图中所示反应是______(填“吸热”或“放热”)反应△H是______(用E1、E2表示).
(2)已知热化学方程式:
H2(g)+[1/2]O2(g)=H2O(g)AH=-241.8kJ•mol-1,
该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能为______.
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是______. xxl-gm1年前1
xxl-gm1年前1 -
 晚抱晨抱时时抱 共回答了25个问题
晚抱晨抱时时抱 共回答了25个问题 |采纳率84%解题思路:(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;
(3)对于同一反应,图中虚线( II)与实线( I)相比,反应所需的活化能降低.(1)依据图象分析反应物的能量大于生成物的能量,反应放热;反应的焓变=生成物的能量-反应物的能量,所以△H=E2-E1;
故答案为:放热,E2-E1 ;
(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变;H2(g)+[1/2]O2(g)═H2O(g)△H=-241.8kJ•mol-1,该反应的活化能为167.2kJ•mol-1,则其逆反应的活化能=167.2KJ/mol+241.8KJ/mol=409.0KJ/mol;
故答案为:409.0KJ/mol;
(3)对于同一反应,图中虚线( II)与实线( I)相比,活化能降低,活化分子的百分数增多,反应速率加快,催化剂有此作用,所以使用了催化剂;
故答案为:使用了催化剂.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,图象的综合应用,读懂图象,焓变和活化能计算方法的理解是解决本题的关键.1年前查看全部
- 下列叙述正确的是( ) A.升高温度会加快化学反应速率,其原因是活化能降低,增加了活化分子的百分数 B.对于反应2NO
下列叙述正确的是( ) A.升高温度会加快化学反应速率,其原因是活化能降低,增加了活化分子的百分数 B.对于反应2NO 2 (g)═N 2 O 4 (g);△H<0,升高温度,正逆反应的速率都增大,但正反应速率的增加幅度小于逆反应速率的增加幅度 C.中和等量的NaOH溶液消耗pH均为3的盐酸、醋酸溶液体积相同 D.已知2C(s)+2O 2 (g)=2CO 2 (g);△H 1 2C(s)+O 2 (g)=2CO (g);△H 2 则△H 1 >△H 2  hermesping1年前1
hermesping1年前1 -
 linlin琪 共回答了22个问题
linlin琪 共回答了22个问题 |采纳率90.9%A、改变反应的温度,提供能量,有效碰撞的机会增大,增大了反应体系中活化分子的百分数,故A错误;B、对于反应2NO 2 (g)═N 2 O 4 (g);△H<0,升高温度,正逆反应的速率都增大,化学平衡向着正方向...1年前查看全部
- 活化分子百分数在任何物质中都一样吗?反应到底是如何发生的?是所有分子都会变成活化分子吗?
活化分子百分数在任何物质中都一样吗?反应到底是如何发生的?是所有分子都会变成活化分子吗?
同种温度下,活化分子百分数在任何物质中都一样吗?
假设有50个O2分子,包含10个活化分子;100个H2分子,含10个活化分子,那它们到底是怎么生成100个水分子的?是所有分子都吸热变成活化分子然后碰撞吗?要是不变的话岂不是只能生成10个水分子?可是如果变化的话活化分子百分数不又不是固定的了?
还有下面这张图片,书上说E1是活化能,E1不是反应物断键吸收的热量吗,那活化能就是断键吸收的能量吗?那最高的那条线代表什么,是反应物所有分子都变成活化分子后具有的总能量吗?
思路很混乱,问题很多,真心求助啊~~
 showwing1年前1
showwing1年前1 -
 丸子妞妞 共回答了15个问题
丸子妞妞 共回答了15个问题 |采纳率86.7%对于同一种物质来说,在一定温度下,物质所具有的能量是一定的,但在不同的反应中,活化能是不同的,所以活化分子数是不一样的.如O2,温度相同,O2和H2的反应与O2与CO的反应,O2中的活化分子数是不一样的.
如O2和H2的反应,开始时,只有一定量的O2和H2是活化分子,但为什么最后都反应完了,这是由于本反应是放热的,放出的热量使分子活化,达到活化分子,使反应得以进行.
那最高的那条线代表什么,
是活化分子所具有的最低能量.1年前查看全部
- 下列说法正确的是( )A.化学反应不一定有分子碰撞B.发生有效碰撞的分子是活化分子C.凡是放热反应都是自发的,吸热反应
下列说法正确的是( )
A.化学反应不一定有分子碰撞
B.发生有效碰撞的分子是活化分子
C.凡是放热反应都是自发的,吸热反应都是非自发的
D.自发反应一定是熵增大,非自发反应一定是熵减少或不变 tuoxie3301年前1
tuoxie3301年前1 -
 qianbeihui 共回答了11个问题
qianbeihui 共回答了11个问题 |采纳率100%解题思路:A.能发生化学反应的碰撞是有效碰撞;
B.发生有效碰撞的分子一定是能量比较高的活化分子;
C.吸热反应也有自发进行的;
D.自发反应不一定是熵增大的反应.A.能发生化学反应的碰撞是有效碰撞,所以化学反应一定有分子碰撞,故A错误;
B.发生有效碰撞的分子一定是能量比较高的活化分子,能量比较低的普通分子,不能发生有效碰撞,故B正确;
C.吸热反应也有自发进行的,如碳酸氢铵分解属于吸热反应,是自发反应,故C错误;
D.自发反应不一定是熵增大的反应,如氨气和氯化氢的反应是熵减小的反应,属于自发反应,故D错误;
故选B.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了有效碰撞理论,反应自发性的判断,比较基础,注意对基础知识的理解掌握.1年前查看全部
- 改变活化分子数和活化分子百分数的因素有什么?
 liuwei8401101年前1
liuwei8401101年前1 -
 zhangrui19800113 共回答了19个问题
zhangrui19800113 共回答了19个问题 |采纳率89.5%升高温度和加入催化剂.
升高温度是提高分子的能量,而提高活化分子数和活化分子百分数.
加入催化剂是降低反应的活化能,来提高活化分子数和活化分子百分数.1年前查看全部
- 一、讨论1.从反应商与标准平衡常数角度讨论平衡移动的规律.2.从活化分子总数、活化分子分数与活化能角度讨论浓度、温度及催
一、讨论
1.从反应商与标准平衡常数角度讨论平衡移动的规律.
2.从活化分子总数、活化分子分数与活化能角度讨论浓度、温度及催化剂对
反应速率的影响.
二、简答
1.在下列物种NH3、HAc、HPO4、H2PO4、HCO3、CO3、NH4、Ac、H3O及H2O中,哪一种与哪一种互为共轭酸碱对?
2.实验测得反应 I2+H2 = 2HI的速率方程为 v = k C(I2) C(H2),则反应物I2与H2的分级数及反应级数各为多少?
三、计算
1.精确测得下列反应的摩尔等容热qv,m=–3268kJ/mol,
C6H6(l)+7.5 O2(g)=6CO2(g)+3H2O(l)
求在298.15K,101325Pa下,进行到反应进度ξ﹦1mol时的反应热.
2.已知在298.15K时的标准条件下:
(1)2H2(g)+O2(g)=2H2O(g),DrHm,1=﹣483.64 kJ/mol
(2) 2Ni(s)+O2(g)=2NiO(s),DrHm,2=﹣479.40 kJ/mol
求反应(3)NiO(s)+ H2(g)= Ni(s)+ H2O(g)的摩尔等压热
3.已知在298.15K下,Fe2O3和Al2O3的标准摩尔生成焓分别为﹣824.2 kJ/mol及﹣1675.7 kJ/mol,求该温度条件下反应:2Al(s)+ Fe2O3(s)= Al2O3(s)+2Fe(s)的标准摩尔焓变.
4. 已知在298.15K时,C(s)、CO2 (g) 及CO(g)的标准摩尔熵分别是5.740J / mol,K 、
213.74 J / mol,K 及197.674 J / mol,K ,CO2 (g) 与CO(g)的标准摩尔生成焓分别为
﹣393.509 kJ/mol与﹣110.525 kJ/mol,分别计算下列反应C(s) + CO2 (g) = 2CO (g)
在298.15K和1173K时的标准平衡常数值.
5.已知反应3H2(g)+ N2 (g) = 2NH3 (g)在298.15K下进行时,反应的标准摩尔焓变为﹣92.22 kJ/mol,标准平衡常数是6.0×105,试计算该反应在700K时的标准平衡常数.
6.已知合成氨反应在未采用催化剂时的活化能为254 kJ/mol,采用铁作催化剂时的活化能
下降至146 kJ/mol,试计算该反应在298K和773K下进行时,采用铁催化剂后,反应速率增加的倍数.
我是大四的,马上大补这科,私信我私聊哇!
分数什么的不是问题,题很多,私聊! 竹6181年前1
竹6181年前1 -
 凌波微步0100 共回答了20个问题
凌波微步0100 共回答了20个问题 |采纳率80%1、德尔塔G=-RTlnK标,当反应商J=K标,反应达平衡;当JK标,反应向着逆反应方向进行.
2、当温度一定时,活化分子百分数不变,浓度越大,单位体积内,活化分子数目越多,即反应体系中活化分子总数越多,易于发生有效碰撞,反应速率加快;当浓度一定时,升高温度.活化分子百分数增大,单位体积内活化分子数增多,反应速率加快;催化剂降低了反应的活化能,对活化分子百分数和活化分子数没影响,但是由于活化能降低,反应速率加快.
1、NH3和NH4、HAc和Ac、HCO3和CO3、HPO4和H2PO4、H3O及H2O.
2、一级、一级、二级
1、Qp=Qv+德尔塔nRT=–3268+(–7.5+6)R×298.15(答案自己算,ok)
2、【1式-2式】/2,即为3式DrHm,也就是摩尔等压热.
3、用生成物的标准摩尔生成焓减去反应物的标准摩尔生成焓.
先解答到这,再给出后三道1年前查看全部
- 下列说法正确l是( )A.其它条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大B.判断过程的
下列说法正确l是( )
A.其它条件相同时,增大反应物浓度使分子获得能量,活化分子百分数提高,反应速率增大
B.判断过程的自发性能确定过程能否发生和过程发生的速率
C.体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律
D.催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 dongtion1年前1
dongtion1年前1 -
 Dollywb 共回答了21个问题
Dollywb 共回答了21个问题 |采纳率95.2%解题思路:A.增大浓度,活化分子数目增多,百分数没有变化;
B.过程的自发性与反应速率无关;
C.普遍规律发现熵增的反应可自发进行;
D.催化剂降低反应所需的活化能.人.其t条件相同时,增如浓度,活化分子数目增多,百分数没有变化,反应速率加快,故人错误;
B.过程的自发性与反应速率无关,可确定过程能否发生,故B错误;
C.由普遍规律可知,熵增的反应可自发进行,所以体系有自发地向混乱度增加(即熵增)的方向转变的倾向,故C正确;
D.催化剂降低反应所需的活化能,只影响反应速率,不影响化学平衡,故D错误;
故选C.点评:
本题考点: 化学反应速率的影响因素;焓变和熵变.
考点点评: 本题考查影响化学反应速率的因素,注意理论性知识的理解,把握活化能与反应速率的关系、反应进行方向的判断等为解答的关键,侧重反应原理的考查,题目难度不大.1年前查看全部
- 为什么活化能越低,活化分子百分数越高?
为什么活化能越低,活化分子百分数越高?
求详解,为什么活化分子越高? Knug1年前1
Knug1年前1 -
 vickem 共回答了15个问题
vickem 共回答了15个问题 |采纳率86.7%活化分子是能量足够高(超过某一能量值),相互碰撞时可能引起反应物分子化学键断裂(从而引发反应)的分子,而能量低于该值的分子相互碰撞时就不可能引起反应物分子化学键断裂,这样的分子称为非活化分子.
打个比方,上述的某一能量值就好像一座山,能量够大能翻过这座山的人,就好比是活化分子,不能翻过这座山的人就好比是非活化分子.而一大群人(就像一大群分子)中有的人年轻力强,有的人年老体弱,只有一部分人体力好的人可以爬过去.山越高(相当于活化能越高),能爬过去的人(活化分子)就会越少,山很矮的时候老太太都可以爬过去,也就是说能翻过山的人占人群的百分比就会比较大(也就是活化能越低,活化分子百分数越高).1年前查看全部
- 增大反应物的浓度、增大气体的压强、升高体系的温度、使用催化剂都可以加快化学反应速率,其中能增大活化分子百分数的是( )
增大反应物的浓度、增大气体的压强、升高体系的温度、使用催化剂都可以加快化学反应速率,其中能增大活化分子百分数的是( )
①增大反应物的浓度②增大气体的压强③升高体系的温度④使用催化剂.
A. ①②
B. ②③
C. ①④
D. ③④ dd9341年前1
dd9341年前1 -
 江南jiangnan 共回答了18个问题
江南jiangnan 共回答了18个问题 |采纳率88.9%解题思路:一般来说,升高温度、加入催化剂等,都可增加反应物分子中活化分子百分数,而增大浓度、压强等只能增大单位体积的活化分子数目,但百分数不变,以此解答.①增大反应物的浓度,单位体积活化分子数目增大,但百分数不变,故错误;
②增大气体的压强单位体积活化分子数目增大,但百分数不变,故错误;
③升高体系的温度,可增大活化分子百分数,故正确;
④使用催化剂,可以降低活化能,使更多的普通分子转化为活化分子,故活化分子的百分数增加,故正确.
故选D.点评:
本题考点: 化学反应速率的影响因素.
考点点评: 本题考查影响活化分子的因素,题目难度不大,注意外界条件对活化分子的影响不同,把握相关基础知识的积累.1年前查看全部
- 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用kJ•mol -1 表示.请认真观察图,然后回答问题.
(1)图中反应是______(填“吸热”或“放热”)反应.
(2)对于同一反应,图中虚线( II)与实线( I)相比,改变的条件是______,对反应热是否有影响?______,原因是______.
(3)已知 C(s)+O 2 (g)=CO 2 (g);△H=-393.5kJ/mol
CO(g)+
O 2 (g)=CO 2 (g);△H=-283.0kJ/mol1 2
请写出C(s)与O 2 (g)反应生成CO(g)的热化学方程式______.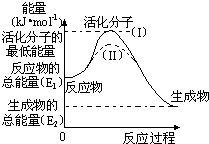
 yanglei9261年前1
yanglei9261年前1 -
 erica315 共回答了16个问题
erica315 共回答了16个问题 |采纳率87.5%(1)依据图象分析反应物的能量大于生成物的能量,反应放热,故答案为:放热;
(2)对于同一反应,图中虚线( II)与实线( I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,说明反应的活化能降低焓变不变,平衡不动,化学反应速率影响因素中,催化剂有此作用,所以最有可能使用了催化剂,反应热不变,反应热只与反应物和生成物的始态有关,故答案为:催化剂; 无/没影响;反应热只与反应物和生成物的始态有关/催化剂只改变活化能;
(3)已知:(1)C(s)+O 2 (g)=CO 2 (g);△H=-393.5kJ/mol
(2)CO(g)+
1
2 O 2 (g)=CO 2 (g);△H=-283.0kJ/mol
利用盖斯定律,将(1)-(2),可得 C(s)+
1
2 O 2 (g)=CO(g),
则:△H=-393.5kJ/mol-(-283.0kJ/mol)=-110.5KJ/mol.
C(s)与O 2 (g)反应生成CO(g)的热化学方程式C(s)+
1
2 O 2 (g)=CO(g)的△H=-110.5 kJ/mol,故答案为:C(s)+
1
2 O 2 (g)=CO(g)的△H=-110.5 kJ/mol;1年前查看全部
- 活化分子百分数是单独看一种物质吗?
活化分子百分数是单独看一种物质吗?
比如so2+o2=so3,活化分子百分数怎样算?是so2自己的单独算,还是so2,o2,so3三者一起算,还是反应物单独算,生成物单独算? 兰黑1年前1
兰黑1年前1 -
 hjfjfj 共回答了19个问题
hjfjfj 共回答了19个问题 |采纳率100%单独计算1年前查看全部
- 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫
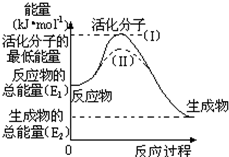 在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用图J•mol-t表示.请认真观察图,然后回答问题.
在化学反应中,能引发化学反应的分子间碰撞称之为有效碰撞,这些分子称为活化分子.使普通分子变成活化分子所需提供的最低能量叫活化能,其单位用图J•mol-t表示.请认真观察图,然后回答问题.
(t)已知热化学方程式:Ht(g)+[t/t]Ot(g)═HtO(g)△H=-t图t.q图J•mol-t,该反应的活化能为t九7.t图J•mol-t,则其逆反应的活化能为______;
(t)对于同一反应,图中虚线(Ⅱ)与实线(得)相比,活化能______,单位体积内活化分子的百分数______,因此反应速率______,你认为最可能的原因是______. luckyyoung0011年前1
luckyyoung0011年前1 -
 今年嫁人 共回答了29个问题
今年嫁人 共回答了29个问题 |采纳率82.8%解题思路:(1)依据活化能的概念和实质分析判断逆反应的活化能=正反应的活化能+反应焓变;
(2)图象分析虚线是降低反应的活化能,化学平衡不变化,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂.(1)热化学方程式:5q(g)+[1/q]Oq(g)═5qO(g)△5=-q61.8k9•mol-1,该反应的活化能为16三.qk9•mol-1,则其逆反应的活化能=正反应的活化能+反应焓变=q61.8k9•mol-1+16三.qk9•mol-1 =609.0K9/mol,
故答案为:609.0K9/mol;
(q)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂;
故答案为:降低;增多;加快;使用催化剂.点评:
本题考点: 反应热和焓变.
考点点评: 本题考查了化学反应能量变化分析,活化能概念的理解应用,化学平衡影响因素的分析判断,掌握基础是关键,题目较简单.1年前查看全部
- 单位体积内活化分子数增加 活化分子百分数为什么不变
 xiaowangxk1年前1
xiaowangxk1年前1 -
 cnchefu 共回答了18个问题
cnchefu 共回答了18个问题 |采纳率100%对对于一个容器,如果压缩它到原来的一半,那么若原来单位体积有一百个分子,五十个是活化的,那么压缩之后就会变为单位体积有二百个分子,一百个是活化的,所以单位体积内活化分子数增加 活化分子百分数却保持不变,呵呵1年前查看全部
- 催化剂能提高活化分子百分数吗?增加浓度呢?为什么?
 niliudeyu1年前1
niliudeyu1年前1 -
 rrrrqqqq05 共回答了25个问题
rrrrqqqq05 共回答了25个问题 |采纳率92%能.
催化剂能降低成为活化分子所需要的能量,加入催化剂后,原有的分子中的一部分分子就会成为活化分子,百分比就提高了1年前查看全部
- 能发生反应的分子一定是活化分子这句话对不对 给个简短的分析谢
 mir2chuan1年前1
mir2chuan1年前1 -
 xinze2001 共回答了11个问题
xinze2001 共回答了11个问题 |采纳率90.9%对
因为放反应中一定有活化分子,但是,活化分子不一定都能发生反应,因为有的分子达不到平均能量1年前查看全部
- 提高活化分子百分数是什么意思?受什么因素影响?当那个因素改变时,它会怎么样?
提高活化分子百分数是什么意思?受什么因素影响?当那个因素改变时,它会怎么样?
急用 m9955001年前1
m9955001年前1 -
 xingyungk 共回答了21个问题
xingyungk 共回答了21个问题 |采纳率85.7%提高活化分子百分数就是在分子总数不变的条件下,增加活化分子的数目.
一般方法是:1、升高温度(全面提高分子能量,让符合活化分子标准的分子多起来);2、加催化剂(降低活化能,让符合标准的分子多起来).1年前查看全部
- 活化能不是活化分子所具有的最低能量与反应物分子的平均能量的差值么?但哪里是活化分子的最低能量
 shuijing121年前1
shuijing121年前1 -
 蝴蝶要飞 共回答了18个问题
蝴蝶要飞 共回答了18个问题 |采纳率94.4%错了,活化能是活化分子所具有的平均能量与反应物分子的平均能量的差值,你记错了!1年前查看全部
- 活化分子数 和活化分子百分数 啥意思
 v2qehk01年前1
v2qehk01年前1 -
 aqjmx 共回答了14个问题
aqjmx 共回答了14个问题 |采纳率85.7%前者是指活化分子的数量
后者是指活化分子数量与所有该物质分子的数量的比1年前查看全部
- 为什么吸热的可逆反应升高温度会向吸热方向进行?实质是怎样的?也从活化分子角度说说
 csdmi1年前1
csdmi1年前1 -
 qblj 共回答了19个问题
qblj 共回答了19个问题 |采纳率89.5%按照勒夏特列原理:改变影响平衡的一个条件平衡就会向着减弱这种改变的方向移动.吸热就会减弱升高温度带来的影响,故向吸热方向移动.升高温度.体系中的活化分子数增多,有效碰撞增多,有利于反映进行1年前查看全部
- 为什么活化分子在反应物分子中所占的百分比一定
 九傲1年前1
九傲1年前1 -
 画工谁写银屏面 共回答了20个问题
画工谁写银屏面 共回答了20个问题 |采纳率95%在一定的条件下,物质具有的内能是一定的,故活化分子的百分比一定!1年前查看全部
- 化学中为什么加入正催化剂反应活化能减小,活化分子百分数增大?
 业已完事1年前1
业已完事1年前1 -
 踏雪无痕1978 共回答了28个问题
踏雪无痕1978 共回答了28个问题 |采纳率89.3%催化剂就是降低反应的活化能,这样原来的一些能量不够的,不是活化分子的分子也就变成了活化分子,可以增加活化分子的数目 从而增加活化分子百分数1年前查看全部
- 为什么说增大压强只可增加活化分子数,不能增加活化分子的百分数.不是总分子数不变,而活化分子数增加,
为什么说增大压强只可增加活化分子数,不能增加活化分子的百分数.不是总分子数不变,而活化分子数增加,
然后活化分子的百分数就增加了呀 ghl量子1年前1
ghl量子1年前1 -
 我要就是登陆 共回答了20个问题
我要就是登陆 共回答了20个问题 |采纳率70%增大压强,不增加活化分子数,不增加活化分子的百分数,但增加单位体积内的活化分子的数量.
因为压强的增大,并不能提高分子的活化能,因此活化分子数不变,总分子数不变.但单位体积内的活化分子数增多了,那么活化分子之间的碰撞几率就大了,所以反应的速度也就快了.
增大活化分子数有几种方法:1、使用催化剂 2、升高温度.1年前查看全部
- 有效碰撞是指活化分子的每次碰撞均能发生化学反应的碰撞这句话是正确的吗?
 sufang0011年前1
sufang0011年前1 -
 米花饭团ac26 共回答了15个问题
米花饭团ac26 共回答了15个问题 |采纳率80%有效碰撞是能引起化学反应的碰撞,并不是每次碰撞都会发生化学反应,所以那句话是错误的.1年前查看全部
- 单位体积内活化分子数与活化分子百分数有什么区别?
 丁赫永1年前1
丁赫永1年前1 -
 萧何音乐 共回答了17个问题
萧何音乐 共回答了17个问题 |采纳率94.1%活化分子数是指单位体积里的个数…
活化分子百分数是指单位体积里活化分子数所占全部分子的百分比…1年前查看全部
- 增加活化分子百分数的途径如何增加活化分子百分数
 迈阿密1年前1
迈阿密1年前1 -
 到處爬的抱抱熊 共回答了18个问题
到處爬的抱抱熊 共回答了18个问题 |采纳率77.8%升高温度或者使用催化剂
升高温度会使反应物的能量升高,这样会有更多的分子具有的能量超过活化能而成为活化分子.分子总数不变,所以,百分数增加
使用催化剂,会降低反应的活化能,分子所具有能量不变,但是,会有更多的分子成为活化分子.分子总数不变,所以,活化分子百分数增加1年前查看全部
- 为何反应物浓度增大活化分子百分数不变,但浓度增大?增大压强活化分子百分数不变,浓度却增加?
 网亦有道1年前1
网亦有道1年前1 -
 ltong_80 共回答了19个问题
ltong_80 共回答了19个问题 |采纳率89.5%就好像,100个人里有1个天才,多少个人里都只有1%的天才,所以百分数不变
100个人在一个大厅中,再放进400人,100个人里还是只有1个天才,现在就有4个天才,所以浓度增大
只有催化剂和温度才改变活化能1年前查看全部
- 因为活化分子能量高 所以时碰撞时才能化学键断裂吗那又为什么有克服原子间作用力需要能力当化学键形成时又会怎么样 请高人把化
因为活化分子能量高 所以时碰撞时才能化学键断裂吗那又为什么有克服原子间作用力需要能力当化学键形成时又会怎么样 请高人把化学键断裂和形成的过程用反应吸热放热活化分子活化能 有效碰撞 联系起来仔细讲讲
 麒胐晗1年前2
麒胐晗1年前2 -
 蒙蒙亲爱滴 共回答了21个问题
蒙蒙亲爱滴 共回答了21个问题 |采纳率90.5%化学键断裂需要吸收能量,而拥有足够能量,可以发生反应的分子就是活化分子,“普通分子”吸收能量后就是活化分子.它们通过碰撞就可能发生断键反应,这就是有效碰撞.新键的形成会放出能量,ΔH=断键时吸收的能量-成键时释放的能量,ΔH>0吸热反应,ΔH1年前查看全部
- “加入反应物,使活化分子百分数增加,化学反应速率增大”错在哪儿了?为什么?
 天蝎71年前1
天蝎71年前1 -
 咸胡菜补 共回答了19个问题
咸胡菜补 共回答了19个问题 |采纳率78.9%有两个地方说错了:1、一定温度下,活化分子的百分数是定值.2、加入反应物,反应速率不一定增大,能使反应速率增大的方法是升温、加大压强(有气体反应物时)、增加反应物浓度、加催化剂.注意,纯固体和纯液体的浓度是固定的(即为其的密度),所以当加入纯固体或纯液体反应物时,反应速率不会增大.1年前查看全部
- 为什么 加入反应物,活化分子百分数增大,化学反应速率的增大 这句话是错的?急...亲们,
 星星1201年前1
星星1201年前1 -
 wen265 共回答了18个问题
wen265 共回答了18个问题 |采纳率94.4%活化分子个数增多,百分数没变啊1年前查看全部
- 如何微观角度解释原电池加快反应速率的原因?他改变活化分子百分数了吗?
 bboos1年前1
bboos1年前1 -
 shy_363832068 共回答了25个问题
shy_363832068 共回答了25个问题 |采纳率88%如果金属与酸直接反应,首先是Zn原子失去电子以Zn^2+的形式扩散到酸溶液中,电子留在金属上,溶液中的H+再移动到金属表面得到电子形成H2.由于金属周围存在从金属上面"脱落"下来的Zn^2+,该Zn^2+一方面阻止金属上面的Zn继...1年前查看全部
- 有关活化分子问题活化分子的定义化学课本上说:分子的能量高于分子的平均能量,属于活化分子.课外书说正催化剂能增大活化分子的
有关活化分子问题
活化分子的定义化学课本上说:分子的能量高于分子的平均能量,属于活化分子.课外书说正催化剂能增大活化分子的百分数,原因是降低了化学反应所需的能量.但没有降低分子的平均能量啊?书上的定义是否要改一改呢?怎么相互矛盾呢? sun-feiwu1年前1
sun-feiwu1年前1 -
 souhuai 共回答了25个问题
souhuai 共回答了25个问题 |采纳率84%化学反应的过程可以有一个图来概括,抱歉我还不能传图,凑活一下,想象.
就像录取分数线一样.分数线460,你考了470,就可以进去,你考了450就不可以进去.加了正催化剂就相当于把分数线降低,440的分数线450的也可以进去了.当然能进那个学校的人就多了.(正催化剂能增大活化分子的百分数)而人的能力是没有变过,所以说没有降低分子的平均能量啊.
不知道我这样解释,你能不能听明白.
汗.1年前查看全部
- 化学平衡速率 两体积碘化氢中有十个活化分子 把它压缩至一体积 它还不是10个活化分子吗 速率怎么会增加呢
 qdgb2197_gb1年前2
qdgb2197_gb1年前2 -
 owen_yu059 共回答了14个问题
owen_yu059 共回答了14个问题 |采纳率78.6%根据C=n/V,当体积压缩为原来的1/2时,那么整个体系活化分子的浓度相当于变为原来的2倍.所以速率在增加.1年前查看全部
- 为什么反应物浓度升高,活化分子百分数会增加?
为什么反应物浓度升高,活化分子百分数会增加?
同上
活化分子百分数和活化分子浓度有什么区别啊? cherry67671年前1
cherry67671年前1 -
 b爱好者t 共回答了15个问题
b爱好者t 共回答了15个问题 |采纳率93.3%活化分子百分数不会增加哦.
浓度会增加
形象一点说吧.反应物浓度升高.同样体积下分子数目增多.就是变挤了.而挤了后相互碰撞的概率就更大.活化分子就增多了,但是同时反应物也增多了.百分数应该不变.浓度由于体积不变所以浓度会增加
分子都是活化分子的量
百分数的分母是所有分子的量
浓度的分母是体积1年前查看全部
- 普通分子能量一定比活化分子能量高吗
 qianxiaolong1年前1
qianxiaolong1年前1 -
 fkame 共回答了13个问题
fkame 共回答了13个问题 |采纳率92.3%活化分子能量高吧1年前查看全部
- 能发生有效碰撞分子一定是活化分子吗..活化分子不一定发生有效碰撞吗
 雪落舞夜1年前1
雪落舞夜1年前1 -
 断肠人lee 共回答了23个问题
断肠人lee 共回答了23个问题 |采纳率95.7%能发生有效碰撞分子一定是活化分子;活化分子不一定发生有效碰撞1年前查看全部
- 增加温度、增加浓度、增加压强为什么能提高化学反应速率(从活化分子的角度做答)
 trongerbone1年前1
trongerbone1年前1 -
 lrbwxl 共回答了24个问题
lrbwxl 共回答了24个问题 |采纳率91.7%增加温度能增加总的活化分子数目,从而加快反应速率;
增加浓度能增加单位体积内的活化分子数目,从而加快反应速率;
增加压强能增加单位体积内的活化分子数目,从而加快反应速率.1年前查看全部
- 一种化学反应中一定有一部分活化分子和非活化分子吗?
一种化学反应中一定有一部分活化分子和非活化分子吗?
假设有2种物质在瞬间完全反应,那么这些分子不都是活化分子吗》?怎么又分活化和非活化? lloyd7181年前1
lloyd7181年前1 -
 山核桃2003 共回答了16个问题
山核桃2003 共回答了16个问题 |采纳率87.5%我认为不同的反应,有不同的反应速度.
无机反应速度相对较快,有机反应速度可能较慢.
在化学反应中,尤其是有机化学反应,某些总有一个中间状态,就是所谓的活化态.
这种状态是由于这个分子得到了一定的能量,比如说通过加热,或得到一个质子,等等.这个活化态很容易跟另外一个分子反应.这可能就是你所说的活化分子.
那另一个分子,并没有发生什么变化,应该就是非活化分子.1年前查看全部
- 温度升高可以加快速度是因为活化分子数目相对增加还是绝对增加?
 香乃尔051年前1
香乃尔051年前1 -
 happyboy1976 共回答了20个问题
happyboy1976 共回答了20个问题 |采纳率85%温度升高,活化分子数目一定是比原来的要多,是绝对增加的,但是如果是活化分子百分数就要看其他变量有没有变了.1年前查看全部
- 某一化学反应的速率大小与单位时间内()有关;有效碰撞次数的多少与单位体积内反应物中()多少有关;活化分子的多少又与该反应
某一化学反应的速率大小与单位时间内()有关;有效碰撞次数的多少与单位体积内反应物中()多少有关;活化分子的多少又与该反应的()活化能大小有关.
 huafenfan1年前1
huafenfan1年前1 -
 无情之城 共回答了13个问题
无情之城 共回答了13个问题 |采纳率92.3%某一化学反应的速率大小与单位时间内(有效碰撞次数)有关;有效碰撞次数的多少与单位体积内反应物中(活化分子)多少有关;活化分子的多少又与该反应的( 反应物)活化能大小有关.1年前查看全部
- “具有较高能量的分子是活化分子” 为什么不对?
 三个靠近1年前2
三个靠近1年前2 -
 pigpigtony 共回答了16个问题
pigpigtony 共回答了16个问题 |采纳率93.8%楼上的回答基本正确,不过表述稍有不当,尤其是这句“平均能量也就是能峰的能量”不够正确,令人不知所云.同时解释不够深入.
更准确、深入的理解,可参见我对另一相似问题的回答1年前查看全部
- 活化分子与活化分子百分数的区别 是活化分子数改变 而影响活化分子百分数 还是活化分子百分数影响活化分子
活化分子与活化分子百分数的区别 是活化分子数改变 而影响活化分子百分数 还是活化分子百分数影响活化分子
活化分子百分数是根据什么求出来的
是 活化分子数 除以总反应分子数么
那为什么 温度能引起活化分子百分数的改变
活化分子百分数不是固定的值么 宝石蓝灯1年前1
宝石蓝灯1年前1 -
 shijishizhong 共回答了13个问题
shijishizhong 共回答了13个问题 |采纳率76.9%活化分子是指具有高于反应所需要的最低能量的分子.它的百分数是它占总分子数的比例.
加热使分子热运动更剧烈,使一些原来没有那么高的能量的分子能量达到活化能,成为活化分子,所以活化分子数增加.由于总分子数不变,活化分子百分数也增加.1年前查看全部
- 关于活化分子...掺杂:增大反应物浓度,反应物中活化分子数也增多,为什么?添加进的东西不一定是活化分子啊?加压:增大了反
关于活化分子...
掺杂:增大反应物浓度,反应物中活化分子数也增多,为什么?添加进的东西不一定是活化分子啊?
加压:增大了反应体系压强,单位体积内分子数增加.为什么?加压是把反应体系内的分子的体积减小了么?
我要问的就是链接里的回答里的两句话,加[ ]的两句话,不太理解
回答是:
[掺杂:增大反应物浓度,反应物中活化分子数,] 也增多有效碰撞几率增加使物质加快熔解,所以熔点降低,而 [加压:增大了反应体系压强,单位体积内分子数增加],也加快了熔解,所以熔点降低,两者使反应加快提前达到了熔点。
我不理解的部分是
掺杂:增大反应物浓度,反应物中活化分子数
加压:增大了反应体系压强,单位体积内分子数增加
对于这两句话的我个人的疑问,都在上面说明了(非补充问题部分) lxbtju1年前3
lxbtju1年前3 -
 过期鱼饵 共回答了21个问题
过期鱼饵 共回答了21个问题 |采纳率95.2%你的问题很奇怪,建议你仔细理一下原来你要问的东西状态究竟是什么
你的链接提出的是改变熔点的问题,这里提出的又是“反应体系”牵涉到了化学反应
物理化学讨论的大部分化学反应都是以气态反应为基准的,和你的熔点完全没有关系,因为熔点牵涉到的是固体的物理变化,一来不牵涉气体二来不牵涉化学反应
你也可以在补充里面把你的问题完整地,严谨地描述一下
活化是一个定概率的问题,这个可能对于你来说比较难理解.就是说比如存在一个活化比率是0.04%,就是说取很多分子,一定会有这么多概率的分子是活化分子.由于阿伏伽德罗常数是一个很大的数字(10的23次方),因此从统计学概念上来说这个活化是肯定存在的.唯一影响是否活化的,就是反应体系的状态,温度.
当然,如果你进了大学,就会知道所谓的活化分子其实就是高能量分子.一个分子活化了,其实的意思是他的能量超过了反应需要的能垒,这个能垒是根据反应决定的.一般情况下同一个体系内的分子能量是不相等的,而是遵循正态分布曲线的,从低能量到高能量都有,高能量的那部分就算很少,也始终是存在的.这个在物理化学中统计热力学的前言或者第一脏就会说,这个建议你去查阅大学中物理化学课本的热力学部分,都是属于基础内容
看到你的补充了
他这两句话的确没错
只不过不该加反应两个字,误导了
活化见我前面的论述
压强的话是这样,压强的实际产生原因是分子无规则运动的时候对于容器器壁的碰撞产生的,如果粒子数多了,压强自然就大了,反之亦然1年前查看全部
- 1.具有较高能量的反应物分子成为活化分子 2.催化剂能够改变化学反应途径 这两句话第一句说的不对,麻烦解
1.具有较高能量的反应物分子成为活化分子 2.催化剂能够改变化学反应途径 这两句话第一句说的不对,麻烦解
麻烦解释下这两句话. 真情流感1年前2
真情流感1年前2 -
 迈克尔鹏鹏 共回答了18个问题
迈克尔鹏鹏 共回答了18个问题 |采纳率77.8%较高能量是个含糊的说法.应该是高于平均能量的分子
在相同温度下,分子的能量并不完全相同,有些分子的能量高于分子的平均能量,称为活化分子.1年前查看全部
- 温度越高活化分子百分数越高?
 梨花暴雨1年前1
梨花暴雨1年前1 -
 syt1234567 共回答了18个问题
syt1234567 共回答了18个问题 |采纳率83.3%温度升高,正常的分子获得能量转化为活化分子.总分子不变,而活化分子数增多,所以百分数就升高,浓度就增大.所以这句话是对的1年前查看全部
大家在问
- 1初中英语,打完给好评
- 2伊索富言读后感
- 3写出下列画线词语的意思。
- 4已知a>b>0求(a^3b-a^2b^2+196)/(ab-b^2)的最小值
- 5下列涉及自由组合定律的表述,正确的是( )
- 6AFor many parents, raising a teenager is like fighting a lon
- 7最好不要方程解,一辆货车与一辆客车相向而行,6小时后相遇,然后再行,两车相距350米时,货车走了全程的70%,客车走了4
- 8一个梯形的上底减少一点六厘米就成为一个三角形,面积减少四点八平方厘米.如果上底增加五厘米就成为一个平行四边形,这个梯形的
- 9三角形ABC中,a=8,b=7,B=60°,求边c及ABC的面积
- 10马拉松比赛中有关运动员体内的生理变化,下列说法不正确的是( )
- 11actor 复数
- 12初三的英语总分是多少?总分是120分。
- 13如图,在△ABC中,∠B=60°,∠C=50°,AD是BC边上的高,AE是∠BAC的平分线,求∠DAE、∠AED的度数.
- 14请回答下列与生长素有关的一些问题.
- 15简不喜欢这条黑色的裙子的英文
